Ingeniero Químico
Química
Conceptos Básicos
Química:
Rama de la ciencia que estudia las características y composición de todos los materiales, de los cambioes que éstos pueden sufrir, así como las leyes que rigen dichos cambios
Cambio Físico: Es cuando un cuerpo cambia su forma exterior, pero su composición interna es la misma:
-
Congelamiento del agua
-
Romper un vidrio
-
Destilar petróleo
-
Mezclar agua y arena
Cambio Químico: Es cuando cambia la estructura interna de una sustancia, por lo que se crea otra sustancia diferente, generalmente debido a una combustión:
-
Quemar una hoja
-
Colorear una camisa
-
Fermentar una fruta
-
Fotosíntesis
Ciencia: Conocimiento organizado que se ha reunido por medio del método científico
Compuesto: Sustancias puras formadas por uno o más elementos combinados en proporciones fijas
Difusión: Es la propiedad de los gases de mezclarse fácilmente entre ellos
Elemento: Sustancias fundamentales con las que se constituyen todas las cosas materiales. Están formados por átomos
Energía: Capacidad para realizar un trabajo o transferir calor
Energía Cinética: Es la energía de un cuerpo en movimiento = ½ mv2
Energía Potencial: Energía almacenada que posee un cuerpo por su composición química o por su posición
Estados de Agregación: Forma en la que encontramos a un cuerpo.
E. Sólido: Tiene forma y volumen definidos. Sus moléculas están muy juntas
E. Líquido: Volumen definido. Adopta la forma del recipiente. Fluyen facilmente
E. Gaseoso: No poseen forma ni volumen definido. Sus moléculas están separadas
Etapas evolutivas:
Periodo Antiguo: Las primeras grandes civilizaciones aprendieron a combinar sustancias para obtener otras, como el vidrio y colorantes. Consideraban los 4 elementos como la base de todo (Agua, Tierra, Aire, Fuego)
Alquimia: Los científicos se dedicaron a combinar sustancias para crear oro o el elixir de la vida
Iatroquímica: Los alquimistas encontraron complicadas sustancias con facultades curativas
Flogisto: Teoría en la que las sustancias contenían flogisto, y al hacer combustión, éstas lo perdían
Química Moderna: Inicia con Antoine Lavoisier, en donde se crea la ley de la conservación de la materia
Ley de la Conservación de la Materia: “La materia no se crea ni se destruye, solo se transforma”
Ley de la Conservación de la Energía: “La energía no se crea ni se destruye, solo se transforma”
Masa: Cantidad de materia que contiene un cuerpo
Materia: Es de lo que están hechas todas las cosas en el Universo
Método Científico: Procedimiento que se sigue para realizar una investigación científica:
Identificar y enunciar el problema
Reunir datos concernientes al problema
Realizar experimentos
Analizar los datos y proponer soluciones posibles (hipótesis)
Realizar el plan o efectuar experimentos
Evaluar resultados (Formular hipótesis, teorías o leyes)
Mezcla: Composición de dos o más sustancias en composición variable
Mezcla Heterogénea: No presenta propiedades uniformes, se pueden distinguir sus componentes a simple vista
Mezcla Homogénea: Composición uniforme por la combinación de sustancias
Miscibilidad: Propiedad de los líquidos mezclarse homogéneamente
Peso: Es la atracción gravitacional de un cuerpo a otro
Ramas de la Química:
Q. Orgánica: Estudio de sustancias que contienen Carbono
Q. Inorgánica: Estudia las sustancias que no contienen Carbono
Q. Analítica: Estudia la composición de la materia
Fisico-Química: E. la estructura de las sustancias y la rapidez de sus cambios
Bioquímica: Estudia las reacciones químicas de los seres vivos
Solución: Es una mezcla uniforme, tiene una composición y apariencia uniforme
Sustancia Pura: Sustancia química individual que se compone íntegramente de una sola clase de materia
Viscosidad: Resistencia de los líquidos de fluir fácilmente
El Átomo:
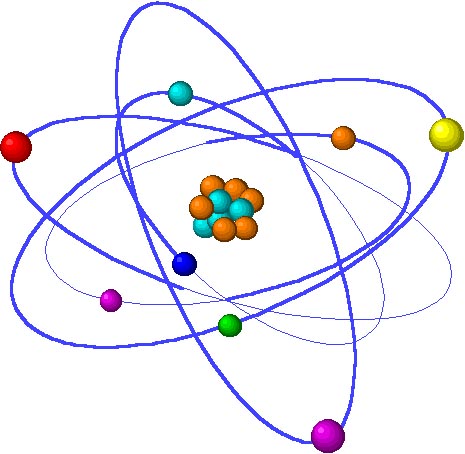
Protón: Partícula subatómica, la cual tiene carga positiva y forma parte del núcleo del átomo
Neutrón: Partícula eléctricamente neutra que se encuentra en el núcleo junto al protón
Electrón: Partícula con carga negativa que ocupa el espacio que rodea al átomo
Masa o Peso Atómico: Promedio ponderado de las masas atómicas de un átomo. Es la suma de los protones más los electrones. Se representa con la letra “A”
Número Atómico: Número de protones que tiene un átomo. Se representa con una “Z”
Isótopo: Átomos de un elemento en particular que tienen diferente número de neutrones
Ion: Partícula con carga eléctrica que se forma cuando un átomo gana o pierde electrones.
Aniones: Ion con carga negativa
Cationes: Iones con carga positiva
Teoría Atómica de Dalton
Todos los elementos están formados por partículas diminutas e indivisibles llamadas “átomos”, que no se pueden destruir
Todos los átomos de un elemento son idénticos
Todos los átomos de elementos mezclados en proporciones fijas forman compuestos
Una reacción química implica cambios
Ley de la Composición Constante
Un compuesto siempre contiene elementos en ciertas proporciones definidas, y en ninguna otra combinación
También se le llama ley de las proporciones definidas
Fue enunciada por Joseph Proust.
Ley de Proporciones Múltiples
Si dos elementos forman más de un compuesto, las diferentes masas de los elementos que se combinan en una masa fija del segundo elemento guardan entre sí una proporción sencilla de números enteros.
| Es equivalente a: | |
| N° Atómico | N° de Protones N° de Electrones |
| Peso Atómico - N° Atómico | N° de Neutrones |
Masa Molecular
Peso Molecular: Suma de las masas atómicas de cada átomo que compone una molécula. Por ejemplo:
(NH4)2SO4
Nitrógeno = 14 x 2átomos = 28 uma
Hidrógeno = 1 x 4 x 2 = 8 uma
Azufre = 32 x 1 = 32 uma
Oxígeno = 16 x 4 = 64 uma
Total: ......................................... 132 uma
N° de Avogadro: Número de partículas que hay en un mol. Es igual a 6.022 x 1023.
Mol: Un mol es igual a la suma de las masas atómicas de cada átomo que compone una molécula de un compuesto. El número dado será igual a un mol de ese compuesto. Por ejemplo
Calcular a cuántos gramos equivale un mol de NaCl
Na = 23 g
Cl = 35.45 g
Un mol de NaCl = 58.45 g
También se puede calcular cuántos átomos de cada elemento hay en x moles de x compuesto. Por ejemplo:
Calcular cuántos átomos de cada elemento hay en 3.35 moles de HClO3:
Primero se hace una regla de proporción:
3.35 moles = x átomos
1 mol = 6.022 x 1023
Se despeja la x, y se tiene que en un 3.35 moles hay 2.011 x 1024 átomos de x elemento
Por lo tanto,
El Hidrógeno posee 2.011 x 1024 átomos en 3.35 moles
El Cloro posee 2.011 x 1024átomos en 3.35 moles
El Oxígeno posee 6.05 x 1024átomos en 3.35 moles
Otro cálculo que se puede hacer es cuántos moles son equivalentes a x gramos de un compuesto:
Calcular cuántos moles son:
37 g de HNO3
Primero se calcula el peso molecular:
H = 1
N = 14
O3 = 48
Total = 63 g = 1 mol
37 g = .387 mol
Números Cuánticos
Número Cuántico Principal
Los electrones de los átomos se encuentran en niveles de energía o capas, las cuales aumentan de energía a medida que aumenta la distancia de éstos al núcleo del átomo. Por ello, entre más cercano esté el electrón al centro del átomo, más pequeña es su energía. Éstos números cuánticos se designan con números enteros o con letras. El número máximo de electrones que puede alojar un nivel está dado por la función 2n2:
| Nivel de Energía | Máximo de electrones |
| 1 (K) | 2 (1)2 = 2 |
| 2 (L) | 2 (2)2 = 8 |
| 3 (M) | 2 (3)2 = 18 |
| 4 (N)… | 2 (4)2 = 32 … |
El número cuántico principal determina la energía de un orbital.
Los electrones que llenan el último nivel de energía de un átomo se conocen como electrones de valencia. El máximo número de electrones que pueden ser admitidos en el último nivel es de ocho electrones, a excepción de los átomos de Hidrógeno y Helio, cuyo máximo número de electrones de valencia es 2.
Los electrones de valencia son importantes porque éstos son los que participan en las reacciones químicas.
Número Atómico Asimutal
Los niveles de energía se dividen a su vez en subniveles, que se designan por las letras s, p, d y f. Después del subnivel f siguen en orden alfabético. Éste número cuántico determina la forma del lugar en el que probablemente se encuentra el electrón. Cada subnivel puede alojar cierto número de electrones:
| Subnivel | Máximo de electrones |
| S | 2 |
| P | 6 |
| D | 10 |
| f | 14 |
Número Cuántico Magnético:
Los subniveles de energía a su vez están divididos en orbitales, que representa una nube electrónica con forma determinada. . El número cuántico magnético representa la orientación del orbital. El subnivel s tiene 1 orbital, el p tiene 3, el d tiene 5 y el f tiene 7. Cada subnivel puede aceptar dos electrones como máximo. Representa el lugar en donde nos sería posible encontrar un electrón. Las formas de algunos de los orbitales son las siguientes:
Orbitales S:

Orbitales P
PX: PY: PZ:


Los Orbitales d y f tienen formas más complejas que sería difícil representar en papel, pero existen modelos tridimensionales que permiten su fácil interpretación.
Número Cuántico Spin:
Éste número se representa con una flecha, ya sea señalando hacia arriba o hacia abajo. Nos indica el sentido hacia donde se gira el electrón dentro del orbital.
Así, los números cuánticos nos representa el lugar en el que encontraremos un electrón, y si por ejemplo tenemos 4px !, quiere decir que el electrón está en el nivel de energía 4, se encuentra en el orbital p girando sobre el eje de las x con un giro hacia arriba o positivo.
Principio de Exclusión de Pauli: Ningún electrón de un mismo átomo tiene sus cuatro números cuánticos iguales.
Llenado de Orbitales:
Para los primeros 18 elementos, los electrones van ocupando los orbitales empezando por el más bajo nivel de energía, y van llenando su capacidad antes de empezar el siguiente.
Regla de Hund: Para cualquier conjunto de orbitales, se llena primero con electrones que tienen su número spin positivo, y luego los que tienen spin negativo.
El llenado de los orbitales se sigue como representa el siguiente diagrama, que se conoce como “Diagrama de AUFBAU”:

Configuración Electrónica:
Esto se refiere a determinar cuáles son los números cuánticos de cada uno de los electrones de un átomo. Por ejemplo, desarrollaremos la configuración electrónica de los siguientes elementos:
Cromo 24
!! !! !! !! !! !! !! !! !! !! ! !
1s 2s 2px 2py 2pz 3s 3px 3py 3pz 4s 3dxy 3dxz
! ! !
3dyz 3dx2-y2 3dz2
Hierro 87
!! !! !! !! !! !! !! !! !! !! !! !!
1s 2s 2px 2py 2pz 3s 3px 3py 3pz 4s 3d 3d
!! !! !! !! !! !! !! !! !! !! !! !!
3d 3d 3d 4px 4py 4pz 5s 4d 4d 4d 4d 4d
!! !! !! !! !! !! !! !! !! !! !! !!
5px 5py 5pz 6s 4f 4f 4f 4f 4f 4f 4f 5d
!! !! !! !! !! !! !! !
5d 5d 5d 5d 6px 6py 6pz 7s
También se puede escribir la configuración de una manera más sintetizada, omitiendo el tipo de spin:
Cesio 55
1s2 | 2s2 2p6 | 3s2 3p6 | 4s2 3d10 4p6 | 5s2 4d10 5p6 | 6s1
Enlaces:
Los átomos se entrelazan entre si para formar compuestos.
Enlace Iónico: Es cuando hay transferencia completa de un átomo a otro. El átomo que pierde electrones se convierte en un ión positivo o catión, y el que gana se convierte en ión negativo o catión. Es más común encontrar enlaces covalentes entre los elementos de los primeros tres grupos. Cuando un átomo pierde electrones se dice que se oxida, y cuando gana se dice que se reduce.
Enlace Covalente: Es cuando los átomos que se combinan comparten electrones. Se forma con facilidad entre átomos semejantes. El hidrógeno siempre forma enlaces covalentes. Hay diversos tipos de enlaces covalentes:
Polar: Entre dos elementos distintos Si**C
No Polar: Entre elementos iguales C**C
Coordinado: El enlace se forma con dos electrones del mismo átomo
Sencillo: Comparten un par de electrones
Doble: Comparten dos pares de electrones
Triple: Comparten tres pares de electrones
Electronegatividad: Es una medida de la tendencia que muestra un átomo de in enlace covalente de atraer hacia sí los electrones compartidos.
Estructura de Lewis: Es una representación de una molécula, en donde solo se indican los electrones de valencia de los átomos. Se utiliza un guión para representar un enlace covalente, y puntos para los electrones no compartidos.
| Tipo de Enlace | ||
| Iónico | ||
|
| ||
| Coordinado | ||
| Polar | ||
| No Polar | ||
Nomenclatura
Formación de Compuestos:
Se escriben los símbolos de los elementos a combinarse
Se intercambian las valencias (si es 1 no se escribe)
Se simplifica si es posible
(2) Be Cl (-1)
Be-1 Cl2
BeCl2
Óxidos
Metal + Oxígeno __________! Óxido Metálico
Se forman cuando se combinan un metal con el ión óxido. Se les nombra indicando primero la palabra óxido, y luego el nombre del metal correspondiente.
Ej:
Sodio + Oxígeno __________! Óxido de Sodio (Na2O)
Magnesio + Oxígeno __________! Óxido de Magnesio (MgO)
Si un elemento tiene dos valencias, con la menor se le agrega la terminación oso al compuesto, y con la mayor se le agrega la terminación ico. Por ejemplo, el hierro tiene dos valencias, +2 y +3. Al combinarse con el oxígeno se tiene:
FeO ___! (Valencia Menor) Óxido Ferroso
Fe2O3 ___! (Valencia Mayor) Óxido Férrico
Anhídridos
No Metal + Oxígeno _____________! Anhídrido
Se forman cuando se combinan un no metal mas oxígeno. También se les conoce como óxidos ácidos u oxiácidos. Se nombran poniendo primero óxido, con el prefijo que indique el número de átomos de oxígeno presentes y el nombre del elemento que los acompaña.
CO ___! Monóxido de Carbono
N2O5 ___! Pentaóxido de Dinitrógeno
Hidróxidos:
Se forman cuando un óxido reacciona con el agua. Contienen el grupo oxhidrilo o hidroxilo, que tiene valencia de -1.
NaOH ___! Hidróxido de Sodio
Ba (OH)2 ___! Hidróxido de Bario
Oxiácidos
Se forman de la reacción de un anhídrido con el agua. Su fórmula se escribe poniendo el Hidrógeno, luego el no metal, y por útlimo el oxígeno.
HNO2 ___!Ácido Nitroso
HNO3 ___! Ácido Nítrico
Hidruros
Son compuestos que resultan de la unión de un compuesto químico con el hidrógeno.
Metálicos: Unión de un metal y el hidrógeno. Primero se pone el metal y luego el hidrógeno, seguido por un subíndice que indique el número de oxidación de el meta:
MgH2 ___! Hidruro de Magnesio
CuH ___! Hidruro Cuproso
CuH2 ___! Hidruro Cúprico
No Metálicos: Se sigue el mismo proceso que en los metálicos, solo que usando elementos no metálicos. También se pueden nombrar poniendo primero la palabra “ácido”, seguido por el nombre del elemento y terminando con “hídrico”
CH4 ___! Hidruro de Carbono o Ácido Carbonhídrico.
SH4 ___! Hidruro de Azufre o Ácido Sulfhídrico
Sales
Se forman de la reacción de un ácido y un hidróxido.
Sales Binarias: Están formadas entre un metal y un no metal. La fórmula se escribe poniendo primero el metal y después el no metal. Se nombra poniendo primero el no metal con la terminación “uro” y después el nombre del metal.
CaBr ___! Bromuro de Calcio
FeCl2 ___! Cloruro Ferroso
FeCl3 ___! Cloruro Férrico
NaCl ___! Cloruro de Sodio
BaF2 ___! Fluoruro de Bario
Halógenos Combinados con Cualquier elemento:
| | | X = Na y Y = Cl |
| YX | Xuro de Y | Cloruro de Sodio |
| YXO | Hipo X ito de Y | Hipoclorito de Sodio |
| YXO2 | X ito de Y | Clorito de Sodio |
| YXO3 | X ato de Y | Clorato de Sodio |
| YXO4 | Per X ato de Y | Perclorato de Sodio |
Halógenos Combinados con Hidrógeno:
| | | X = Cl |
| HX (-1) | Ácido X hídrico | Ácido Clorhídrico |
| HX (+1) | Ácido hipo X oso | Ácido Hipocloroso |
| HX (+3) | Ácido X oso | Ácido Cloroso |
| HX (+5) | Ácido X ico | Ácido Clórico |
| HX (+7) | Ácido per X ico | Ácido Perclórico |
Halógenos Combinados con Hidrógeno y Oxígeno:
| | | X = Cl |
| HXO | Ácido Hipo X oso | Ácido Hipocloroso |
| HXO2 | Ácido X oso | Ácido Cloroso |
| HXO3 | Ácido X ico | Ácido Clórico |
| HXO4 | Ácido Per X ico | Ácido Perclórico |
Iones Comunes
Éstos se nombran poniendo primero el nombre del ión y luego del elemento que lo acompaña, como en CaCO3, se nombra Carbonato de Calcio
Peróxido O2 (-2)
Hidróxido OH (-1)
Carbonato Ácido HCO3 (-1)
Cianuro CN (-1)
Acetato CH3COO (-1)
Nitrato NO3 (-1)
Nitrito NO2 (-1)
Óxido O (-2)
Carbonato CO3 (-2)
Oxalato C2O4 (-2)
Cromato CrO4 (-2)
Dicromato Cr2O7 (-2)
Sulfato SO4 (-2)
Sulfito SO3 (-2)
Fosfato PO4 (-3)
Fosfito PO3 (-3)
Reacciones Químicas
Tipos de Reacciones
Las reacciones son los procesos que se llevan a cabo en diversas sustancias para formar compuestos.
Para escribir una reacción, se ponen de un lado los compuestos que van a reaccionar, seguidos de una flecha, y por último el resultado. Existen diferentes tipos:
Síntesis: A + B ___! AB
K Cl + O3 ___! K Cl O3
Cloruro de Potasio + Ozono Clorato de Potasio
Descomposición: AB ___! A + B
K Cl O3 ___! K Cl + O3
Clorato de Potasio Cloruro de Potasio + Ozono
Sustitución Simple: AB + C ___! AC + B
2Al + 3H2 SO4 ___! Al2 (SO4)3 + 3H2
Aluminio + Ácido Sulfúrico Sulfato de Aluminio + Dihidrógeno
Sustitución Doble: AB + CD ___! AD + BC
Fe2 (SO4)3 + 6NaOH ___! 2Fe(OH)3 + 3Na2SO4
Sulfato Férrico + Hidróxido de Sodio Hidróxido Férrico + Sulfato de Sodio
Balanceo de Ecuaciones
El balanceo de ecuaciones pretende que en una ecuación química exista el mismo número de átomos tanto reactivos como productos. Para ello se agregan coeficientes que indican el número de moles que se están usando de determinada sustancia. Los subíndices en una fórmula química indican el número de elementos presentes de un compuesto.
Por tanteo:
Se trata de buscar que tanto la parte que reacciona como la resultante tengan el mismo número de átomos. Para ello agregamos coeficientes a las fórmulas (nunca se agregan subíndices)
N2 + O2 ___! NO2
Primero se escriben todos los Elementos que se tengan y se cuentan cuántos átomos están presentes de cada lado de la flecha:
2 - N - 1
2 - O - 2
Se puede ver que al lado derecho le falta un N para estar igual que al izquierdo, entonces se pone un 2 en el lado derecho para tener dos N de ese lado:
N2 + O2 ___! 2NO2
Se vuelven a contar los átomos presentes:
2 - N - 2
2 - O - 4
Ahora se tienen más O del lado derecho que del izquierdo, por lo que se trata de igualar el lado izquierdo agregando dos O:
N2 + 2O2 ___! 2NO2
Se vuelven a contar los átomos:
2 - N - 2
4 - O - 4
Como ya existen igual número de átomos en ambos lados de la flecha, se dice que la reacción está balanceada.
Ejemplo 2:
Fe2(SO4)3 + NaOH ___! Fe(OH)3 + Na2SO4
2 - Fe - 1
3 - S - 1
12 - O - 7
1 - Na - 2
1 - H - 3
Fe2(SO4)3 + NaOH ___! 2Fe(OH)3 + Na2SO4
2 - Fe - 2
3 - S - 1
12 - O - 10
1 - Na - 2
1 - H - 6
Fe2(SO4)3 + NaOH ___! 2Fe(OH)3 + 3Na2SO4
2 - Fe - 2
3 - S - 3
12 - O - 18
1 - Na - 6
1 - H - 6
Fe2(SO4)3 + 6NaOH ___! 2Fe(OH)3 + 3Na2SO4
2 - Fe - 2
3 - S - 3
18 - O - 18
6 - Na - 6
6 - H - 6
Balanceo Por Redox:
Todos los elementos solos tienen por número de Oxidación 0
Siempre hay uno que se oxida y otro que se reduce
Por lo general el Hidrógeno trabaja con valencia +1 y el Oxígeno con valencia -2
Se identifica el número de valencia de todos los átomos presentes
El número de valencia será igual al de oxidación
Se compara el número de oxidación de los átomos de un mismo elemento del lado izquierdo de la flecha con los del lado derecho
Si el número de oxidación aumentó de izquierda a derecha, se dice que se Oxida, es decir, que pierde electrones.
Si el número de oxidación disminuyó de izquierda a derecha, se dice que se Reduce, es decir, que gana electrones.
Se busca que el número de electrones ganados sea igual al número de electrones perdidos, por lo que se multiplica por diferentes coeficientes como sigue:
N de Oxidación 1 3 -2 0 2 1 0
AgNO3 + Cu ___! Cu(NO3)2 + Ag
1 - Ag - 0 (Se Redujo)
0 - Cu - 2 (Se Oxidó)
Cu0 +2e ___! Cu+2
Ag1 - 1e ___! Ag0
Aquí es donde se multiplica por algún número, para que el número de electrones ganados y perdidos sea igual:
Cu0 +2e ___! Cu+2
2[Ag1 - 1e ___! Ag0] =
Cu0 +2e ___! Cu+2
2Ag2 - 2e ___! 2Ag0
Aquí ya quedaron iguales el número de electrones ganados y el número de electrones perdidos.
Se rescribe la ecuación, poniendo los coeficientes obtenidos en su lugar correspondiente
2AgNO3 + Cu ___! Cu(NO3)2 + 2Ag
Estequiometría:
Esto se refiere al cálculo de cantidades de sustancias que participan en reacciones químicas. Cuando se conoce la cantidad de una sustancia que toma parte de una reacción química, y la ecuación química está bien balanceada, se puede conocer las cantidades de otros reactivos o productos.
Se pueden establecer las relaciones molares que existen entre los elementos presentes en una reacción, por ejemplo:
N2 + 3 H 2 ___! 2 NH2
Existe un mol de N2 por cada 3 moles de H2, o también se expresa:
o
También existe un mol de N2 por cada 2 moles de NH2
o
De manera similar, existen 3 moles de H2 por cada 2 moles de NH2
o
Cálculos Estequiométricos de Mol a Mol
Mediante la estequiometría podemos saber, cuando se conoce la ecuación química y también el número de moles de uno o de cualquiera de los reactivos o productos, el número proporcional de moles necesarios para dicha reacción.
Para ello se siguen éstos pasos
Obtener la ecuación química balanceada
Anotar la cantidad conocida de una sustancia química (expresada en éste caso en moles) Puede ser cualquier reactivo o producto de la reacción. (Ésta será la sustancia de partida)
Anotar la relación molar apropiada con base de la ecuación química como sigue:
Moles de la sustancia deseada
Moles de la sustancia de partida
Multiplicar el número conocido de moles de la sustancia química de partida (paso 2) por la relación molar apropiada (paso 3) para obtener los moles de la sustancia deseada.
Ejemplo:
Obtener el número de moles de Oxígeno gaseoso necesario para quemar 1.20 moles de alcohol etílico C2H5OH, cuya ecuación química es:
C2H5OH + 3O2 ___! 2CO2 + 3H2O
1.2 moles C2H5OH
1.2 mol C2H5OH * = 3.6 mol de O2
Cálculos Estequiométricos con Moles y Masas
En ocasiones las cantidades de sustancias químicas en una reacción se expresan en gramos o kilogramos. Para realizar cálculos estequiométricos se requiere primero que la sustancia se convierta de gramos a moles. Para ello:
Obtener la ecuación química balanceada
Anotar la cantidad conocida de una sustancia química en “gramos de A”
Convertir los “gramos de A” a “moles de A”
Convertir los “moles de A” a “moles de B” usando la relación molar apropiada, como se vio en el cálculo de mol a mol.
Convertir los “moles de B” en “gramos de B”
Ejemplo:
Obtener cuántos gramos de Oxígeno gaseoso se requieren para quemar 10 g de alcohol etílico C2H5OH, cuya ecuación química es:
C2H5OH + 3O2 ___! 2CO2 + 3H2O
Obtener la ecuación balanceada
10g de C2H5OH
10g de C2H5OH *
10g de C2H5OH * *
10g de C2H5OH * * *
R = 20.9 g de O2
Descargar
| Enviado por: | Karla Lszz |
| Idioma: | castellano |
| País: | México |
