Química
Identificación de aldehídos y cetonas
PRACTICA No. 7
IDENTIFICACION DE ALDEHIDOS Y CETONAS
I. OBJETIVOS
a) Identificar el grupo carbonilo de aldehídos y cetonas.
b) Distinguir entre un aldehído y una cetona por medio de reacciones características y fáciles de llevarse a cabo en el laboratorio.
II. REACCION
Para la realización de esta práctica se llevaron a cabo diversas reacciones que se anotaran a continuación:
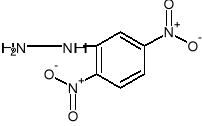
Reacción de identificación de grupo carbonilo con 2,4 - dinitrofenilhidrazonas.
![]()
+ 
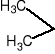
+
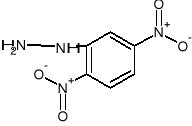
+ H2+ 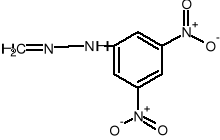
+ H2O
Ensayo con ácido crómico.
![]()
+ 2CrO3 + H2SO4 ![]()
+ Cr+ + 3O- + H2+ + SO4 -
![]()
+ Cr2(SO4)3 + H2O
Reacción de Tollens para identificación de aldehidos.
Prueba con yodoformo.
III. MATERIAL
-
Vasos de precipitado.
-
Probetas graduadas.
-
Pinzas de tres dedos con nuez.
-
Pipetas.
-
Resistencia eléctrica.
-
Tubos de ensaye.
-
Espátula.
-
Gradilla.
-
Agitador de vidrio.
-
Pinzas para tubo de ensaye.
-
Embudo de vidrio.
-
Vidrio de reloj.
-
Bencenona
-
Benzaldehido.
-
Formaldehído.
-
Acetona.
-
Solución de 2,4 - dinitrofenilhidrazina.
-
Etanol.
-
Solución de hidróxido de sodio al 10%
-
Solución de AgNO3 al 5%
-
NH4OH 5%
-
H2SO4 concentrado.
-
HNO3 concentrado.
-
Solución de ácido crómico.
-
Yoduro de potasio / solución de yodo.
IV. FUNDAMENTO TEÓRICO.
1.- Propiedades físicas, químicas y toxicidad de reactivos y productos.
BENZALDEHIDO
El benzaldehido (C6H5 - CHO) es un líquido incoloro de olor agradable a almendras amargas que se emplea en la fabricación de colorantes y perfumes. Se obtiene a partir del tolueno por oxidación parcial con dióxido de manganeso hidratado o por cloruración previa a cloruro de benzal (C6H5 - CHCL2) e hidrólisis o mediando una síntesis a partir de benceno y monóxido de carbono con cloruro de aluminio anhídrido o CHI o CNH como catalizador. Es también componente de algunos frutos secos, tales como las almendras amargas, siendo el causante del sabor y olor tan característico de estos frutos. Es ligeramente soluble en agua, con la que reacciona lentamente, y miscible en isopropanol y aceites.
Entre las características químicas del benzaldehido se encuentra su capacidad para oxidarse lentamente en presencia del aire, dando un compuesto químico de propiedades conservantes conocido como ácido benzoico (E-210). Dicho compuesto puede obtenerse al estar en contacto con álcalis, reacción conocida como la reacción de Cannizaro, obteniendo como producto el alcohol bencílico Esto hace que sea utilizado como solvente de aceites, resinas, y de varios ésteres y éteres celulósicos.
Reactividad:
Condensación aldólica: Negativa, al carecer de hidrógenos en posición alfa.
FORMALDEHIDO
El formaldehído o metanal es un compuesto químico, más específicamente un aldehído (el más simple de ellos) es altamente vólatil y muy inflamable (o flamable), de fórmula H2C=O. Fue descubierto en 1867 por el químico alemán August Wilhelm von Hofmann. Se obtiene por oxidación catalítica del alcohol metílico. A temperatura normal es un gas incoloro de un olor penetrante, muy soluble en agua y en esteres. Las disoluciones acuosas al ± 40 % se conocen con el nombre de formol, que es un líquido incoloro de olor penetrantemente placentero y sofocante; estas disoluciones pueden contener alcohol metílico o etanoatodimetilico como estabilizante. Puede ser comprimido hasta el estado líquido; su punto de ebullición es -21 °C.
Tiene muchos nombres su nombre tradicional proviene de fornica, el nombre latín de hormiga; su nombre según la nomenclatura sistemática de la IUPAC es metanal.
En el cuerpo se producen pequeñas cantidades de formaldehódo en forma natural. Sin embargo se trata de un compuesto tóxico que ha demostrado propiedades cancerígenas en diversos experimentos con animales. En ratas puede provocar cáncer si se aplica de forma prolongada en concentraciones superiores a 6 ppm en el aire respirado. En el hombre estas concentraciones provocan ya irritaciones en ojos y muscosidades en poco tiempo (10 a 15 min. luego de la exposición). Estudios epidemiológicos aún no han demostrado ninguna relación causa - efecto sobre los casos de cáncer estudiados, igualmente cabe destacar que tratar pacientes con cáncer con derivados de formaldehído ha causado en pocos casos una disminución de las células cancerosas o en estado de metástasis.
Niveles bajos de metanal pueden producir irritación a la piel, los ojos, la nariz y la garganta. La gente que sufre de asma es probablemente más susceptible a los efectos de inhalación de formaldehído.
A partir de 30 ppm el formaldehído puede resultar letal o fatal.
ACETONA
La acetona o propanona es un compuesto químico de fórmula química CH3 (CO) CH3 del grupo de las cetonas que se encuentra naturalmente en el medio ambiente. Es un líquido incoloro de olor y sabor característicos. Se evapora fácilmente, es inflamable y es soluble en agua. La acetona sintetizada se usa en la fabricación de plásticos, fibras, medicamentos y otros productos químicos, así como disolvente de otras sustancias químicas.
Si una persona se expone a la acetona, ésta pasa a la sangre y es transportada a todos los órganos en el cuerpo. Si la cantidad es pequeña, el hígado la degrada a compuestos que no son perjudiciales que se usan para producir energía para las funciones del organismo. Sin embargo, respirar niveles moderados o altos de acetona por períodos breves puede causar irritación de la nariz, la garganta, los pulmones y los ojos; dolores de cabeza; mareo; confusión; aceleración del pulso; efectos en la sangre; náusea; vómitos; pérdida del conocimiento y posiblemente coma. Además, puede causar acortamiento del ciclo menstrual en mujeres.
Tragar niveles muy altos de acetona puede producir pérdida del conocimiento y daño a la mucosa bucal. Contacto con la piel puede causar irritación y daño a la piel.
El aroma de la acetona y la irritación respiratoria o la sensación en los ojos que ocurren al estar expuesto a niveles moderados de acetona son excelentes señales de advertencia que pueden ayudarlo a evitar respirar niveles perjudiciales de acetona.
Los efectos de exposiciones prolongadas sobre la salud se conocen principalmente debido a estudios en animales. Las exposiciones prolongadas en animales produjeron daño del riñón, el hígado y el sistema nervioso, aumento en la tasa de defectos de nacimiento, y reducción de la capacidad de animales machos para reproducirse. No se sabe si estos mismos efectos pueden ocurrir en seres humanos.
ETANOL
El compuesto químico etanol es un alcohol que se presenta un líquido incoloro e inflamable con un punto de ebullición de 78 °C. Al mezclarse con agua en cualquier proporción, da una mezcla azeotrópica con un contenido de aproximadamente el 96 % de etanol.
Su fórmula química es CH3-CH2--OH, principal producto de las bebidas alcohólicas.
El etanol puede afectar al sistema nervioso central, provocando estados de euforia, desinhibición, mareos, somnolencia, confusión, alucinaciones (como lo sean ver doble o que todo se mueve de forma espontánea). Al mismo tiempo, baja los reflejos. Con concentraciones más altas ralentiza los movimientos, impide la coordinación correcta de los miembros, pérdida temporal de la visión, etc. En ciertos casos se produce un incremento en la irritabilidad del sujeto intoxicado como también en la agresividad; en otra cierta cantidad de individuos se ve afectada la zona que controla los impulsos, volviéndose impulsivamente descontrolados y frenéticos. Finalmente, conduce al coma y puede provocar la muerte.
La resistencia al alcohol parece aumentar en las personas adultas, de mayor peso y de menor altura, mientras que los niños son especialmente vulnerables. Se han comunicado casos de bebés que murieron por intoxicación debida a la inhalación de vapores de etanol tras haberles aplicado trapos impregnados de alcohol. La ingesta en niños puede conducir a un retardo mental agravado o a un subdesarrollo físico y mental. También se han realizado estudios que demuestras que si las madres ingerían alcohol durante el embarazo, sus hijos podían ser más propensos a tener malformaciones o retardos.
También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70 %.
NITRATO DE PLATA
El nitrato de plata es un compuesto químico cuya fórmula es AgNO3. Es un sólido blanco.
Aplicación médica: cauterización de hemorragias cuando no se detienen por otras vías. Es muy tóxico, puede causar daños graves e incluso de la muerta. Causa irritación sus efectos a largo plazo son desconocidos y en los ojos puede causar ceguera.
ACIDO NITRICO
El compuesto químico ácido nítrico o ácido trioxonítrico (V) (HNO3) es un líquido corrosivo, tóxico, que puede ocasionar severas quemaduras.
Es utilizado comúnmente como un reactivo de laboratorio, se utiliza para fabricar explosivos como la nitroglicerina y trinitrotolueno (TNT), así como fertilizantes como el nitrato de amonio. Tiene usos adicionales en metalurgia y en refinado ya que reacciona con la mayoría de los metales y en la síntesis química. Cuando se mezcla con el ácido clorhídrico forma el agua regia, un raro reactivo capaz de disolver el oro y el platino. El ácido nítrico también es un componente de la lluvia ácida.
Es un líquido viscoso, incoloro e inodoro. A menudo, distintas impurezas lo colorean de amarillo-marrón. A temperatura ambiente libera humos rojos o amarillos. El ácido nítrico concentrado tiñe la piel humana de amarillo al contacto.
YODURO DE POTASIO
El yoduro de potasio (KI) es un compuesto cristalino blanco, muy soluble en agua. Son casi indefinidos los riesgos que puede causar a la salud humana.
2.- Formación de derivados para caracterización de aldehídos y cetonas.
a) Hidrogenación
Los aldehídos y cetonas se transforman en alcoholes al hacerlos pasar sobre Cu a 300°C en un proceso inverso al de deshidrogenación de alcoholes. Los aldehídos conducen a la formación de alcoholes primarios:
| R—CHO + H2 | Cu | Rr—CH2OH |
| aldehído |
| alcohol primario |
Las cetonas por su parte se reducen a alcoholes secundarios:
| R—CO—R' + H2 | Cu | R—CHOH—R' |
| cetona |
| alcohol secundario |
b) Reacción bisulfítica
Los aldehídos y metilcetonas (con un grupo metilo en posición ![]()
), reaccionan con bisulfito sódico para dar lugar a un compuesto cristalino: el «compuesto bisulfítico».
| R—CHO + NaHSO3 | R—CHOH—SO3Na | |
| aldehído |
| derivado bisulfítico de un aldehído |
| R—CO—CH3 + NaHSO3 | R—COH(CH3)—SO3Na | |
| cetona |
| derivado bisulfítico de una cetona |
c) Adición de CNH
Aldehídos y cetonas adicionan cianuro de hidrógeno para dar lugar a la formación de cianhidrinas (hidroxinitrilos).
| R—CHO + HCN | R—CHOH—CN | |
| aldehído |
| cianhidrina |
| R—CO—R' + HCN | R—COH(CN)—R' | |
| cetona |
| cianhidrina |
d) Condensación aldólica
Los aldehídos en presencia de disoluciones diluidas de hidróxidos alcalinos sufren la denominada «condensación aldólica», con formación de un aldol (molécula que contiene simultáneamente las funciones aldehído y alcohol).
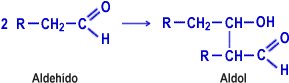
e) Polimerización
En presencia de ácidos inorgánicos diluidos, los aldehídos sufren una autoadición con ciclación simultánea en la que se forman trímeros cíclicos; así en el caso del formaldehído se forma trioxano:

En el caso del acetaldehído se forma paraldehído. Las cetonas, sin embargo, no se polimerizan.
3.- Reacción de identificación de aldehídos
Los aldehídos se oxidan con facilidad incluso bajo la acción de oxidantes suaves para dar lugar a un ácido carboxílico (o sus sales) con el mismo número de átomos de carbono que el aldehído sometido a oxidación.
-
Reacción de Tollens:
-
Reacción de Fehling:
-
Reacciones de identificación del grupo carbonilo con 2,4—dinitrofenilhidrazina.
-
Ensayo con ácido crómico.
-
Reacción de Tollens para aldehídos.
-
Prueba del yodoformo.
-
http://es.wikipedia.org/wiki/Benzaldehido
-
http://es.wikipedia.org/wiki/Formaldeh%C3%ADdo
-
http://es.wikipedia.org/wiki/Acetona
-
http://es.wikipedia.org/wiki/Etanol
-
http://es.wikipedia.org/wiki/Nitrato_de_plata
-
http://es.wikipedia.org/wiki/%C3%81cido_n%C3%ADtrico
-
http://es.wikipedia.org/wiki/Yoduro_de_potasio
-
http://www.geocities.com/jojoel99/principal/cac.html
-
http://www.canalsocial.net/GER/ficha_GER.asp?titulo=CETONAS&cat=ciencia
-
Efectuar una condensación aldólica mixta.
-
Obtener un producto de uso comercial.
-
Pipetas
-
Bomba de vacio
-
Matraz
-
Parrilla
-
Termómetro
-
Agitador
-
Embudo de adicion
-
Kitazato
-
Embudo Bugner
-
Papel filtro
-
Cormatoplaca
-
Pipeta Pasteur
-
Vidrio de reloj
-
Vasos de precipitado
-
Embudo de adicion
-
Hidroxido de sodio
-
Etanol
-
Benzaldehido
-
Yodo
-
Acetona
-
Hexano
-
Gel de sílice
-
Acetato de etilo
-
Revista:
-
Química Orgánica
-
Matraz pera de una boca.
-
Probeta graduada.
-
Refrigerante con manguera.
-
T de destilación.
-
Porta termómetro.
-
Colector.
-
Vasos de precipitado.
-
Matraces Erlenmeyer.
-
Embudo de separación con tapón.
-
Termómetro.
-
Pinzas de tres dedos.
-
Agitador de vidrio.
-
Espátula.
-
Alcohol isoamílico.
-
Ácido acético glacial.
-
Ácido sulfúrico concentrado.
-
Solución de NaHCO3 al 5%.
-
Solución saturada de cloruro de sodio.
-
Sulfato de sodio anhidro.
-
http://enciclopedia.us.es/index.php/%E1cido_ac%E9tico
-
http://www.fichasdeseguridad.com/alcohol_isoamilico.htm
-
http://www.ubp.edu.ar/todoambiente/empresasyambientes/tratamiento_de_residuos/liquidos/acetato_de_isoamilo.htm
-
http://enciclopedia.us.es/index.php/%C9ster
-
http://html.rincondelvago.com/sintesis-del-benzoato-de-metilo.html
-
Tubos de ensaye.
-
Vasos de precipitado.
-
Espátula.
-
Pinzas de tres dedos con nuez
-
Parrilla
-
Pinzas para tubo de ensaye.
-
Matraz erlenmeyer.
-
Solución de nitrato de plata (AgNO3) al 2.5%
-
Solución de hidróxido de sodio (NaOH) al 5%
-
Hidróxido de amonio al 5%
-
Reactivo de Fehling A.
-
Reactivo de Fehling B.
-
Acido nítrico concentrado.
-
Reactivo de Benedict.
-
Manosa al 5%.
-
Glucosa al 5%.
-
Sacarosa al 5%.
-
Fructuosa al 5%.
-
Reactivo de fenilhidrazina.
-
http://es.wikipedia.org/wiki/Fructosa
-
http://www.um.es/molecula/gluci02.htm
-
http://es.wikipedia.org/wiki/Monosac%C3%A1rido
-
http://www.monografias.com/trabajos24/carbohidratos/carbohidratos.shtml#monos
-
http://www.ehu.es/biomoleculas/HC/SUGAR31A.
-
http://es.wikipedia.org/wiki/Fehling
-
http://es.wikipedia.org/wiki/%C3%81cido_n%C3%ADtrico
-
http://www.fichasdeseguridad.com/ficha_seguridad_msds/zf-008.htm
-
http://es.wikipedia.org/wiki/Sacarosa
-
Matráz pera de una boca.
-
Probeta graduada.
-
Espátula.
-
Refrigerante.
-
Pinzas de tres dedos con nuez.
-
Vasos de precipitado.
-
Embudo de separación.
-
Matraz Elernmeyer.
-
Colector.
-
Parrilla.
-
Embudo de filtración rápida.
-
T de destilación.
-
Malonato de dietilo.
-
Hidróxido de amonio en etanol.
-
Benzaldehido.
-
Ácido clorhídrico 1:1.
-
http://www.segulab.com/acido_cinamico.htm
-
http://es.wikipedia.org/wiki/Benzaldehido
-
http://training.itcilo.it/actrav_cdrom2/es/osh/ic/110894.htm
-
http://es.wikipedia.org/wiki/Piridina
-
http://dta.utalca.cl/quimica/profesor/astudillo/Capitulos/capitulo21.htm
| R—CHO + 2AgOH + | NH4OH | R—COONH4 + 2 H2O + 2Ag | ||
| aldehído | hidróxido | sal amoniacal del | ||
El reactivo es una disolución amoniacal de nitrato de plata. Con frecuencia la plata se deposita sobre el vidrio del recipiente originando un espejo.
| R—CHO + 2Cu(OH)2 + | NaOH | R—COONa + 3 H2O + Cu2O | |
| aldehído | hidróxido | sal amoniacal del | |
Los reactivos son: una disolución de sulfato cúprico y otra de hidróxido sódico y tartrato de sodio y potasio (que evita la precipitación del hidróxido cúprico).
4.- Reacción de identificación de cetonas.
Las cetonas son muy resistentes a la acción de los agentes oxidantes, y cuando se oxidan lo hacen dando lugar a una mezcla de ácidos carboxílicos con menos átomos de carbono cada uno de ellos que la cetona que se oxida.
V. DIBUJO
Para la realización de las observaciones el orden de los aldehídos y cetonas es el siguiente: bencenona, benzaldehido, formaldehído y acetona. Todos los tubos están ordenados de esa forma.


Reacción de 2,4 - dinitrofenilhidrazina Ensayo crómico


Reacción de Tollens Reacción de yodoformo
VI. RESULTADOS Y OBSERVACIONES
1.- Bencenona.- resultado positivo con presencia de un precipitado amarillo y con el líquido color naranja.
2.- Benzaldehido.- resultado positivo con presencia de un precipitado amarillo.
3.- Formaldehído.- resultado positivo con presencia de un precipitado amarillo y con el líquido color amarillo.
4.- Acetona.- resultado positivo con la presencia de un precipitado.
1.- Bencecnona.- resultado negativo sin presencia de cambios.
2.- Benzaldehido.- resultado negativo sin presencia de cambios.
3.- Formaldehído.- resultado positivo con el cambio a un verde muy oscuro.
4.- Acetona.- resultado negativo sin la presencia de un cambio.
1.- Bencenona.- resultado negativo sin la presencia de cambios.
2.- Benzaldehido.- resultado positivo con la presencia de un aspecto lechoso.
3.- Formaldehído.- resultado positivo con la presencia de un color plata.
4.- Acetona.- resultado negativo sin la presencia de un cambio.
1.- Bencenona.- resultado negativo sin presencia de cambios.
2.- Benzaldehido.- resultado negativo sin presencia de cambios.
3.- Formaldehído.- resultado negativo sin presencia de cambios.
4.- Acetona.- resultado negativo sin presencia de cambios.
La presente práctica no requiere el cálculo de rendimiento.
VII. CONCLUSIONES
Las conclusiones para el presente experimento son muy largas por la presencia de tantas pruebas. Primeramente para la reacción de identificación de grupos carbonilos con la presencia de 2,4—dinitrofenilhidrazina, evidentemente las 4 reacciones resultaron positivas por que los cuatro grupos analizados contienen en sus compuestos el grupo carbonilo. Evidentemente si la muestra analizada hubiera sido de otro tipo como un alcohol, la reacción hubiera resultado negativa on tal vez con otro tipo de resultados.
Para la prueba número 2 que es la presencia de aldehídos con el ensayo de ácido crómico, en efecto salió positivo la prueba en presencia de formaldehído y negativa para los dos tipos de cetonas analizadas. Sin embrago para la presencia de aldehídos en la muestra de benzaldehído salió negativa, probablemente por el mal manejo de la muestra o una mala observación.
Para la tercera prueba que es la presencia de aldehídos con la reacción de Tollens resultó correcta ya que los dos aldehídos observados presentaron positiva la reacción y las cetonas observadas dieron negativas.
Finalmente para la prueba del yodoformo es evidente que las cuatro reacciones resultaran negativas, ya que el yodoformo sólo reacciona con metil cetonas y alcoholes y ninguna de las muestras anteriores fueron analizadas.
VIII. BIBLIOGRAFIA
IX. CUESTIONARIO
1.- ¿Cómo identificó el grupo carbonilo en aldehídos y cetonas?
Con la utilización del reactivo 2,4—dinitrofenilhidrazina.
2.- Escriba la reacción que permitió dicha identificación
![]()
+ 

+

+ H2+ 
+ H2O
3.- ¿Cómo diferenció a un aldehído de una cetona?
Con la reacción de el ensayo crómico pero principalmente con la prueba de Tollens.
4.- Escriba la o las reacciones que le permitieron diferenciar uno de otro.
![]()
+ 2CrO3 + H2SO4 ![]()
+ Cr+ + 3O- + H2+ + SO4 -
![]()
+ Cr2(SO4)3 + H2O
5.- ¿En qué consiste la reacción de haloformo y en que casos se lleva a cabo?
Un caso interesante de halogenación es la llamada reacción del haloformo, que tiene interés preparativo y analítico, sirviendo para la caracterización en una molécula orgánica de grupos C13-CO- y C113-CHOH-. La reacción del haloformo se realiza tratando una metilcetona (o un metilcarbinol, ya que éste en las condiciones de la reacción se oXIda a metilcetona) con un halógeno en medio básico. La reacción consiste primero en una sustitución, catalizada por la base del medio, de los hidrógenos del grupo metilo por átomos de halógeno, seguido de una sustitución nucleófila del carbanión trihalogenometilo por un ion hidróxido. Este último tipo de sustitución, poco frecuente en los compuestos carbonílicos sencillos, se produce por la relativamente escasa basicidad del carbanión trihalogenometilo (comparativamente con otros carbaniones) y por la irreversibilidad, ya que en el medio acuoso básico de la reacción los dos productos resultantes en la sustitución nucleófila se «consumen» transformándose inmediatamente en el anión carboXIlato y una molécula de haloformo.
6.- Escriba la reacción

7.- Complete el siguiente cuadro, indicando los resultados:
| Sustancia | 2,4-dinitrofenilhidrazina | Ácido crómico | Reacción de Tollens | Reacción del yodoformo |
| Aldehído alifático | Positivo | Positivo | Positivo | Negativo |
| Aldehído aromático | Positivo | Negativo | Positivo | Negativo |
| Cetona alifática | Positivo | Negativo | Negativo | Negativo |
| Cetona aromática | Positivo | Negativo | Negativo | Negativo |
PRACTICA No. 8
CONDENSACION DE CLAISEN-SCHMIDT
OBTENCION DE DIBENZALACETONA
I. OBJETIVOS
II. REACCION
Obtención de acetato de isoamilo
III. MATERIAL
IV. FUNDAMENTO
1.- Reacciones de condensación aldólica.
Una reacción de condensación conduce a un producto con un nuevo enlace C-C. Muy a menudo el nuevo enlace resulta de una adición nucleófila de un carbanión enolato relativamente estable al grupo C=O (aceptor) de un aldehído; menos frecuentemente el grupo C=O pertenece a una cetona o un derivado de ácido. Otro aceptor es el grupo ![]()
de un nitrito.
La condensación aldólica es una reacción propia de aldehídos con hidrógenos en . También la dan algunas cetonas. En general, la reacción es un equilibrio que está desplazado hacia los productos de partida.
La condensación aldólica da lugar a un aldol o -hidroxialdehído, en baja proporción. Sin embargo, la calefacción de este compuesto provoca su deshidratación produciendo un aldehído ,-insaturado. La pérdida de agua “tira” de los equilibrios.
La autocondensación de un aldehído con hidrógenos en a conduce a un nuevo aldehído ,insaturado. Pero esta reacción tiene algunas limitaciones.
Los equilibrios de una condensación aldólica suelen estar desplazados hacia el producto de partida.
Una manera de conseguir desplazarlos hacia el producto final es evitar que la mezcla de reacción esté en contacto con la base todo el tiempo. Esto se logra utilizando un aparato denominado Sohxlet.
El aldehído o cetona de partida, situado en el matraz redondo, entra en ebullición y, tras condenserse en el refrigerante, se va acumulando en el Sohxlet. Ahí entra en contacto con la base sólida e insoluble y se establece el equilibrio. Cuando el Sohxlet se ha llenado, se vacía automáticamente por medio del sifón y el líquido en equilibrio retorna al matraz redondo. La pequeña cantidad de aldol producida deja de estar en contacto con la base y no puede abandonar el matraz porque su punto de ebullición es mayor. Se repite el ciclo numerosas veces (toda una noche, por ejemplo) y la mezcla final del matraz estará muy enriquecida en el aldol.
2.- Mecanismo de formación del aldol
ETAPA 1.- Formación del enolato.
ETAPA 2.- Ataque nucleófilo.
ETAPA 3.- Protonación.
A temperaturas elevadas el aldol se convierte en su enolato, que sufre una eliminación de ion hidróxido para dar lugar al producto final. El resultado neto es la deshidratación del aldol catalizada por hidróxido. Las condensaciones aldólicas suelen ser de diferentes tipos, entre las que están las intramoleculares que conducen a la formación de anillos.
Mecanismo de la deshidratación:
En general, la condensación aldólica no puede llevarse a cabo entre aldehídos o cetonas diferentes ya que se obtendría una mezcla de productos.
En esta reacción sólo se puede producir un enolato: el del acetaldehído. El pivalaldehído no tiene hidrógenos en . Pero para evitar que el acetaldehído reaccione consigo mismo es necesario adicionarlo lentamente, para que su concentración se mantenga siempre lo más baja posible. Así, el enolato del acetaldehído reaccionará con mayor probabilidad con la especie más abundante en la mezcla de reacción: el pivalaldehído.
La condensación aldólica puede llevarse a cabo intramolecularmente, con dialdehídos o dicetonas adecuados. Esto permite obtener compuestos cíclicos de cinco o seis miembros altamente funcionarizados.
a) Reacciones de condensación aldólica.
b) Reacciones de condensación aldólica mixta.
c) Otros ejemplos de reacciones de condensación de Claisen- Schmidt.
d) Usos de la dibenzalacetona
e) Propiedades físicas, químicas y toxicidad de los reactivos y productos.
3.- Reacciones de condensación adólica mixta.
Otros ejemplos de reacciones de condensación de Claisen- Schmidt.
Cuando los enolatos de éster atacan a otra molécula de éster se forma un producto de condensación de Claisen, dando lugar a un producto conocido como -ceto-éster. Esto se debe a que los enolatos no deben estar presentes en cantidades estequiométricas, sino que pueden existir en concentraciones de equilibrio, como ee la reacción aldólica, Tanto el alcóxido (base) como el éster empleado deben ser derivados del mismo alcohol para evitar la una transesterificación.
Ejemplo:
Mecanismo:
1) Formación del enolato del éster
2) Adición nucleófila
3) Eliminación
La condensación de Claisen es esencialmente análoga a la aldólica, pero con un éster en lugar de un aldehído. En de estar presente ésteres de distinta naturaleza química se produce una condensación de Claisen cruzada, dando lugar a mezclas de productos, y en el caso de que una misma molécula posea dos grupos ésteres da lugar a una condensación de Claisen intramolecular, conocida con el nombre de condensación de Dieckmann.
Ejemplos:
a) Condensación de Claisen mixta
b) Condensación de Claisen intramolecular (Dieckmann)
Otra reacción relacionada con la condensación de Claisen-Schmidth es la acilación de la acetofenona con éster dando su correspondiente beta-dicetona.
4.- Usos de la dibenzilacentona
Se usa como insumo para la fabricación de productos farmacéuticos (cosméticos o medicamentos).
Es el precursor del componente de aroma principal en la frambuesa.
5.- Propiedades físicas, químicas y toxicidad de los reactivos y productos.
ETANOL
Propiedades:
Aspecto: líquido incoloro
Punto de ebullición de 78 ºC
Peso molecular: 46,07 uma
Punto de fusión: 158.9 K (-114.25 ºC)
Punto de ebullición: 351.6 K (78.45 ºC)
Densidad: n/d kg/m³ (0,789 g/cm³)
Daños a la salud: El etanol puede afectar al sistema nervioso central, provocando estados de euforia, desinhibición, mareos, somnolencia, confusión, alucinaciones (como lo sean ver doble o que todo se mueve de forma espontánea.
Usos: es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70 %.
HIDROXIDO DE SODIO
Propiedades:
Color: blanco (en sólido como lenteja)
Aspecto: Sólido blanco, deliquescente en diversas formas e inodoro.
Peso molecular: 40
Punto de ebullición: 1390ºC
Punto de fusión: 318ºC
Densidad relativa: 2.1
Solubilidad en agua: 109g/100ml a 20ºC
Presión de vapor: 0.13 KPa a 739ºC
Propiedades químicas: El NaOH reacciona con metales como Al, Zn y Sn, generando aniones como AlO2 - , ZnO2 - y SnO3 2- e hidrógeno. Con los óxidos de estos metales, forma esos mismos aniones y agua. Con cinc metálico, además, hay ignición.
Daños a la salud: El hidróxido de sodio es irritante y corrosivo de los tejidos. Los casos más comunes de accidente son por contacto con la piel y ojos, así como inhalación de neblinas o polvo. La inhalación de polvo o neblina causa irritación y daño del tracto respiratorio.
ACETONA
Propiedades:
Aspecto: Líquido incoloro, de olor característico.
Punto de ebullición: 56ºC
Punto de fusión: -95ºC
Densidad relativa (agua = 1): 0.8
Solubilidad en agua: Miscible
Presión de vapor, kPa a 20ºC: 24
Densidad relativa de vapor (aire = 1): 2.0
Densidad relativa de la mezcla vapor/aire a 20°C (aire = 1): 1.2
Punto de inflamación: -18ºC c.c.
Temperatura de autoignición: 465ºC
Daños a la salud: Salivación, confusión mental, tos, vértigo, somnolencia, dolor de cabeza, dolor de garganta, pérdida del conocimiento. Piel seca, enrojecimiento. En los ojos causa enrojecimiento, dolor, visión borrosa. Posible daño en la córnea y si es ingerido produce náuseas, vómitos (para mayor información, véase Inhalación).
BENZALDEHIDO
Propiedades:
Aspecto: Líquido entre incoloro y amarillo viscoso, de olor característico.
Punto de ebullición: 179ºC
Punto de fusión: -26ºC
Densidad relativa (agua = 1): 1.05
Solubilidad en agua, g/100 ml: Escasa.
Presión de vapor, Pa a 26ºC: 130
Densidad relativa de vapor (aire = 1): 3.65
Daños a la salud: La sustancia irrita los ojos, la piel y el tracto respiratorio. La exposición puede causar disminución de la conciencia. Convulsiones, tos, vértigo, dolor de cabeza, náuseas, dolor de garganta, vómitos
V. DIBUJO
Vaso de
Precipitado.
VI. RESULTADOS Y OBSERVACIONES
En un matraz erlenmeyer colocamos 1.25g de NaOH, 12.5ml de agua y 10ml de etanol, la mezcla era de color transparente.
Después colocamos el matraz en una parrilla de agitación y fuimos agregando poco a poco 12.5nk de benzaldehido, que era aceitoso y luego 0.5 ml de acetona. Ahora la mezcla ya tenía un color amarillo-transparente.
Continuamos la agitación durante 30 minutos y controlando la temperatura que no aumentara y que permaneciera entre 20 y 25ºC,; si la temperatura aumentaba sometíamos el matraz en baños de agua fría.
Durante el transcurso de el tiempo de agitación la mezcla se tornó turbia amarilla, a los 8 minutos de estar agitando era naranja y con algunas partículas sólidas de color naranja también (precipitado). En los últimos minutos la coloración era otra vez color amarillo.
Filtramos el precipitado usando un kitazato, un bugner, papel filtro y la bomba de vacío, lavamos el precipitado con agua fría, lo secamos y determinamos el punto de ebullición.
El punto de ebullición era de 80ºC lo cual nos indicó que el producto no era del todo puro.
En la sección siguiente realizamos la cristalización.
Para ello nuestro producto ya seco y de color amarillo lo disolvimos en etanol y o calentamos, lo dejamos reposar y enfriar a temperatura ambiente para que cristalizara.
Filtramos los cristales con un embudo y papel filtro y procedimos a calcular el rendimiento del producto puro.
Una vez calculado el rendimiento continuamos con la cromatografía del mismo. Para ello utilizamos una suspensión de gel de sílice al 35% en CHCl3 / MeOH o en acetato de etilo, como disolvente utilizamos acetona o acetato de etilo, como eluyente hexanol/acetona 3:1.
Colocamos nuestra muestra en la cromatoplaca con ayuda de una pipeta pasteur y empezó la cromatografía.
Por último para revelar utilizando yodo y postieriomente lo observamos bajo luz uv.
CALCULOS DE RENDIMIENTO

v=1.25ml 0.5 ml PM= 234.30
d=m/v PM= 58.02 peso crudo = 234.30
d=1 .044 d=0.791 moles = w/PM
m=dxv w=(0.791)(0.5) moles =(0.012)(234.3)= 2.8116 gr (100%)
m=(1.044)(1.25) w=0.3955/58.02
m=1.305g moles=0.0068
moles= w/PM
moles= 1.305/106.12
moles= 0.012 moles
2.8116gr-------------------100%
2.375 gr-------------------x x= 84.48 % crudo
VII. CONCLUSIONES
Por medio de la investigación sobre la cual se fundamenta esta práctica pude darme cuenta de que las reacciones de condensación adoólica ocurren en los aldehidos y las cetonas que tienen hidógenos unidos al carbono alfa, Asi como que los hidrógenos son ácidos.
En nuestra reacción no obtuvimos una mezcla debido a que no es una reacción de condensación adolica mixta.
La practica estuvo muy interesante porque aprendimos cosas nuevas como son : la filtración del producto usando el embudo bugner y la bomba de vacío , hacer la cromatografía y además la técnica de recristalización.
VIII. BIBLIOGRAFÍA
Journal of Organic Chemistry 1962,27,327-328
Libros:
Neckers y Doyle
IX. CUESTIONARIO
1.- Explique por qué debe adicionar primero benzaldehido y después la acetona a la mezcla de la reacción.
Porque los aldenidos reaccionan más fácilmente que las cetonas. Las cetonas son más estables.
2.-Explique porqué se obtiene un solo producto y no una mezcla de productos en esta práctica.
Porque los aldehidos y las cetonas sufren una reacción de condensación aldolica y no una reacción de condensación aldólica mixta en donde se obtiene una mezcla de los productos
PRACTICA No. X
OBTENCION DE ACETATO DE ISOAMILO (ACEITE DE PLATANO)
I. OBJETIVOS
a) Preparar un éster a partir de alcohol y un ácido carboxílico.
b) Aplicar algunas técnicas de laboratorio ya conocidas como son calentamiento a reflujo, extracción y destilación simple.
II. REACCION
III. MATERIAL
VI. FUNDAMENTO TEÓRICO
1.- Métodos de obtención de esteres
Los ésteres se preparan por reacción de los yoduros de alquilo con sales de plata.
CH3-COOAg+ICH3à CH3-COOCH3+Iag
Por la acción de un cloruro de ácido sobre un alcohol.
CH3_COCL+NaOC2H5 à CH3-COOC2H5+CLNa
2.- Propiedades físicas, químicas y toxicidad de reactivos y productos.
ACIDO ACETICO
El ácido acético es un ácido que se encuentra en el vinagre, y que es el principal responsable de su sabor y olor agrios. Su fórmula es CH3-COOH, y, de acuerdo con la IUPAC se denomina sistemáticamente ácido etanoico.
H O
\ //
H - C - C
/ \
H OH
Es el segundo de los ácidos carboxílicos, después del ácido fórmico o metanoico, que sólo tiene un carbono, y antes del ácido propanoico, que ya tiene una cadena de tres carbonos. El punto de fusión es 16.6 °C y el punto de ebullición es 117.9 °C.
En disolución acuosa, el ácido acético puede perder el protón del grupo carboxilo para dar su base conjugada, el acetato. Su pKa es de 4.8 a 25ºC, lo cual significa, que al pH moderadamente ácido de 4.8, aproximadamente la mitad de sus moléculas se habrán desprendido del protón. Esto hace que sea un ácido débil y que, en concentraciones adecuadas, pueda formar disoluciones tampón con su base conjugada.
ALCOHOL ISOAMILICO
Es un líquido incoloro de olor característico, inflamable, puede ser nocivo por inhalación ya que irrita las vías respiratorias.
La exposición repetida puede provocar sequedad o formación de grietas en la piel.
SULFATO DE SODIO
Es un sólido color plateado brillante sin olor. Es un producto no peligroso si se maneja con la precaución debida.
ACETATO DE ISOAMILO
Tiene un peso molecular de 130.19 g/mol; presenta una temperatura de ignición de 380 °C; presión de vapor de 4 mmHg a 20 °C. Su solubilidad en el agua es de 0.1-1 g/ 100 ml.
Es utilizado como solvente, en perfumes y en condimentos artificiales con sabor frutal. Tiene un alto grado de inflamabilidad ya que puede arder en condiciones normales de temperatura. No reacciona con agua.
Es un compuesto tóxico por inhalación e ingestión además de que causa daños en el sistema nervioso.
V. DIBUJO

Para la primera parte de la práctica se realizó durante una hora el reflujo de la muestra, para después se suspendiera el calentamiento y se enfriara a temperatura ambiente.

Después para la obtención del acetato de isoamilo se hizo una destilación simple hasta que el termómetro llegara a los 134ºC. Posteriormente se realizó el enfriado de la mezcla obteniendo el acetato puro con un olor característico a plátano.
VI. RESULTADOS Y OBSERVACIONES
En un matráz de pera de una boca colocamos 4.5ml de alcohol isoamílico, 6ml de ácido acético glacial y añadimos 1ml de ácido sulfúrico concentrado (se agregó poco a poco y con agitación), agregamos cuerpos de ebullición y conectamos el condensador en posición de reflujo.
La mezcla era transparente pero una vez que comenzamos a calentar se observó un cambio físico pues cambió a un color café.
Dejamos el reflujo por media hora, suspendimos el calentamiento y dejamos enfriar la mezcla de reacción a temperatura ambiente.
Pasamos la mezcla fría a un embudo de separación y agregamos cuidadosamente 14ml de agua fría, lavamos el matráz con 2.5 ml de agua fría y la pasamos al embudo de
separación. Agitamos varias veces y separamos la fase acuosa y la desechamos para quedarnos solo con la fase orgánica.
Esta mezcla contiene el éster y un poco de ácido acético, el cual fue removido por dos lavados sucesivos con 7.5ml de solución de bicarbonato de sodio al 5%.
La fase orgánica la lavamos con 6ml de agua mezclados con 1.5ml de una solución saturada de cloruro de sodio. Desechamos la fase acuosa, y vertimos la fase orgánica en un vaso de precipitados.
Posteriormente secamos con un gramo de sulfato de sodio anhidro.
Montamos el equipo de destilación simple, decantamos la fase orgánica al matraz pera, agregamos cuerpos de ebullición y destilamos.
El recipiente que recibía el destilado era un baño de hielo y solo colectamos la fracción que destila entre 132-134 ºC y por último calculamos el rendimiento.
RENDIMIENTO:

Acido acético Alcohol isoamílico Acetato de isoamílo
D = 1.053 gr / mol D = 0.815 gr / mol D = 0.876 gr / mol
PM = 65.06 gr / mol PM = 88.15 gr / mol PM = 130.19 gr / mol
Volumen = 6 ml Volumen = 4.5 ml M = 5.416 gr
Peso del matraz = 51.2 gr.
Peso del matraz con el producto = 55.537gr.
Peso del producto = 4.337 gr.
0.815 gr = 1 ml. 0.876 gr = 1ml 0.876 gr = 1ml
X = 4.5 ml 5.416 gr = X 4.337 gr = X
X = 3.6675 gr. X = 6.183 ml X = 3.799 ml
6.183 ml = 100%
3.799 ml = X
X = 61.44%
VII. CONCLUSIONES
La realización de la práctica no fue complicada en especial por que el producto obtenido no tenia mal olor como en otras ocasiones, ya que como el nombre de la práctica lo dice, tiene un agradable olor a plátano que perduró algún tiempo después de la realización del mismo.
VIII. BILBIOGRAFIA
IX. CUESTIONARIO
1.- Escriba un mecanismo razonable para la formación de acetato de isoamílo.
2.- Un método para favorecer la formación de un éster, es añadir un exceso de ácido acético. Sugiera otro método que permita desplazar la reacción hacia la formación del éster.
El método de esterificación de Fischer, que emplea un gran exceso de alcohol, es uno de los más empleados en la preparación de ésteres etílicos y metílicos de ácidos carboxílicos. El gran exceso de alcohol favorece el desplazamiento del equilibrio hacia la formación del éster (principio de Le Chatelier). Dicho exceso es económicamente aceptable en el caso de etanol o metanol, ya que estos alcoholes son baratos. Por ejemplo, en la preparación del benzoato de metilo, se disuelve ácido benzoico en un gran exceso molar de metanol y, como catalizador, se añade una gota de un ácido mineral fuerte como el sulfúrico. La mezcla se calienta a reflujo de 1 a 2 horas y, tras eliminar el metanol residual, se obtiene por destilación el benzoato de metilo. La esterificación de Fischer es especialmente adecuada cuando el alcohol usado como disolvente es barato y volátil.
3.- Explique cuales son los usos de los ésteres.
Los ésteres son compuestos líquidos y sólidos que poseen olores agradables, los cuales se encuentran distribuidos ampliamente en la naturaleza en flores y frutas. En el comercio son utilizados como materia prima en perfumes y esencias saborizantes, confiterías, solventes, agentes sintéticos, y para la preparación de plásticos. Son de especial importancia el acetato de etilo, acetato de butilo, dibutilftalato, acetato y xantogenato de celulosa, trinitrato de glicerilo, acetato de vinilo y nitrato de celulosa.
El salicilato de metilo se emplea principalmente como agente aromatizante y posee la ventaja de que se absorbe a través de la piel. Una vez absorbido, el salicilato de metilo puede hidrolizarse a ácido salicílico, el cual actúa como analgésico. Este producto puede extraerse de varias plantas medicinales capaces de aliviar el dolor.
El ácido acetilsalicílico o aspirina, como es conocido comercialmente, es el más popular de los medicamentos sintéticos, esto se debe a su acción analgésica, antipirética, anti-inflamatoria y antirreumática, además de ser utilizada en la prevención del infarto de miocardio, su bajo costo, obtención y adquisición, aunque se conocen numerosos compuestos con dichas propiedades analgésicas, en la aspirina se encuentran presentes ambos efectos. Es por ello que la aspirina se usa en muchas preparaciones conjuntamente con un gran número de otros medicamentos.
PRACTICA No. 11
REACCIONES DE CARBOHIDRATOS
I. OBJETIVOShttp://enciclopedia.us.es/index.php/%C9s
a) Realizar diferentes pruebas de oxidación para la determinación de azúcares reductores.
b) Formación de osazonas de algunos monosacáridos.
II. MATERIAL
III. FUNDAMENTO TEORICO
1.- Estructura de los principales monosacáridos.
Los monosacáridos o azúcares simples son los glúcidos más sencillos, conteniendo de tres a siete átomos de carbono. Su fórmula empírica es (CH2O)n donde n ≥ 3. Se nombran haciendo referencia al número de carbonos (3-12), terminado en el sufijo osa. La cadena carbonada de los monosacáridos no está ramificada y todos los átomos de carbono menos uno contienen un grupo alcohol (-OH). El átomo de carbono restante tiene unido un grupo carbonilo (C=O). Si este grupo carbonilo está en el extremo de la cadena se trata de un grupo aldehído (-CHO) y el monosacárido recibe el nombre de aldosa. Si el carbono carbonílico está en cualquier otra posición, se trata de una cetona (-CO-) y el monosacárido recibe el nombre de cetosa.
Las dos cadenas de monosacáridos más importantes son las aldosas y las cetosas, y en base a ellas se separan los diversos tipos de monosacáridos más conocidos.
Serie de las aldosas:

Serie de las cetosas:

2.- Reacciones de oxidación de los monosacáridos
Las aldosas reciben el nombre genérico de "azúcares reductores", reducen oxidantes suaves como los reactivos de Tollens (espejo de plata), Fehling y Benedit (precipitado rojizo de Cu2O). Todo esto se debe a la presencia de la estructura abierta en el equilibrio de la ciclación.
Un monosacárido con el C1 oxidado a carboxilo, recibe el nombre de ácido Aldónico.

D-glucosa línea ondulada forma abierta anión de un ácido
(α, β o mezcla) aldσnico o glicσnico

Complejo tártaro-cúprico ácido
R. de Fehling aldónico o glicónico
Los tres reactivos, Tollens, Fehling y Bénedic, son básicos, por lo que las cetosas, también los reducen, pues en medio alcalino, están en equilibrio con dos aldosas epímericas a través de un Enodiol intermediario.

Esto se puede representar:

D- fructosa Aniones de ácidos aldónicos
Para preparar ácidos aldónicos, no es conveniente el medio básico, de los reactivos mencionados, pues el medio básico induce otros cambios en los monosacáridos. Se utiliza mejor agua de bromo (pH ~ 6).
3.- Reacción de los monosacáridos con fenilhidrazina (ozasonas)
Las osazonas son derivados de azúcares formados al calentar una solución de estos con clorhidrato de fenilhidrazina, acetato sódico y ácido acético. Si los cristales amarillos que se forman se examinan al microscopio, son lo suficientemente característicos para identificar ciertos azúcares. Hay que advertir que la glucosa y la fructosa forman la misma osazona (glucosazona, punto de fusión 205º C). Antes de determinar los puntos de fusión de las osazonas deben purificarse por recristalización en alcohol. La sacarosa no forma osazonas, pero en las condiciones expuestas para el ensayo, tiene lugar una hidrólisis, suficiente para la producción de algo de glucosazona.
4.- ¿Qué se obtiene por epímero?
Si dos isómeros ópticos difieren en la configuración de un único átomo de carbono, se dice que son epímeros. La D-glucosa y la D-galactosa son epímeros porque sólo difieren en la configuración del carbono 4.
5.- Propiedades físicas, químicas y toxicidad de reactivos y productos
REACTIVOS DE FEHLING
El reactivo está formado por dos soluciones llamadas A y B. La primera es una solución de sulfato cúprico; la segunda, de hidróxido de sodio y una sal orgánica llamada tartrato de sodio y potasio (sal de Seignette).
Cuando se mezclan cantidades iguales de ambas soluciones, aparece un color azul intenso por la formación de un complejo formado entre el ion cúprico y el tartrato. Agregando un aldehído y calentando suavemente, el color azul desaparece y aparece un precipitado rojo de óxido cuproso (Cu2O).
Se utiliza como reactivo para la determinación de azúcares reductores, y es útil para demostrar la presencia de glucosa en la orina.
Al reaccionar con monosacáridos, se torna verdoso; si lo hace con disacáridos, toma el color del ladrillo. El licor de Fehling es útil también para detectar derivados de la glucosa como la sacarosa o la fructosa.
ACIDO NITRICO
El ácido nítrico puro es un líquido viscoso, incoloro e inodoro. A menudo, distintas impurezas lo colorean de amarillo-marrón. A temperatura ambiente libera humos rojos o amarillos. El ácido nítrico concentrado tiñe la piel humana de amarillo al contacto.
El ácido nítrico es un agente oxidante potente; sus reacciones con compuestos como los cianuros, carburos, y polvos metálicos pueden ser explosivas. Las reacciones del ácido nítrico con muchos compuestos orgánicos, como de la terebentina, son violentas, la mezcla siendo hipergólica (es decir, autoinflamable). Es un fuerte ácido: en solución acuosa se disocia completamente en un ion nitrato NO3- y un protón hídrico. Las sales del ácido nítrico (que contienen el ion nitrato) se llaman nitratos. La casi totalidad de ellos son muy solubles en el agua. El ácido nítrico y sus sales, los nitratos, no deben confundirse con el ácido nitroso y sus sales, los nitritos.
REACTIVO DE BENEDICT
Se usa para detectar la presencia de azúcar en la orina, en la saliva está la ptialina o amilasa salival que es una enzima que se encarga de transformar azucares complejos como el almidón en otros mas simples como la dextrina y sacarosa y finalmente glucosa gracias a otras enzimas de las células del intestino (disacaridasas) y en colaboración con la enzima fundamental en la absorción de hidratos de carbono por el tubo digestivo que es la amilasa pancreática.
Está formado por solución de 17.3 g de sulfato de cobre cristalizado, 173 g de citrato de sodio o potasio y 200 g de carbonato de sodio en 1.000 ml de agua destilada
FENILHIDRAZINA
La fenilhidrazina son Cristales o líquido aceitoso, de incoloro a amarillo, vira a marrón por exposición al aire y a la luz. La sustancia se descompone al calentarla intensamente y al arder, produciendo humos tóxicos, conteniendo óxidos de nitrógeno. Reacciona con oxidantes. Reacciona violentamente con dióxido de plomo.
Esta puede irritar los ojos, la piel y el tracto respiratorio. Puede causar efectos en la sangre, dando lugar a hemólisis, alteraciones renales y hepáticas. Los efectos pueden aparecer de forma no inmediata. Se recomienda vigilancia médica.
El contacto prolongado o repetido con la piel puede producir dermatitis. El contacto prolongado o repetido puede producir sensibilización de la piel. La sustancia puede afectar a la sangre, dando lugar a anemia.
MANOSA
La Manosa es un azúcar simple (monosacárido) que se encuentra en los polisacáridos de las plantas, llamados glucoproteínas animales.
Pertenece al grupo de las hexosas, que son monosacáridos (glúcidos simples) formados por una cadena de seis átomos de carbono. Su fórmula general es C6H12O6. Su principal función es producir energía. Un gramo de cualquier hexosa produce unas 4 kilocalorías de energía. Esta sustancia no es nociva para la salud
GLUCOSA
Glucosa, o dextrosa, es una forma de azúcar encontrada en las frutas y en la miel. Es un monosacárido con la misma fórmula empírica que la fructosa pero con diferente estructura. Es una hexosa (6 átomos de carbono).
Todas las frutas naturales tienen cierta cantidad de glucosa (a menudo con fructosa), que puede ser extraída y concentrada para hacer un azúcar alternativo. Pero a nivel industrial tanto la glucosa líquida (jarabe de glucosa) como la dextrosa (glucosa en polvo) se obtienen a partir de la hidrólisis enzimática de almidón de cereales (generalmente trigo o maíz). Esta sustancia no es nociva para la salud.
SACAROSA
La sacarosa o azúcar común es un disacárido formado por una molécula de glucosa y otra de fructosa.
Su nombre químico es: alfa-D-glucopiranosil(1->2)-beta-D-fructofuranósido.
Su fórmula química es:(C12H22O11)
Es un disacárido que no tiene poder reductor sobre el licor de Fehling.
En la naturaleza se encuentra en un 20% del peso en la caña de azúcar y en un 15% del peso de la remolacha azucarera, de la que se obtiene el azúcar de mesa. La miel también es un fluido que contiene gran cantidad de sacarosa parcialmente hidrolizada.
El azúcar de mesa es el edulcorante más utilizado para endulzar los alimentos y suele ser sacarosa.
Una curiosidad de la sacarosa es que es triboluminiscente, que produce luz mediante una acción mecánica.
FRUCTOSA
Fructosa, o levulosa, es una forma de azúcar encontrada en las frutas y en la miel. Es un monosacárido con la misma fórmula empírica que la glucosa pero con diferente estructura. Es una hexosa (6 átomos de carbono). Su poder energético es de 4 kilocalorías por cada gramo.
Todas las frutas naturales tienen cierta cantidad de fructosa (a menudo con glucosa), que pueden ser extraída y concentrada para hacer un azúcar alternativo
La fructosa depende de la glucosa para que sea absorbida a los intestinos y finalmente pase al torrente sanguíneo. Los transportadores de membrana GLUT-5 y GLUT-2 son los encargados de estos fenómenos de transporte. La absorción de fructosa en ausencia de glucosa es muy baja, acumulándose en el intestino grueso donde sirve de alimento a la flora que reside produciendo gases. La ingesta de un exceso de fructosa también favorece la retención de agua. Estos efectos dan lugar a la expansión del abdomen, flatulencia, excrementos no compactos e incluso diarrea dependiente de las cantidades ingeridas y de otros factores.
Se ha implicado la fructosa en la etiogénesis de la obesidad, y en elevar el colesterol LDL y los triglicéridos produciendo el denominado síndrome metabólico.
La fructosa también puede quelar minerales en la sangre. Este efecto es especialmente importante con respecto a micronutrientes que se encuentran en muy bajas cantidades como el cobre, el cromo y el zinc. El quelaje de una pequeña parte de estos iones puede llevar a una deficiencia de los mismos produciendo carencias, problemas del sistema inmunitario e incluso resistencia a la insulina, uno de los factores implicados en la diabetes mellitus de tipo II.
La fructosa es un azúcar reductor, como todos los monosacáridos. Aun así, se considera que es diez veces más activa que la glucosa a la hora de glicosilar proteínas. Por lo tanto, su consumo tiene que ser limitado con tal de reducir los daños celulares y moleculares derivados de la glicosilación. Este efecto podría contribuir de manera sustancial en muchas enfermedades asociadas a la edad.
La fructosa se usa frecuentemente en productos dietéticos pero no está recomendada su ingesta en diabéticos. Aunque suele ser una buena opción para aquellas personas que desean una restricción en la ingesta de azúcares. Muchas personas, sin saberlo, son más o menos intolerantes a la fructosa y no pueden asimilar bien alimentos con alto contenido de este azúcar. En tal caso, se dice que sufren intolerancia a la fructosa.
La mayor parte de la fructosa absorbida, al igual que pasa con el resto de los monosacáridos, es transformada en el hígado en lípidos y se acumula en las reservas de tejido adiposo.
IV. DIBUJO
Los tubos están ordenados de la siguiente forma: manosa, glucosa, sacarosa y fructosa.


Prueba de Tollens Reacción de Fehling


Prueba de Benedict Prueba de fenilhidrazina



V. RESULTADOS Y OBSERVACIONES
| CARBOHIDRATO | REACCION DE TOLLENS | REACCION DE FEHLING | REACCION DE BENEDICT |
| MANOSA | NEGATIVO (No hubo cristal de plata) | POSITIVO (precipitado rojo) | POSITIVO (precipitado amarillo) |
| GLUCOSA | POSITIVO (presencia del cristal de plata) | POSITIVO (precipitado rojo) | POSITIVO (precipitado naranja oscuro) |
| SACAROSA | NEGATIVO (no hubo cristal de plata) | NEGATIVO | NEGATIVO (sin presencia de precipitado) |
| FRUCTOSA | POSITIVO (presencia del cristal de plata) | POSITIVO (precipitado rojo) | POSITIVO (precipitado naranja) |
PRUEBA DE FENILHIDRAZINA
| CARBOHIDRATO | TIEMPO DE REACCION |
| MANOSA | 8.53 MINUTOS |
| GLUCOSA | 6.17 MINUTOS |
| SACAROSA | 4.00 MINUTOS |
| FRUCTOSA | NO HIZO REACCION |
VI. CONCLUSIONES
La realización de la primera parte del experimento que en este caso es la reacción de Tollens nos mostró como resultado que tanto la glucosa como la fructosa son azúcares reductores ya que ante la presencia del reactivo y posteriormente ante el calentamiento de la misma se formó un espejo de plata, esto nos indica una prueba positiva. Por el contrario para la sacarosa y la manosa la reacción antes descrita no se suscito por lo que se concluye que estos dos glúcidos no son reductores. Comparando con las dos pruebas siguientes la manosa es positiva como azúcar reductor, al contrario de esta purba. Probablemente hubo un error en el manejo de la muestra
Para la prueba de Fehling que detecta también azúcares reductores al igual que la prueba de Tollens nos dio como resultado positivo para la manosa, glucosa y fructosa y negativo para la sacarosa.
Para la prueba de Benedict el resultado dio positivo para la manosa, glucosa y fructosa y negativo para la sacarosa para azúcares reductores.
Para la prueba con fenilhidrazina la manosa, la glucosa y la sacarosa resultaron positivas al contrario de la fructosa. Sin embargo en la información obtenida en la práctica, esta nos menciona que para la realización de osazonas mediante el proceso de la reacción con fenilhidrazina, la glucosa y la fructosa forman la misma osazona, es decir que reaccionan con el reactivo y en los resultados de la práctica nos da negativo esta pruebe, probablemente falto calentamiento y por esta razón se obtuvo un resultado erróneo.
VII. BIBLIOGRAFIA
VIII. CUESTIONARIO
1.- ¿Por qué se considera reductor un azúcar?
Por que es capaz de reducir su carbono anomérico, formando enlaces glucosidicos con otras moléculas de azúcares.
La Sacarosa no es reductor ya que no posee un carbono anomérico libre, y esto también no le permite la oxidación.
2.- ¿En qué consisten las pruebas que nos permiten saber si un azúcar es reductor?
Las pruebas realizadas son tres fundamentalmente: la de Tollens que consiste en hacer una mezcla de nitrato de plata con hidróxido de sodio e hidróxido de amonio junto con el azúcar que se va a evaluar, para posteriormente llevarla a calentamiento en baño María, para prueba positiva aparecerá un cristal de plata; para la segunda prueba conocida como de Fehling se realizó una mezcla de ambas soluciones Fehling (A y B) con el azúcar a evaluar y después calentar a ebullición, para prueba positiva debe de dar un precipitado rojo; finalmente la última prueba consiste principalmente en una mezcla del reactivo de Benedict y el azúcar a evaluar para después someterla a calentamiento, para la prueba de Benedict el resultado positivo debe resultar en un precipitado rojo hasta amarillo.
4.- ¿Se puede desechar libremente en el drenaje los efluentes líquidos obtenidos en cada prueba? Diga que tratamiento se les deberá dar en cada caso para desecharlos en el drenaje.
Para el desecho debe de la prueba con Tollens, el tubo utilizado sebe ser lavado con ácido nítrico para destruir el cristal de plata. Tanto para la prueba de Fehling como para la prueba de Benedict no es necesario darles un tratamiento específico ya que no son sustancias muy tóxicas.
5.- ¿Por qué no se deben desechar las sales de plata al drenaje?
La plata y sus derivados pueden llegar a ser productos muy tóxicos al ambiente en grandes concentraciones ya que es absorbida por los tejidos lentamente ocasionando pigmentación en los mismos color negruzco. Puede ocasionar daños irreversibles en tejidos renales, hepáticos pulmonares y cerebrales.
PRACTICA No 13
REACCION DE KNOEVENAGEL - OBTENCION DEL ÁCIDO CINAMICO
I. OBJETIVOS
a) Obtener un ácido carboxílico mediante una reacción recondensación
II. REACCION

III. MATERIAL
IV. FUNDAMENTO TEORICO.
1.- Diferentes tipos de bases utilizadas en estas reacciones de condensación.
En la condensación de Knoevenagel el compuesto -dicarbonílico se trata con una cantidad catalítica de una base débil, tal como la N-etiletanamina (dietilamina), en presencia de un aldehído o cetona para dar el producto de condensación aldólica.
Otras bases utilizadas son la glicina o la etilamina.
2.- Otras reacciones de condensación de aldehídos aromáticos.
Los aldehídos en presencia de disoluciones diluidas de hidróxidos alcalinos sufren la denominada «condensación aldólica», con formación de un aldol (molécula que contiene simultáneamente las funciones aldehído y alcohol).

3.- Ventajas y desventajas del uso de la piridina y piperidina.
La piridina (fórmula molecular C5H5N, masa molecular: 79,10) es un líquido incoloro de olor desagradable, similar al pescado. Pertenece a la familia de los compuestos aromáticos heterocíclicos, y está estructuralmente relacionada al benceno, siendo la única diferencia entre ellos el reemplazo de un grupo CH del anillo bencénico por un átomo de nitrógeno.
El par de electrones ecuatoriales del nitrógeno no participa en el sistema pi aromático en la piridina. Esto hace, de dicho compuesto, una base con propiedades químicas similares a las aminas terciarias, siendo el pKa de su ácido conjugado 5,30. La reacción de la piridina con ácidos la protona y forma un ion aromático poliatómico cargado positivamente al que se le da el nombre de catión piridinio. Los ángulos y longitudes de unión entre ella y en el catión piridinio no varían considerablemente, debido a que la protonación no involucra al sistema pi aromático. La piperidina tiene el mismo efecto que la piridina la gran desventaja de la piperidina es que es un compuesto muy tóxico y reactivo, difícil de manejar y de almacenar ya que debe estar aislado de oxidantes fuertes y ácidos.
4.-Propiedades físicas, químicas y toxicidad de reactivos y productos.
BENZALDEHIDO
El benzaldehido (C6H5 - CHO) es un líquido incoloro de olor agradable a almendras amargas que se emplea en la fabricación de colorantes y perfumes. Se obtiene a partir del tolueno por oxidación parcial con dióxido de manganeso hidratado o por cloruración previa a cloruro de benzal (C6H5 - CHCL2) e hidrólisis o mediando una síntesis a partir de benceno y monóxido de carbono con cloruro de aluminio anhídrido o CHI o CNH como catalizador. Es también componente de algunos frutos secos, tales como las almendras amargas, siendo el causante del sabor y olor tan característico de estos frutos. Es ligeramente soluble en agua, con la que reacciona lentamente, y miscible en isopropanol y aceites.
Entre las características químicas del benzaldehido se encuentra su capacidad para oxidarse lentamente en presencia del aire, dando un compuesto químico de propiedades conservantes conocido como ácido benzoico (E-210). Dicho compuesto puede obtenerse al estar en contacto con álcalis, reacción conocida como la reacción de Cannizaro, obteniendo como producto el alcohol bencílico Esto hace que sea utilizado como solvente de aceites, resinas, y de varios ésteres y éteres celulósicos.
ACIDO CINAMICO
Es un polvo finamente cristalizado de color blanco con un olor débilmente aromático.
Este compuesto tiene bajos niveles de toxicidad por lo tanto no es dañino sólo causa una leve irritación en los ojos. No produce efectos crónicos.
V. DIBUJO


VI. RESULTADOS Y OBSERVACIONES
Primeramente cabe mencionar que el reactivo utilizado no fue el que la práctica mencionaba, sino que se utilizó malonato de dietilo. Para poder utilizarlo se tuvieron que realizar algunos cambios para las cantidades utilizadas que en este caso son las siguientes:

+ malonato de dietilo NH3 
2.5 ml 2.5 gr
1.044 d = 1.055
PM = 106.2 PM = 160.17
N=gr/PM n = m/PM
d = m/v n = 2.5 gr/ 160.17
m = dv n = 0.0155 mol
m = (1.044) (2.5ml) d = m/v
m = 2.61 gr v = md
n = 2.61 gr/106.12 v = (2.5 gr) (1.055)
n = 0.0245 mol v = 2.6375 ml
Como dato importante se debe mencionar que se utilizó el doble de la cantidad.
Primeramente se hace una mezcla de 2.6 ml de malonato de dietilo, 20 ml de solución de hidróxio de amonio y 5 ml de benzaldehído. Este se colocó en un matráz de pera de una boca. La mezcla era de un color amarillo intenso.
Se hizo un reflujo y a partir de ello se contarón 10 minutos. La solución cambió a un color más claro, casi y amarillo transparente.
Se destiló para eliminar el etanol hasta 80ºC. Las primeras gotas de la destilación se obtuvieron a los 60ºC.
Después quitamos el matráz, que contenía el etanol y colocamos un matráz nuevo y limpio. Se comenzó a destilar de nuevo.
El contenido del matraz era color amarillo muy intenso.
A los 100ºC comenzó a destilar y la solución llegó a los 240ºC.
VII. CONCLUSIONES
La obtención de un ácido carboxílico es muy sencilla ya que sólo se necesita un alcohol. Esta condensación es poco conocida generalmente se utiliza la condensación aldólica.
VIII. BIBLIOGRAFIA
Condensación aldólica mixta (un aldehído no enolizable)
Alcohol isoamílico, ácido acético y ácido sulfúrico
Acetato de isoamílo
Fase orgánica después de diversos lavados



Esta imagen representa los espejos de plata formados en la prueba de Tollens.
Esta imagen representa los precipitados formados para la prueba de Fehling
Formación de precipitado durante la prueba de Benedict
Prueba de fenilhidrazina
Descargar
| Enviado por: | Kompabrose |
| Idioma: | castellano |
| País: | México |
