Química
Alcoholes
INTRODUCCIÓN
En la practica realizada el viernes 1 de agosto del 2003 cuyo titulo fue : alcholes
En la cual después de diversas pruebas y un marco teorico apropiado se aprendio a diferenciar las diferencia de los tres tipos de alcoholes mediante distintos metodos.
PARTE EXPERIMENTAL
PRUEBA DEL ANHIDIRIDO CROMICO:
Se tomaron tres distintas muestras de alcoholes desconocidos de los tres diferentes tipos.
A cada una de ellas se le agrego 1 ml de acetona aproximadamente en un tubo de ensayo.
Inmediatamente se le agrego a cada una de las muestras unas gotas de anhídrido cromico.
![]()
![]()
![]()
2. PRUEBA DE LUCAS:
Se tomo cada una de de las muestras desconocidas en tres tubos de ensayo , y se le agrego a cada una un poco de agua.
Se agito cada una de las muestras con agua con una varilla de agitación.
Se observo la solubilidad de cada una de las muestras en agua.
De acuerdo a lo anterior si no era totalmente soluble en agua no se procederia a efectuar el test de lucas
Las muestras que si fuesen solubles en agua, de le adicionaron 3 ml de reactivo de lucas:
![]()
PRUEBA CON IODOFORMO
Se disuelvio cada uno de los tres tipos de alcoholes con 2 ml de agua aproximadamente.
Si al haber realizado el paso anterior el alcohol era insoluble en agua, se le adiciona dioxano hasta que sea totalmente miscible
![]()
Luego se le adiciono 2 ml aproximadamente de hidroxido de sodio al 5%.
Se agrgo gota a gota solucion de yodo- yoduro hasta que el color del yodo permanezca.
Se espero durante 3 minutos para observar que si no se separa el yodoformo , se colocaria el tubo de ensayo en un baño de agua dentro de un vaso de precipitados a 60° C.
Se removio el exceso de reactivo por adicion de unas gotas de hiroxido de sodio al 5 %.
Se diluyo en un volumen igual de agua y se dejo quieto durante 15 minutos.
OXIDACIÓN DEL ALCOHOL AL CARBONILICO Y FORMACIÓN DEL 2,4 DINITROFENILHIDROZANO.
Se coloco mas o menos 1ml de cada muestra de alcohol y se le adiciono 3-4 ml en solucion de KMnO4 H2SO4 2 molar.
Se agito la mezcla durante dos minutos aproximadamente.
Se le adiciono solucion saturada de acido oxalico gota a gota hasta que la solucion quedara clara.
Si resultaba una sola capa del derivado se hallaba directamente con esta solucion
De lo contrario si se separa en dos capas, la capa organica se separa con un gotero y se coloca en el erlenmeyer.
Se le adiciono 2 ml de solucion de 2.4 difenilhidrazona a el erlenmeyer.
Se dejo enfriar la mezcla con hielo para apresurar.
ANÁLISIS DE RESULTADOS:
Para entrar a diferenciar los diferentes tipos de alcoholes se tubo en cuenta la siguiente información:
Alcoholes:
La función alcohol no es de las que tiene una prioridad muy elevada.
Es frecuente encontrarla como función principal pero aun más frecuente como secundaria.
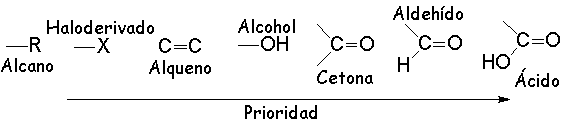
Dependiendo de la sustitución del carbono al que se une el grupo hidroxilo, un alcohol será:
|
|

Los ángulos de enlace sugieren que el oxígeno está en hibridación sp3.
Los alcoholes pueden considerarse como derivados del agua, en la que se reemplaza
un hidrógeno por un grupo carbonado. Los alcoholes se caracterizan por la formación de enlaces de hidrógeno fuertes y, por tanto, tienen puntos de fusión y ebullición elevados,
en comparación con los alcanos correspondientes.
El grupo hidroxilo confiere polaridad a la molécula y posibilidad de formar enlaces de hidrógeno.
La parte carbonada es apolar y resulta hidrófoba. Cuanto mayor es la longitud del alcohol su solubilidad en agua disminuye y aumenta en disolventes poco polares.
| Compuesto | IUPAC | Común | p.f. | p.eb. | solub. | NaCl |
| CH3OH | Metanol | Alcohol metílico | -97.8 | 65.0 | Infinita | 14g/L |
| CH3CH2OH | Etanol | Alcohol etílico | -114.7 | 78.5 | Infinita | 0.6g/L |
| CH3(CH2)2OH | 1-Propanol | Alcohol propílico | -126.5 | 97.4 | Infinita | 0.1g/L |
| CH3CHOHCH3 | 2-Propanol | Isopropanol | -89.5 | 82.4 | Infinita |
|
| CH3CHClCH3 | 2-Cloro- | Cloruro de isopropilo | -117.2 | 35.7 | 3.1 g/L |
|
| CH3CH2CH3 | Propano |
| -187.7 | -42.1 | 0.038 g/L |
|
| CH3(CH2)3OH | 1-Butanol | Alcohol butílico | -89.5 | 117.3 | 80 g/L |
|
| (CH3)3COH | 2-Metil-2- | Alcohol terc-butílico | 25.5 | 82.2 | Infinita |
|
| CH3(CH2)4OH | 1-Pentanol | Alcohol pentílico | -79 | 138 | 22 g/L |
|
| (CH3)3CCH2OH | 2,2-Dimetil- | Alcohol neopentílico | 53 | 114 | Infinita |
|
El enlace O-H es más fuerte (ðHº = 104 kcal/mol) que el C-H (ðHº = 98 kcal/mol).
sin embargo, es mucho más fácil de romper heterolíticamente
La acidez de un alcohol se puede establecer cualitativamente observando la estabilidad del ion alcóxido correspondiente.


Los alcoholes son anfóteros porque los pares de electrones libres sobre el oxígeno.
hacen que sean básicos si se enfrentan a ácidos suficientemente fuertes.
Propiedades físicas
| Compuesto | IUPAC | Común | p.f. | p.eb. | solub. | NaCl |
| CH3OH | Metanol | Alcohol metílico | -97.8 | 65.0 | Infinita | 14g/L |
| CH3CH2OH | Etanol | Alcohol etílico | -114.7 | 78.5 | Infinita | 0.6g/L |
| CH3(CH2)2OH | 1-Propanol | Alcohol propílico | -126.5 | 97.4 | Infinita | 0.1g/L |
| CH3CHOHCH3 | 2-Propanol | Isopropanol | -89.5 | 82.4 | Infinita |
|
| CH3CHClCH3 | 2-Cloro- | Cloruro de isopropilo | -117.2 | 35.7 | 3.1 g/L |
|
| CH3CH2CH3 | Propano |
| -187.7 | -42.1 | 0.038 g/L |
|
| CH3(CH2)3OH | 1-Butanol | Alcohol butílico | -89.5 | 117.3 | 80 g/L |
|
| (CH3)3COH | 2-Metil-2- | Alcohol terc-butílico | 25.5 | 82.2 | Infinita |
|
| CH3(CH2)4OH | 1-Pentanol | Alcohol pentílico | -79 | 138 | 22 g/L |
|
Las propiedades físicas de un alcohol se comprenden mejor si reconocemos este hecho simple: estructuralmente, el alcohol es un compuesto de un alcano y agua. Contiene un grupo lipófilo, del tipo de un alcano, y un grupo hidroxilo que es hidrófilo, similar al agua. De estas dos unidades estructurales, el grupo -OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
El grupo -OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras, con otras moléculas neutras.
Prueba del Anhídrido cromico
En esta parte al adicionarle las gotas del anhídrido cromico a cada uno de los distintos alcoholes se encontro en cada uno de ellos:
En el primero de estos al adicionarle la acetona y el anhídrido cromico se observo que la reaccion era exotérmica; en un principio se empezo a formar un complejo oscuro como con verde y luego del tiempo el agua se fue poniendo clara.
![]()
En el alcohol 2- se observo que en el momento es que se agrego el anhídrido cromico reacciono haciendo un push, formándose un precipitado negro azuloso , tomando la fase aguada un color azul verdoso un poco lento con color como lechoso.
![]()
y en la ultima de las muestras luego de agregarle la acetona y el anhídrido cromico se observoque no reacciono, y se noto como una especie de coloide transparente amarillenta.
![]()
Los alcoholes se pueden diferenciar de alquenos y alquinos y de casi todos los demás tipos de compuestos por la oxidación con anhídrido crómico, CrO3, en ácido sulfúrico acuoso: en dos segundos, la solución transparente anaranjada se vuelve azul verdosa y opaca.
Los alcoholes terciarios no dan esta prueba. Los aldehídos sí la dan, pero se pueden diferenciar fácilmente con otros ensayos.
La reacción de los alcoholes son sodio metálico, produciendo hidrógeno gaseoso, sirve para caracterizarlos; sin embargo, es evidente que cualquier compuesto húmedo hará lo mismo, hasta haber consumido el agua.
A menudo se detecta la presencia del grupo OH en una molécula por la formación de un éster después del tratamiento con un cloruro o anhídrido de ácido. Algunos ésteres tienen olores dulces, otros son sólidos con puntos de fusión muy definidos, por lo que pueden emplearse para fines de identificación. (Si se determinan las fórmulas moleculares de los materiales originales y de los productos, es posible calcular cuántos grupos OH hay presentes.)
Prueba de lucas:
a). En la primera muestra al adicionarle agua se observaron dos fases transparentes inmiscibles la mas densa ubicada abajo y por esta razon no se le realizo el test de lucas por no ser totalmente soluble.
![]()
b). En la segunda tambien se observaron dos capas inmiscibles aceitosas la de abajo un poco aguada.
![]()
c). Con la tercera muestra si se observo que era totalmente soluble en agua por lo que se noto una sola fase totalmente miscible ; y por esto se procedio a la prueba de lucas .
En la cual se observo al adicionarle el reactivo de lucas dos fases inmiscibles, la de abajo un poco blancuzca y la otra transparente.
![]()
Preparación del reactivo de Lucas:
Se añaden 68 g de ZnCl2, en porciones,
a 45 ml de HCl conc., procurando enfriar la disolución a lo largo del proceso.
Debe indicarse que este ensayo, aunque puede utilizarse para detectar
alcoholes secundarios, es poco fiable. Además, no es válido para alcoholes alílicos ni para los insolubles en agua.
La prueba de Lucas indica si se trata de un alcohol primario, secundario o terciario, y se basan en la diferencia de reactividad de los tres tipos con los halogenuros de hidrógeno. Los alcoholes (de no más de seis carbonos) son solubles en el reactivo de Lucas, que es una mezcla que en agua Los cloruros de alquilo correspondientes son insolubles. La formación de un cloruro, a partir de alcohol, se manifiesta por la turbiedad que aparece cuando se separa el cloruro de la solución; en consecuencia, el tiempo que transcurra hasta la aparición de la turbiedad es una medida de la reactividad del alcohol.
Un alcohol terciario reacciona de inmediato con el reactivo de Lucas, mientras que uno secundario reacciona en cinco minutos; a temperatura ambiente, un alcohol primario no reacciona de forma apreciable. El alcohol alílico reacciona tan velozmente como los alcoholes terciarios con el reactivo de Lucas; sin embargo, el cloruro de alilo es soluble en el reactivo.
PRUEBA CON YODOFORMO:
Al tomar cada una de las muestras y agregarle dioxanato e hidroxido de sodio al 5% se observo lo siguiente en cada una de las muestras:
a). Se observo que primero con el dioxanato se volvio totalmente miscible y al agregar el hidroxido de sodio, no sucedió nada.
Al adicionarle el yodo de yoduro se observo que reacciono formándose dos fases notándose en la parte inferior un precipitado de color amarillento; unos minutos mas tarde al agitar el tubo de ensayo se observo un color uniforme ( anaranjado)y el precipitado, permanecio debido a que se le adiciono poco alcohol de la muestra pertinente.
![]()
b). Al tomar la muestra 2 y efectuar el mismo procedimiento anterior , se observo de la misma forma que se forma un precipitado amarillento en el fondo, teniendo en cuenta que fue una reaccion mucho mas lenta que la primera .
![]()
c). No se observo ningun cambio Y a este se le puso en baño de maria y a pesar de que se calento no precipito .lo que nos muestra como resultado inmediato el hecho de que este es un alcohol terciario.
La prueba del yodoformo indica si un alcohol contiene o no una unidad estructural determinada.
Se trata de alcohol con yodo e hidrógeno de sodio (hipoyodito de sodio, NaOI); un alcohol de estructura
Da un precipitado amarillo de yodoformo (CHI3, p.f. 119ºC). Por ejemplo:
La reacción comprende oxidación, halogenación y degradación.
Como es de suponer a partir de las ecuaciones, un compuesto de estructura
También da una prueba positiva.
En ciertos casos especiales, esta reacción no se emplea como ensayo, sino para sintetizar ácidos carboxílicos, RCOOH. Aquí probablemente se utilizaría hipobromito, o hipoclorito, que es más barato.
OXIDACIÓN DEL ALCOHOL AL COMPUESTO CARBONILICO Y FORMACIÓN DE 2,4 DINITROFENILHIDRAZONA.
En este al agregarle el KMnO4 se observo que de una vez se coloco marron, y al agregarle oxalato se formaron dos capas no tan transparentes y se deja enfriar, demorándose largo tiempo en la formación de cristales.
![]()
Al pasar aproximadamente ½ hora se paso a filtrar al vacio para obtener los cristales observando una pequeña cantidad de cristales.
Muestra 1
Muestra 2
Muestra 3
Agua
Muestra
Reactivo de lucas
Muestra
Dioxanato
Muestra con agua
Solucion de difenilhidrazo
na.
Capa organica
Descargar
| Enviado por: | Tila |
| Idioma: | castellano |
| País: | Colombia |