Química
Teoría Cuántica: unidad didáctica
Química I
Unidad 1 Teoría cuántica
Las leyes de la mecánica clásica solo se aplican al estudio de los movimientos de los cuerpos microscópicos pero al estudiar el movimiento de las partículas la física atómica tuvo que considerar nuevas hipótesis, la mecánica cuántica aplicable a las partículas ATOMO, ELECTRON, NUCLEOS ATOMICOS nos señala lo siguiente:
La energía solamente puede ser absorbida o emitida por cantidades discretas llamadas cuantos o cuanta ya firma que la luz también es emitida y absorbida en dichas cantidades discretas o paquetes.
Además la luz presenta contradicciones en su comportamiento ya que al difractarse o sufrir fenómenos en su propagación pero se comporta como una onda en su propagación pero al interaccionar con sustancias fotosensibles le arrancan electrones y se comporta no como onda si no en forma de corpúsculo que hiere a la materia manifestándose como diminutos proyectiles.
La mecánica ondulatoria termina con la contradicción y considera que onda y corpúsculo son dos aspectos complementarios de la misma realidad por eso a toda partícula en movimiento se encuentra asociada una onda.
Corpúsculo = materiales de dimensiones muy pequeñas que constituyen a los átomos o que son originados por la transformación de las partículas constituidas por los mismos.
Cuanto = Es una porción de energia que posee emite o absorbe una fuente de ondas electromagnéticas, es decir un oscilador de frecuencia natural
Shorondinger: abandono la idea de órbitas precisas y las sustituyo por descripciones de las regiones del espacio llamadas orbitales donde es más probable que de encuentre el electrón.
Broglie: 1892 crea la mecánica cuántica y obtuvo el premio Nobel de física de 1929 expuso que una partícula puede comportarse como una onda por ello una onda asociada a una partícula recibe el nombre de onda Broglie este físico determino que la longitud de onda de una partícula se encuentra con la ecuación.
____h____ longitud de onda de la partícula
mv m= masa de la partícula
v= velocidad de la partícula
Principio de incertidumbre
El principio de incertidumbre afirma que es imposible medir simultáneamente de forma precisa la posición y el momento lineal de una partícula.
También conocido por incertidumbre fue formulado en 1927 por el físico alemán Heinserberg y tuvo gran importancia para el desarrollo de la mecánica cuantía.
Las implicaciones filosóficas de la indeterminación crearon un fuerte misticismo. Albert Einstein, consideraba que la incertidumbre asociada a la observancia no contradice la existencia de leyes que gobiernan, el comportamiento de las partículas ni la capacidad de los científicos para descubrir dichas leyes.
I Mecánica cuántica
El modelo actual de los átomos fue desarrollado principalmente por Erwin Shordinger, en el que describe el comportamiento del electrón en función de sus características ondulatorias. La teoría moderna supone que el núcleo del átomo esta rodeado de una nube tenue de electrones que retienen el concepto de niveles de energía, pero a diferencia del modelo de Bohr no le atribuye al electrón trayectorias definidas si no que describe su localización en términos de los sistemas atómicos y moleculares
Esta teoría deriva 3 conceptos fundamentales:
Concepto de estados estacionarios de energía del electrón propuestos por Bohr. Normalmente los electrones se encuentran en el nivel de mínima energía (estado basal o fundamental) pero pueden absorber energía pasando a un nivel superior más alejado del núcleo (estado excitado) este estado a su nivel original emite la energía absorbida en forma de radiación electromagnética. Mientras los electrones describen una órbita no hay absorción ni emisión de energía
Naturaleza dual de la masa sugerida por Luis de Broglie el cual concluyo que la masa como la luz tienen ambas características de partícula y de onda
Principio de incertidumbre de Heinsenberg el cual presento el principio de incertidumbre como consecuencia de la dualidad de la naturaleza del electrón Heinserberg imaginó un microscopio super potente por medio del cual se pudiese observar la coalición entre un fotón y un electrón y postulo que debido a que ambos cambian su posición y su velocidad, en imposible en un momento dado establecer la posición y la velocidad del electrón en un nivel energético.
Fue así como Shurodinger después de sopesar las ideas de Bohr y de Broile y tratando de anudar ambas dedujo una ecuación matemática en donde el electrón era tratado en funcion de su comportamiento ondulatorio.
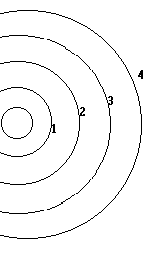
Deacuerdo con la ecuación de onda de Schrondiger la posición probable de un electrón esta determinada por 4 parámetros llamados cuánticos, los cuales tienen valores dependientes entre sí.
s2 p6 d10 f14 numero máximo de orbitales
El primer nivel energético solo hay un subnivel, al cual da un valor de cero y lo representa la letra S del ingles sharp
El segundo nivel energético hay 2 subniveles a los que da el valor de cero y uno y lo representa con las literales S y P respectivamente (P del ingles principal)
En el tercer nivel energético hay 3 subniveles a los que da el valor de cero, 1, 2 y se representa por la literales S, P y D (D de difuce)
En el cuarto nivel energético hay 4 subniveles de los que da el valor de cero 1, 2 y 3 y lo representa por las literales S, P, D y F (F de fundamental)
Para el 5to 6to y 7mo nivel energético teóricamente habría 5, 6 y 7 subniveles solo que para los átomos conocidos son suficientes 4 subniveles en el 5to nivel S P D y F 3 subniveles para el sexto nivel S P y D y dos subniveles para el séptimo nivel energético s y P
S = 0
P = 1
D = 2
F = 3
Números cuánticos
Ahora bien resumiendo los datos lo los números cuánticos nos proporcionan, podemos decir que:
Orbital soporta como máximo 2 electrones
Los orbitales que tienen la máxima energia forman los subniveles atómicos
Un subnivel S con un solo orbital soporta como máximo 2 electrones
Un subnivel P con 3 orbitales puede soportar seis electrones
Un subnivel D con 5 orbitales puede soportar 10 electrones
Un subnivel F con orbitales puede soportar 14 electrones
El primer nivel energético (n=1) habrá máximo 2 electrones ya que este solamente tiene un orbital
En el segundo nivel energético (n=2) puede haber hasta 8 electrones 2 en el orbital S y 6 de los 3 orbitales del subnivel P
En el tercer nivel energético (n=3) puede haber hasta 18 electrones 2 del orbital S 6 de los orbitales del P y 10 de los 5 orbitales del subnivel D
En el cuarto nivel energético (n=4) puede haber hasta 32 electrones 2 del orbital S 6 de los orbitales P, 10 de los orbitales de subnivel D y 14 de los 7 orbitales del subnivel F. De esta manera es posible calcular la cantidad máxima de electrones que puede soportar los niveles energéticos (5, 6, 7)
Regla de AUF-BAU
Cada nuevo electrón añadido a un átomo entra en el orbital disponible de mínima energía la separación de energía en el subnivel de los átomos polielectronicos, origina que se superponga o se traslade el valor de energía, orbitales con diferentes valores de n
Principio de multiplicidad de Hund
Esta nos habla en que entran electrones paralelos (spin)
1s2
2s2 2p6
3s2 3p6 3d10
4s2 4p6 4d10 4f14
5s2 5p6 5d10 5f14
Electronegatividad:
Es la capacidad de un elemento para ganar electrones
Potencial de ionización:
Es la energía necesaria para liberar un electrón
Valencia:
Es la capacidad de combinación
Numero atómico:
Es él numero de electrones de un átomo o protones
Masa:
Es él numero de protón más electrones
Isótopo:
Átomos de un mismo elemento que tienen diferentes cantidad de electrones o masas diferentes, son átomos de un mismo elemento con igual numero atómico y diferente numero de masa debido a diferente números de neutrones.
II Características de la clasificación de los elementos
Se comenzó a clasificar sobre la base de su numero atómico
Numero atómico: Es él numero de electrones protones que tiene el átomo
Los átomos de varios elementos difieren debido a distintas cantidades de electrones, protones, los núcleos de los átomos de un elemento dado que tiene el mismo numero de protones y consiguiente el mismo de electrones
La cantidad de protones dentro de un núcleo de un átomo o él numero de electrones en órbita del mismo, se conoce como numero atómico
Principio de exclusión de Pauli
Es imposible que 2 electrones de un mismo átomo tengan los mismos valores en los 4 números cuánticos
Masa y peso
La masa es la sustancia de los objetos materiales
Peso: fuerza que ejerce la gravedad de la tierra sobre un objeto
Propiedades atómicas y su variación atómica
Valencia se define como la capacidad de un elemento para unirse a otro
Periodo: se llama a la serie de elementos comprendidos entre 2 gases nobles sucesivos de izq. a derecha
Grupo y familia
Los elementos que se encuentran en una columna de la de la tabla se llaman grupo o familia, mientras que la s sucesiones horizontales de los elementos se conoce como renglones
Familia Vertical
Periodo horizontal
Ley periódica
Las propiedades de los elementos están directamente relacionados con la configuración electrónica de los átomos de los elementos y cada uno tiene una configuración electrónica semejante
Energía de ionización es la energía que ser requiere para quitar un electrón o de ceder o compartir a un átomo
Afinidad electrónica: es cuando un elemento es más electronegativo es capas de arrancar electrones a elementos del grupo I y II es la atracción de un electrón por un protón
Numero de oxidación: es que representaba la carga aparente del átomo y puede ser anion carga negativa y cation carga positiva
Regla para asignar números de oxidación
Él numera de oxidación de un elemento es su forma natural es cero
Él numera de oxidación de un elenco es un ion monoatómico y esta dado por la carga del ion
En un compuesto de la suma algebraica de losa números de oxidación de los elementos deben ser iguales a cero
En un ion poliatómico la suma algebraica del mol. De oxidación debe ser igual a la la carga en el ion
Los elementos más electronegativos comúnmente toma él numera de oxidación negativas y viceversa
Él numera de oxidación de un elemento en un compuesto o un ion poliatomico puede determinarse asignando números de oxidación razonables a los otros elementos aplicando lo dicho en el punto 4 y 5
En la naturaleza abunda el titanio magnesio potasio sodio aluminio silicio hidrogeno
Los mas utilices son Carbono oxigeno nitrógeno
Definiciones Unidad II
Estequiometría: Parte de la Química que trata sobre las relaciones cuantitativas entre los elementos y los compuestos en reacciones químicas
Fórmula Química: Representación escrita de la relación existente entre los átomos en un compuesto (por ejemplo: H2O)
Fórmula Empírica (o Condensada): Fórmula de un Compuesto que se escribe utilizando la relación de números enteros más simple de átomos presentes en el compuesto (por ejemplo para Benceno: C1H1)
Fórmula Molecular: Fórmula Química para una sustancia que representa su molécula y proporciona el número y tipo de cada átomo presente en cada molécula. (por ejemplo, benceno: C6H6)
Ecuación Química: Representación de una Reacción Química por medio de Números y Símbolos
Atomo: Partícula más pequeña de un elemento que retiene sus propiedades.
Peso Atómico: Masa promedio de los átomos de un elemento en relación a la masa de un átomo de carbono 12, tomado exactamente como 12.0000
Peso Fórmula: Suma de los pesos atómicos de los átomos en una Fórmula.
Peso Molecular: Suma de los pesos atómicos de los átomos de una Molécula.
Mol: Cantidad de sustancia que contiene tantas entidades elementales como átomos existen en 12 gramos de “Carbono 12”. (es decir que 12 gramos de “Carbono 12” contienen el mismo número de átomos que 16 gramos de “Oxígeno 16”). Para propósitos prácticos puede definirse al Mol como el peso fórmula expresado en gramos, por ejemplo: 1 mol de Carbono son 12 gramos, 1 mol de H2O son 18 gramos, etc.
Número de Avogadro (N): Cantidad de átomos en 1 mol de átomos, y es igual a 6.02205 x 1023 ( 1 mol de un compuesto contiene N moléculas).
Coulomb: Es la cantidad de carga que pasa en un segundo por un punto dado de un circuito eléctrico cuando la corriente es de 1 ampere (En otras palabras, 1 Ampere = 1 Colulomb/segundo).
Radiactividad: Fenómeno de Radiación espontánea producida por ciertos átomos que poseen una combinación inestable de partículas sub-atómicas.
Número Atómico (Z): Número de Protones o Electrones en un átomo Neutro
Número de Masa (A): Número Total de Protones y Neutrones
Isótopos: Atomos con el mismo Número Atómico (Z) pero diferente Número de Masa (A)
Potencial de Ionización: Cantidad de energía para eliminar los electrones menos retenidos por un átomo que se halla en su estado fundamental.
Afinidad Electrónica: Cambio de Energía Asociado con el proceso con el cual un electrón se agrega a un átomo gaseoso en estado fundamental.
Electronegatividad: Medida de la capacidad relativa de un átomo en una molécula para atraer electrones hacia él mismo.
Radiación Electromagnética: Energía Radiante que se propaga a través del vacío a una velocidad característica e interpretada en términos de ondas o cuantos
Cuanto: Una cantidad pequeña y definida de Energía Radiante
Volver al Inicio
Reacciones Químicas y Estequiometría
Si se busca en la Literatura el peso atómico del Carbono se encontrará que es igual a 12.011, lo cual no parece concordar con el concepto de Peso Atómico.
La explicación es la siguiente: Existen dos “especies” diferentes de átomos de Carbono, cuyas propiedades son idénticas, pero que difieren en el peso. Una de ellas es Carbono 12, cuya abundancia relativa al total de “especies” de Carbono es del 99 %. Para calcular el Peso Atómico del Carbono se suman las contribuciones de cada “especie” de Carbono, ésto es:
Peso Atómico de carbono = (12)x(0.99) + (13)x(0.01) = 12.01
Estas “especies” de átomos son conocidas como isótopos.
Nota: 1 Mol de un gas a 0 °C y 1 Atmósfera de Presión tiene un volumen de 22.4 Litros
Determinación de Fórmulas Empíricas y Moleculares:
Ejemplo: Determine la Fórmula Empírica y la Fórmula Molecular de un compuesto que contiene 40.0 % de C, 6.67 % de H y 53.3 % de O y tiene un peso molecular de 180.2.
Cuando los datos se expresan como porcentaje, se pueden considerar 100 gramos del compuesto para realizar los cálculos. Los pesos atómicos son: C = 12.0, O = 16.0 y H = 1.0
El primer paso para el cálculo es determinar el número de moles de cada elemento.
# moles de C = 40/12.0 = 3.33
# moles de O = 53.3/16.0 = 3.33
# moles de H = 6.67/1.0 = 6.67
El siguiente paso consiste en dividir cada valor entre el valor más pequeño.
C = 3.33/3.33 = 1
O = 3.33/3.33 = 1
H = 6.67/3.33 = 2
puede apreciarse que los valores obtenidos son los números enteros más pequeños y la fórmula empírica será: C1H2O1 o bien, CH2O.
Para obtener la Fórmula Molecular, calculemos el peso de la Fórmula empírica:
C = (12.0)x(1) = 12.0
H = (1.0)x(2) = 2.0
O = (16.0)x(1) = 16.0
Suma = 30.0
Ahora se divide el Peso Molecular entre el Peso de la Fórmula Empírica
180/30 = 6
La Fórmula Molecular será igual a 6 veces la Fórmula empírica:
C6H12O6
En los casos en que una fórmula empírica dé una fracción, como por ejemplo:
PO2.5
habrá que multiplicar por un número entero que nos proporcione la relación buscada, por ejemplo 2
P2O5
Ejemplo.
Calcule el Peso Fórmula del BaCl2 (Cloruro de Bario).
Primero deben consultarse los Pesos Atómicos del Bario y del Cloro. Estos son:
Peso Atómico (P. A.) del Bario = 137.3
Peso Atómico (P. A.) del Cloro = 35.5
Peso Fórmula del BaCl2 = (1)*(P. A. del Bario) + (2)*(P. A. del Cloro)
Peso Fórmula del BaCl2 = (1)*(137.3) + (2)*(35.5) = 137.3 + 71 = 208.3
Ejemplo: Cuántos moles de Aluminio hay en 125 gramos de Aluminio?
Primero se consulta el Peso Atómico del Aluminio, el cual es 27 gramos por Mol. Enseguido hacemos el planteamiento:
27 gramos de Al ------ 1 Mol de Aluminio
125 gramos de Al ----- ?
Moles de Aluminio = (125 gramos de Aluminio)*(1 Mol de Aluminio)/(27 gramos de Aluminio)
Moles de Aluminio = 49.25 Moles de Aluminio
Relaciones Molares
En la Fórmula: Al2O3, 1 Mol de Al2O3 (Peso Fórmula = 102 g/Mol) contiene 2 Moles de Aluminio y 3 Moles de Oxígeno Atómico. Si se tuvieran 10 gramos de Al2O3 cuántos gramos de Aluminio se obtendrían?
Debemos partir de los 10 gramos de Alúmina.
| 10 g de Al2O3 | 1 Mol de Al2O3 | 2 Moles de Al | 27 g de Al |
| 102 g Al2O3 | 1 Mol de Al2O3 | 1 Mol de Al |
gramos de Aluminio = 5.294
Las celdas reteñidas en la expresión representan la Relación Molar
Ejemplo: Cuando se calientan 9.7 g de un Hidrato de CuSO4 pierde 3.5 g de H2O. ¿Cuál es la Fórmula empírica del Hidrato?
El Hidrato de CuSO4 debe tener la siguiente fórmula: CuSO4.xH2O y por lo tanto hay que determinar cuantos Moles de H2O hay por cada Mol de CuSO4.
Los Moles de Agua se pueden Calcular a Partir de la Pérdida de Peso = 3.5 g de H2O
Moles de Agua = g de H2O/P.F. H2O
Moles de Agua = 3.5/18 = 0.1944 Moles de H2O
Los Moles de CuSO4 se pueden calcular restando los 3.5 g al Peso Inicial del Hidrato.
gramos de CuSO4 = 9.7 g - 3.5 g = 6.2 g de CuSO4
Moles de CuSO4 = 6.2 g/P.F. CuSO4
Moles de CuSO4 = 6.2/160 = 0.03875 Moles de CuSO4
Ahora se Divide el Número de Moles de Agua entre los Moles de CuSO4.
0.1944/0.03875 = 5.01
Es decir que por cada Mol deCuSO4 hay 5 Moles de H2O
La Fórmula del Hidrato será: CuSO4.5H2O
Ecuaciones Químicas
El Tratamiento es el mismo que en el punto anterior solamente que deberá trabajarse con una Ecuación Química Balanceada. (Balanceada quiere decir que la suma de átomos en ambos lados de la ecuación deben ser iguales).
Ejemplo: Determinar los gramos de O2 que se requieren para reaccionar con 5 Moles de C2H6 de acuerdo con la siguiente ecuación:
2 C2H6 + 7 O2 4 CO2 + 6 H2O
según la Ecuación, 2 Moles de C2H6 reaccionan con 7 Moles de O2 siendo ésto la Relación Molar.
| 5 Moles de C2H6 | 7 Moles de O2 | 32 g de O2 |
| 2 Moles de C2H6 | 1 Mol de O2 |
La Respuesta son 560 gramos de O2
Molaridad
La Molaridad es una forma de expresar concentración y se define por medio de la siguiente fórmula:
Molaridad = Moles de Soluto/1 Litro de Solución
Ejemplo: Cuántos gramos de NaOH se necesitan para preparar 250 mL de una Solución 0.3 M?
# Moles de NaOH = (Volumen en Litros)*(Molaridad) = (0.25L)*(0.3 Moles NaOH/L)
# Moles de NaOH = 0.075
gramos de NaOH = (Moles de NaOH)*(P.F. NaOH) = (0.075 Moles)*(40 g NaOH/Mol)
gramos de NaOH = 3.0 gramos de NaOH
Teoría Atómica
En el Siglo V A.C. dos Filósofos Griegos Leucipo y Demócrito propusieron que la Materia no podía dividirse indefinidamente tal y como lo estipulaba Aristóteles. Ellos proponían que al final de la división llegarían a los Atomos. (La palabra griega atomos significa “indivisible”)
Entre 1803 y 1808 John Dalton propone una teoría atómica compuesta de los siguientes postulados:
-
Los elementos están compuestos de partículas extremadamente pequeñas llamadas átomos.
-
Todos los átomos del mismo elemento son similares entre sí y diferentes de los átomos de otro elemento.
-
La separación de átomos y la unión se realiza en las reacciones químicas. En estas reacciones, ningún átomo se crea o destruye y ningún átomo de un elemento se convierte en un átomo de otro elemento.
-
Un compuesto químico es el resultado de la combinación de átomos de dos o más elementos en una proporción numérica simple.
Además de la teoría atómica de Dalton surgieron otras leyes que concordaban con lo expuesto por Dalton:
Ley de la Conservación de la Masa: La Materia no se crea ni se destruye, sólo se transforma.
Ley de las Proporciones Definidas: Un Compuesto Puro siempre contiene los mismos elementos combinados en las mismas proporciones en masa.
Ley de las Proporciones Múltiples: Cuando dos elementos A y B forman más de un compuesto, las cantidades de A que se combinan en estos compuestos, con una cantidad fija de B, están en relación de números pequeños enteros.
Partículas Sub-atómicas
El Electrón
El Descubrimiento del Electrón deriva de los experimentos realizados con Electricidad.
Julius Plücker en 1859 realizó experimentos con Rayos Catódicos consistiendo en lo siguiente:
Dos Electrodos se encuentran dentro de un tubo sellado de vidrio al que se ha extraído casi completamente el aire. Cuando se aplica un Voltaje alto a través de los electrodos, emerge un haz de rayos desde el electrodo negativo llamado Cátodo hacia el electrodo positivo llamado Anodo.
Estos rayos tienen naturaleza negativa, ya que son repelidos por el extremo negativo de campos eléctricos (Cátodo) y magnéticos (Sur Magnético). Seleccione aquí para ver un Diagrama del Dispositivo generador de Rayos Catódicos.
En 1891 Stoney les llamó electrones.
En 1897 Joseph J. Thomson determinó la relación carga/masa (e/m) del electrón estudiando la desviación de los rayos Catódicos por los campos eléctrico y magnético.
e/m = -1.75 x 108 coulomb/gramo
en 1909 Robert A. Millikan determinó la carga del electrón que resultó ser:
e = -1.602 x 10-19 Coulomb
al contar con el valor de e/m y con el de e, fué posible obtener el valor de m (masa del electón) que resultó ser:
me = 9.1096 x 10-28 g
El Protón
Si se remueven 1 o más electrones de un átomo neutro o molécula, el residuo posee una carga positiva igual a la suma de las cargas negativas de los electrones removidos
Ne Ne+ + e-
Ne Ne2+ + 2e-
Eugene Goldstein realizó experimentos con Rayos Catódicos en los cuales se introdujo Hidrógeno gas a baja presión, observando la presencia de Rayos que viajaban en dirección opuesta a los Rayo Catódicos. El llamó a estos “Rayos Positivos” Protones. Seleccione aquí para ver un Esquema del experimento de Goldstein.
Se determinó la relación e/m para el protón resultando ser:
e/m = +9.5791 x 104 Coulomb/g
A los protones se les asignó el símbolo H+ y se determinó que la carga del protón es igual a la del electrón sólo que de signo contrario (+).
eH+ = +1.602 x 10-19 Coulomb
Así mismo, se determinó la masa del Protón siendo ésta de:
mH+ = 1.6726 x 10-24 g
Esto quiere decir que la masa del protón es 1836 veces la masa del electrón.
El Neutrón
En 1932 Chadwik determinó mediante el estudio de reacciones nucleares la masa del Neutrón, el cual no posee carga (Por eso le llamaron Neutrón) siendo ésta de:
mn = 1.6750 x 10-24 g
n = neutrón
Modelos Atómicos
En 1896 Henri Becquerel descubrió la Radiactividad
Un átomo radiactivo emite radiación resultando en otro átomo de identidad química diferente (Véase la reacción involucrada en el descubrimiento del Neutrón).
Ernest Rutherford estudió los componentes de la radiación que ocurre espontáneamente en la Naturaleza. A continuación se presenta una tabla resumiendo las características de estos componentes:
| Rayo | Composición | Carga |
| alfa | 2 protones y 2 neutrones (llamados también núcleos de Helio) | 2+ |
| beta | Electrones de alta energía | 1- |
| gamma | Radiación Electromagnética de Longitud de onda muy corta (Alta Energía) | 0 |
En 1911 Rutherford realizó un experimento dirigiendo rayos a hacia láminas delgadas de oro, platino, plata y cobre, observando que la mayoría de las partículas alfa atravesaban las láminas, algunas eran desviadas y algunas rebotaban hacia la fuente de origen. Rutherford sugirió que la mayor parte de los átomos son espacio vacío y por eso la mayor parte de los rayos atravesaban la lámina, algunos rayos se desviaban por pasar cerca del núcleo que contiene la carga positiva del átomo los rayos que rebotaban hacia la fuente chocaban con el núcleo.
Debido a que un átomo es eléctricamente neutro, el número de electrones es igual al número de protones.
Radiación Electromagnética
= Longitud de onda: Distancia entre dos crestas en una onda (Longitud de un ciclo)
c = Velocidad de la luz (2.998 x 108 cm/seg)
= Frecuencia: Número de ondas que pasan por un punto en un segundo
La relación entre estas tres variables es:
En 1900 Max Plank propone la teoría cuántica para la energía radiante: “La Energía Radiante sólo puede ser emitida o absorbida en cantidades discretas llamadas cuantos”.
Plank desarrolló una ecuación que define la energía de un cuanto de Energía Radiante:
donde:
E = Energía Radiante
h = Constante de Plank (6.6262 x 10-34 Joule-seg)
= Frecuencia (seg-1)
En 1905 Albert Einstein propuso que los cuantos son paquetes discontinuos llamados “fotones”.
El Espectro Electromagnético.
Seleccione aquí para ver un Diagrama del Espectro Electromagnético.
Cuando un rayo de luz atraviesa un prisma, el rayo se desvía o se refracta. el grado de desviación depende de la Longitud de Onda.
El Espectro Electromagnético representa el Intervalo de Longitudes de Onda de la Radiación Electromagnética.
Espectros Atómicos
Cuando los vapores o gases de una sustancia se calientan en una llama, se produce luz. Si un rayo de esta luz se hace pasar por un prisma, se produce un Espectro de Líneas (o Discontinuo).
El Espectro de Líneas de cada Elemento es Unico (Es como su Huella Digital)
En 1885 J. J. Balmer estudió el espectro de emisión del Hidrógeno y obtuvo la siguiente ecuación:
donde n = 3, 4, 5, ...
La serie de líneas que se obtiene se conoce como “Serie de Balmer”.
Modelo Atómico de Bohr
En 1913 Niels Bohr propuso una Teoría para describir la estructura atómica del Hidrógeno, que explicaba el espectro de líneas de este elemento. A continuación se presentan los postulados del Modelo Atómico de Bohr:
· El Atomo de Hidrógeno contiene un electrón y un núcleo que consiste de un sólo protón. · El electrón del átomo de Hidrógeno puede existir solamente en ciertas órbitas esféricas las cuales se llaman niveles o capas de energía. Estos niveles de energía se hallan dispuestos concéntricamente alrededor del núcleo. Cada nivel se designa con una letra (K, L, M, N,...) o un valor de n (1, 2, 3, 4,...)
-
El electrón posee una energía definida y característica de la órbita en la cual se mueve. Un electrón de la capa K (más cercana al núcleo) posee la energía más baja posible. Con el aumento de la distancia del núcleo, el radio del nivel y la energía del electrón en el nivel aumentan. El electrón no puede tener una energía que lo coloque entre los niveles permitidos.
-
Un electrón en la capa más cercana al núcleo (Capa K) tiene la energía más baja o se encuentra en estado basal. Cuando los átomos se calientan, absorben energía y pasan a niveles exteriores, los cuales son estados energéticos superiores. Se dice entonces que los átomos están excitados.
-
Cuando un electrón regresa a un Nivel inferior emite una cantidad definida de energía a la forma de un cuanto de luz. El cuanto de luz tiene una longitud de onda y una frecuencia características y produce una línea espectral característica. (Ver Esquema).
-
La longitud de onda y la frecuencia de un fotón producido por el paso de un electrón de un nivel de energía mayor a uno menor en el átomo de Hidrógeno esta dada por:
Ejercicio: Determine la longitud de onda de la línea en el Espectro de Hidrógeno que corresponde a la transición del nivel 3 al nivel 2. Respuesta: 656.3 nm (1 nm = 1 x 10-9m).
![]()
![]()
Descargar
| Enviado por: | Héroe |
| Idioma: | castellano |
| País: | México |
