Química
Química
UNIVERSIDAD AUTONOMA DEL ESTADO DE MÉXICO
INSTITUTO TÉCNICO HUMANISTICO Y ADMINISTRATIVO DE TOLUCA
PREPARATORIA INCORPORADA CON CLAVE 17
APUNTES DE QUÍMICA I
TEORIA Y EJERCICIOS
PROFESOR:
CUARTO SEMESTRE
SEMESTRE PAR MARZO-SEPTIEMBRE DEL 2000
UNIDAD I INTRODUCCIÓN AL A QUÍMICA
Tema 1 Método Científico
El método científico es la principal herramienta que usa el ser humano para desarrollar las ciencias. En particular la química fundamenta todos conocimientos en este.
Aunque no existe propiamente una persona a la que se considere inventora del método científico, el gran sabio italiano Galileo Galilei es llamado el padre del método científico moderno.
De acuerdo a la ciencia o al investigador que lo utilice, el método tendrá un número variable de pasos, sin embargo los pasos básicos de los cuales consta son:
a) Planteamiento de problema: En este paso se elige el tema de estudio
b).- Hipótesis: Son una serie de suposiciones que son las probables respuestas al problema.
c) Observación: Aquí se emplean los cinco sentidos para analizar el problema.
d) Experimentación: Se llevan acabo experimentos de acuerdo en lo planteado en la hipótesis.
e) Ley: Una vez que se han obtenido resultados satisfactorio se puede plantear una ley que muestre la conclusión a la que se ha llegado.
Tema 2 Descripción e importancia de la química
La química es una ciencia que se basa en la observación de los fenómenos que se producen sobre la materia que existe en el universo.
La química se ha desarrollado debido a la necesidad de descubrir como están formados los objetos y la manera en que su estructura determina las propiedades que presentan
2.1 Concepto y definición de química.
La química se define como la ciencia que estudia a la materia y sus transformaciones.
2.2 Interdisciplinariedad de la química.
La química es una de las tres ciencias básicas que existen, por lo tanto necesita de estas para su desarrollo.
Dichas ciencias y una disciplina auxilian a la química:
FÍSICA
MATEMÁTICAS FILOSOFÍA.
A sus vez la química auxilia a otras ciencias como son:
Medicina
Farmacología
Botánica
Biología
2.3 Aplicaciones de la química.
Los químicos exploran la naturaleza y experimentan con sustancias para desarrollar y mejorar teorías concernientes a la estructura y comportamiento de la materia, por lo tanto los campos de aplicación son innumerables y el ser humano se beneficia día con día de las transformaciones químicas hechas por acción de la química.
Algunos de los campos de aplicación de la química son:
Agricultura
Fármacos
Cosméticos
Plásticos
Tema 3 Materia y energía
Materia y energía son los dos pilares en los que descansa el universo. Materia es la sustancia, lo palpable; energía es el motor de dicha sustancia.
3.1 Concepto de materia y energía
Materia. Las personas, las rocas, los animales, los árboles son lo que llamamos materia. Por definición, materia es todo aquello que ocupa un lugar en el espacio.
Energía. El concepto de energía es bastante nuevo en el mundo de la ciencia, debido a su intangibilidad e invisibilidad es un término bastante difícil de comprender.
Los griegos explicaban que los cuerpos caían al suelo por que los movía un deseo interno de “buscar sus lugares”, Aristóteles sostenía que un cuerpo caía más rápido hacia la tierra mientras más pesado era. Esta idea prevaleció hasta que Galileo demostró en la Torre de Pisa, al soltar dos balas de 50 kg y 0.5 kg de una altura de 55m, que todos los cuerpos caen a la misma velocidad, las balas salieron juntas y llegaron juntas a la tierra, se había sentado las bases de la mecánica, ciencia que estudia primordialmente a la energía.
De la misma forma, los científicos estudiaron la fuerza (masa por aceleración), pero más aun estudiaron los efectos de la aplicación de una fuerza sobre un cuerpo al desplazarlo, Von Leibnitz llamo vis viva la acción de una fuerza sobre un cuerpo y el desplazamiento que este sufre y expreso esta como 1/2mv2, esa fue la primer ecuación que expresaba la energía.
En 1807 la palabra Energía (del griego trabajo), se introdujo en el vocabulario científico del mundo, fue Thomas Young el introductor y definió a la energía como la capacidad para realizar un trabajo.
En realidad el trabajo es energía que se manifiesta, en términos más generales la energía es una manifestación del universo que permite efectuar un cambio en la materia, generalmente en forma de desplazamiento, pero se puede manifestar de las siguientes maneras:
Energía química
Energía cinética
Energía potencial
Energía eléctrica
Energía nuclear
Energía mecánica
Calor
Trabajo
3.2 Relación entre materia y energía.
La relación que existe entre la materia y la energía, es muy sencilla:
Ninguna puede existir aisladamente, es decir donde hay materia siempre habrá energía y viceversa.
Teóricamente se puede lograr transformar materia en energía según la ecuación planteada por Albert Einstein:
E = mc2
Donde:
E = Energía
m = masa
c = velocidad de la luz
3.3 Ley de la conservación de la materia y energía.
“La materia y la energía ni se crean, ni se destruyen, sólo se transforman”.
En otras palabras, desde que se creo el universo la cantidad de materia y energía ha sido la misma.
3.4 Estados de agregación de la materia.
La materia puede presentarse en diferentes formas, de acuerdo al grado de unión que exista entre las moléculas que la componen.
Sólido: Tiene forma definida, no se deforma con facilidad, sus moléculas están muy integradas, por ejemplo piedra, oro, mármol.
Líquido: Toma la forma del recipiente que lo contiene, se deforma con facilidad, sus moléculas están poco integradas, es incompresible, como ejemplos tenemos agua, mercurio, gasolina.
Gas: Ocupa todo el recipiente que lo contiene, es amorfo, sus moléculas no están integradas, es compresible, como ejemplos tenemos aire, helio, neón.
3.5 Transformaciones de fase.
La materia puede transformarse de un estado de agregación a otro mediante fenómenos físicos llamados transformaciones de fase
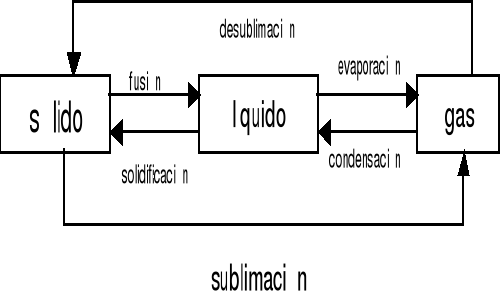
Tema 4 Cambios en la materia.
La naturaleza esta en constante transformación, de hecho cambia segundo a segundo. A la serie de eventos que provocan que la naturaleza se transforme les llamamos fenómenos.
4.1 Fenómenos Físicos, Químicos y Nucleares.
Fenómeno Físico. Ocurre cuando la materia se transforma pero no se altera la unión que existe entre los átomos que la forman sin formar nuevas sustancias, por ejemplo la evaporación del agua, disolver sal en azúcar, tritrurar un grano de azúcar.
Fenómeno Químico. Ocurre cuando la materia se transforma alterando la unión entre los átomos que la forman, dando origen a sustancias nuevas, por ejemplo la oxidación, la combustión, la fermentación.
Fenómenos nucleares. Ocurre cuando los cambios se dan en la estructura interna de los átomos, dando lugar al origen de elementos nuevos, básicamente ocurren dos tipos de fenómenos nucleares:
Fisión nuclear. Ocurre cuando un átomo pesado se fragmenta dando origen a elementos más ligeros y se desprende energía además de partículas radioactivas.
Fusión nuclear. Ocurre cuando dos o más átomos ligeros se unen para formar un elemento más pesado y se desprende energía y partículas radioactivas.
Tema 5 Tipos básicos de materia
Muchas sustancias aparentemente puras no lo son. De lejos, una losa de concreto parece un material de uniforme de color gris; pero si la observamos de cerca veremos que está formada de diferentes partes (grava, cemento, arena, etc)
Se ha encontrado que toda la materia está formada por aproximadamente un centenar de sustancias puras que no pueden separarse en otras más simples, a estas sustancias se les llama elementos, definición propuesta en 1661 por Robert Boyle en 1661. Cuando se combinan elementos para constituir una sustancia completamente nueva se forman los llamados compuestos , a su vez la combinación de compuestos nos da las llamadas mezclas. En la tabla siguiente se observan las principales características de los elementos, los compuestos y las mezclas.
5.1 Conceptos de elemento, compuesto y mezcla
| Elementos | Compuestos | Mezclas |
| Sustancias formadas por moléculas o conjuntos de átomos iguales | Sustancias formadas por moléculas en las cuales aparecen átomos de diferentes elementos | Sustancias formadas por la congregación de otras diferentes que no pierden sus propiedades al formarlo, elementos con elementos, elementos con compuestos, etc. |
| Las propiedades de los elementos dependen de las de sus moléculas. Cuando estos se rompen estas los átomos libres tienen propiedades distintas de las del elemento | Los compuestos tienen propiedades diferentes de las de los elementos que los formaron. Un compuesto se forma a partir de sus elementos por medio de un fenómeno químico que se llama síntesis | Al formarse una mezcla no se efectúa un fenómeno químico |
| De un elemento no es posible extraer otra sustancia diferente ni por procedimientos físicos ni químicos | De un compuesto es posible extraer otras sustancias diferentes por medio de un fenómeno químico llamado análisis | Los componentes de una mezcla pueden separarse aprovechando sus propiedades físicas. Al hacer esta separación no se presenta algún fenómeno químico |
| Oro, plata, oxígeno, calcio, etc. | Sal, oxido de hierro, ácido sulfúrico | Leche, sangre, concreto |
UNIDAD II ESTRUCTURA ATÓMICA
Tema 1 Átomo
La palabra átomo proviene de un vocablo griego que significa indivisible.
Concepto de átomo.
Un átomo es la parte más pequeña de la materia que aún conserva sus características físicas y químicas.
Función de los átomos en las cambios físicos, químicos y nucleares.
Los átomos forman enlaces entre sí, lo cual constituye la estructura interna de la materia.
Cuando ocurre un cambio físico en la materia, la unión entre los átomos no se ve afectada, por lo que no se da origen a sustancias nuevas.
Cuando ocurre un cambio químico, la unión entre los átomos se ve afectada, dando lugar al surgimiento de nuevas sustancias.
Un cambio nuclear afecta directamente a la estructura interna de los átomos que forman la materia del universo.
Partículas fundamentales del átomo: electrón, protón, neutrón.
Electrón. Es la partícula más pequeña, se encuentra orbitando el núcleo, tiene carga negativa y su masa es casi cero, su símbolo es e-
Fue descubierto por Joseph John Thomson en 1897, quien dedujo que los llamdos rayos catódicos estaban formadas por partículas cargadas negativamente, con una masa aproximadamente 1/2000 de la masa del átomo de hidrógeno y les llamó electrones.
Protón. Se encuentra dentro del núcleo, tiene carga positiva, su masa es de 1 u.m.a., su símbolo es p+
En 1886 Eugen Goldstein realizó algunos experimentos con un tubo al vacío que poseía un cátodo (electrodo negativo) perforado; cuando se conectaba a una fuente de alto poder, fluían los electrones del cátodo al ánodo (electrodo positivo). Otros rayos pasaban a través de los agujeros del cátodo y eran despedidos en sentido contrario. Como estos nuevos rayos viajaban en sentido contrario al de los rayos catódicos de carga negativa se dedujo que debian tener carga positiva llamándoles protones..
Neutrón. Se encuentra dentro del núcleo, tiene carga neutra, su masa es de 1 u.m.a. (unidad de masa atómica), su símbolo es n0
En 1932 el físico James Chadwick aisló e identificó una partícula que tenía exactamente la misma masa del protón, pero que no poseía ninguna carga eléctrica, por esta razón se le nombró neutrón.
Número atómico.
Indica el número de protones, que es el mismo que el de electrones, que tiene un átomo, se puede leer en la tabla periódica.
Masa atómica.
Indica la suma del número de protones y neutrones que en el átomo.
Ejercicio completar la tabla siguiente:
| Elemento | Símbolo | # atómico | Masa atómica | e- | p+ | n0 |
| Boro | ||||||
| Oxigeno | ||||||
| Sodio | ||||||
| Flúor | ||||||
| Cromo | ||||||
| Azufre | ||||||
| Selenio | ||||||
| Bromo | ||||||
| Níquel | ||||||
| Rubidio | ||||||
| Cloro |
Tema 2 modelo atómico de Bohr (Teoría atómica).
La palabra átomo, que significa indivisible, tuvo su origen en la cultura griega y surgió como respuesta a la pregunta que había intrigado a los filósofos por mucho tiempo, ¿De qué y de que modo está hecho el mundo?. Aristóteles sostenía que el universo estaba constituido de cuatro elementos vitales, tierra, aire, agua y fuego.
Sin embargo el gran pensador Demócrito aseguraba que todo lo que existe estaba integrado por pequeñísimas partículas compactas agrupadas como las celdillas de una colmena llamadas átomos, también supuso que los átomos de cada sustancia eran diferentes en tamaño y forma y que por ello conferían a las sustancias distintas propiedades.
En 1803 John Dalton se baso en las investigaciones de Lavoisier, Gay Lussac y Ritcher para proponer la primera teoría atómica, que dice:
Los elementos químicos están formados por átomos.
Los átomos no pueden crearse ni destruirse
Los átomos de un mismo elemento son idénticos y tienen la misma masa
Los átomos de diferentes elementos tienen masas distintas
Las combinaciones ocurren entre los átomos en relaciones de números enteros.
El primer modelo atómico fue propuesto por Thomson en 1902, dicho modelo también conocido como el modelo del budín de pasas proponía que el átomo era una masa sólida positiva y que los electrones estaban insertados en el como las pasas del budín.
Dibuja el modelo del budín de pasas.
En 1913 Niels Bohr propuso que los electrones estaban separados de las partículas positivas y que el átomo semejaba un sistema solar donde las cargas negativas orbitaban alrededor del núcleo de carga positiva, el modelo atómico de Bohr quedó expuesto en sus postulados.
Postulados de Bohr:
1.- Los electrones giran alrededor del núcleo en orbitas fijas llamdos orbitales.
2.- Entre mayor sea el orbital mayor será el contenido de energía del electrón.
3.- Para que un electrón cambie de orbital necesita ganar o desprender energía.
4.- La energía ganada o perdida por el electrón es una cantidad fija llamada cuanto que significa salto.
2.1 Nivel electrónico.
El aspecto más importante que planteó Bohr en su modelo atómico es la forma en que se distribuyen los electrones de un átomo en los diferentes niveles llamados orbitales, o niveles electrónicos.
Cada nivel puede tener sólo un cierto número de electrones de acuerdo a la forma siguiente:
| Nivel | Número de electrones |
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
| 5 | 32 |
| 6 | 11 |
| 7 | 2 |
El modelo atómico de Bohr es útil para representar la distribución de los electrones de un átomo, a esta distribución se le llama distribución electrónica.
Ejercicio realizar las siguientes distribuciones electrónicas:
Nitrógeno
Cloro
Germanio
Bromo
Cesio
2.2 Electrones de valencia
Los electrones de valencia de un átomo son aquellos que se encuentran en el último nivel u orbital en la configuración electrónica de los elementos y son los responsables de la actividad química de los átomos.
Las valencias de un elemento son los electrones que un átomo puede perder, ganar o compartir.
Si la valencia es positiva entonces el átomo pierde electrones.
Si la valencia es negativa entonces el átomo gana electrones
2.3 Regla del octeto.
El comportamiento de los átomos es el de tender a lograr una configuración electrónica que presente 8 electrones en el último nivel, ya sea ganado, perdiendo o compartiendo electrones.
Ejemplos
Cloro
Sodio
De hecho los átomos tienden a lograr una configuración electrónica igual a la de los gases inertes.
Ejemplos
Neón
Argón
Tema 3 Variaciones en las partículas subatómicas.
Los átomos de un mismo elemento pueden presentar diferencias entre si, debido a diferencias en el número de electrones o protones que poseen respectivamente; dichas diferencias provocan cambios en las propiedades físicas o químicas de los elementos.
3.1 Ión.
Un ión es un átomo que ha ganado o perdido electrones y por lo tanto posee carga eléctrica, existen dos tipos de iones:
Catión. Átomo que ha perdido electrones y tiene carga positiva.
Anión. Átomo que ha ganado electrones y tiene carga negativa.
3.2 Formación de iones
En la naturaleza los iones se pueden formar mediante la disolución de sales, por ejemplo:
NaCl + H2O --------------- Na+ + Cl-
3.3 Isótopos
En 1913, Frederich Soddy encontró dos pesos atómicos para el plomo, provenientes de dos fuentes distintas.
J. J. Thomson también encontró que parecia haber dos átomos de neón de distinto peso atómico, uno de ellos tenía un número másico de 20 y el otro de 22, a demás encontró que uno de ellos (20) era más abundante que el de 22.
Soddy propuso que un mismo lugar en la tabla periódica podía ser ocupado por un mismo tipo de átomo, llamando a dichos átomos isótopos (mismo lugar).
Los diferentes isótopos en un lugar dado en la tabla periódica tendrán el mismo número atómico y el mismo número de protones en el núcleo y de electrones, pero su número de neutrones variará.
Los isótopos de un mismo elemento tendrán las mismas propiedades químicas, por lo que es casi imposible separarlos una vez que se han mezclado.
3.4 Cálculo del número de protones, electrones y neutrones en átomos isótopos o iones.
Completa la tabla siguiente
| Elemento | Nombre | # atómico | Masa atómica | e- | p+ | no |
| Mg | ||||||
| Se-2 | ||||||
| Cl+6 | ||||||
| 14C | ||||||
| 42K | ||||||
| Au | ||||||
| Ca | ||||||
| Ca+2 | ||||||
| 45Ca |
Tema 4 Mecánica cuántica.
4.1 Números cuánticos.
Aun cuando el modelo atómico de Bohr es útil para representar la configuración electrónica de los elementos, esta se complica cada vez más cuanto mayor es el número atómico del elemento.
Por otra parte, la investigación acerca de la naturaleza atómica ha demostrado que cada electrón tiene una serie de características irrepetibles en los demás electrones que componen el átomo, a esta serie de características se les denomina números cuánticos y son el resultado de años de investigación acerca de la naturaleza de los átomos y la forma de representarlos.
4.2 Configuración cuántica
Realiza las siguientes configuraciones cuánticas:
Cloro
Bromo
Cesio
Hierro
Argón
Trabajo para el primer parcial
Tema 5 Química nuclear
5.1 Concepto de radiación
5.2 Naturaleza de la radioactividad
5.3 Tipos de desintegración (natural y artificial)
5.4 Concepto de vida media
5.5 Masa crítica
5.6 Fusión nuclear
5.7 Fisión nuclear
5.8 Concepto de reacción encadena
5.9 Aplicaciones de la radiactividad.
UNIDAD III TABLA PERIÓDICA
Tema 1 Generalidades de la tabla periódica
En su trabajo como profesor de química, Dimitri Ivanovich Mendeleiev buscaba enseñar las propiedades de los elementos de una manera ordenada, sin que los alumnos tuvieran que memorizar cada una de ellas.
Para encontrar principios generales, escribía en tarjetas el símbolo y las propiedades de cada uno de los elementos y después jugaba a organizarlas según la masa atómica, empezando por el hidrógeno
Un día observo algo importante: las propiedades de los elementos se repetían debido al ordenamiento por el peso atómico, es la llamada ley periódica. Así de esta forma construyó la primer tabla periódica en 1869.
El merito que tuvo Mendeleiev , fue el de predecir la existencia de elementos que aun no se descubrían al momento de crear la tabla periódica; por ejemplo el dejó espacios para los elementos que el llamó ekaalumnio (galio, descubierto en 1874), ekaboro (escandio, descubierto en 1879) y el ekasilicio (germanio, descubierto en 1885)
Estructuración de la tabla periódica.
Periodos. Los periodos son los renglones de la tabla periódica en los cuales los elementos se distribuyen de acuerdo al número atómico.
Familias. Las familias son las columnas de la tabla periódica, agrupan a elementos cuyas características químicas y fichas son similares.
Grupos. En la tabla periódica existen dos grupos; Grupo A abarca a aquellos elementos cuyo carácter metálico o no metálico está perfectamente definido; Grupo B comprende a aquellos elementos llamados de transición.
Símbolo, estado físico, número atómico, masa atómica y estado de oxidación realizar los ejercicios siguientes:
Tema 2 Relación entre el nivel energético (modelo de Bohr) y el periodo.
El modelo atómico ayudo a la construcción de la tabla periódica ya que cada nivel energético corresponde a un periodo.
Tema 3 Metales y no metales
| Metales | No metales | |
| 3.1 propiedades físicas | Presentan brillo metálico Conductores del calor y la electricidad Maleables Dúctiles Sólidos a excepción del mercurio | Opacos No conducen el calor No conducen la electricidad Se encuentan en los tres estados de agregación de la materia |
| 3.2 Propiedades químicas | Son agentes reductores Se oxidan para formar óxidos metálicos Pierden electrones Presentan 1,2 o 3 electrones en su último nivel Forman bases | Son agentes oxidantes Se reducen para formar anhidros Ganan electrones Tienen 5,6 o 7 electrones en su último nivel Forman ácidos |
Tema 4 Concepto de agente reductor y agente oxidante
4.1 Oxidación
La oxidación se define como la perdida de electrones que sufre un átomo al combinarse químicamente.
4.2 Reducción
La reducción se define como la ganancia de electrones que sufre un átomo al combinarse químicamente.
4.3 Agente oxidante
Es aquel elemento que al intervenir en una reacción química provoca la oxidación de otro elemento, reduciéndose en dicha reacción.
4.4 Agente reductor
Es aquel elemento que al intervenir en una reacción química provoca la reducción de otro elemento, oxidandose en dicha reacción
Tema 5 Concepto y utilidad de las valencias fijas y variables.
El número de electrones que gana o pierde un elemento al oxidarse o reducirse puede conocerse consultando la tabla periódica, las valencias fijas se obtienen de acuerdo a la familia a la cual pertenece el elemento, para todos los elementos que constituyen la familia IA la valencia es 1, para los de la familia IIA la valencia es de 2, para los de la familia VIIA la valencia es de -1. Las valencias variables dependen de cada elemento en particular, podemos encotrar casos de 2 o más valencias para un solo elemento, por ejemplo el oro presenta valencias 2 y 3, las empleara dependiendo del tipo de reacción química en a la que intervenga dicho elemento.
Tema 6 Propiedades periódicas de los elementos
Determinadas propiedades de los átomos se relacionan con la posición que guardan en la tabla periódica, estas propiedades se llaman propiedades periódicas porque se repiten de modo regular cada determinado número de elementos.
6.1 Radio atómico
Se de fine como la distancia que existe desde el núcleo del átomo hasta el último orbital.
En la tabla periódica el radio atómico disminuye de izquierda a derecha en los periodos y aumentan de arriba hacia abajo en los grupos.
6.2 Electronegatividad
Es la tendencia que tiene un átomo por los electrones de otro átomo
La electronegatividad aumenta de izquierda a derecha en los periodos.
La electronegatividad disminuye de arriba hacia abajo en los grupos
Los metales tienen electronegatividad baja.
Los no metales tienen electronegatividad alta.
6.3 Energía de ionización
La energía de ionización es la energía necesaria para que un átomo pierda un electrón y forme un ion positivo.
Aumenta de izquierda a derecha en los periodos
Disminuye de arriba hacia abajo en los periodos
6.4 Afinidad electrónica
La afinidad electrónica es la energía que se desprende cuando un átomo gana un electrón para transformarse en ion negativo.
Aumenta de izquierda a derecha en los periodos
Disminuye de arriba hacia abajo en los periodos
UNIDAD IV NOMENCLATURA INORGÁNICA.
Tema 1 Generalidades de la tabla periódica
En el principio de la historia de la química los científicos empleaban nombres arbitrarios para designar los compuestos químicos, creando confusión y entorpeciendo el avance de la química, debido alas dificultades que se presentaban en el intercambio de conocimientos.
Fue a finales del siglo XIX cuando se estableció lo que sería la I.U.P.A.C. (unión internacional de química pura y aplicada), la cual se encarga hasta la fecha de fijar las reglas que se emplean en la asignación de nombres a todas las sustancias químicas conocidas.
Concepto de molécula.
Una molécula es la unión de dos o más átomos que comparten electrones y que forman compuestos químicos.
Tipos de moléculas
Existen diferentes tipos de moléculas de acuerdo al número de elementos químicos que la conforman.
Binaria. Molécula que está compuesta por dos elementos diferentes, ejemplo H2O
Terciaria. Molécula que está compuesta por tres elementos diferentes, ejemplo H2CO3
Cuaternaria. Molécula compuesta por cuatro elementos diferentes ejemplo NaHCO3
Concepto de fórmula
Una fórmula química es la descripción, utilizando números y letras, de una sustancia química, señalando los elementos que la componen y la proporción que guardan entre ellos.
Tema 2 Nomenclatura de los compuestos binarios y terciarios.
2.1 Óxidos
2.1.1 Óxidos metálicos
Los óxidos metálicos se forman por la unión de un metal con oxígeno y se nombran colocando la palabra óxido seguido del nombre del metal; si el metal tiene dos números de oxidación se agrega la terminación ico al de mayor valencia y la terminación oso al de menor.
Ejemplos
Na + O NaO
Fe + O FeO
Fe + O Fe2O3
Cu + O CuO
Cu + O Cu2O
Ti + O TI2O4
Ti + O TI2O3
Es común encontrar el nombre de los óxidos metálicos refiriéndose a su valencia expresada en números romanos.
Ejemplos:
PbO
PbO2
Au2O
Au2O3
2.1.2 Óxidos no metálicos
Se forman por la reacción entre oxígeno y no metales , se nombran utilizando los prefijos griegos de los números junto a la palabra óxido, seguidos del nombre del no metal.
Ejemplos
CO
CO2
SO3
SO3
Frecuentemente se encuentran los nombres de los óxidos no metálicos, refiriéndose a ellos como anhídridos, se nombran anteponiendo la palabra anhídrido seguida del no metal, con los sufijos per ico, ico, oso e hipo oso, refiriéndose a las valencias de mayor a menor.
Ejemplos
CO
CO2
SO3
SO2
S2O3
SO
2.2 Radicales químicos
Los radicales químicos son conjuntos de elementos que presentan comportamientos similares a los de un solo elemento químico, presentando una valencia característica.
Ver tabla anexa.
2.3 Hidróxidos
Los hidróxidos son compuestos formados por el radical hidróxido y un metal. Para nombrarlos se coloca la palabra hidróxido de, seguido del metal, en este caso también se usan las terminaciones ico y oso o los números romanos.
Ejemplos
Au(OH)3
Na(OH)
Sn(OH)
Hidróxido de calcio
Hidróxido cúprico
Hidróxido de hierro II
2.4 Ácidos
2.4.1 Hidrácidos
Se forman por la unión del Hidrógeno y un no metal, se nombran escribiendo la palabra ácido seguida del nombre del no metal con la terminación hídrico.
Ejemplos
HF
HCl
HBr
HI
HCN
Casos especiales
CH4 metano
NH3 amoniaco
PH3 fosfina
H2O agua
2.4.2 Oxiácidos
Se forman por la unión de un radical que contenga oxígeno e hidrógeno. Se nombran con la palabra ácido seguida del nombre del radical, si el radical tiene terminación ato cambia a ico, la terminación ito cambia a oso.
Ejemplos
H3PO4
HCO3
HClO4
HClO3
HClO2
HClO
Ácido sulfúrico
Ácido bórico
Ácido nitroso
2.5 Sales
Las sales son compuestos que se forman mediante la reacción de un hidróxido y un ácido
2.5.1 Sales haloideas
Son aquellas sales que no presentan oxígeno en su fórmula, se forman por la reacción entre un radical de terminación uro y un metal. Se nombran escribiendo el nombre del radical seguido del nombre del metal, en este caso también se usan las terminaciones ico y oso o los números romanos.
Ejemplos
Au(CN)3
Fecl2
Fluoruro de sodio
Cloruro de cobre II
2.5.2 Oxisales
Son sales que están formadas por un radical que contenga oxígeno y un metal. Se nombran de la misma forma que las sales haloideas.
Ejemplos
Sr3(BO)2
K3PO3
ZnIO4
Hipoclorito de estaño I
Hipoclorito estánico
Ejercicios generales
Nombrar los compuestos siguientes
HgOH
CO
HCN
KCl
AuBO
HBrO2
K2SO4
Co2O3
H3PO3
Co(ClO2)2
Ba(OH)2
Escribir la fórmula
Hidróxido de magnesio
Ácido carbónico
Sulfito de litio
Cloruro de plata
Monóxido de nitrógeno
Fosfato titanoso
Bisulfito de litio
Anhídrido carbónico
Ácido bromhidrico
Hidruro de sodio
Ácido nitroso
2.6 Nombres comunes de algunas sustancias químicas
En la vida diaria algunas sustancias químicas de gran uso han adquirido nombres comunas.
H2O agua
NH3 amoniaco
CaSO4 yeso o sulfato de calcio
CaCO3 mármol o carbonato de calcio
Mg(OH)2 magnesia o hidróxido de calcio
CaO cal u óxido de calcio
Ca(OH)2 calidra o hidróxido de calcio
HCl ácido muriático o ácido clorhídrico
KOH potasa o hidróxido de calcio
NaOH sosa o hidróxido de sodio
H2O2 agua oxigenada o peroxido de hidrógeno
2.7 Ácidos y bases
Las características principales de los ácidos y las bases son:
Ácidos. Presentan sabor acido.
Son corrosivos
Cambian el papel tornasol rojo a azul
Liberan iones H+ en solución acuosa
Bases. Presentan sabor amargo
Son caústicos
Cambian el papel tornasol azul a rojo
Liberan iones OH- en solución acuosa
2.8 pH
El pH se define como el nivel de acidez que presenta una sustancia en solución.
La escala de pH va de cero a 14
UNIDAD V REACCIONES QUIMICAS
Tema 1 Reacción química.
1.1 Concepto de reacción química
Una reacción química es el proceso mediante el cual, a partir de una o más sustancias (llamadas reactantes o reactivos), se originan otras (llamadas productos) diferentes a las iniciales.
1.2 Representación
Las reacciones se representan mediante ecuaciones químicas, en donde las fórmulas de los compuestos y los símbolos de los elementos, indican su estado de agregación y en ocasiones, las condiciones necesarias para que se efectué la reacción.
Los estados de agregación de las sustancias se representan por las letras (s) sólido, (l) líquido y (g) gas; si la sustancia esta disuelta se escribe (disol), si la disolución es en agua se anota (ac). Cuando los reactivos tienen que calentarse se coloca el símbolo D
1.3 Tipos de reacción
Endotérmica. Es aquella que absorbe calor o requiere calentarse para llevarse a cabo:
H2 + I2 HI
D
Exótermica. Es aquella que desprende calor o energía
CaO + H2O HI
Reversible. Aquella en la que los productos pueden ser reactivos y los reactivos productos
CO2 + H2O H2CO3
Irreversible. Es aquella en la que los productos no pueden ser reactivos
C3H8 + O2 H2O + CO2
Homogénea. Son aquellas en las que tanto productos como reactivos se encuentran en el mismo estado de agregación.
C3H8(g) + O2(g) H2O(g) + CO2(g)
Heterogénea. Son aquellas en la que en productos como en reactivos existen al menos dos estados de agregación de la materia.
H2O(l) + CO2(g) H2CO3(g)
Velocidad de reacción.
Es la rapidez con la que aparecen los productos y desaparacen los reactivos por unidad de tiempo.
Factores que afectan la velocidad de reacción.
Los factores que aumentan la velocidad de reacción son:
Temperatura
Presión
Concentración
Si aumentan, aumenta la velocidad de reacción
Catalizador
Un catalizador es aquella sustancia que modifica la velocidad de reacción, sin sufrir cambio en sus composición.
Existen dos tipos de catalizadores. Catalizador positivo, aquel que aumenta la velocidad de reacción, catalizador negativo es aquel que frena la velocidad de reacción.
Tema 2 Resolución de ecuaciones químicas (balanceo)
Toda reacción química debe cumplir con la ley de conservación de la materia; la masa total de productos deberá ser igual a la masa total de reactivos.
2.1 Peso atómico y molecular
Peso atómico. Es el peso de los elementos de manera individual, se reporta en la tabla periódica, ejemplos:
Ni =
Cl =
F =
Au=
Peso molecular. Es la suma de los pesos atómicos individuales de los átomos que constituyen un compuesto químico; ejemplos
FeO =
K3PO4=
Mg(NO3)2
2.2 Tipos de reacciones químicas de acuerdo a sus resolución.
a) De síntesis:
A + B AB
b) De análisis o descomposición
AB A + B
c) De sustitución simple
AB + C AC + B
d) De sustitución doble
AB + CD AD + CB
e) De neutralización
ácido + base sal + agua
f) Hidrólisis
sal + agua ácido + base
g) oxido-reducción. Una especie química se oxida y otra se reduce.
Zn + HCl ZnCl2 + H2
Zn se oxida
H se reduce
2.3 Balanceo por tanteo de reacciones químicas.
El balanceo por tanteo de reacciones químicas es un método empírico para hacer cumplir la ley de conservación de la materia en las reacciones químicas.
Ejercicios
Balancear las siguientes reacciones:
1.- H2 + O2 H2O
2.- Fe + O2 Fe2O3
3.- I2 + H2 HI
4.- N2 + H2 NH3
5.- Na + H2O NaOH + H2
6.- HgO Hg + O2
7.- KClO3 KCl + O2
8.- CaCO3 + H3PO4 Ca2(PO4)2 + CO2 + H2O
9.- Mg(OH)2 + HCl MgCl2 + H2O
10.- Ba3(PO4)2 + K2SO4 K3PO4 + BaSO4
11.- C2H6 + O2 H2O + CO2
12.- Na2O2 + H2O NaOH + O2
13.- C3H8 + O2 H2O + CO2
Tema 3 Balanceo de reacciones por el método óxido-reducción
3.1 Oxidación y reducción
Oxidación. Se define como la perdida de electrones que sufre un átomo.
Na Na+1 + 1e-
Reducción. Se define como la ganancia de electrones que sufre un átomo.
Fe+3 +1e- Fe+2
La oxidación y la reducción se realizan siempre de manera simultanea durante una reacción química, mientras un átomo pierde electrones otro gana la misma cantidad; de tal manera que las reacciones en las que existe transferencia de electrones se denominan de óxido-reducción o REDOX..
En una ecuación REDOX el átomo que se oxida se llama agente reductor y el átomo que se reduce se llama agente oxidante.
3.2 Reglas para la determinación del número de reducción de los átomos.
1.- El número de oxidación de cualquier elemento libre es de cero.
2.- El número de oxidación del hidrógeno es +1
3.- El número de oxidación del oxígeno es -2
4.- Los elementos de la familia IA tienen número de oxidación +1
5.- Los elementos de la familia IIA tienen número de oxidación +2
6.- Todos los metales tienen número de oxidación positivo
7.- El número de oxidación de los elementos de la familia VIIA en compuestos binarios es -1
8.- Cuando se combinan dos no metales el elemento colocado a la derecha es negativo y el de la izquierda positivo
9.-.La suma algebraica de los números de oxidación de todos los átomos en un compuesto es cero.
Ejercicios
Encontrar los números de oxidación de:
KMNO4 BaSO4 Cl2
H3PO3 HNO2 Al(NO3)2
Ag2SO3 K Pb(OH)4
Mg(ClO4)2
3.3 Método de balanceo de ecuaciones REDOX
Este método se aplica cuando existe un intercambio de electrones por medio de óxido-reducción; para emplearlo es conveniente usar la siguiente recta numérica:
-6 -5 -4 -3 -2 -1 0 1 2 3 4 5 6
Pasos para el balanceo por el método REDOX
1.- Escribir la reacción correctamente
2.- Encontrar los números de oxidación de cada elemento
3.- Identificar los elementos que se oxidan o reducen
Nota: en elementos diatómicos se duplica el número de electrones ganados o perdidos.
4.- Multiplicar cruzado el número de electrones ganados o perdidos.
5.- Colocar los coeficientes obtenidos en la ecuación original.
6.- Terminar de balancear por tanteo
7.- Simplificar lo más posible.
Ejercicios
Balancear por el método REDOX las siguientes reacciones
a) C + H2SO3 H2S + CO2
b) Cu + HNO3 Cu(NO3) + NO + H2O
c) C + H2SO4 CO2 + SO2 + H2O
d) HClO HClO3 + HCl
e) Sb + HNO3 Sb2O5 + NO + H2O
UNIDAD VI ESTEQUIOMETRÍA
Tema 1 Conceptos básicos
1.1 Definición
La estequiometria es la parte de la química que se encarga del estudio de ley de conservación de la materia en las reacciones químicas.
Definición de mol
Es el equivalente al peso atómico o molecular de cualquier sustancia; por ejemplo 1mol de azufre = 32gramos de azufre
1molde agua = 18gramos de agua
1.3 Número de Avogadro.
Es el número de átomos o moléculas uqe contiene un mol de cualquier sustancia y es equivalente a:
6.023 x 1023 átomos o moléculas
1.4 Cálculo del número de moles en elementos y compuestos.
Calcular cuantos gramos son:
a) 2.7 mol de Fe
b).0.57 mol de K2SO4
c) 3.1 mol de Mg(OH)2
d) 0.03 mol de Ba3(PO4)2
Calcular cuantas moles son:
a) 35 gramos de K
b) 123 gramos de LiNO2
c) 45.6 gramos de Na2SO3
d) 34.6 gramos de Pb3(PO4)4
Tema 2 Cálculo de reactivos y productos en reacciones químicas.
El balanceo de reacciones nos permite establecer las relaciones que existen entre reactivos y productos mediante el uso de los coeficientes estequiométricos.
Para resolver un problema estequiométrico se siguen los pasos siguientes a partir del problema:
Problema 1
Se tiene la reacción:
H2 + O2 H2O
¿ Cuantos gramos de H2 son necsarios para prepara 23 gramos de agua?
Pasos a seguir.
1.- Blancear la reacción
2.- Encontrar los pesos moleculares de los compuestos involucrados
3.- Identificar el dato inicial y transformarlo a moles
4.- Establecer reglas de tres que nos lleven a la respuesta.
Problema 2
Se tiene la reacción:
Fe + O2 FeO
¿Cuántos gramos de O2 se necesitan para formar 125 gramos de FeO?
Problema 3
Se tiene la reacción:
Fe + O2 Fe2O3
¿Cuántos gramos de O2 se necesitan para obtener 125 gramos de óxido férrico?
Problema 4
Se tiene la reacción
C3H8 + O2 CO2 + H2O
a)¿Cuántos gramos de O2 se necesitan para consumir 125 gramos de C3H8?
b)¿Cuántos gramos de agua se forman?
Quedan reservados todos los derechos a favor del autor.
Prohibida la reproducción total o parcial por cualquier medio sin permiso escrito del autor
Toluca, México Marzo del 2000.
Descargar
| Enviado por: | Heroe |
| Idioma: | castellano |
| País: | México |
