Química
Química Orgánica
QUIMICA
CONCEPTOS
1. Electroquímica:
Parte de la ciencia química que reparte con la interrelación de corrientes eléctricas, o voltajes y reacciones químicas, y con la conversión mutua de energía química y eléctrica. En el sentido más ancho, electroquímica es el estudio de las reacciones químicas que producen efectos eléctricos y de los fenómenos químicos que son ocasionados por la acción de corrientes o los voltajes.
Oxido Reducción:
Son aquellas reacciones químicas en las cuales un átomo se oxida y otro se reduce. La cantidad de electrones perdidos (Átomos que se oxidan) es igual a la cantidad de electrones ganados (Átomos que se reducen). Para determinar cual es el átomo que se oxido y cual es el que se produce, se utiliza lo que se conoce como numero de oxidación.
Electrolisis:
Es un proceso de oxidación-reducción que tiene lugar por el paso de la corriente eléctrica a través de las disoluciones electrolíticas.
2. Celda Voltaica o Galbanita
Es un arreglo electroquímico que aprovecha la electricidad de una reacción química espontánea para producir el efecto deseado al convertir energia potencial química en energía eléctrica. En su arreglo mas comun (Ver Figura) la tira de cinc y cobre dentro de una disolución de ácido sulfúrico diluido es el sulfato de cobre respectivamente actúa como ánodo. El puente salino (en este caso cloruro de potasio) permite los electrones fluir entre las cubetas sin que se mezclen las disoluciones cuando el circuito entre los dos sistemas se completa como se muestra a la derecha de la reacción Genera una corriente electrica
Celda galvanizada recubierta de hierro con una capa de cincocomo proteccion a la corrosion. En cuanto se aplica con mas facilidad y menos costo que otro revestimiento metalico como el estaño, el cromo, el niquel o el aluminio. El metodo de galvanizado mas frecuente es el proceso de inmersion en caliente se aplica un baño quimico(inmersion en acido) al hierro para limpiarlo de polvo o grasa y suciedad después de lavar, se introduce en Zinc fundido. En un proceso llamado shievodigacion se descubre el producto con elel polvo de zinc y se calienta en un tambor cerrao duracnte varias horas a una temperatura de 300 y 420 ªC
Fundamento
Ejemplo de Construcción
Celda Electrolítica
Fundamento
Ejemplo de Construcción
Estado de Segregación de la Materia
Definición de los siguientes términos:
VOLUMEN:
El volumen es la medida del espacio ocupado por un cuerpo. El volumen de los cuerpos es el resultado de sus tres dimensiones: ancho, alto y profundidad.
El volumen resulta de la relación entre peso (masa) y densidad ya que la densidad se define como el cociente (división) entre la masa y el volumen.
PRESIÓN:
En física la presión está definida como al cociente entre la acción de una
fuerza sobre la unidad de superficie.
P = F/S
Por lo tanto, la presión atmosférica es numéricamente igual al peso de una
columna de aire que tiene como base la unidad de superficie y como altura la de la
atmósfera.
UNIDAD DE PRESION:
Desde el punto de vista histórico, la primera unidad empleada para medir la
Presión atmosférica fue el "milímetro de mercurio" (mm Hg), en razón de la conocida capacidad de una columna de mercurio, de unos 760 mm, consistente en lograr equilibrar la referida presión. Dicha propiedad era muy utilizada en la construcción de
TEMPERATURA:
El termino temperatura es un concepto difícil de definir en pocas palabras, aunque se conoce y se utiliza desde hace mucho tiempo. En algunos libros elementales, para definir el concepto temperatura, habremos leído algo así: “Es el grado de calentamiento de un cuerpo “. Acercándonos a su definición y sin decir mucho se puede decir con propiedad, que la temperatura es la magnitud principal de la teoría relacionada con el calor.
3. LEY DE BOYLE-MARRIOT:
Fundamento:
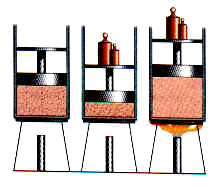
Si fijamos la cantidad de gas y su temperatura, pero modificamos la presión a la que se halla sometido, veremos qué cuanto mayor sea la presión, menor será el volumen que ocupe. El físico inglés Robert Boyle y el francés Edme Mariotte, trabajando independientemente uno de otro descubrieron la relación numérica entre la presión y el volumen de un gas: Si no varía la temperatura a la que se encuentra un gas, el producto del volumen que ocupa por la presión que ejerce es constante. Matemáticamente, la ley de Boyle-Mariotte puede enunciarse P0*V0=P1*V1en la que los subíndices 0 indican la presión y volumen inicial y los subíndices 1 la presión y el volumen después.
A continuación puedes comprobar esta ley. Introduce los valores iniciales de la presión y el volumen y el valor de la presión o el volumen final. Pulsa después el botón 'Calcular'. Para realizar un nuevo cálculo pulsa el botón 'reiniciar'.
Ejemplo de aplicación:
El globo de un niño se ha inflado con helio, hasta alcanzar un volumen de 3 l, a la presión de 760 mmHg. Se le escapa al niño subiendo hasta una altura en la que la presión es de 0'9 bares. ¿Qué volumen tiene el globo?
En primer lugar deberemos expresar la presión en las mismas unidades de medida: como 1'013 bar son 760 mmHg, 0'9 bares serán ![]()
. Ahora se puede aplicar la ley de Boyle-Mariotte: P0*V0=P1*V1, siendo P0 = 760 mmHg, V0 = 3 l y P1 = 675'22 mmHg, quedando ![]()
, multiplicando 760 por 3: 2280 = 675'22V1, y como 675'22 está multiplicando, pasa al otro miembro de la ecuación dividiendo: 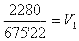
, por lo que el volumen resulta: 3'377 l.
LEY COMBINADA DE LOS GASES:
Fundamento:
Gracias a las leyes de Boyle-Mariotte y de Charles y Gay-Lussac, conocemos las relaciones que hay entre la presión, el volumen y la temperatura de un gas, pero siempre que una de las tres permanezca constante. Intentaremos determinar que ocurre cuando cambiamos las tres propiedades, presión, volumen y temperatura, simultáneamente.
|
|
| ¿Qué ocurre al cambiar a la vez las tres variables |
Digamos que las condiciones iniciales del gas son P0, V0 y T0, y las finales P1, V1 y T1. Podemos suponer que en un principio cambiamos sólo el volumen y la presión, dejando constante la temperatura. El gas, pasaría de las condiciones iniciales P0, V0 y T0 a las finales P1, V' y T0. Ahora cambiaríamos únicamente el volumen y la temperatura, de forma que el gas pasaría de estar P1, V' y T0 a P1, V1 y T1.
En el primer cambio, como no cambia la temperatura, se cumple la ley de Boyle-Mariotte, es decir, el producto de la presión y el volumen es constante: P0 x V0 = P1 x V'. En el segundo caso se cumple la ley de Charles y Gay-Lussac, el cociente entre volumen y temperatura es constante: V'/T0 = V1/T1. Como en las dos ecuaciones que obtengo aparece el término V', puedo despejarlo en la segunda y sustituirlo en la primera obteniendo la ecuación:![]()
y agrupando según el subíndice quedará:
![]()
que es la Ley de los gases: el producto de la presión y el volumen de un gas, dividido por la temperatura a la que se encuentra permanece siempre constante. Como en la ley de Charles y Gay-Lussac, la temperatura ha de estar expresada en Kelvin.
Ejemplo de Aplicación:
Los neumáticos de un coche deben estar, a 20 ºC, a una presión de 1'8 atm. Con el movimiento, se calientan hasta 50 ºC, pasando su volumen de 50 a 50'5 litros. ¿Cuál será la presión del neumático tras la marcha?
En primer lugar debemos expresar las temperaturas en Kelvin, es decir debemos sumar 273 a cada una de ellas. Así la temperatura inicial T0 será 20 + 273 = 293 K y la final, T1, valdrá 273 + 50 = 323 K, como el volumen inicial es de V0 = 50 litros y el final de V1 = 50'5 litros y la presión inicial P0 = 1'8 atm, aplicando la ley de los gases obtendremos: realizando las operaciones del primer miembro de la ecuación quedará ![]()
. Como 323 está dividiendo, pasará multiplicando y 50'5 que multiplica, pasará dividiendo: ![]()
, con lo que la presión final será de 1'965 atm.
Ejemplo 2
Cierto gas ocupa un volumen de 5 l a 20 ºC y una presión de760 mmHg. Si se comprime hasta 2500 cc a 1'2 atm, ¿cuánto valdrá su temperatura?
Debemos, en primer lugar, expresar la temperatura en Kelvin, por lo que añadimos 273 a 20 ºC quedando 293 K. Las presiones deben expresarse en la misma unidad, así que como P0 = 760 mmHg, expresaremos P1 en mmHg, para lo que multiplicamos por 760 (760 mmHg es lo mismo que 1 atm), quedando P1 = 912 mmHg. Otro tanto ocurre con los volúmenes, como V0 = 5 l, tenemos que poner V1 en litros también. 2500 cc equivalen a 2'5 dm3 (al ser cúbico, debemos dividir entre mil), que son 2'5 l. Aplicando ahora la ecuación de los gases: 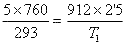
. Realizando las operaciones quedará 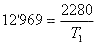
. Como T1 está dividiendo, pasará multiplicando al primer miembro de la ecuación 12'969xT1=2280, y pasando el número que multiplica a la temperatura dividiendo nos quedará que ésta es de 175'80 K o -97'20 ºC.
LEY DE CHARLES:
Fundamento:
Relación entre la temperatura y el volumen de un gas cuando la presión es constante
| El volumen es directamente proporcional a la temperatura del gas: •Si la temperatura aumenta, el volumen del gas aumenta. |
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
¿Por qué ocurre esto?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:

(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:

que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
Ejemplo de Aplicación:
Un gas tiene un volumen de 2.5 L a 25 °C. ¿Cuál será su nuevo volumen si bajamos la temperatura a 10 °C?
Recuerda que en estos ejercicios siempre hay que usar la escala Kelvin.
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K= 298 K
T2 = (10 + 273 ) K= 283 K
Ahora sustituimos los datos en la ecuación:
| 2.5L |
| V2 |
| ----- | = | ----- |
| 298 K |
| 283 K |
Si despejas V2 obtendrás un valor para el nuevo volumen de 2.37 L.
4. LEY DE GAS IDEAL: DEL GAS UNA ECUACON DE ESTADO
Fundamento:
Las leyes de los gases mencionados anteriormente entre los párrafos 3.2.1 y 3.2.4 toman en consideración una masa constante de gas.
Si se toma en cuenta la masa de gas, se dice que a temperatura y presión constante el volumen de un gas varía en forma directamente proporcional con el número de moles de gas considerado. Dicho de otra manera: un mol de cualquier gas medido a la misma temperatura y presión ocupa el mismo volumen (principio de Avogadro).
V a n
V = Kn
Si se combina esta ecuación con las leyes de Boyle y charles se obtiene una ecuación general que relaciona todas las variables mencionadas: volumen, temperatura, presión y números de moles.
V a nT falta
Cambiamos el signo de proporcionalidad por una constante que se simboliza por R y que se denomina “constante de los gases ideales “, reagrupando se tiene:
PV = nRT
Este es una ecuación de Estado denominada Ley del Gas Ideal. En realidad es una ecuación de estado que se aplica cuando el gas tiene comportamiento idea.
Condiciones Estándar
Para poder comparar las propiedades volumétricas de diferentes gases se ha especificado estado estándar arbitrario de referencia generalmente conocidos como condiciones estándar científicas.
Temperatura estándar: 0 ªC, 273.15 K
Presión estándar: 760.0 mm Hg, 1atm.
Bajo las condiciones estándar mencionadas, para un gas ideal se cumplen los siguientes volúmenes morales:
Volumen molecular gramo: 1 grmol = 1 = 22.4136 litros = 22.4 litros
Volumen molecular libra: 1 lb mol =359 pie3
LIQUIDOS
En los líquidos existen las fuerzas de atracción intermoleculares que son capaces de mantener las moléculas unidas en un volumen DEFINIDO y la moléculas se mueven más lentamente que las de los gases.
5. CARACTERISTICAS GENERALES:
1.- Son casi incomprensibles. NO sufren cambios de volumen
2.- Mantienen su volumen: pero no su forma
3.- Se dilatan (Ligeramente)
4.- Se difunden
5.- Demuestran viscosidad
6.- Tienen Tensión Superficial
7.- Se evaporan
ESTADO SÓLIDO
Un sólido es una determinada cantidad de materia que tiene consistencia rígida, en el cual las moléculas tienen posiciones fijas, desde donde no pueden moverse en forma apreciable.
CARACTERISTICAS GENERALES:
1.- Los sólidos tiene forma definida.
2.- Mantienen su volumen
3.- Son prácticamente incompresibles
4.- Solidifican en forma de cristales
DIFERENCIA ENTRE LOS DIFERENTES ESTADOS
La diferencia entre estos tres estados es la siguiente:
Estado Sólido:
Son sustancias rígidas que mantienen su volumen, es decir, son prácticamente incompresibles debido a que las moléculas o átomos están unidos unos con otros y mantiene su forma y posición, es decir, no fluye bajo circunstancias ordinarias.
Estado Líquido:
Son sustancias prácticamente incompresibles. (Ligeramente comprensibles), mantienen su volumen, pero no mantienen su forma, por lo tanto pueden adoptar la forma del recipiente.
Estado Gaseoso:
Están constituidos por molécula individual ampliamente separada que se mueven en rápido y constantes movimientos. Los gases pueden expandirse o comprimirse y pueden hacerse fluir fácilmente.
Estado sólido es una sustancia que conserva fijo la forma y el volumen. En otras palabras el tamaño y la forma no se modifican por el tamaño y la forma de su recipiente.
Un sólido es una sustancia que tiene sus partículas contribuyentes dispuestos en un arreglo interno regularmente ordenado. La primera definición se basa en propiedades físicas y la segunda en la estructura interna, la pregunta seria. ¿Son estos consecuentes entre si?
Ecuación de estado Comparada para 1 mol de Co2 a 350 K
Comparación de los diferentes Estados.
La comparación de los diferentes estados puede observarse en la siguiente curva de calentamiento o enfriamiento en las que los cambios de temperatura y sus valores constante se pueden correlacionar con los cambios de la energía cinético-molecular y potencial son posible las transiciones sólida-Liquida-Gas y Sólida—Gas en los diagramas de fase se pueden resumir la presión y la temperatura a las cuales se producen. En este diagrama también se puede mostrar la transición Sólido-Sólido
Puente
Tira de Zinc
Tira de Cobre
Corriente Eléctrica
Cu
Zinc
Cu
Zinc
Ecuación de Vander vals
Ley de Gases Ideales
0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6
V, Litros
100
80
60
40
20
P. Atm
S
S-2
Z
Ebullición
Z-3
3
Aumento de la energía cinética
Aumento de la Energía Potencial
Aumento de la energía cinética
Aumento de la Energía Potencial
Aumento de la energía cinética
T1 T2 T3 T4
Te
Tf
0
Descargar
| Enviado por: | Oskxam |
| Idioma: | castellano |
| País: | Venezuela |