Química
Química inorgánica
Objetivos
1.- El alumno conocerá y aplicará el método volumétrico para realizar una titulación ácido-base.
2.- Determinará el punto de equivalencia de una reacción ácido -base, mediante el uso de una disolución indicadora.
3.- Justificará mediante los resultados obtenidos la validez de la reacción química que se establece entre un ácido fuerte y una base fuerte.
Antecedentes
La acidez y la basicidad constituyen el conjunto de propiedades características de dos importantes grupos de sustancias químicas: los ácidos y las bases. Las ideas actuales sobre tales conceptos químicos consideran los ácidos como dadores de protones y las bases como receptoras. Los procesos en los que interviene un ácido interviene también su base conjugada, que es la sustancia que recibe el protón cedido por el ácido. Tales procesos se denominan reacciones ácido-base.
La acidez y la basicidad son dos formas contrapuestas de comportamiento de las sustancias químicas cuyo estudio atrajo siempre la atención de los químicos. En los albores mismos de la ciencia química, Boyle y Lavoisier estudiaron sistemáticamente el comportamiento de las sustancias agrupadas bajo los términos de ácido y álcali (base). Pero junto con los estudios descriptivos de sus propiedades, el avance de los conocimientos sobre la estructura del átomo y sobre la naturaleza íntima de los procesos químicos aportó nuevas ideas sobre los conceptos de ácido y de base.
En la actualidad, el resultado final de la evolución de esos dos conceptos científicos constituye un importante capítulo de la química general que resulta imprescindible para entender la multitud de procesos químicos que, ya sea en la materia viva, ya sea en la materia inerte, se engloban bajo el nombre de reacciones ácido-base.
Propiedades químicas de los ácidos
El comportamiento químico de los ácidos se resume en las siguientes propiedades:
· Poseen un sabor agrio. La palabra ácido procede, precisamente, del latín (acidus = agrio) y recuerda el viejo procedimiento de los químicos antiguos de probarlo todo, que fue el origen de un buen número de muertes prematuras, por envenenamiento, dentro de la profesión.
· Colorean de rojo el papel de tornasol. El tornasol es un colorante de color violeta en disolución acuosa (tintura de tornasol) que puede cambiar de color según el grado de acidez de la disolución. Impregnado en papel sirve entonces para indicar el carácter ácido de una disolución. Es, pues, un indicador.
· Sus disoluciones conducen la electricidad. La calidad de una disolución ácida como conductor depende no sólo de la concentración de ácido, sino también de la naturaleza de éste, de modo que, a igualdad de concentración, la comparación de las conductividades de diferentes ácidos permite establecer una escala de acidez entre ellos.
· Desprenden gas hidrógeno cuando reaccionan en disolución con cinc o con algunos otros metales.
Propiedades químicas de las bases
Las bases, también llamadas álcalis, fueron caracterizadas, en un principio, por oposición a los ácidos. Eran sustancias que intervenían en aquellas reacciones en las que se conseguía neutralizar la acción de los ácidos. Cuando una base se añade a una disolución ácida elimina o reduce sus propiedades características. Otras propiedades observables de las bases son las siguientes:
· Tienen un sabor amargo característico.
· Al igual que los ácidos, en disolución acuosa conducen la electricidad.
· Colorean de azul el papel de tornasol.
· Reaccionan con los ácidos para formar una sal más agua.
Aun cuando Faraday había introducido el término ion para designar las partículas cargadas que transportaban la electricidad en el seno de las disoluciones conductoras, no especificó en qué consistían realmente esos iones. El químico sueco Arrhenius se interesó pronto por el estudio de las disoluciones y, en particular, por las de los llamados electrolitos o sustancias capaces de conducir la electricidad en disolución. Observó que las disoluciones de electrolitos no cumplían ni las leyes de Raoult sobre la variación de los puntos de ebullición y congelación de las disoluciones, ni la de Van't Hoff sobre la presión osmótica de la misma manera que lo hacían las disoluciones de los no electrolitos.
Al disolver en agua el cloruro de sodio (NaCl) se producía una disminución del punto de congelación de la disolución doble del que resultaba aplicando las leyes de Raoult; si se empleaba cloruro de bario (BaCl2) como soluto, la temperatura de congelación bajaba tres veces más que lo calculado a partir de dichas leyes.
Tal circunstancia se repetía de una forma regular para otras sustancias análogas, lo que hizo sospechar a Arrhenius la existencia de una disociación o ruptura de las supuestas moléculas del electrolito en varios fragmentos por efecto de la disolución. Además, las partículas deberían poseer carga eléctrica de acuerdo con el concepto de ion avanzado por Faraday. Según Arrhenius el cloruro de sodio se disociaría en la forma:
NaCl ® Na+ + Cl-
y el cloruro de bario:
BaCl2 ® Ba2+ + 2 Cl-
Tal disociación, al multiplicar el número de partículas, explicaba los resultados anómalos obtenidos en la aplicación de las leyes de Raoult y en el estudio de la presión osmótica, que dependen, como es sabido, de la concentración de partículas de soluto en la disolución.
La idea de la disociación iónica fue extendida por el propio Arrhenius a los ácidos y a las bases, lo que le permitió encontrar una explicación coherente a su comportamiento característico.
VALORACIONES DE ÁCIDO-BASE
Una disolución ácida puede neutralizarse con otra básica (y viceversa) parcial o totalmente. La neutralización total, que lleva consigo la pérdida de propiedades de ácido o de base por la disolución, se consigue cuando se igualan sus concentraciones de iones H3O+ y OH-.
Debido a esta circunstancia, será posible determinar la cantidad de ácido (o de base) presente en una disolución desconocida midiendo el volumen de base (o de ácido) de una disolución de concentración conocida o disolución patrón que es necesario añadir para conseguir la neutralización. La utilización de un pH-metro o de un indicador adecuado señalará el momento o punto final de la reacción, que se alcanza cuando el pH de la disolución toma un valor igual a siete. El proceso correspondiente recibe el nombre de análisis volumétrico o valoración ácido-base y es una técnica frecuente en los laboratorios químicos.
Los cálculos químicos para esta reacción de neutralización se efectúan con la ayuda de la ecuación:
Vácido Mácido nácido = Vbase Mbase nbase
donde V representa el volumen, M la concentración molar y n el número de protones cedidos (nácido) o aceptados (nbase) por cada molécula de ácido o de base respectivamente. Dicha ecuación traduce el hecho de que, para alcanzar el punto final de la reacción, el número total de protones cedidos por el ácido ha de ser igual al número total de protones aceptados por la base. El producto V · M representa, de acuerdo con la definición de molaridad, el número de motes, el cual es proporcional al número de moléculas (1 mol = NA moléculas, siendo NA el número de Avogadro). Luego el producto V · M · n es proporcional en ambos casos al número de protones cedidos por el ácido o aceptados por la base, según la correspondiente ecuación química, siendo la constante de proporcionalidad la misma para ambos e igual a:
![]()
En términos prácticos nácido coincide con el número de átomos de hidrógeno que pierde cada molécula de ácido en la reacción, y si la base es un hidróxido, nbase es igual al número de grupos OH- de la base que reacciona con el ácido.
Con el fin de controlar cuidadosamente el volumen de solución patrón empleado en la valoración, se utiliza una bureta que permite medir no sólo la cantidad total de disolución añadida, sino también añadir gota a gota la disolución patrón a la disolución problema. La representación gráfica de la variación del pH con la cantidad de disolución patrón añadida recibe el nombre de curva de valoración. El punto de corte de la gráfica con la línea horizontal de pH = 7 define el punto final de la valoración. En la figura se advierte cómo en el entorno de ese punto la pendiente de la gráfica se hace muy elevada, lo que significa que pequeñas cantidades de disolución producen cambios importantes en el pH. En tal circunstancia la adición de disolución patrón ha de efectuarse gota a gota para no sobrepasar el valor neutro del pH.
APLICACIÓN DE LA VALORACIÓN ÁCIDO-BASE
Se desea valorar una disolución de ácido sulfúrico con la ayuda de otra de hidróxido de sodio 0,5 M y un indicador apropiado. Se toman 10 ml de la disolución problema y se depositan, junto con el indicador, en un vaso de precipitados. Con la llave cerrada, se llena la bureta con la solución patrón. A continuación se abre la llave y se hace gotear sobre el vaso. Cuando el descenso del nivel de la bureta indica que se han consumido 20 ml, el indicador, con su cambio característico de color, señala el punto final de la valoración. Calcular la concentración molar de la disolución problema y la cantidad de gramos de H2SO4 disueltos en la muestra.
La ecuación química de la correspondiente neutralización viene dada por:
2 NaOH + H2SO4 ® Na2SO4 + 2 H2O
Cuando la disolución patrón ha neutralizado a la disolución problema se cumple la ecuación estequiométrica:
Vácido Mácido nácido = Vbase Mbase nbase
es decir:
10 ml · Mácido · 2 átomos de H/molécula de ácido =
= 20 ml · 0,5 · 1 grupo OH-/molécula de base
luego, despejando Mácido resulta:
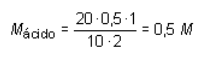
El número de gramos contenidos en la muestra será entonces:
0,5 moles/litro · 98,02 g/mol · 10 · 10-3 litros de muestra = 0,49 g
puesto que:
M(H2SO4) = 2 M(H) + M(S) + 4 M(O) =
= 2 · 1,00 + 32,06 + 4 · 15,99 = 98,02 g/mol
Hipótesis
De acuerdo a la valoración que vamos a realizar el volumen del NaOH , será menor de 20 ml. Posteriormente notaremos que la concentración del ácido resulta menor a la que tenemos que es = 0.1M ya que se va perdiendo constantemente cada que se abre la botella.
Material y equipo
Un soporte con varilla
una pinza doble para bureta
una bureta de vidrio de 50 ml
un matraz erlenmeyer de 250 ml
una parrilla de agitación
un agitador magnético
un embudo de filtración
dos pipetas volumétricas: una de 20 ml. Y otra de 10 ml.
una perilla de hule
papel pH
un vaso de precipitados de 100 ml.
Sustancias
agua destilada
disolución de fenolftaleína
hidróxido de sodio, .1 M
ácido clorhídrico, .1M
Procedimiento
Primeramente vertimos dentro de la bureta (cerrada) la disolución de hidróxido de sodio, hasta la marca de 0 ml. Colocamos la bureta en la pinza doble, la cual ya estará ya previamente fija en la varilla del soporte. Posteriormente agregamos 20 ml. Del ácido dentro del matraz al mismo tiempo que se introdujo el agitador magnético. Colocamos el matraz sobre la parrilla y la bureta de tal manera que la punta de ésta quedara en el interior del matraz. Inmediatamente se añadieron dos gotas de fenolftaleína al ácido. Se encendió la parrilla y verificando que el botón de calentamiento estuviera inactivo se dio vuelta al botón de agitación hasta que el agitador estuviera a una velocidad moderada. Poco a poco se fueron dejando caer gotas de hidróxido de sodio abriendo la llave de la bureta. Después de cierto tiempo y gotas añadidas comenzó a tornarse de rosa el ácido y cuando la agitación no provocaba el desvanecimiento del color después de cierto tiempo, nos indicó que la neutralización de las dos sustancias estaba lista.
Resultados
Tenemos HCl al 36.5%
C = N/V
N= C x V N= (36.5 gr HCl) x (.25 lts) = 9.125 g HCl
9.125 g HCl = 25 gr HCl al 36.5 %
0.365
si la densidad es 1.188, entonces
V = 25 / 1.188 = 21.04 ml
Nuestros resultados fueron los siguientes:
Después de obtener el color indicado con la mezcla de estos dos reactivos, comprobamos que fueron necesarios 18.9 ml de Hidróxido de sodio para la neutralización y de acuerdo a la ecuación del punto de equivalencia cuando se neutralizan ácidos y bases tenemos que :
C NaOH * V NaOH = CHCl * VHCl
Pero en nuestro caso la cantidad de NaOH que se utilizó fue menor a 20 ml, que son los mismos 20 ml. Que se utilizaron de HCl. Por lo que la ecuación si es sustituida con los valores correspondientes no será verdadera.
C NaOH * V NaOH = CHCl * VHCl
.1 M 18.9 ml. .1 M 20ml.
NaOH + HCl NaCl + H2O
.1 M .1 M
? ml. 20ml.
Teóricamente este es el volúmen de sosa que debió utilizarse de acuerdo a la reacción anterior:
1°
Moles HCl= MV = (0.1) ( 0.02 lt. ) = .002
2°
1 Mol NaOH = 1 Mol HCl
x = .002 Mol HCl
x = .002 Moles de NaOH
3°
Moles NaOH = MV
V= moles NaOH = .002 = .02 Lt = 20 ml
M .1
La concentración de ácido, después de la neutralización obtenemos que fue la siguiente:
Tabla de pH
| Disolución | pH experimental | pH teórico |
| NaOH,0.1 M | 13 | 13 |
| HCl, 0.1 M | 1 | 1 |
| NaOH,0.1 M + HCl, 0.1 M | 7 | 7 |
Discusión
Durante esta práctica pudimos observar la valoración de ácido - base entre una sosa (NaOH) y un ácido (HCl). Primeramente calculamos el pH de las sustancias antes de mezclarlas. Posteriormente comenzamos a mezclar la sosa con el ácido, gota por gota y la neutralización se dio con sólo 18.9 de NaOH. De acuerdo con la fórmula eso no debería ser posible ya que para lograr la neutralización se deben utilizar las mismas cantidades tanto de sosa como de ácido, y lo que utilizamos de sosa fue un poco menos, es decir se utilizaron 18.9 ml. De acuerdo a nuestra discusión concluimos que el resultado obtenido se debe a que la concentración del ácido no es precisamente .1M , la reportada tanto en su frasco como en el manual. Tenemos entonces una solución menos concentrada (0.0945 M) , la cual tiene una mínima diferencia de 0.0055 M. El margen de error en este caso es :
Conclusiones
Casi en todos los casos ocurren pérdidas de este tipo ya que como todos hemos observado , al abrir algún frasco , en especial de ácido , se escapa o se deja ver una especie de humo y es ahí donde se da la perdida , que es mínima pero que finalmente afecta cuando se necesitan calcular datos teóricamente . El ácido clorhídrico no tenía la concentración que suponíamos debería tener que era la reportada en el manual = 0.1 M
Por lo tanto concluimos que nuestra hipótesis resulta verdadera ya que una solución que no tiene la concentración esperada afecta el volumen necesario para la titulación.
Bibliografía:
-
Brown , T.L, Lemay, H.E. y Bursten, B.E. Quimica. La ciencia central. Prentice Hall, México, 1991
-
Reacciones quimicas. [electronico].(2005). Google. www.politecnicovirtual.edu.co/ pra-quimica-gral/estequiometria.htm (recuperado el 23 de septiembre de 2005 de WWW).
-
Apuntes de clase
Descargar
| Enviado por: | El remitente no desea revelar su nombre |
| Idioma: | castellano |
| País: | México |
