Ingeniero Técnico Industrial
Química industrial
PRACTICA 1
TERMOQUIMICA: CALORES DE REACCIÓN
Determinación experimental de la entalpía de disolución del hidroxido sódico
A 200 ml de Agua le añadimos 10 gr de NaOH.
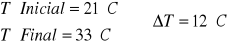
![]()
![]()
Como en este apartado no utilizamos el vaso el calor especifico del vaso lo despreciamos.
![]()
Determinación experimental de la entalpía de neutralización del hodroxido sódico con ácido clorhídrico.
Ncesitamos obtener una disolución 1M de NaOH a partir de la disolución del aprtado anterior. Para ello procedemos a calcular la molaridad de dicha disolución:
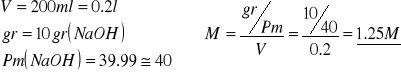
Como en el caso de NaOh la valencia es 1. Entonces N=M.
![]()
Es decir que a los 200ml de la disolución de 1.25M le hemos de añadir 50ml de Agua para que sea una disolucion 1M. De esa disolución de NaOH 1M cojomos 100ml y se los añadimos a 100ml de HCl. 1M.
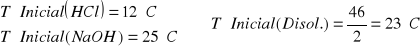
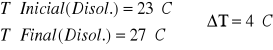
![]()
![]()
PRACTICA 2
Concentración de las disoluciones
Practica: calculo de las concentraciones de la tabla
Calculo de las molaridades
![]()

Aplicando esta expresión a cada sustancia:
HCl ![]()
HNO3 ![]()
H2SO4 ![]()
NH3 ![]()
Calculo de las normalidades
Como Normalidad = Molaridad x Valencia. Resulta :
HCl ![]()
HNO3 ![]()
H2SO4 ![]()
NH3 ![]()
Calculo de las molalidades

que aplicando a cada sustancia:
HCl 
HNO3 
H2SO4 
NH3 
Tabla completa:
HCl HNO3 H2SO4 NH3
| ºBe | 22 | 39,7 | 65,8 | 27 |
| d(gr/ml) | 1,17 - 1,18 | 1,37 - 1,38 | 1,89 | 0,89 - 0,9 |
| % | 35 | 60 | 66 | 28 |
| M | 11,21 | 18,04 | 12,39 | 14,65 |
| N | 11,21 | 18,04 | 24,78 | 14,65 |
| m | 19,75 | 23,8 | 20,9 | 22,87 |
Para conseguir 1 litro de HCl 0.1 M:
nº equivalentes HCl concentrado = nº equivalentes HCl diluido
V x N = V' x N'
V x 11.21 = 1 x 0.1
V=0.000892 L = 8.92ml HCl concentrado
1000-8.92 = 991.08ml de H2O
Para conseguir 1 litro de HCl 0.1 N:
8.92ml HCl concentrado
Como M = N
991.08ml de H2O
Para conseguir 1 litro de HCl al 12%:
Si en 100![]()
hay 35 de HCl ![]()
de reactivo
En X ![]()
hay 120 de HCl
De H2O hay que añadir: 1000-342.85 =657.15
Para conseguir 1 litro de H2SO4 0.1M:
nº equivalentes H2SO4 concentrado = nº equivalentes de H2SO4 diluido. (Por el procedimiento anterior)
29.78 x V = 0.2 x 1
V = 0.00807 L = 8.07ml H2SO4
1000-8.07 = 991.95ml H2O
Para conseguir 1 litro de H2SO4 0.1N:
V = 4.05ml H2SO4
Como N= 2M
1000-4.03=995.97ml H2O
Para conseguir 1 litro de H2SO4 al 12%
Si en 100![]()
hay 60 de H2SO4 ![]()
de reactivo
En X ![]()
hay 120 de H2SO4
De H2O hay que añadir 1000-200=800
Para conseguir 1 litro de NH3 0.1M:
nº equivalentes NH3 concentrado = nº equivalentes diluidos (Por el mismo procedimiento):
14065 x V = 0.1 x 1
V=0.00682 L=6.82ml NH3 concentrado
1000-6.82=993.18ml de H2O
Para conseguir 1 litro de NH3 0.1N:
6.82ml NH3 concentrado
Como N=M
993.18ml H2O
Para conseguir 1 litro de NH3 al 12%:
Si en 100![]()
hay 28 de NH3 ![]()
de reactivo
En X ![]()
hay 120 de NH3
De H2O hay que añadir 1000-428.57 = 571.43
Tabla completa:
| 0,1 M | 0,1 N | 12% | ||
| HCl | Vol reactivo | 8,92 ml | 8,92 ml | 342,85 ml |
| HCl | Vol agua | 991,08 ml | 991,08 ml | 657,15 ml |
| H2SO4 | Vol reactivo | 8,07 ml | 4,03 ml | 200 ml |
| H2SO4 | Vol agua | 991,93 ml | 995,97 ml | 800 ml |
| NH3 | Vol reactivo | 6,82 ml | 6,82 ml | 428,57 ml |
| NH3 | Vol agua | 993,18 ml | 993,18 ml | 571,43 ml |
Electrolitos fuertes y débiles
Practica: preparar 100ml de ácido acético 0.1N
Con los datos calcular la molaridad del acético en la botella
D=1.05 gr/ml
%=99.5 
calculo del volumen necesario del ácido concentrado
nº equivalentes concentrado = nº equivalentes diluido
x 100(ml)= 17.39 x V![]()
V=0.57ml acético concentrado
100 - 0.57 = 99.43ml H2O
ph = 2.75
Practica: preparar 100 ml de HCl 0.1N
HCl = 11.21M = 11.21N
nº equivalentes HCl concentrado = nº equivalentes HCl diluido
11.21 x V = 0.1 x 100
V =0.89ml HCl concentrado
100 - 0.89 = 99.11ml de H2O
ph = 0.79
Practica: preparar 100ml de amoniaco 0.1N
NH3=14.65M=14.65N
nº equivalentes NH3 concentrado = nº equivalentes diluido
14.65 x V = 0.1 x 100
V = 0.68ml de NH3 concentrado
100 - 0.68 = 99.32ml H2O
ph = 11.2
Practica: preparar 100ml de sosa 0.1N
NaOH = 10N
nº equivalentes NaOH concentrado = nº equivalentes NaOH diluido
![]()
![]()

;m = 0.4gr NaOH (diluidos en 100ml de H2O)
ph = 13.18
Practica: preparar disoluciones 0.01N en cada una de las sustancias anteriores
Se toman muestras de 10ml de cada una de las disoluciones obtenidas anteriormente, y se diluyen con agua hasta 100ml llegando a disoluciones 0.01N de cada especie.
ph(HCl)=1.88
ph(CH3-COOH)=3.65
ph(NH3)=10.03
ph(NaOH)=11.89
Practica: calculo del ph suponiendo ionización completa
ácido clorhídrico
| HCl |
| H+ | + | Cl- | |
| Inicio | 0,1 | 0 | 0 | ||
| Disociación | 0 | 0,1 | 0,1 | ||
![]()
= 0.1 = 10-1![]()
ph = -log(10-1) = 1
| HCl |
| H+ | + | Cl- | |
| Inicio | 0,01 | 0 | 0 | ||
| Disociación | 0 | 0,01 | 0,01 |
![]()
= 0.01 = 10-2![]()
ph = -log(10-2) = 2
Acido acético
| HAc |
| H+ | + | Ac- | |
| Inicio | 0,1 | 0 | 0 | ||
| Disociación | 0,1 - X | X | X |
![]()
Nota: la X del denominador se puede despreciar frente al 0.1 por ser la constante de disociación del ácido del orden de 10-5
![]()
Cuando ![]()
![]()
![]()
![]()
Cuando ![]()
Amoniaco
| NH4OH |
| NH4+ | + | OH- | |
| Inicio | 0,1 | 0 | 0 | ||
| Disociación | 0,1 - X | X | X |
![]()
![]()
Cuando![]()
![]()
Cuando![]()
![]()
Sosa
| NaOH |
| Na+ | + | OH- | |
| Inicio | 0.1 | 0 | 0 | ||
| Disociación | 0 | 0.1 | 0.1 |
![]()
Cuando ![]()
Tabla completa:
| HCl | HAc | NH3 | NaOH | |
| Ph(0.1N) | 0.74 | 2.73 | 11.2 | 13.18 |
| Ph(0.01N) | 1.88 | 3.65 | 10.03 | 11.89 |
| Ph ionización completa | 1 2 | 13 12 |
Contestar las siguientes preguntas:
¿Qué ácidos y bases están completamente ionizados y cuales no? ¿Por qué?.
El HCl y el NaOH tienen constantes de ionización tan elevadas que no se pueden medir en el seno del agua. Por esto se supone que están completamente disociados.
El AcH y el NH3 mantienen un equilibrio con sus formas disociadas que sus constantes son del orden de 10-5, y esto indica que son débiles.
¿Qué es la constante de disociación? ¿Cuál es su expresión y cómo se relaciona con el grado de disociación?.
Constante que mide el mayor o menor desplazamiento del equilibrio hacia la derecha.
Se expresa como el producto de las concentraciones de las sustancias disociadas, entre el producto de las concentraciones de las sustancias sin disociar elevadas a sus correspondientes coeficientes estequiometricos. Tiene la siguiente relación con el grado de disociación:
| AH |
| A- | + | H+ |
|
|
|
|

grado disociación ![]()
cte. disociación
3 -
| AcH |
| Ac- | + | H+ |
|
|
|
|

![]()

| NH4OH |
| NH4+ | + | OH- |
|
|
|
|

![]()

¿Cómo varia el grado de disociación con la concentración? ¿Por qué?
Conforme aumenta la concentración, el grado de disociación es más pequeño ó aumenta la disociación con la dilución ya que:
![]()
PRACTICA 3
Reacciones de algunos metales con los ácidos y el agua
Pasos seguidos y explicaciones
La introducir muestras de metales en agua, es sodio reacciona casi explosivamente, el resto no reacciona.
Se decanta el agua.
Se introducen muestras en disolución HCl 0.5N, reacciona el hierro apreciándose un burbujeo. El resto son calentados. Rápidamente reacciona el aluminio consumiéndose y tomando su disolución un color blanco. Lentamente reacciona el zinc apreciándose burbujas.
SE decanta el ácido.
El resto se introduce en HCl concentrado. Lentamente la muestra de cobre reacciona tomando un color amarillento. Al calentar el ácido, reacciona el estaño con lentitud.
Se decanta el ácido.
Por ultimo se introduce la muestra de plomo (la única que no ha reaccionado) en HNO3. El plomo reacciona rápidamente tomando un color rojizo.
Tabla completa:
| Al | Cu | Fe | Zn | Sn | Pb | Na | |
| H2O | No | No | No | No | No | No | Si rápida |
| HCl dil. frío | No | No | Si lenta | No | No | No | ----- |
| HCl dil. caliente | Si rápida | No | ----- | Si lenta | No | No | ----- |
| HCl conc. frío | ----- | Si lenta | ----- | ----- | No | No | ----- |
| HCl conc. caliente | ----- | ----- | ----- | ----- | Si lenta | No | ----- |
| HNO3 | ----- | ----- | ----- | ----- | ----- | Si rápida | ----- |
Contestar a las siguientes preguntas
Escribir y ajustar las reacciones de ataque de los metales.
Na + H2O ![]()
NaOH + ½ H2O
Fe + 2HCl ![]()
FeCl2 + H2
Al + 3HCl ![]()
AlCl3 + 3/2 H2
Zn + 2HCl ![]()
ZnCl2 + H2
Sn + 2HCl ![]()
SnCl2 + H2
Cu + 2HCl ![]()
CuCl2 + H2
Pb + HNO3 proceso redox:
![]()
![]()
Reacción ionica: ![]()
Reacción global: ![]()
Ordenar los metales por orden creciente de su potencial redox, colocando el hidrogeno donde corresponde.
Cada ácido de los procesos anteriores era mas oxidante que su anterior. Entonces según el orden en que reaccionan los metales su potencial crecerá así:
![]()
Comparar la ordenación anterior con la de una serie electroquimica y explicar las diferencias.
![]()
Algunos de los metales que se encuentran por encima del hidrogeno no se disuelven en agua. ¿Por qué?
Como el potencial del hidrogeno depende del ph, se cumple en general que todos los metales situados debajo del hierro en la serie electroquimica no reaccionan con el agua, pues son incapaces de desplazar el catión H+ de esta. (El ph del agua pura es aproximadamente -0.413 Voltios)
¿Por qué los metales que están debajo del hidrogeno se disuelven en nítrico y no en clorhídrico?
Por que el nítrico es mas oxidante que el clorhídrico.
Otras reacciones redox
Siguiendo los pasos indicados, se llega a los siguientes resultados:
HCl con NaCl, color transparente (si reaccionan).
AcH con NaCl, color rosa (no reaccionan).
H3BO3 con NaCl, color rosa (no reaccionan).
HCl con NaBr, color amarillo-blanco (si reaccionan).
AcH con NaBr, color amarillo-blanco(si reaccionan).
H3BO3 con NaBr, color rojo vinagre(no reaccionan).
HCl con IK, color amarillo (si reaccionan).
AcH con IK, color amarillo (si reaccionan).
H3BO3 con IK, color amarillo(si reaccionan).
Tabla completa:
| MnO4- | NaCl | NaBr | IK |
| ph=0 | Si | Si | Si |
| ph=3 | No | Si | Si |
| ph=6 | No | No | Si |
Contestar a las preguntas siguientes:
Explicar los hechos observados en base a los potenciales redox:
HCl con NaCl; ![]()
1.56>1.35![]()
Hay reacción
![]()
AcH con NaCl: ![]()
1.27<1.35![]()
No reaccionan
![]()
H3BO3 con NaCl; ![]()
0.99<1.35![]()
Imposible que reaccionen
![]()
HCl con NaBr: ![]()
1.56>1.08![]()
Si hay reacción.
![]()
Ac con NaBr; ![]()
1.27>1.08![]()
Si hay reacción
![]()
H3BO3 con NaBr; ![]()
0.99<1.08![]()
No hay reacción.
![]()
HCl con IK; ![]()
1.56>0.53![]()
Si hay reacción
![]()
AcH con IK; ![]()
![]()
1.27>0.53![]()
Si hay reacción
![]()
H3BO3 con IK; ![]()
0.99>0.53![]()
Si hay reacción
![]()
Escribir las reacciones redox que tiene lugar en cada caso.
1º- MnO4 + HCl:
![]()
![]()
![]()
Reacción global: ![]()
![]()
2º-MnO-4+Br-;
![]()
![]()
![]()
3º- MnO-4+I-;
![]()
![]()
![]()
¿Cuál es el peso equivalente del MnO4- sin estas reacciones?
El peso molecular dividido entre 5
PRACTICA 4
Determinación de la dureza del agua
Determinación de ![]()
Se toman 50ml de agua corriente, a la que se añaden 5ml de disolución tampón.![]()
Se añaden unas 20 gotas del indicador negro de ericromo T. Se remueve y toma la disolución un color oscuro. Se añade EDTA hasta conseguir un color verde-azul. Se necesitan 33ml de EDTA.
determinación de la disminución de ![]()
Se toman 50ml de agua corriente, a los que se les añade una punta de espátula de Na2CO3. Se calienta la mezcla hasta ebullición. Se deja enfriar la mezcla unos minutos y se filtra a otro matraz.
Se procede como en la experiencia anterior añadiendo las mismas cantidades de tampón amoniacal, negro de eriocromo T. Se necesitan ahora 23ml de EDTA para llegar al resultado anterior.
Calculo de las concentraciones de ![]()
y de la disminución en % de la dureza del agua:
![]()
![]()
equivalentes EDTA = equivalentes Ca+2 +equivalentes Mg+2 = equivalentes dureza
N x V = equivalentes de dureza
x 23 x10-3 = 33 x 10-5=equivalente dureza 1ª experiencia (iniciales).
0.01 x 23 x 10-3 =23 x 10-5=equivalentes dureza 2ª experiencia (finales).
Determinación en % de la dureza:
![]()
PRACTICA 5
Preparación y propiedades de substancias gaseosas
Preparación de NH3 y propiedades.
Practica:
Se calienta una disolución formada por agua, una pizca de ClNH4 y unas gotas de NaOH (2N).
Se exponen los vapores producidos a un papel indicador humedecido, que pasa de color amarillo a azul.
La reacción que tiene lugar es:
![]()
![]()
NH4OH![]()
Practica:
Se expone a los vapores de la anterior disolución una varilla mojada en HCl y se aprecia, aunque en poca cantidad, vapores de color blanquecino.
La reacción que tiene lugar es:
![]()
NH4Cl![]()
Practica: propiedades reductoras del NH3.
Se añade a hipoclorito sódico un poco de NH3. Se observan grandes emanaciones de gas.
La reacción que tiene lugar es:
![]()
N2H4![]()
Causante de los gases desprendidos
Preparación y carácter ácido del cloruro de amonio.
Practica:
Se calienta una disolución de NaCl en H2SO4. Reacciona formando una espuma blanca.
Se observa el desprendimiento de gases. Se humedece el papel indicador porque el HCl (g) desprendido reacciona con el agua del papel, dando protones (cationes hidronio) que es el que da el color rojo al papel.
La reacción que tiene lugar es:
![]()
![]()
; reacción en el papel indicador.
Practica: Insolubilidad del cloruro de plata.
Se añaden unas gotas de AgNO3 en una disolución de NaCl con agua. La disolución toma un color blanco que poco a poco queda dividido en un color transparente (el de la disolución) y al fondo un color más blanco (el del precipitado). El aspecto final de la disolución es blanco arriba y tendiendo a transparente abajo.
Las reacciones que tienen lugar son:
![]()
AgCl![]()
Causante del precipitado
PRACTICA 1
Preparación de disoluciones a partir de sólidos
Practica: preparar 50ml de BaCl2 y 100ml de Na2SO4 0.1 M
Cantidad necesaria de sales.

masa BaCl2=1.04gr
![]()

masa Na2SO4=1.4gr
Se mide en una balanza masas muy aproximadas a las anteriores (tomando una masa de 1.22gr de BaCl2 por estar este diluido) y tras varios enjuagues se diluyen los dos solutos en agua destilada hasta formar ambas disoluciones.
Preparación de disoluciones a partir de otros concentrados.
Practica: preparar 50ml de BaCl2 0.01 M a partir de BaCl2 0.1 M
Volumen necesario de BaCl2 0.1 M
Como el numero de equivalentes se conserva, se cumple que::
nº equivalentes disolución concentrada = nº equivalentes disolución diluida
Nconcentrada x Vconcentrada = Ndiluida x Vdiluida
0.1x 2 x Vconcentrada = 0.01 x 2 x 50
![]()
Se vierte este volumen en un vaso y se diluye hasta 50ml con agua destilada.
Precipitación y filtración
Practica: mezcla de 3ml 0.1 M de disoluciones de BaCl2 y Na2SO4
Reacción: BaCl2 + Na2SO4 2NaCl + BaSO4 ![]()
En el momento de entrar en contacto ambas sustancias la mezcla se vuelve de un color blanco intenso. Pasado un tiempo se aprecia poso que se queda con la tonalidad más blanquecina.
Tras la ebullición de la mezcla y posterior enfriamiento se filtra la mezcla con un papel de filtro. Dejando secar aproximadamente 24 horas los residuos (BaSO4) y pesándolo se obtiene 0.54gr de este precipitado.
Descargar
| Enviado por: | Sherman |
| Idioma: | castellano |
| País: | España |
