Ingeniero Químico
Química industrial
1.- Dir si és veritat o mentida i el per què, la següent afirmació. Si obtenim el SO2 a partir del sofre, en lloc de fer-ho a partir de pirites, resulta molt més pur i ja no caldrà cap catalitzador per fer l'oxidació del SO2 a SO3.
Incorrecte. Si bé es cert que en obtenir el SO2 a partir de sofre tindrà menys impureses, en ambdós casos és necesari passar pel catalitzador per l'oxidació a SO3. Així, la materia prima d'origen si està relacionada amb el sistema de purificació de l'SO3 previ a la catàlisi, en el cas de partir de pirites, posarem énfasi en evitar la presencia d'arsènic i al ferro, i en tots dos casos serà necesari treure pols i humitat.
2.- Un òleum del 20% i un àcid sulfúric del 110%, són el mateix?
No ben bé. Un òleum del 20% té sulfuric en un 104,5% i un 20% de SO3 lliure, molt higroscòpic, que formarà més àcid sulfúric en entrar en contacte amb humitat/aigua.
3.- Per què el procés d'oxidació de SO2 a SO3 es fa en vàries etapes?
Degut a que el catalitzador és sòlid i cal afavorir temps de contacte, a la vegada que controlar la temperatura. Posant més capes de catalitzadors i amb la temperatura òptima a la que treballen, aprofitant la gravetat pel fluxe descendent, el millor rendiment (la millor conversió) s'obté amb un reactor de 4 etapes:
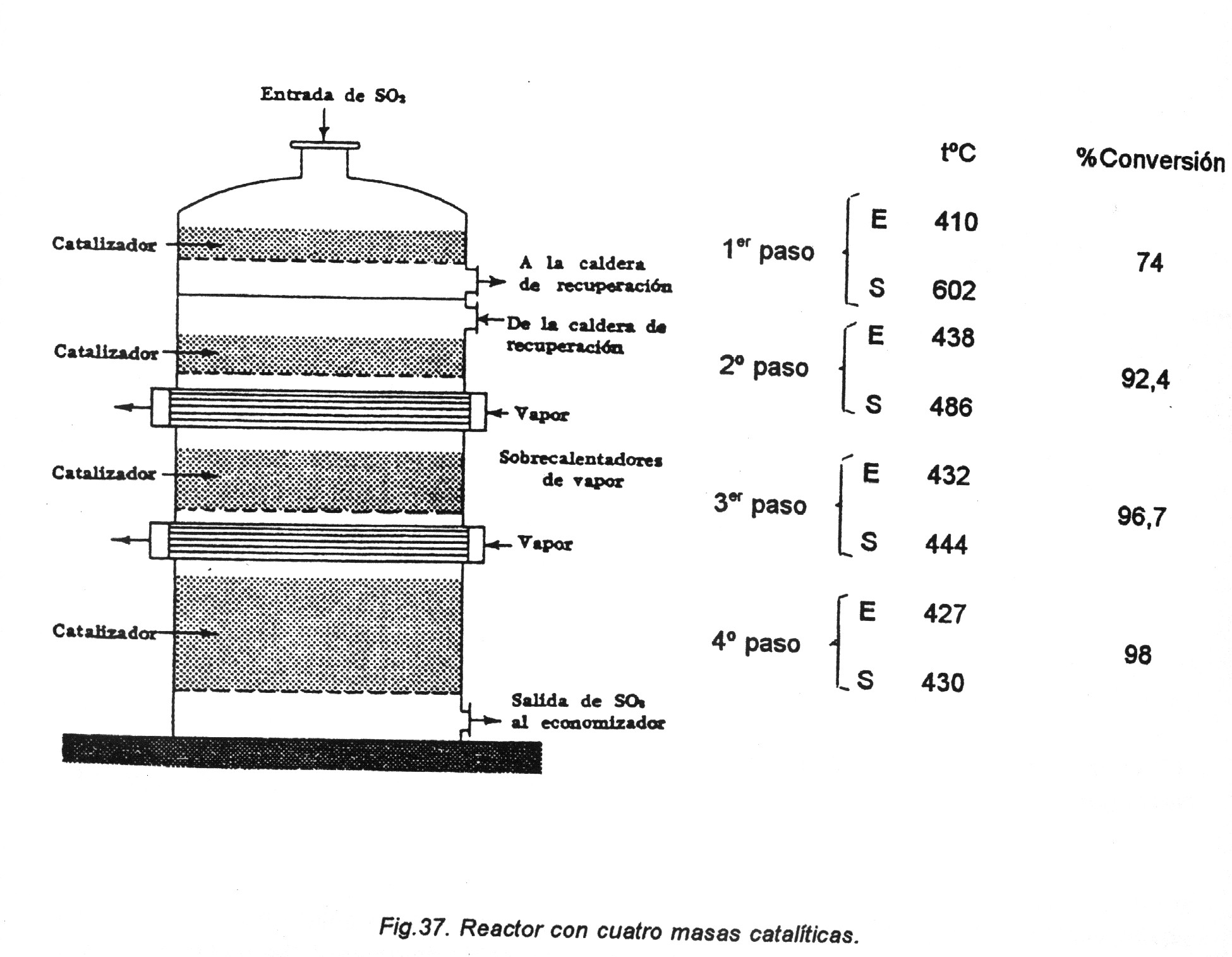
4.- El procés d'oxidació de SO2 a SO3, amb oxigen, desprén 22600 kcal/mol. Normalment es fa a temperatura de l'ordre de 400-450ºC. Per què a aquest nivell de temperatura el procés va bastant bé i no hi va per sota ni per sobre?
Degut a l'equilibri que té lloc:
SO2 + ½ O2 SO3 + Q
A més temperatura, l'equilibri es desplaça cap a l'esquerra, disminuint la conversió que ens interesa, i a menys temperatura, els catalitzadors no proporcionen una velocitat de reacció acceptable.
5.- Estudiant bé el diagrama de flux de la fabricació de l'àcid sulfúric per contacte, identificar quin és el reactor principal i explicar què s'hi fa.
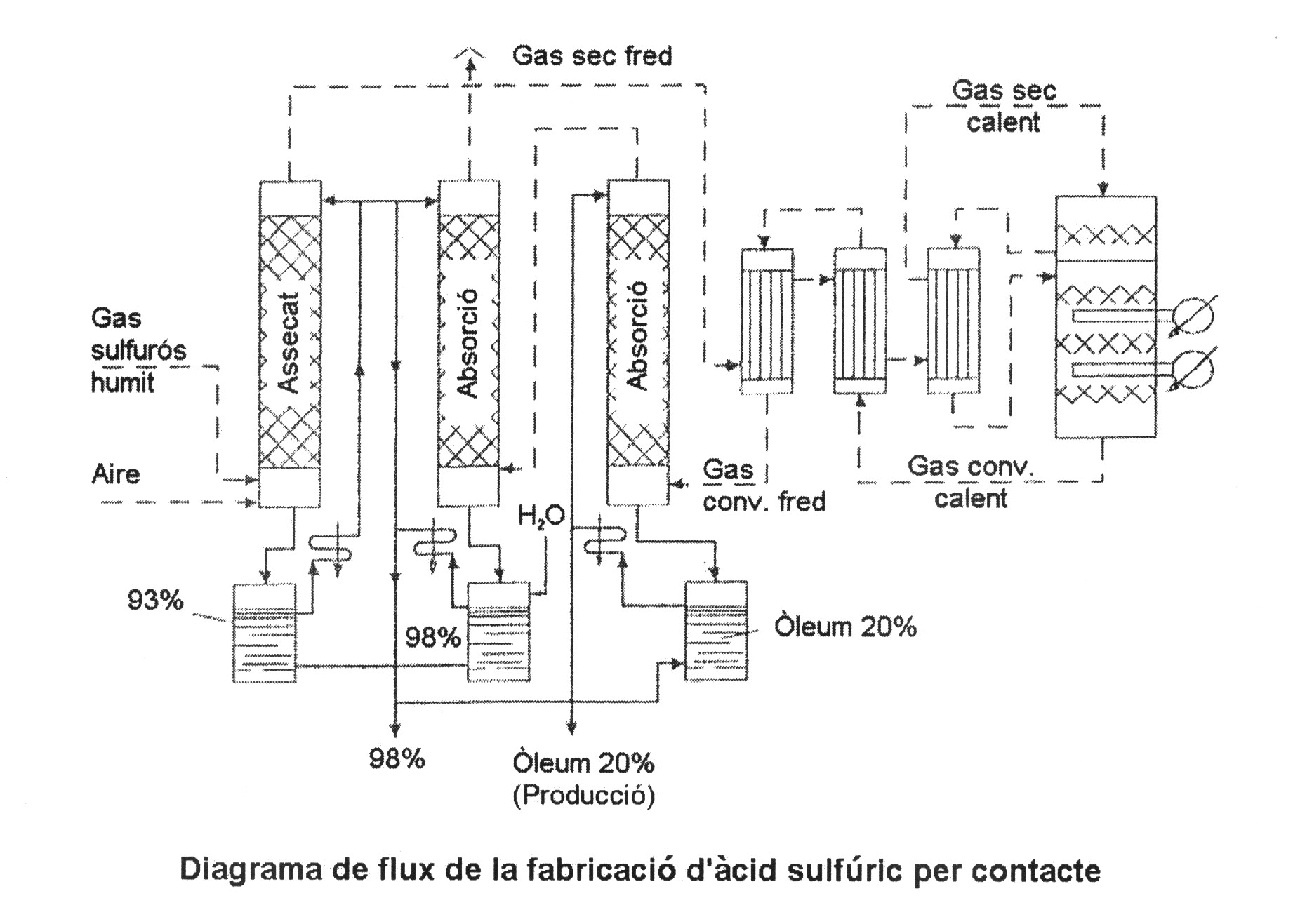
El reactor principal és el situat a la dreta del diagrama, on entra el gas sec calent.
El que es fa es ficar els gasos d'SO2 i fer-los passar a través del catalitzador (V2O5), que es troba sobre quars i cobert de quars per mantenir la temperatura d'activació. Es refreden els vapors obtinguts, cada cop més concentrats, aprofitant el calor per escalfar aigua.
Finalment, amb un grau de conversió satisfactori, surten per la part inferior els gasos que ens interesen, que seguiran el procés.
6.- En el procés de l'esmentat diagrama, per què s'hi posen dues torres d'absorció?
Per absorbir els gasos de la catàlisi, a una primera absorció, fem servir àcid sulfúric concentrat, de menys pressió de vapor, que evitarà que tinguem boires. Així, saturem aquest sulfúric amb SO3, obtenint òleum, i derivem la sortida de vapors a una segona absorció amb sulfúric menys concentrat, que anirà guanyant concentració i podrem separar com a producte final, també. Aquest sulfúric serà al 98%, i podrem controlar la seva qualitat per mitjà de la seva densitat.
BIBLIOGRAFIA
-
Diccionario de Química y de productos químicos. Ed.Omega.
-
Química Industrial Inorgánica. Terrassa 2005. Fernando González Lagunas, Manuel J.Lis Arias, Fernando Carrillo Navarrete.
EUETII 2A QUÍMICA INDUSTRIAL 1
Capítol 7: Sofre i àcid sulfúric.Qüestions. 1/12/06
Página 1 de 3
Descargar
| Enviado por: | Conrado |
| Idioma: | catalán |
| País: | España |
