Química
Propiedades físicas de sólidos y líquidos
UNIVERSIDAD NACIONAL DE
SAN CRISTÓBAL DE HUAMANGA
FACULTAD DE INGENIERÍA QUÍMICA Y METALURGIA
Departamento Académico de Ingeniería Química
Escuela de Formación Profesional Ingeniería Civil
Práctica de Laboratorio N° 02
“Propiedades Físicas de Sólidos y Líquidos”
CURSO : QUÍMICA GENERAL
CUCLO ACADÉMICO : 2002 - I
FECHA DE EJECUCIÓN : 01 - 07 - 2002
HORA : 11:00 a.m. - 1:00 p.m.
FECHA DE ENTREGA : 08 - 07 - 2002
Ayacucho - Perú
2002
Propiedades Físicas de Sólidos y de Líquidos
FINALIDAD:
Medición de propiedades físicas básicas de sólidos y de líquidos puros.
Determinar parámetros principales que identifican y caracterizan a las sustancias químicas puras.
FUNDAMENTACIÓN TEÓRICA:
Medición.- Comparación de magnitudes físicas observables y medibles, de sustancias en relación a patrones y estándares definidos, de naturaleza física semejante.
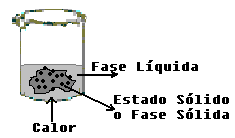
Punto de Fusión.- Es la temperatura en la cual una sustancia se funde(paso del estado de agregación sólido al líquido) a temperatura y presión constantes. El punto de fusión de un sólido cristalino se puede definir como la temperatura a la cual un sólido se transforma en líquido a la presión de 1 atmósfera. En una sustancia pura el cambio de estado es generalmente muy rápido y la temperatura es característica, no afectando prácticamente por un cambio moderado de la presión. Por esta razón el punto de fusión es una buena constante en la identificación de sólidos. Debido a que el punto de fusión se altera sensiblemente por la presencia de impurezas esta constante constituye un buen criterio de pureza. Un sólido puro funde en un intervalo muy pequeño de temperatura y un límite superior muy próximo al verdadero punto de fusión. Un sólido bastante impuro presenta generalmente un intervalo de fusión bastante más amplio y una temperatura límite superior considerablemente inferior (intervalo de 10° a 20°) a la del punto de fusión verdadero.
Ecuación Físico-Químico de Fusión del Agua Sólido(hielo):
; s: estado sólido; l: estado líquido
Punto de Ebullición.- Es la temperatura en el cual una sustancia pura se vaporiza(paso del estado líquido al estado de vapor), a temperatura y presión constantes. El Punto de ebullición es la temperatura a la que la presión de vapor de un líquido se iguala a la presión atmosférica existente sobre dicho líquido. A temperatu ras inferiores al punto de ebullición (p.e.), la evaporación tiene lugar únicamente en la superficie del líquido. Durante la ebullición se forma vapor en el interior del líquido, que sale a la superficie en forma de burbujas, con el característico hervor tumultuoso de la ebullición. En resumen, se define punto de ebullición de un liquido como la temperatura a la cual la presión del vapor es igual a la presión externa. Cuando se aplica calor a un liquido, su presión de vapor aumenta hasta hacerse igual a la presión atmosférica. El punto de ebullición varia con la presión externa que existe por encima de la superficie del liquido. Al descender la presión, el punto de ebullición disminuye; un aumento en la presión aumenta el punto de ebullición.
Solubilidad en Líquidos.-
La solubilidad es la capacidad que tiene una sustancia para disolverse en otra, la solubilidad de un soluto es la cantidad de este.
Algunos líquidos, como el agua y el alcohol, pueden disolverse entre ellos en cualquier proporción. En una disolución de azúcar en agua, puede suceder que, si se le sigue añadiendo más azúcar, se llegue a un punto en el que ya no se disolverá más, pues la disolución está saturada.
La solubilidad de un compuesto en un disolvente concreto y a una temperatura y presión dadas se define como la cantidad máxima de ese compuesto que puede ser disuelta en la disolución. En la mayoría de las sustancias, la solubilidad aumenta al aumentar la temperatura del disolvente. En el caso de sustancias como los gases o sales orgánicas de calcio, la solubilidad en un líquido aumenta a medida que disminuye la temperatura
En general, la mayor solubilidad se da en disoluciones que moléculas tienen una estructura similar a las del disolvente.
La solubilidad de las sustancias varia, algunas de ellas son muy poco solubles o insolubles. La sal de cocina, el azúcar y el vinagre son muy solubles en agua, pero el bicarbonato de sodio casi no se disuelve.
La solubilidad se mide en: ó
Densidad.-
Es una propiedad empleada ampliamente para caracterizar las sustancias. Se define como la cantidad de masa en una unidad de volumen de la sustancia:
o como símbolo:
Como es de propiedad cuantitativa suele ser de mayor utilidad para identificar una sustancia que una propiedad cualitativa, como el color o el olor. Además, la densidad determina si un objeto flota en un cierto liquido.
Aunque la unidad básica de la densidad es Kg/m3, es mas común expresar la densidad de unidades de gramos por centímetro cúbico.
Viscosidad de Fluidos(gases y líquidos).-
Algunos líquidos, literalmente fluyen al igual que la maleza, mientras que otros fluyen con facilidad, la resistencia a fluir se conoce con el nombre de viscosidad. Entre mayor es la viscosidad, el liquido fluye mas lentamente. Los líquidos como la maleza o el aceite de los motores son relativamente viscosos; el agua y los líquidos orgánicos como el tetracloruro de carbono no lo son. La viscosidad puede medirse tomando en cuanta el tiempo que transcurre cuando cierta cantidad de un liquido fluye a través de un delgado tubo, bajo la fuerza de la gravedad. En otro método, se utilizan esferas de acero que caen a través de un liquido y se mide la velocidad de caída. Las esferas mas lentamente en los líquidos mas viscosos. La formula para determinar la viscosidad con respecto al tiempo es:
Donde: dV/dt = Velocidad de flujo del liquido a lo largo de un tubo .
r = Radio del tubo.
L = Longitud
(P1 - P2)= Diferencia de presión
Las viscosidad se relaciona con la facilidad con la cual las moléculas individuales del liquido se mueve en relación con las otras. Esto depende de la fuerza de atracción entre las moléculas y también del hecho de que existan características estructúrale que provoquen que las moléculas se enreden entre si. La viscosidad disminuye a medida que aumenta la temperatura, debido a que a altas temperaturas la energía cinética promedio es mayor y hace que las moléculas superen con facilidad las fuerzas de atracción entre ellas.
Tensión Superficial.-
Es la capacidad de un líquido de ascender o descender en un tubo capilar. En un liquido, cada molécula se desplaza siempre bajo influencia de sus moléculas vecinas. Una molécula cerca del centro del liquido, experimenta el efecto de que sus vecinas la atraen casi en la misma magnitud en todas direcciones. Sin embargo, una molécula en la superficie del liquido no esta completamente rodeado por otras y, como resultado, solo experimenta la atracción de aquellas moléculas que están por abajo y a los lados. Por lo tanto, las moléculas a lo largo de la superficie, experimentan una atracción en una dirección hacia el interior del liquido, lo cual provoca que las moléculas en la superficie sean arrastradas al interior. La situación mas estable se presentan estas desiguales fuerzas de atracción en la superficie del liquido es tan pequeña que sea posibles.
Susceptibilidad Magnética.-
Algunos materiales presentan susceptibilidad magnética, que consiste en que son afectados cuando se les aplica un campo magnético. A nivel microscópico este fenómeno puede asociarse a la orientación de todos los pequeños campos magnéticos que presentan los átomos y las moléculas, que normalmente están distribuidos al azar, de forma que todos ellos quedan colocados de forma paralela al citado campo.
La susceptibilidad magnética tiene numerosas aplicaciones científicas y técnicas, siendo una de las más conocidas la resonancia magnética nuclear (RMN), utilizada como método de diagnóstico médico. En esquema, la RMN consiste en aplicar un campo magnético a un paciente, estudiando la respuesta de los campos magnéticos microscópicos de los átomos y las moléculas que componen sus diferentes tejidos, ya que estos varían en función de su entorno. Esta técnica, complementaria de las radiografías de rayos X, tiene la ventaja sobre éstas de que puede ser aplicada a tejidos blandos sin necesidad de preparación previa y que, además, resulta inocua para la salud a diferencia de los rayos X.
Físicamente hablando, la falta de una relación entre ![]()
y ![]()
(análoga a la relación entre ![]()
y ![]()
para medios conductores). Para una gran cantidad de materiales se cumple una relación lineal:
![]()
La cantidad ![]()
es adimensional y se denomina susceptibilidad magnética
El material se denomina paramagnético si ![]()
.
El material se denomina diamagnético si ![]()
.
Si ![]()
, el material es ferromagnético.
| Table 7.1: Valores de la susceptibilidad magnética para algunos materiales | ||
| Material |
|
|
| Aluminio |
| paramagnético |
| CO2 (1 atm.) |
| diamagnético |
| Bi |
| diamagnético |
| Cu |
| diamagnético |
| etc. |
|
|
La susceptibilidad ![]()
mide la capacidad de los momentos magnéticos microscópicos a alinearse con el campo externo. Se define tambien la 'permeabilidad magnética' del medio ![]()
, que establece una relación de proporcionalidad entre 
y ![]()
,
![]()
Conductividad Eléctrica.-
La conductividad eléctrica, que es la capacidad de conducir la corriente eléctrica cuando se aplica una diferencia de potencial, es una de las propiedades físicas más importantes. Ciertos metales, como el cobre, la plata y el aluminio son excelentes conductores. Por otro lado, ciertos aislantes como el diamante o el vidrio son muy malos conductores. A temperaturas muy bajas, los semiconductores puros se comportan como aislantes. Sometidos a altas temperaturas, mezclados con impurezas o en presencia de luz, la conductividad de los semiconductores puede aumentar de forma espectacular y llegar a alcanzar niveles cercanos a los de los metales. Las propiedades de los semiconductores se estudian en la física del estado sólido.

MATERIALES Y REACTIVOS:
MATERIALES:
-
Soporte Universal.
-
Mechero de Bunsen
-
Trípode y Rejilla metálica
-
Tubo de ensayo
-
Vaso de Precipitado
-
Nueces
-
Pinzas para tubos de ensayo
-
Hilos
-
Agua destilada, etc.
-
REACTIVOS QUÍMICOS:
-
Benceno
-
Tolueno
-
Naftaleno sólido
-
PROCEDIMIENTO EXPERIMENTAL:
-
ENSAYO N° 1: PUNTO DE FUSIÓN DE SÓLIDOS:
-
Determinar el punto de fusión del naftaleno sólido:
-
ENSAYO N° 2: PUNTO DE EBULLICIÓN DEL LÍQUIDO:
-
Punto de Ebullición del Agua Líquido:
-
Punto de Ebullición del Benceno:
-
ENSAYO N° 3:CONDUCTIVIDAD ELÉCTRICA DEL LÍQUIDO:
-
CONCLUSIONES:
-
Punto de Fusión del naftaleno a nivel del mar(presión atmosférica estándar o normal=760 mmHg o Torr.), es de 80,0 °C
-
Punto de Fusión del Naftaleno en Huamanga = 79,0 °C
-
Punto de Ebullición del benceno normal o estándar(1 atm del benceno líquido)=80,1 °C
-
Punto de Ebullición del benceno en Huamanga = 76 °C
-
Punto de Ebullición del Tolueno en Huamanga = 85 °C, etc.
-
RECOMENDACIONES:
-
La recomendación a mis compañeros a que tengan más cuidado en el uso de los reactivos, como de los equipos y materiales de laboratorio ya que presentan una consistencia muy frágil; en algunos casos muy delicado.
-
Se recomienda al Sr. Profesor, que para la mejor comprensión de los métodos u operaciones de laboratorio es necesario realizar más ensayos experimentales; asimismo utilizar más reactivos e instrumentos que nos adecue a su correcto uso; además manejar con facilidad y comprender lo estudiado o fenómeno materia de estudio.
-
BIBLIOGRAFÍA:
-
TEXTOS:
-
VARIOS AUTORES “QUÍMICA EXPERIMENTAL”. Edit.Mercantil Ayacucho. 1995.
-
MORRIS GORAN “QUÍMICA EXPERIMENTAL PARA TODOS” Edit. Ramón Sopena S.A. Barcelona España.1976
-
ZAMBRANO GUIMARAY, Tomasa Z. “MANUAL DE TÉCNICAS DE LABORATORIO”. Edit. UNSAM. Huaraz Perú.1990.


Ecuación Fisicoquímica de la Ebullición del Agua Líquido:

Presión Atmosférica local: 548 mm.Hg ó Torr.
Punto de Fusión Experimental del Naftaleno:


Presión atmosférica local : 548 mmHg
Punto de Ebullición experimental del Benceno:
(Soluciones Líquidas, puros)

50 ml H2O(d)+1ml HCl(c)
c = concentrado


Después de haber realizado los ensayos, podemos llegar en síntesis a los resultados estándares siguientes:
.INTERNET:
1







Descargar
| Enviado por: | Nanaqsunqu |
| Idioma: | castellano |
| País: | Perú |
