Química
Oxidación del ión de yodo por el agua oxigenada
PRÁCTICA 4
OXIDACIÓN DEL IÓN I ¯ POR EL AGUA OXIGENADA.
16 de Abril de 1999
RESUMEN.-
En esta práctica, se realiza el estudio cinético de la reacción de oxidación del I- con agua oxigenada en medio ácido. Para ello, el proceso experimental se basa en una volumetría.
INTRODUCCIÓN.-
La oxidación del I- por el agua oxigenada, viene dada por la reacción:
H2O2 + 2 I ¯ + 2 H+ ! I2 + 2 H2O ( 1 )
La ecuación de la velocidad de reacción se puede escribir como:
![]()
( 2 )
El estudio experimental se realiza respecto del agua oxigenada, para lo cual hay que conseguir que las concentraciones de I- y H+ permanezcan constantes:
-
la reacción se lleva a cabo en medio ácido, y por tanto, la concentración de H+ se puede considerar constante porque la cantidad que desaparece es despreciable.
-
para mantener constante la concentración de I-, añadimos a la mezcla reaccionante un volumen pequeño de tiosulfato sódico. Entonces a la reacción que viene dada por (1), se le superpone la siguiente:
2 S2O3= + I2 ! S4O6= + 2 I- ( 3 )
Esta reacción es rápida e irreversible, y por tanto, nos permite considerar constante la concentración de I- mientras haya tiosulfato presente en la disolución.
Bajo estas condiciones, la ecuación de la velocidad de reacción ( 2 ), se puede escribir en función de la concentración de H2O2:
![]()
K [ H2O2]a ( 4 )
donde K = K [H+]c [I-]b ( 5 )
MÉTODO EXPERIMENTAL.-
El procedimiento experimental consta de dos partes:
Valoración de la disolución de H2O2
Estudio de la cinética de reacción.
Para ello, se preparan las siguientes disoluciones:
-
H2O2 : usaremos agua oxigenada comercial que habrá que valorar previamente para conocer su concentración exacta.
-
Na2S2O3 : 100 cm3 de concentración 1.0 M
-
H2SO4 : 100 cm3 de concentración 1.0 M
-
KI : de proporciona disolución al 10%
-
Engrudo de almidón: se proporciona disolución al 1%
-
Molibdato amónico: se proporciona disolución al 1%
Valoración del agua oxigenada comercial.-
La valoración del H2O2 comercial se realiza con S2O3= (ambas
disoluciones diluidas). Para ello, la reacción en la que los I- se oxidan por el H2O2 se lleva a cabo de forma total e instantánea mediante un catalizador (molibdato amónico), y el I2 liberado se valora con la disolución de S2O3= (reacciones 1 y 3).
Para ver el cambio del estado de oxidación del yodo, se añaden unas gotas de almidón, de tal forma, que cuando en la disolución haya I2, esta se verá de color azul, y cuando en la disolución haya I-, esta será incolora.
Experimentalmente se han realizado dos valoraciones del agua oxigenada para obtener un valor de su concentración mas exacto:
v1 = 20.90 mL
v2 = 20.88 mL
Considerando que el volumen de S2O3= empleado para la valoración del H2O2 es la media aritmética de los dos volúmenes, obtenemos que:
v = 20.89 mL
Por tanto, la concentración del H2O2 comercial se puede calcular como sigue:
n(S2O3=) = M × V = 0.1 mol/L × 20.89 · 10-3 L = 0.002089 moles de S2O3= que han
reaccionado con I2.
Teniendo en cuenta la estequiometría de la reacción (3), los moles que teníamos de yodo en la disolución eran:
n(I2) = ![]()
Teniendo en cuenta que todo el yodo proviene de la oxidación del yoduro con H2O2, y que la reacción es mol a mol, entonces los moles de H2O2 que habían en la mezcla eran 0.0010445 moles. Así pues la concentración de las dos disoluciones de H2O2 son:
![]()
![]()
Estudio cinético.-
Se emplea S2O3= 1 M, que se verterá a la disolución desde la bureta. Por
otro lado, en un erlenmeyer de 250 cm3 se añadirán 30 cm3 de H2SO4, alrededor de 0.7 cm3 de engrudo de almidón y 10 cm3 de KI al 10%.
Antes de comenzar la reacción, se añaden desde la bureta 0.5 cm3 de S2O3=. A continuación se añaden en el erlenmeyer 10 cm3 de H2O2 (el cronómetro se pone en marcha cuando se ha añadido la mitad del H2O2 ).
Se irán anotando tiempos según se vayan añadiendo pequeños volúmenes de S2O3= (aproximadamente se añaden 0.5 mL). Cuando la disolución se ponga de color azul, quiere decir que hay I2 libre en el medio, y entonces hay que añadir una nueva cantidad de S2O3= desde la bureta (anotamos los volúmenes exactos que se añaden, porque es muy difícil añadir justamente los 0.5 mL).
El procedimiento se repetirá hasta que la disolución del erlenmeyer tarde en volverse azul unos 15 o 20 minutos desde la última medida.
CÁLCULOS Y RESULTADOS.-
1.- Sea co la concentración de H2O2 en el vaso de reacción en el tiempo t = 0, y sea c la concentración de H2O2 en el tiempo t. Calcular y tabular todas ellas.
La concentración inicial de agua oxigenada, será el número de moles de agua oxigenada que tenemos en la disolución dividido por el volumen total:
![]()
= 0.0593 M
Para calcular la concentración en un tiempo t, hay que tener en cuenta que los moles que hay de H2O2 serán los iniciales menos los que han reaccionado, y estos últimos los podemos relacionar con los moles de S2O3= que añadimos desde la bureta como sigue:
1 mol de H2O2 _ 1 mol de I2 _ 2 moles de S2O3=
x mol de H2O2 _ x mol de I2 _ 1(mol/L)×Vs2o32-
moles de H2O2 que reaccionan = ![]()
= 0.5×Vs2o32- moles.
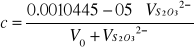
" concentración del H2O2 en un tiempo t.
Los datos se encuentran recogidos en la TABLA 1.
2.- Representar la gráfica Ln ( co / c ) = f (t) y deducir el orden de la reacción respecto al H2O2.
La representación se encuentra en la GRÁFICA 1, y los datos tabulados se encuentran en la TABLA 1.
La ecuación de la recta obtenida es: y = 0.0012x + 0.0862
El orden de la reacción es uno, ya que en la representación gráfica hemos obtenido una recta que pasa por el origen.
3.- Calcular la constante de velocidad con sus unidades. Esta constante será k = k [I-] b [H+] c
La constante cinética experimental que se obtiene, corresponde a la pendiente de la recta obtenida en la representación gráfica:
k = 0.0012 sg-1
TABLA1
| tiempo (sg) | VS2O32- (L) | CH2O2 (mol/L) | Ln (c0/c) |
| 0 | 0.00050 | 0.0593 | 0 |
| 15 | 0.00100 | 0.0577 | 0.0271 |
| 34 | 0.00155 | 0.0544 | 0.0859 |
| 55 | 0.00200 | 0.0530 | 0.1119 |
| 70 | 0.00245 | 0.0516 | 0.1386 |
| 95 | 0.00300 | 0.0499 | 0.1719 |
| 115 | 0.00349 | 0.0484 | 0.2024 |
| 140 | 0.00405 | 0.0467 | 0.2382 |
| 165 | 0.00457 | 0.0451 | 0.2725 |
| 190 | 0.00499 | 0.0439 | 0.3009 |
| 210 | 0.00550 | 0.0424 | 0.3363 |
| 237 | 0.00602 | 0.0408 | 0.3735 |
| 265 | 0.00650 | 0.0394 | 0.4090 |
| 292 | 0.00700 | 0.0379 | 0.4471 |
| 323 | 0.00750 | 0.0364 | 0.4864 |
| 355 | 0.00801 | 0.0350 | 0.5281 |
| 388 | 0.00851 | 0.0335 | 0.5704 |
| 420 | 0.00902 | 0.0320 | 0.6152 |
| 457 | 0.00956 | 0.0305 | 0.6647 |
| 500 | 0.01001 | 0.0292 | 0.7076 |
| 536 | 0.01055 | 0.0277 | 0.7614 |
| 580 | 0.01097 | 0.0265 | 0.8051 |
| 616 | 0.01151 | 0.0250 | 0.8640 |
| 666 | 0.01202 | 0.0236 | 0.9226 |
| 718 | 0.01250 | 0.0222 | 0.9808 |
| 770 | 0.01300 | 0.0209 | 1.0449 |
| 825 | 0.01357 | 0.0193 | 1.1229 |
| 895 | 0.01404 | 0.0180 | 1.1917 |
| 958 | 0.01460 | 0.0165 | 1.2799 |
| 1035 | 0.01502 | 0.0153 | 1.3512 |
| 1108 | 0.01558 | 0.0138 | 1.4544 |
| 1208 | 0.01603 | 0.0126 | 1.5453 |
| 1301 | 0.01647 | 0.0155 | 1.6525 |
| 1398 | 0.01695 | 0.0102 | 1.7599 |
| 1515 | 0.01750 | 0.0088 | 1.9131 |
| 1668 | 0.01801 | 0.0074 | 2.0788 |
| 1808 | 0.01853 | 0.0061 | 2.2806 |
| 2070 | 0.01902 | 0.0048 | 2.5158 |
| 2338 | 0.01955 | 0.0034 | 2.8518 |
| 2740 | 0.02001 | 0.0022 | 3.2747 |
| 3303 | 0.0250 | 0.0010 | 4.0909 |
Descargar
| Enviado por: | José María Gómez Saso |
| Idioma: | castellano |
| País: | España |
