Química
Mediciones de masa

UNIVERSIDAD NACIONAL DE SAN CRISTÓBAL DE HUAMANGA
FACULTAD DE INGENIERÍA QUÍMICA Y METALURGIA
DEPARTAMENTO ACADÉMICO DE INGENIERÍA QUÍMICA
ESCUELA DE FORMACIÓN PROFESIONAL DE INGENIERÍA QUÍMICA
LABORATORIO DE QUIMICA
QUÍMICA I
TRABAJO Nº 03
MEDICIONES DE MASA
SIGLA : QU-141
GRUPO martes 8-11 AM
AÑO Y SEMESTRE AC. : 2008-I
FECHA DE EJECUCION : 09-09-08
FECHA DE ENTREGA : 18-09-08
AYACUCHO - PERÚ
2008
MEDICIONES DE MASA
I) OBJETIVOS
-
Reconocimiento de diferentes tipos de balanza.
-
Conocer el modo de operar las balanzas.
-
Reconocer los errores al medir.
II) PARTE TEORICA
II. a).-UNIDADES DE MEDICION.
Muchas propiedades de la materia son cuantitativas; es decir, están asociadas a números. Cuando un número representa una cantidad medida, siempre debemos especificar las unidades de esa cantidad. Decir que la longitud de un lápiz es17.5 no tiene sentido. Decir que tiene 17.5cm. (Centímetros) especifica correctamente la longitud. Las unidades que se emplean para mediciones científicas son las de sistema métrico.
El sistema métrico, que se desarrolló inicialmente en Francia a fines del siglo XVIII, que se emplea como sistema de medición en casi todos los países del mundo. En EE.UU. Se ha usado tradicionalmente el sistema ingles, aunque el empleo del sistema métrico se ha popularizado más en los últimos años.
II. b) UNIDADES SI.
En 1960 se llego a un acuerdo internacional que especificaba un grupo dado de unidades métricas para emplearse en mediciones científicas. Estas unidades preferidas se denominan unidades SI, que es la abreviatura del sistema internacional de unidades. El sistema SI tiene 7 unidades fundamentales de las cuales se derivan todas las demás, para ver las 7 unidades los plasmaremos en el cuadro siguiente.
CUADRO Nº 1
| MAGNITUD | UNIDAD | |
| . | Nombre | Símbolo |
| Longitud | metro | m |
| Masa | kilogramo | Kg |
| Tiempo | segundo | s |
| Intensidad de Corriente Eléctrica | ampere | A |
| Temperatura Termodinámica | kelvin | K |
| Cantidad de Sustancia | mol | mol |
| Intensidad Lumínica | candela | cd |
-
En esta práctica nos centraremos en el estudio de la masa.
II. c) INCERTIDUMBRE AL MEDIR.
Entre las posibles fuentes que deben ser consideradas como contribuyentes de
la incertidumbre total de una medición (aunque no todas son relevantes en
todos los casos) están:
a) Definición incompleta del mensurando.
b) Preparación, transporte, almacenamiento y manipulación del objeto a medir.
c) Muestreos no representativos (la muestra medida puede no representar el mensurando definido).
d) Conocimiento inadecuado de los efectos de las condiciones ambientales sobre las mediciones, o mediciones imperfectas de dichas condiciones ambientales.
e) Errores de apreciación del operador en la lectura de instrumentos analógicos.
f) Resolución del instrumento o equipo de medición.
g) Incertidumbre de la calibración de los patrones de medición y materiales de referencia.
h) Valores inexactos de constantes y otros parámetros obtenidos de fuentes externas y en los algoritmos y software utilizados.
i) Aproximaciones y suposiciones incorporadas en los métodos y procedimientos de medición.
j) Variaciones en observaciones repetidas del mensurando bajo condiciones aparentemente iguales e incertidumbre que aparece de la corrección de los resultados de la medición por los efectos sistemáticos.
II. d) PRECISION Y EXATITUD
-
PRECISIÓN.- Se refiere a la dispersión del conjunto de valores obtenidos de mediciones repetidas de una magnitud. Cuanto menor es la dispersión mayor la precisión. Una medida común de la variabilidad es la desviación estándar de las mediciones y la precisión se puede estimar como una función de ella.
-
EXACTITUD.- Se refiere a que tan cerca del valor real se encuentra el valor medido. En términos estadístico, la exactitud está relacionada con el sesgo de una estimación. Cuanto menor es el sesgo más exacto es una estimación.
En el cuadro número 2 observamos una grafica de qué es precisión y exactitud.
CUADRO Nº 2
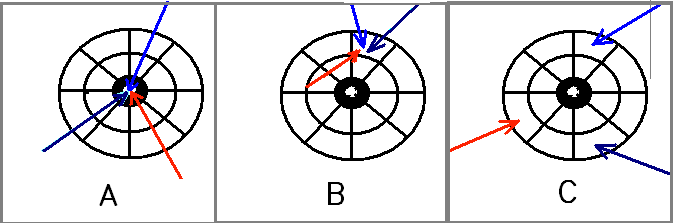
A.- Buena precisión y buena exactitud.
B.- Buena precisión y mala exactitud.
C.- Mala precisión y mala exactitud.
II. e) TIPOS DE ERRORES DE MEDICIÓN.
Los tipos de error cometido pueden ser:
1. Error Absoluto.
2. Error Relativo.
3. Aleatorio.
4. Sistemático.
5. Humano.
Pasamos ha definir cada uno de ellos
1.-ERROR ABSOLUTO: El error absoluto de una medida es la diferencia entre el valor real de una magnitud y el valor que se ha medido.
= valor observado - valor real
2.-ERROR RELATIVO: Es la relación que existe entre el error absoluto y la magnitud medida, es adimensional, y suele expresarse en porcentaje.
%e = X 100
3.- ERROR ALEATORIO: Es producido por el sistema de realización de la medición. Ejemplo: al pesar un cuerpo. Es producido por el mecanismo de la pesada, por el sistema de realización de las pesadas, es un error constante, que está presente en todas y cada una de las pesadas que se efectúen.
4.- ERROR SISTEMÁTICO: Es producido por la medición de cada una de las pesadas, no es constante, es el error de redondeo que se lleva a cabo en cada una de las pesadas que se efectúan.
5.- ERROR HUMANO.- El "medidor" (observador) puede originar errores sistemáticos por una forma inadecuada de medir, introduciendo así un error siempre en el mismo sentido. No suele ser consciente de cómo introduce su error. Sólo se elimina cambiando de observador.
El observador puede introducir también errores accidentales por una imperfección de sus sentidos. Estos errores van unas veces en un sentido y otros en otro y se pueden compensar haciendo varias medidas y promediándolas.
ESTRATEGIAS PARA REDUCIR LOS ERRORES
-
Estandarizar los métodos de medición en el manual de operaciones.
-
Adiestramiento y acreditación del observador.
-
Refinamiento del instrumento de medida.
-
Automatización del instrumento.
-
Repetición de la medición.
-
Calibración del instrumento.
-
Anotar cuidadosamente los valores obtenidos en tablas.
-
Cumplir las normas de utilización del fabricante del aparato en cuanto a conservación y condiciones de uso.
II. f) CIFRAS SIGNIFICATIVAS.
Definición.- Son todos los dígitos que se conocen con seguridad, o de los que existe una cierta certeza. El número de cifras significativas es el número de cifras sin contar ceros a la izquierda. Se considera que las cifras significativas de un número son aquellas que tienen significado real o aportan alguna información. Las cifras no significativas aparecen como resultado de los cálculos y no tienen significado alguno. Las cifras significativas de un número vienen determinadas por su error. Son cifras significativas aquellas que ocupan una posición igual o superior al orden o posición del error.
Para ello plasmamos en el siguiente cuadro, algunas normas de uso de las cifras significativas:
CUADRO Nº 3
| Norma | Ejemplo |
| Son significativos todos los dígitos distintos de cero. | 8723 tiene cuatro cifras significativas |
| Los ceros situados entre dos cifras significativas son significativos. | 105 tiene tres cifras significativas |
| Los ceros a la izquierda de la primera cifra significativa no lo son. | 0,005 tiene una cifra significativa |
| Para números mayores que 1, los ceros a la derecha de la coma son significativos. | 8,00 tiene tres cifras significativas |
| Para números sin coma decimal, los ceros posteriores a la última cifra distinta de cero pueden o no considerarse significativos. Así, para el número 70 podríamos considerar una o dos cifras significativas. Esta ambigüedad se evita utilizando la notación científica. | 7 · 102 tiene una cifra significativa |
Ejemplos:
-
3400 ± 100 tiene dos cifras significativas.
-
100,0 ± 0,1 tiene cuatro cifras significativas
-
0,0005670 ± 0,0000001 tiene cuatro cifras significativas.
III) PARTE EXPERIMENTAL.
ENSAYO 1:
MANEJO Y USO DE DIFERENTES TIPOS DE BALANZA.
DEFINICION DE LAS BALANZAS VISTAS EN EL LABORATORIO.
a) BALANZA DE TRIPLE BARRA:
Esta balanza consiste en un platillo, donde se miden las masas de los sólidos con menor exactitud. Esta consiste en la comparación en una masa ya establecida en el brazo, que desliza sobre una barra con las medidas de masa pertinentes. Al quedar balanceado el sistema, se puede ver la masa del objeto en el punto que se marca en el brazo de la balanza.
b) BALANZA ELECTRÓNICA:
La determinación de los pesos de las sustancias se realiza habitualmente mediante una balanza electrónica monoplato. Este aparato se calibra y se tara automáticamente. La lectura, con una precisión de ±0.001 g, es prácticamente instantánea
c) BALANZA ANALÍTICA:
Una balanza de las características de la llamada analítica es altamente utilizada debido que ofrece una precisión que otros modelos de básculas quizás no puedan ofrecer por contar con otros rasgos y por estar destinadas a otros ámbitos. En el caso que nos ocupa, se la emplea en lugares donde la determinación del peso resulta de gran importancia, como es el caso de los laboratorios. En este medio, este instrumento de medición es tan trascendental que se cree que de éste dependen la mayor parte de los resultados analíticos que se están buscando en la realización de un determinado estudio, análisis o experimento. Como ocurre con la mayoría de las balanzas, la balanza analítica presenta una gran variedad de modelos modernos que contribuyen al fin que se quiere perseguir: el de la obtención de resultados sumamente precisos.
REPRESENTACION GRAFICA DE LAS BALANZAS YA ESTUDIADAS.
CUADRO Nº 4
| BALANZA TRIPLE BARRA | |
| BALANZA ELÉCTRICA |
|
| BALANZA ANALÌTICA |
|
LISTADO DE LOS CUIDADOS PARA REALIZAR UNA BUENA PESADA.
Cuidados en la balanza triple barra:
-
Ver si está calibrada la balanza.
-
Manipular personalmente la balanza.
Cuidados en la balanza eléctrica:
CUADRO Nº 5
|
| Verificar si la Balanza ha encendido. Apriete el botón on/off y espere hasta que se muestre 0.0 g. |
|
| Colocar un recipiente o un papel de pesado grande y plegado en la parte superior de la Balanza. Pulse el botón de la tara para poner a cero la Balanza. |
|
| Agregar cuidadosamente la sustancia al recipiente o papel. Anotar la masa. |
|
| Usar el cepillo proporcionado para limpiar cualquier derramamiento. Deseche cualquier resto de sustancia que haya derramado cuando estuvo usando el papel o recipiente. |
Observación al cuadro Nº 5
-
La sustancia a pesar nunca se deposita sobre el plato de la balanza. Si es un sólido, se emplea un vidrio de reloj, vaso de precipitados o un papel de filtro con los que previamente se haya tarado la balanza. Si es un líquido, éste puede pesarse sobre un vaso de precipitados o un matraz erlenmeyer que estén limpios y secos por debajo.
ENSAYO 2
PESAJE DE SÓLIDOS COMPACTOS
1.- En nuestro grupo usamos para medir en las balanzas, monedas de 0.20 centavos.
Lo cual plasmaremos en el siguiente cuadro.
CUADRO Nº 6
| objeto | P. en triple barra | P. balanza eléctrica | P. balanza analítica |
| 1 | 4.3g | 4.32g | 4.3226g |
| 2 | 4.3g | 4.32g | 4.3316g |
| 3 | 4.4g | 4.44g | 4.4431g |
| 4 | 4.4g | 4.41g | 4.4232g |
| 5 | 4.4g | 4.42g | 4.4232g |
| promedios | 4.36g | 4.382g | 4.38712g |
OBSERVACIONES AL CUADRO NO 6
-
En el cuadro se ve que cada una de las balanzas tienen distintas formas de medir debido a la lectura de sus cifras significativas.
-
Los cuidados para una buena medición son más estrictos según a la exactitud de cada balanza.
-
Los promedios en el cuadro de cada medición con su respectiva balanza, resulta al sumar los valores pesados de cada uno de los objetos dividido al numero de ellos.
2.- Ya dados los pesos, seguidamente los promedios lo llevamos alas unidades de Kg, lb y onz. Caso que se ve en el siguiente cuadro.
CUADRO Nº 7
| Promedio de la balanza Tb | Kg | Lb | oz |
| 4.36g | 4.36E-3 | 9.592 E-03 | 1.54E-1 |
| Promedio de la balanza Eléctrica. | Kg | Lb | onz |
| 4.382g | 4.382 E-3 | 9.6404 E-3 | 1.55 E-1 |
| Promedio de la balanza Analítica. | Kg | lb | Onz |
| 4.38712g | 4.38712 E-3 | 9.6517 E-3 | 1.5487 E-2 |
OBSERVACIONES AL CUADRO NO 7
-
Los datos obtenidos para la transformación de gramos a Kg, lb y onz lo daremos en el siguiente ejemplo.
1g -----------------------> 0.001 Kg
1g -----------------------> 0.352739 oz (avdp)
1g -----------------------> 0.0022049 lb (avdp)
Estas equivalencias obtenidas lo utilizaremos para las transformaciones siguientes.
Ejemplo con el promedio del peso de la balanza triple barra;
a) 4.36g x = 4.36E-3 Kg
b) 4.36g x = 9.592 E-03 lb
c) 4.36g x = 1.54E-1 oz
-
Para sacar las transformaciones en la balanza eléctrica y la balanza analítica se recurre al mismo procedimiento ya realizado, los resultados obtenidos está en el cuadro Nº 7.
3.- En el cuadro siguiente obtenemos: error absoluto y error relativo.
CUADRO Nº 8
| objeto | Peso TB | Peso BA | Error absoluto(e.a) | Error relativo(%e) |
| 1 | 4.3g | 4.3226g | -2.26E-2g | -5.23E-1g |
| 2 | 4.3g | 4.3316g | -3.16 E-2g | -7.30 E-1g |
| 3 | 4.4g | 4.4431g | -4.31 E-2g | -9.70 E-1g |
| 4 | 4.4g | 4.4151g | -1.51 E-2g | -3.42 E-1g |
| 5 | 4.4g | 4.4239g | -2.39 E-2g | -5.40 E-1g |
| promedios | -2.71 E-2g | -6.18 E-1g |
OBSERVASION AL CUADRO Nº 8
-
Los promedios se realizaron de la siguiente manera:
error absoluto en el objeto número 1.
ea = Peso TB - peso BA
Aplicación:
ea = 4.3 - 4.3226
ea = -2.26E-2g
error relativo en el objeto numero 2.
%er = x 100
Aplicación:
%er = x 100
%er = -5.23E-1 g
-
Para sacar el error absoluto y relativo de los objetos 2, 3,4 y 5 se requiere de los procedimientos ya realizados.
ENSAYO 3:
PESAJES DESÓLIDOS COMPACTOS
1.-Pesaje de un objeto sólido dado en el laboratorio por el docente.
CUADRO Nº 8
| Objeto | Balanza TB | Balanza eléctrica | Balanza analítica |
| 1 | 12.6g | 13.69g | 13.7196g |
2.-sacando error absoluto y relativo del sólido pesado.
CUADRO Nº 9
| objeto | Peso TB | Peso BA | Error absoluto | Error relativo |
| 1 | 12.6g | 13.7196g | -1.12 | -8.16 |
3.- llevando la unidad de gramo a kg, oz y lb.
CUADRO Nº 10
| Peso en g | Kg | oz | lb |
| 12.6g | 1.26 E-2 | 4.44 | 2.78 E-2 |
| 13.69g | 1.37 E-2 | 4.83 | 3.02 E-2 |
| 13.7196 | 1.37 E-2 | 4.84 | 3.03E-2 |
OBSERVASION.- los cuadros 8, 9 y 10 tienen una secuencia lógica del cual ya estudiamos, el como sacar errores y llevar a otras unidades.
ENSAYO 4
PESAJES DESÓLIDOS CORROSIVOS.
Para pesar los sólidos o líquidos corrosivos se debe de emplear una luna de reloj para que sea recipiente para pesar deseado y no causar daño alas balanzas o uno mismo.
Para pesar lo corrosivo se requiere esencialmente los siguientes pasos:
-
pesar la luna de reloj.
-
Presionar la opción tara de la balanza.
-
Agregar la masa deseada para pesar.
-
Apuntar los datos obtenidos.
-
O también se puede pesar la luna de reloj y restarla con el peso de la masa total, para saber el peso de la masa pesada.
Ejemplo:
Peso de la luna de reloj (vacía) = 21.04g
Peso de la sustancia corrosiva más la luna de reloj (NaOH) = 21. 58g
Ya obtenidos estos resultado lo restamos para saber el peso de la sustancia corrosiva.
21.04g - 21. 58g = 0.54g
Llevando a Kg, oz y lb.
CUADRO Nº 10
| Peso de NaOH en g | Kg | oz | lb |
| 0.54g | 5.40E-4 | 1.90E-1 | 1.19E-3 |
PESAJES DESÓLIDOS POLVERULENTO.
Para poder pesar un sólido pulverulento requerimos de los siguientes procedimientos.
-
Hacer un cartucho de papel (limpio o nuevo).
-
Colocar el cartucho en la balanza y tararlo.
-
Sacar la masa pulverulenta con una espátula de su recipiente.
-
Echar calculadamente a la balanza para obtener el resultado deseado.
El peso obtenido en la práctica fue de 0.35g.
Llevando a Kg, oz y lb.
CUADRO Nº 10
| Peso del sólido pulverulento | Kg | oz | lb |
| 0.35 | 3.50 E-4 | 1.23 E-1 | 7.72 E-4 |
Observaciones.-
-
en los cálculos de los cuadros anteriores trabajamos con 3 cifras significativas.
-
El valor de E = 10
IV CONCLUSION
-
En el laboratorio tuvimos la oportunidad de reconocer los instrumentos de medición de masa, como la balanza triple barra, balanza eléctrica y balanza analítica. Sus funciones y precauciones en el momento de pesar.
-
Aprendimos a pesar en objetos que nos protegen nuestra salud.
-
Aprendimos a usar las cifras significativas en el SI.
V.- BIBLIOGRAFIA
-
http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_i/conceptos/conceptos_bloque_1_3.htm.
-
http://www.fisicanet.com.ar/fisica/mediciones/tp02_errores.php
-
http://www.abcpedia.com/basculas-balanzas/laboratorio.html
-
http://es.mt.com/mt/products/productos-aplicaciones_pesaje-laboratorio_balanzas-analiticas_balanzas-classic_ab-s/AB54-S_043541029710242401.jsp
-
Problemas de química - colección Racso - felix aucallanchi Velásquez - racso editores - pag. 11 - 12.
-
Quimican la ciencia central 7ma edicion- brow theodorel , lemay eugene y bursten bruce E- impreso en mexico - pag 13 -17.
Descargar
| Enviado por: | Limacozes |
| Idioma: | castellano |
| País: | Perú |








