Química
Ácido Fórmico
1.- Ácidos Carboxílicos
Los ácidos orgánicos (RCOOH), son compuestos que contienen un grupo carboxilo. Este grupo consta de un grupo -OH unido directamente a un grupo carbonilo (-C=O). El comportamiento ácido de un ácido carboxílico se debe principalmente a la estabilización por resonancia del anión carboxilato, el ión que se produce después de que el carboxílico se ioniza y da un ión H+. Los ácidos carboxílicos son más débiles que la mayoría de ácidos inorgánicos.
Los ácidos carboxílicos pueden formar enlaces de hidrógeno. La habilidad para formar enlaces de hidrógeno explica la solubilidad en agua de los ácidos de menor masa molecular. Los ácidos carboxílicos tienen puntos de ebullición más altos que los alcoholes de aproximadamente la misma masa molecular.
Los ácidos carboxílicos se combinan con las bases inorgánicas para formar sales carboxilato y agua. Los ácidos de mayor masa molecular o ácidos grasos, reaccionan con los iones de los metales alcalinos tales como el Na+ o el K+ para producir jabones. Los jabones pueden disolver la grasa no polar y la mugre, dado que las moléculas de jabón tienen un extremo hidrofóbico no polar para unirse a la grasa, y un extremo iónico hidrofílico para unirse a las moléculas del agua. Algunas de las sales carboxilato de menor masa molecular tienen actividad antimicrobiana y son relativamente poco tóxicas. Éstas se utilizan como compuestos preservantes de alimentos.
Los ácidos carboxílicos presentan reacciones de sustitución en las que es reemplazado el grupo -OH. Cuando ocurre esta reacción se produce un derivado de ácido. Dos clases importantes de derivados de ácidos son los cloruros de acilo (RCOCl) y los ésteres (RCOOR'). Todos los derivados de los ácidos se pueden hidrolizar nuevamente de sus ácidos principales.
Los ésteres (RCOOR') están compuestos de dos partes, el componente del ácido precursor y el componente del alcohol precursor. Tienen puntos de ebullición inferiores a los de los ácidos correspondientes puesto que no pueden donar enlaces de hidrógeno. Pueden aceptar enlaces de hidrógeno de los solventes polares; por lo tanto, los de baja masa molecular son solubles en agua y en otros solventes polares. Los ésteres tienen olores frutales agradables y se utilizan como aromatizantes. Si la reacción de hidrólisis de un éster se lleva a cabo en una solución básica, se denomina reacción de saponificación, es decir, una reacción de formación de jabón.
Se encuentran en el mundo natural. Muchos aditivos de alimentos son ésteres, incluyendo los aromatizantes y los preservativos.
Los ésteres del ácido salicílico se utilizan en medicina. El ácido acetil salicílico o aspirina es la droga analgésica más utilizada en el mundo.
2.- Ácido fórmico, metanoico o hidroxicarboxílico
El A. Fórmico (en adelante A.F.) es el ácido más sencillo, cuya fórmula desarrollada se puede escribir:
![]()
Es un líquido incoloro, móvil, de olor picante, soluble en agua, alcohol y éter. En su estructura se encuentra también el grupo funcional aldehído y eso lo transforma en el único ácido carboxílico reductor. Se oxida fácilmente por acción de oxidantes suaves:
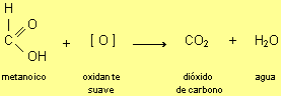
Tiene un peso molecular de 46.03, sus puntos de fusión y de ebullición son 35 y 216 grados Fahrenheit. Tiene una gravedad específica de 1.2, una presión de vapor de 23 mm de Hg en condiciones normales; y un umbral del olor de 21 PPM.
3.- Producción del Ácido Fórmico
El A.F., principalmente es el subproducto en la oxidación en fase líquida de diversos hidrocarburos para formar ácido acético. La recuperación del ácido fórmico de estos productos es complicada porque esterifica cualquier alcohol presente, más rápidamente que el ácido acético. Aproximadamente la tercera parte de la producción mundial de A.F. está basada en la obtención de formiato de metilo a partir de formamida:
HCONH2+CH3OHHCOOCH3+NH3
la cual se hidroliza fácilmente en presencia de ácido sulfúrico para dar ácido fórmico y sulfato amónico:
HCOOCH3+NH3HCOOH+SO4(NH4)2
Otra ruta para generar A.F. a partir del formiato de metilo, incluye la hidrólisis directa. En principio reaccionan monóxido de carbono y metanol, formando el formiato de metilo:
CO+CH3OHHCOOCH3
que en una segunda fase se hidroliza, proporcionando metanol y A.F. que luego se separan:
HCOOCH3CH3OH+HCOOH
Una variante al proceso descrito anteriormente, puede darse, al producirse la síntesis directa a partir del agua y del monóxido de carbono, en presencia de haluros de cobre o catalizadores de ácidos minerales:
H2O+COHCOOH
Además de los procesos que se han citado, el A.F. se puede sintetizar a partir de diversos compuestos. Entre ellos cabe destacar el etileno (C2H4), y el carburo cálcico (C2Ca).
El Etileno, es el miembro más simple de los alquenos. Es ligeramente soluble en agua. Arde con una llama brillante. Tiene un punto de fusión de -272.92 Farenheit y punto de ebullición de -154.84 Farenheit. Se produce comercialmente mediante "cracking" de petróleo y a partir del gas natural. En agricultura se utiliza como colorante y agente madurador de muchos frutos.
En la formación del A.F., el etileno, sufre una serie de transformaciones, a través de las cuales, se van elaborando unos compuestos hasta obtener el producto deseado.
En primer término, el etileno, sufre una reacción catalítica, a través de la cual, pasa a transformarse en etano:
C2H4+H2C2H6
En esta reacción se rompe el doble enlace que existe entre los átomos de carbono, y se añade a la molécula de etileno dos átomos de hidrógeno.
Con el etano formado, se produce a su combustión específica (oxidación), dando lugar a monóxido de carbono (CO) y agua (H2O), como productos.
C2H6+O2CO+H2O
Obtenido el monóxido de carbono (CO), se mezcla con metanol, para obtener ya el A.F.:
CO+CH3OHHCOOCH3
HCOOCH3CH3OH+HCOOH
El carburo de calcio es el carburo salino más importante. Se forma con los metales de los grupos 1 y 2, el aluminio y algunos otros metales, conteniendo aniones o C4-. Los metales del bloque s forman carburos salinos cuando sus óxidos se calientan en presencia de carbono. Con agua todos los carburos C4- producen metano y el hidróxido correspondiente.
La especie es el ión acetileno o etino; los carburos que lo poseen reaccionan con agua para formar acetileno (que es el ácido conjugado del ión acetileno) y el hidróxido correspondiente).
En el etino(alqueno), los átomos de carbono presentan una hibridación sp, y los 2 orbitales p restantes en cada anillo forman 2 enlaces ðð
En el caso propuesto, el carburo de calcio (CaC2) se mezcla con agua (H2O), para formar hidróxido de calcio (Ca(OH)2 y etileno (C2H2):
CaC2)+(H2O)(Ca(OH)2+(C2H2)
Una vez obtenido el acetileno (en forma de gas), se produce a su combustión, formando dióxido de carbono, que en procesos sucesivos se convertirá en monóxido e carbono, pues es mejor materia prima para poder formar A.F. a partir de formaldehído.
C2H2+O2CO2+H2O
CO2CO+O2
CO+CH3OHHCOOCH3
HCOOCH3CH3OH+HCOOH
4.- Derivados del Ácido Fórmico
El A.F. tiene muy diversos derivados, ya sea derivados directos de él, como relacionados estrictamente en su estructura.
Dado que el A.F. entra dentro del grupo de ácidos carboxílicos, éstos tienen una serie de derivados de los cuales se explicará su síntesis desde un punto de vista mecanístico, para poder así comprender mejor el proceso que formación de los mismos.
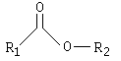
Entre los derivados de los ácidos carboxílicos, los principales se componen de:
-
Ésteres:
-
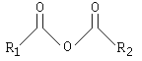
Anhídridos de ácido:
-
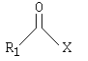
Haluros de ácido:
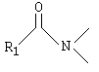
-
Amidas:
-
Nitrilos:
![]()
Los ésteres son compuestos que se forman al sustituir el hidrógeno del ácido por una cadena hidrocarbonada. Cuando el grupo característico, es sustituyente frente a otro grupo principal, o frente a otros grupos carboxilato, se emplean los prefijos alcoxicarbonil-, ariloxicarbonil-, o en su caso se utiliza el prefijo aciloxi-.
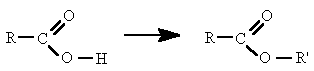
En el caso particular del ácido fórmico, R representa un átomo de hidrógeno (ya que se está tratando con el ácido carboxílico más simple), y R' puede representar CH3:
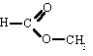
En este caso el éster formado es el metanoato de metilo, o formiato de metilo. El átomo de hidrógeno que se enlazaba al átomo de oxígeno, sale, y lo sustituye el grupo funcional CH3. Esta sustitución, provoca la acentuación del carácter iónico.
Los anhídridos de ácido provienen de la pérdida de una molécula de agua entre dos grupos carboxilo (RCOOH). Pueden ser simétricos o mixtos.
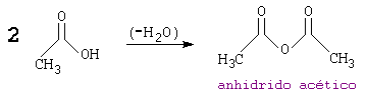
De forma análoga al grupo anterior, el carácter iónico del anhídrido del ácido producido, se hace presente.
Hidroliza
Haluros de cobre/Catalizadores de ácidos minerales
X=Halógeno
Descargar
| Enviado por: | Lixi |
| Idioma: | castellano |
| País: | España |
