Ingeniero de Telecomunicación
Química. Propiedades de la materia
-
OBJETIVO.-
EN ESTA PRACTICA IDENTIFICAREMOS LAS PROPIEDADES DELA MATERIA, COMO LAS:
-DENSIDAD DE LIQUIDOS.
-DENSIDAD DE SÓLIDOS AMORFOS.
-SONPUNTO DE EBULLICIÓN.
-PUNTO DE FUSIÓN.
ASI TAMBIEN PODREMOS IDENTIFICAR LOS PROCEDIMIENTOS PARA OBTENER CADA UNA DE ESTAS PROPIEDADES.
-
INTRODUCCIÓN.-
La masa es una propiedad general de la materia, es decir, cualquier cosa constituida por materia debe tener masa.
Además es la propiedad de la materia que nos permite determinar la cantidad de materia que posee un cuerpo. La mesa tiene más masa que la silla en la que te sientas porque tiene más materia, el lápiz contiene menos materia que la libreta y, por tanto, tiene menos masa.
Aunque no es lo mismo, el peso y la masa son proporcionales, de forma que al medir uno se puede conocer la otra y, de hecho, en el lenguaje corriente, ambos conceptos se confunden.
Además de masa, los cuerpos tienen una extensión en el espacio, ocupan un volumen. El volumen de un cuerpo representa la cantidad de espacio que ocupa su materia y que no puede ser ocupado por otro cuerpo, ya los cuerpos son 
impenetrables.
El volumen también es una propiedad general de la materia y, por tanto, no permite distinguir un tipo de materia, una sustancia, de otra, ya que todas Tienen un volumen.
Aunque toda la materia posee masa y volumen, la misma masa de sustancias diferentes ocupan distintos volúmenes, así notamos que el hierro o el hormigón son pesados, mientras que la misma cantidad de goma de borrar o plástico son ligeras. La propiedad que nos permite medir la ligereza o pesadez de una sustancia recibe el nombre de densidad. Cuanto mayor sea la densidad de un cuerpo, más pesado nos parecerá.
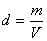
La densidad se define como el cociente entre la masa de un cuerpo y el volumen que ocupa. Es decir, se calcula dividiendo la masa de un cuerpo entre su volumen.
El punto normal de ebullición se define como el punto de ebullición a una presión total aplicada de 101.325 kilopascales ( 1 atm); es decir, la temperatura a la cual la presión de vapor del líquido es igual a una atmósfera. El punto de ebullición aumenta cuando se aplica presión. Para las sustancias que hierven en el intervalo de la temperatura ambiente, la tasa de cambio del punto de ebullición con la temperatura ambiente, la tasa de cambio del punto de ebullición con la temperatura es de aproximadamente 0.3º/kPa o 0.04º/mm Hg (donde la presión es aproximadamente de una atmósfera).
El punto de ebullición no puede elevarse en forma indefinida. Conforme se aumenta la presión, la densidad de la fase gaseosa aumenta hasta que, finalmente, se vuelve indistinguible de la fase líquida con la que está en equilibrio; ésta es la temperatura crítica, por encima de la cual no existe una fase líquida clara. El helio tiene el punto normal de ebullición más bajo (4.2 K) de los correspondientes a cualquier sustancia, y el carburo de tungsteno, uno de los más altos (6300 K).
Temperatura a la cual un sólido cambia a líquido. En las sustancias puras, el proceso de fusión ocurre a una sola temperatura y el aumento de temperatura por la adición de calor se detiene hasta que la fusión es completa.
Los puntos de fusión se han medido a una presión de 105 pascales (1 atm), por lo general 1 atm de aire. (La solubilidad del aire en el líquido es un factor que complica las mediciones de precisión.) Al fundirse, todas las sustancias absorben calor y la mayor parte de dilatan; en consecuencia, un aumento en la presión normalmente eleva el punto de fusión. Algunas sustancias, de las cuales el agua es el ejemplo más notable, se contraen al fundirse; así, al aplicar presión al hielo a 0ºC (32ºF), se provoca su fusión. Para producir cambios significativos en el punto de fusión se requieren grandes cambios en la presión.
En soluciones de dos o más componentes el proceso de fusión ocurre normalmente dentro de un intervalo de temperaturas y se hace una distinción entre el punto de fusión, la temperatura a la que aparece la primera traza de líquido y el punto de congelamiento, es decir, la temperatura más alta a la que desaparece la última traza de sólido, o, en forma equivalente, si se está enfriando en vez de calentar, la temperatura a la que aparece la primera traza de sólido.
-
material.-
-soporte universal.
-probeta
-mechero de bunsen.
-tubo de ensayo.
-rejilla.
-vaso de precipitados.
-termometro.
-tubos capilares.
-naftaleno.
-ligas.
-etanol.
-
DESARROLLO.-
1.- Densidad- sólidos amorfos.- En una probeta adicionar 50 ml. De agua y una vez determinado la masa del sólido introducir el sólido dentro de la probeta para obtener su volumen .
2.- Densidad de líquidos.- pesar una probeta limpia y seca, después adicionar 10 ml de agua y volver a determinar la masa del agua y la probeta (la diferencia de la masa del agua). Repetir el procedimiento pero un lugar de agua, hacerlo con aceite, con cloro, con vinagre y por ultimo con leche.
3.-Punto de Ebullición.- en un vaso deprecipitado adicionar 100ml y calentar, después determinar el punto de ebullición (usar un tubo capilar que se debe calentar para tapar uno de los extremos).
Después en un tubo de ensayo poner , acetona, etanol y por ultimo éter, amarrar el tubo capilar al termómetro e introducirlo en el tubo de ensayo que este a su vez se introducirá en el vaso depreciptado que anteriormente se calentó.
4.- Punto de Fusión.- sellar otro tubo capilar por uno de los extremos (esto es calentándolo), introducir neftaleina al tubo capilar, esto es usando el tubo de vidrio y dejándolo caer para que la neftaleina se vaya hasta el fondo. Después amarrarlo al termómetro y sumergirlo en el agua caliente. Cuando la neftaleina se vuelve liquido, es en ese momento es el punto de fusión del agua.
-
RESULTADOS.-
1.- 31.8/3cm3 = 10.6 g/ cm3
2.- Probeta seca: 132.5 g.
Probeta con agua: 141.2g. 141.2-132.5= 8.7g. 8.7/10 cm3
Densidad = .87 g /cm3
Probeta seca: 132.5 g.
Probeta con aceite: 140.6 g. 140.6-132.5= 8.1 g. 8.1/10 cm3
Densidad =.81 g/ cm3
Probeta seca: 132.5 g.
Probeta con vinagre: 141.1 g. 141.1-132.5 = 8.6g. 8.6/10 cm3
Densidad = .86 g/ cm3
Probeta seca: 132.5 g.
Probeta con leche: 140.4 g. 140.4-132.5 =7.9 g 7.9/10 cm3
Densidad = .79 g/ cm3.
3.-punto de EBULLICIÓN del agua: 93º c
4.-punto de EBULLICIÓN del etanol: 73º c
5.- punto de EBULLICIÓN del acetona: 49º c
6.-punto de EBULLICIÓN del eter: 29º c
7.-punto de fusin del naftaleno: 80º c
-
conclusiones.-
se observo el comportamiento de los compuestos ante la temperatura.
también se pudo identificar el procedimiento para obtener la DENSIDAD de sólidos amorfos y de líquidos.
se logro obtener un procedimiento para identificar los puntos de fusión y de EBULLICIÓN mas preciso.
-
bibliografía.-
www.mcgrawhill.es/tabla_periodica/defi/defi8.html
personal1.iddeo.es/romeroa/materia/
Encarta 2000 Multimedia
Descargar
| Enviado por: | Gori |
| Idioma: | castellano |
| País: | México |
