Ingeniero Químico
Hierro y Biología
EL HIERRO: PAPEL BIOLOGICO
El hierro es un elemento metálico, integrado en la tabla periódica dentro de los metales de transición. Está situado en el grupo 8 y periodo 4, y como metal de transición posee la propiedad de formar complejos con otras moléculas. Es esta una propiedad fundamental desde el punto biológico, ya que es en forma de complejo como este elemento participa en numerosos procesos.
Nos centraremos en el caso de la hemoglobina, proteína que se encuentra en los glóbulos rojos y que da el color rojo a la sangre. Su función es transportar el O2 en la sangre desde los pulmones hacia otros órganos del cuerpo, para proveer a las células del O2 que requieren.
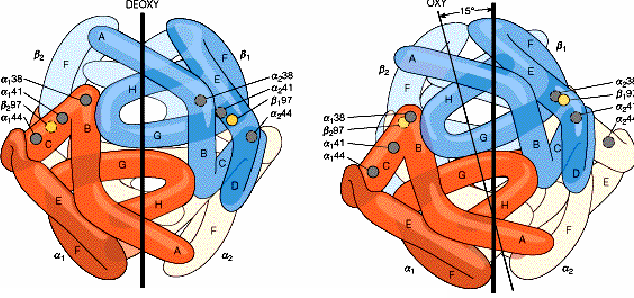
La hemoglobina esta formada por cuatro cadenas polipeptídicas, dos de un tipo y dos de otro. Las cuatro cadenas se mantienen unidas por interacciones no covalentes (interacciones hidrofóbicas y también por enlaces iónicos entre grupos con cargas opuestas), y están dispuestas en el espacio con una disposición tetraédrica. En cada cadena se sitúa además un grupo en el que interviene el hierro, denominados grupos hemo.
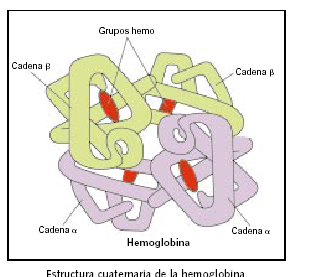
La capacidad de la hemoglobina para enlazar oxígeno depende de la presencia de este grupo hemo. El grupo hemo consta de una parte orgánica, un anillo de porfinrina, y un átomo de hierro.
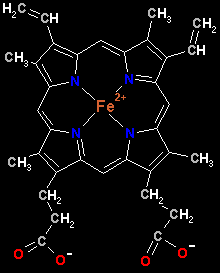
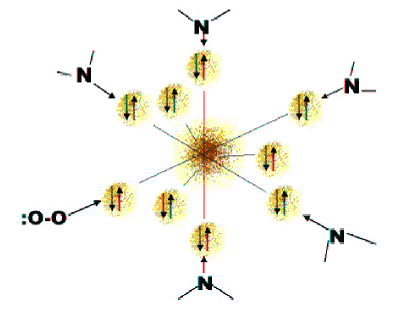
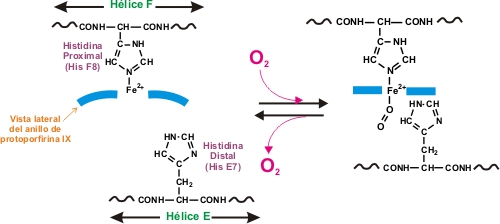
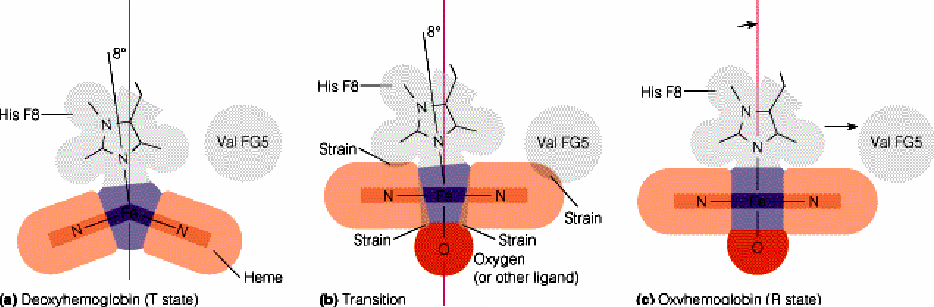
El Fe2+ tiene como configuración electrónica en la capa de valencia 3d6, por lo que dispone de seis orbitales libres. El átomo de hierro del hemo está ligado a los cuatro nitrógenos en el centro del anillo de la porfirina. El hierro puede formar otros dos enlaces, uno a cada lado del plano del hemo. Estos lugares se denominan la quinta y sexta posición de coordinación. La quinta posición se coordina con un grupo de una de las cadenas polipeptídicas, denominado histidina que es el punto de anclaje del grupo hemo a la cadena peptídica, mientras que la sexta posición es ocupada por el oxígeno. Todos estos ligados dotan al grupo hemo de una estructura octaédrica.
Cerca de este enlace de unión al oxígeno hay otro resto de histidina de la cadena peptídica, que no forma enlace ni con el grupo hemo ni con el oxígeno, que por su proximidad genera un entorno molecular que hace que la unión del oxígeno con el hierro sea una unión más débil y no permanente, que se puede formar y romper, para ceder el oxigeno a las células. El átomo de hierro del hemo puede estar en estado de oxidación ferroso (+2) o férrico (+3) pero solamente la hemoglobina con hierro (+2) puede captar oxígeno. La unión del O2 a una subunidad de hemoglobina, induce cambios conformacionales que se transmiten a otras subunidades, incrementando su afinidad por el O2. Por lo tanto, se dice que la unión del oxígeno a la hemoglobina es cooperativa.
La cristalografía de rayos-X reveló que la oxihemoglobina (que tiene cuatro moléculas de O2 enlazadas), difiere de manera importante en su estructura cuaternaria de la deoxihemoglobina (que no tiene O2 enlazado). En ausencia de O2, el Fe2+ se encuentra en un lado del anillo de porfirina, que se encuentra ligeramente curveado. Cuando una molécula de O2 se une al grupo prostético hemo, tira del Fe2+ hacia el plano del anillo de porfirina, haciendo que se vuelva plano en el proceso. El movimiento del Fe2+ causa que la histidina proximal se mueva también. Esto provoca un cambio en la posición de la hélice F, de esta manera, un movimiento en el centro de una subunidad se transmite a la superficie, donde causa la ruptura de las interacciones iónicas que mantienen unidas a las cuatro subunidades causando una reordenación y alterando la estructura cuaternaria, lo que tiene como consecuencia un incremento de afinidad de las subunidades restantes por el O2.
El efecto Bohr
Una alta concentración de H+ y de CO2 en los tejidos, favorece la liberación de O2 por la hemoglobina; este fenómeno se denomina efecto Bohr y sucede debido a que en la deoxihemoglobina existen sitios de unión más afines para protones que en la oxihemoglobina y a que el CO2 se une a los grupos amino primarios de las cadenas polipeptídicas para formar carbamatos cargados negativamente, que favorecen la conformación de deoxihemoglobina. En los pulmones, donde la concentración de O2 es relativamente alta y la de CO2 y H+ es baja, este proceso se revierte y la hemoglobina puede enlazar nuevamente al O2.
Descargar
| Enviado por: | SiLvA |
| Idioma: | castellano |
| País: | España |
