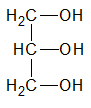Química
Funciones orgánicas
TRABAJO PRÁCTICO DE QUIMICA ORGÁNICA
“FUNCIONES ORGÁNICAS”
3º Polimodal Ciencias Naturales
Índice
Alcoholes --------------------------------------------------------------------------------------- 3
Aldehídos y Cetonas ------------------------------------------------------------------------- 11
Éteres ------------------------------------------------------------------------------------------- 32
Ácidos Carboxílicos ------------------------------------------------------------------------- 43
Derivados de Ácidos Carboxílicos -------------------------------------------------------- 58
Aminas ----------------------------------------------------------------------------------------- 77
ALCOHOLES
Los alcoholes son el grupo de compuestos químicos que resultan de la sustitución de uno o varios átomos de hidrógeno (H) por grupos hidroxilo (-OH) en los hidrocarburos saturados o no saturados.
Alcoholes primarios, secundarios y terciarios
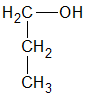
Un alcohol es primario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) primario:
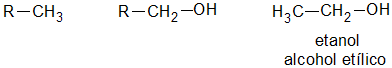
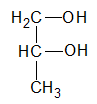
es secundario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) secundario:
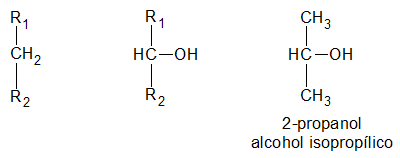
y finalmente, es terciario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) terciario:
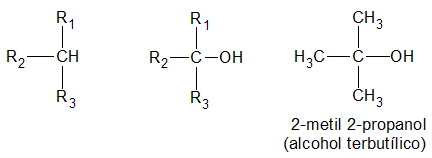
La función alcohol puede repetirse en la misma molécula, resultando monoles, o alcoholes monovalentes; dioles, o alcoholes bivalentes; trioles, o alcoholes trivalentes, etc.
| Fórmula | Nombre | Clasificación |
|
| 1-propanol | monol |
|
| 1,2-propanodiol | diol |
|
| 1,2,3-propanotriol | triol |
Ensayos de solubilidad
Técnica. Se añaden 10 ml de alcohol etílico de 95 % a 10 ml de agua contenidos en un tubo de ensayos. Se satura la solución con carbonato de potasio y se observa el resultado. Des pues se determina, aproximadamente, la cantidad en peso de alcohol n-butílico, alcohol sec-butílico y alcohol ter-butílico que pueden disolverse en 5 ml de agua, anotándose todas las observaciones y resultados.
Observaciones
| Alcohol | Solubilidad en agua |
| METANOL | EN TODAS PROPORCIONES |
| ETANOL | EN TODAS PROPORCIONES |
| BUTANOL | 8,3 % |
| OCTANOL | PRACTICAMENTE INSOLUBLE |
| Alcohol | Solubilidad en agua |
| n-butílico | 9,1 % |
| t-butílico | miscible |
| iso-butílico | 10,0 % |
| Alcohol | Solubilidad en agua |
| Etanol + carbonato de sodio | Insoluble |
Interpretación
Los alcoholes de pocos átomos de carbono son solubles en todas las proporciones. La solubilidad del alcohol reside en el grupo -OH incorporado a la molécula del alcano respectivo.
Las uniones puente de hidrógeno también se manifiestan entre las moléculas de agua y el alcohol
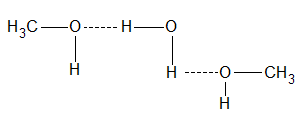
ASOCIACIÓN DE METANOL CON AGUA
Esta asociación explica la solubilidad del alcohol metílico y etílico con el agua: forman semicombinaciones.
La solubilidad de los alcoholes disminuye con el aumento del número de átomos de carbono, pues el grupo hidroxilo constituye una parte cada vez más pequeña de la molécula y el parecido con el agua disminuye a la par que aumenta la semejanza con el hidrocarburo respectivo.
A partir del exanol (incluido) son prácticamente insolubles. Los miembros superiores de la serie son solamente solubles en solventes polares.
Se puede explicar de una manera similar la causa de insolubilidad en presencia de carbonato: la posibilidad de formar uniones puente de hidrógeno disminuye y con ello la solubilidad. El carbonato impide que se efectivicen estas fuerzas de unión.
Se pueden disolver cantidades apreciables de compuestos iónicos como el cloruro de sodio con alcoholes inferiores. Se dice que el grupo hidroxilo es hidrofílico, lo cual signifixa amigo del agua, debido a su afinidad por esta y otras sustancias polares.
Al grupo alquilo del alcohol se le llama hidrofóbico, lo cual significa que odia el agua porque funciona como un alcano: rompe la red de atracciones dipolo-dipolo y los puentes de hidrógeno de un solvente polar como el agua. El grupo alquilo hace que el alcohol sea menos hidrofílico, pero confiere solubilidad en solventes orgánicos no polares. Muchos alcoholes son miscibles con una gran variedad de solventes no polares.
Un grupo alquilo de cuatro carbonos es lo suficientemente grande para que algunos de sus isómeros no sean solubles en agua, aunque, el alcohol t-butílico, con su forma esférica compacta, es miscible.
PROPIEDADES QUIMICAS DE LOS ALCOHOLES.
Reacciones del -H de hidroxilo por ruptura del enlace.
Técnica. Un trocito de sodio del tamaño de un guisante se echa sobre 5 ml de alcohol etílico puesto en un tubo de ensayos. Cuando la reacción se ha completado, se añade un volumen igual de éter anhidro y se observa el resultado. A continuación se vierte la mezcla en un vidrio de reloj y se deja evaporar el éter y el exceso de alcohol etílico. Se observa el carácter del residuo y se añaden 3 ml de agua. La solución resultante se ensaya con papel de tornasol y se observa el color.
Interpretación
Formación de alcoholatos.
Reaccionan con los metales alcalinos como como el Li, Na, K ... y aún con los alcalino-térreos como el Ca. El hidrógeno del hidroxilo es reemplazado por el metal desprendiéndose en estado gaseoso.
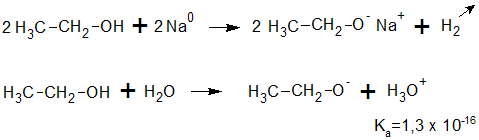
La sustancia que se forma es un alcóxido o alcoholato que en este caso se denomina etanolato o etóxido de sodio.
EL ALCOHOL EN ESTAS REACCIONES ACTÚA COMO UN ÁCIDO DÉBIL.
Como los alcanos no reaccionan con los metales alcalinos, debe admitirse que el átomo reemplazado es el de hidrógeno unido al hidroxilo, lo que prueba la polarización de la molécula de los alcoholes.
La reacción de los alcoholes con los metales alcalinos es menos enérgica que la de éstos con el agua.
La acidez de los alcoholes varía ampliamente, desde los alcoholes que son casi tan ácidos como el agua. hasta algunos que son mucho menos ácidos. La constante de disociación ácida, Ka, de un alcohol, queda definida por el equilibrio siguiente:
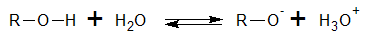
Los alcoholes más ácidos, como el etanol y el metanol, reaccionan rápidamente con sodio para formar metóxido y etóxido de sodio. Los alcoholes secundarios, como el 2-butanol, reaccionan con velocidad más moderada. Los alcoholes terciarios, como el alcohol t-butílico, reaccionan lentamente. Con los alcoholes terciarios con frecuencia se usa el potasio, K, porque es más reactivo que el sodio y la reacción puede completarse en un tiempo razonable.

Reacciones por sustitución del grupo hidroxilo. Formación de ésteres inorgánicos.
CUANDO SE EFECTÚA LA REACCIÓN ENTRE UN ALCOHOL Y UN ÁCIDO INORGÁNICO SE PRODUCE UN ÉSTER INORGÁNICO.
En estos casos el agua se forma entre el -OH del alcohol y el protón del ácido

Otro ejemplo es la reacción del ácido clorhídrico con alcoholes secundarios y terciarios. El alcohol ter-butílico reacciona para dar un 98 % de cloruro de ter-butilo.
Ensayo del TEST DE LUCAS.
Reactivo. El reactivo formado por HCl y ZnCl2 se llama reactivo de Lucas. Los alcoholes secundarios y terciarios reaccionan generalmente con el reactivo de Lucas por un mecanismo SN1.Preparación. Disolver 68 g (0,5 ml) de cloruro de zinc anhidro en 52,5 g de ácido clorhídrico concentrado, enfriando para evitar pérdidas del ácido. Técnica. Colocar 1 ml del alcohol en un tubo de ensayos y agregar 6 ml de reactivo de Lucas. Tapar y dejar reposar durante 5 minutos.
Prueba de Lucas. El reactivo de Lucas reacciona con los alcoholes primarios, secundarios y terciarios con velocidades bastante predecibles, y dichas velocidades se pueden emplear para distinguir entre los tres tipos de alcoholes. Cuando se agrega el reactivo al alcohol, la mezcla forma una fase homogénea. La solución concentrada de ácido clorhídrico es muy polar, y el complejo polar alcohol-zinc se disuelve. Una vez que ha reaccionado el alcohol para formar el halogenuro de alquilo, el halogenuro no polar se separa en una segunda fase.
La prueba de Lucas implica la adición del reactivo de Lucas a un alcohol desconocido para observar si se separa de la mezcla de reacción una segunda fase. Los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables. Los alcoholes secundarios tardan más tiempo, entre 5 y 20 minutos, porque los carbocationes terciarios son menos estables que los terciarios. Los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ión cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
Oxidación de los alcoholes.
a) Con permanganato a distintos valores de pH. Se han desarrollado muchos métodos para la oxidación de alcoholes. Por ejemplo, con frecuencia se emplea el permanganato de potasio como alternativa más económica en comparación con los oxidantes de cromo. El permanganato oxida a los alcoholes secundarios llegando a la cetona, los alcoholes primarios a ácidos carboxílicos. Las oxidaciones con permanganato se deben controlar con cuidado, porque de otra manera el oxidante fuerte romperá los enlaces carbono¾carbono.


b) Comparación entre los alcoholes primarios, secundarios y terciarios. Los alcoholes secundarios se oxidan fácilmente para dar rendimientos excelentes de cetonas. El reactivo ácido crómico constituye el procedimiento más eficiente para oxidar alcoholes secundarios en el laboratorio. El ácido crómico se prepara disolviendo dicromato de sodio en una mezcla de ácido sulfúrico y agua. La especie activa en la mezcla probablemente sea el ácido crómico, o bien el ión cromato ácido. se lograría el mismo resultado con trióxido de cromo en solución diluída de ácido sulfúrico.
El mecanismo de oxidación del ácido crómico implica probablemente la formación de un éster cromato. La eliminación de este éster produce la cetona. En la eliminación el carbono del carbinol retiene su átomo de oxígeno pero pierde su hidrógeno y gana el segundo enlace al oxígeno.
El cromo (IV) que se forma sigue reaccionando para dar la forma reducida estable, Cr(III)
La oxidación de un alcohol secundario origina una cetona y la semejante de un primario origina un aldehído. Éste se oxida fácilmente para dar un ácido carboxílico.
Por lo general es difícil obtener un aldehído, porque la mayor parte de los agentes oxidantes que pueden oxidar el alcohol primario, también oxidan al aldehído.
El reactivo de Jones, que es una solución diluida de ácido crómico en acetona, es más suave que el reactivo normal de ácido crómico. Oxida algunos alcoholes primarios a aldehídos con rendimientos aceptables. Otros reactivos que se pueden utilizar son el reactivo de Collins y el de Clorocromato de piridinio.
Los alcoholes terciarios son difícilmente oxidables, necesitándose de condiciones drásticas. La prueba del ácido crómico con un alcohol terciario no vira el color anaranjado del reactivo.
Color. Cuando la prueba del ácido crómico se efectúa con un alcohol primario o secundario, el color anaranjado cambia a verde o azul.
| Para oxidar | a | reactivo que usa |
| alcohol 2° | cetona | ácido crómico o reactivo de Jones |
| alcohol 1° | aldehído | reactivo de Jones o clorocromato |
| alcohol 1° | ácido | ácido crómico |
Ensayos de la presencia de agua en el alcohol.
Con sulfato de cobre anhidro. Técnica. A cinco mililitros del alcohol, puestos en un tubo de ensayos, se añaden aproximadamente 0.5 gr. de sulfato y se agita enérgicamente. Se repite el ensayo con alcohol absoluto.
Observación e interpretación. El sulfato de cobre anhidro al ponerse en contacto con el agua presente en el alcohol se hidrata y toma el color azul característico del sulfato de cobre hidratado. El producto anterior no presentaba un color característico.
Con carburo cálcico. Técnica. Un trocito de carburo cálcico del tamaño de medio guisante se calienta suavemente en la llama de un mechero Bunsen para eliminar cualquier traza de humedad. Inmediatamente después se hecha en un tubo de ensayos que contiene 5 ml. de alcohol absoluto. Se repite el ensayo utilizando 5 ml. de alcohol al 95 %.
Observación e interpretación. Al agregar el carburo cálcico en el alcohol al 95 % (que contiene agua) reacciona liberando acetileno. En cambio, con el alcohol absoluto (que carece de agua), no se observa reacción alguna.
Ensayo de diferenciación de los alcoholes etílico y metílico.
Ensayo del acetato. Técnica. Se añade 1 ml. de ácido sulfúrico concentrado a una mezcla de alcohol etílico absoluto y 1 ml. de ácido acético glacial en un tubo de ensayos. La mezcla, se calienta suavemente (sin llegar a ebullición) y después se enfría por debajo de los veinte grados centígrados y se añaden 5 ml. de una solución de sal común fría. Obsérvese el olor característico del éster formado: acetato de etilo.
La experiencia se repite con alcohol etílico puro y se observa el olor del acetato de metilo. Si se tiene interés se puede repetir el ensayo con alcohol amílico.
Observación. Se obtuvo un líquido translúcido de olor característico.
Ensayo del salicilato. Técnica. A una mezcla de 1 ml. de alcohol metílico puro y unos 0.25 gr. de ácido salicílico se añade 1 ml. de ácido sulfúrico concentrado. Se calienta suavemente durante unos minutos, después se enfría y se hecha la mezcla sobre 10 ml. de agua fría contenidos en un pequeño vaso de precipitados. Obsérvese el olor del salicilato de metilo.
Observación. Se obtuvo un precipitado blanco gelatinoso de olor a ungüento, agradable.
Alcohol sólido. Técnica. 45 ml. de alcohol del 96 % se mezclan con 5 ml. de una solución acuosa saturada de acetato de calcio echando las dos soluciones simultáneamente en un vaso de precipitados pequeño. La mezcla se deja en reposo hasta que gelifica, observando su naturaleza. Después se coloca una pequeña cantidad en una cápsula de hierro y se quema. Esta sustancia es una forma de alcohol sólido.
Observaciones. Se obtuvo un sólido gelatinoso blanco.
Ensayo del borato de metilo. Preparación del reactivo. Colocar en un tubo de ensayos tres puntas de espátula de ácido bórico y 3 ml. de alcohol metílico hasta cubrir. Disolver, agregar 2 ml. de ácido sulfúrico, agitar, y calentar suavemente. Acercar una llama a la boca del tubo.
Observación e interpretación. Al acercar la llama al tubo se observa una llama de color verde, persistente y voluminosa.
Reacciones del alcohol isopropílico.
Reacción del iodoformo. En un tubo de ensayos se coloca 1 ml. de alcohol a ensayar, 2-3 ml. de agua y 4-5 ml. de solución iodo iodurada. Luego se añade solución de hidróxido de sodio 10-20 %. Gota a gota hasta que desaparece el color del iodo y queda amarillo. A veces precipita enseguida. Si no lo hace calentar a baño María a 60°C durante dos minutos y dejar enfriar. Filtrar, secar y determinar el punto de fusión.
Observaciones. Se observa la aparición de un precipitado blanco amarillento, de fórmula CHI3.
ALDEHÍDOS Y CETONAS
Los aldehídos y cetonas se encuentran entre los compuestos de mayor importancia, tanto en bioquímica como en la industria química. En el laboratorio, los aldehídos normalmente se elaboran por ruptura oxidativa de alquenos, por oxidación de alcoholes primarios o por reducción parcial de cloruros de ácidos o ésteres. Las cetonas se producen de manera similar por ruptura oxidativa de alquenos, por oxidación de alcoholes secundarios, o por adición de diorganocupratos a cloruros de ácido.
La reacción de adición nucleofílica es la reacción más importante de los aldehídos y las cetonas, siendo posible elaborar una gran cantidad de productos por adición nucleofílica. Las reacciones son aplicables a cetonas y aldehídos, pero en general estos últimos son más reactivos por razones tanto estéricas como electrónicas.
En el presente capítulo abordaremos la forma de obtención de cetonas y aldehídos y a continuación las reacciones más significativas de ellos, mostrándose en forma de resumen.
ALDEHÍDOS Y CETONAS:
Los aldehídos y cetonas se encuentran entre los compuestos de más importancia tanto en la naturaleza como en la industria química. En la naturaleza, muchas de las sustancias necesarias para los sistemas vivos son aldehídos y cetonas. En la industria química se sintetizan grandes cantidades de tales compuestos, que se usan como solventes o como materias primas para una multitud de otros productos.
Propiedades de Aldehídos y Cetonas.-
El doble enlace carbono-oxígeno de los grupos carbonilos es similar en muchos aspectos al doble enlace carbono-carbono de los alquenos. El átomo de carbono carbonílico tiene hibridación sp2 y tres enlaces sigma. El cuarto electrón de valencia permanece en un orbital p del carbono, y por superposición con un orbital p del oxígeno forma con él un enlace pi. El átomo de oxígeno tiene otros dos pares de electrones no compartidos, que ocupan los dos orbitales restantes.
|
|
|
|
|
Como los alquenos, los compuestos carbonílicos son planares respecto al doble enlace, y tienen ángulos de enlace de 120º aproximadamente. Como podría esperarse, el doble enlace carbono-oxígeno es más corto (1.22 Aº contra 1.43 Aº) y más fuerte (175 kJ/mol contra 92 kJ/mol) que un enlace sencillo carbono-oxígeno. Los dobles enlaces carbono-oxígeno se encuentran polarizados debido a la elevada electronegatividad del oxígeno respecto a la del carbono.
La consecuencia más importante de la polarización del grupo carbonilo es la reactividad química del doble enlace carbono-oxígeno. En vista de que el carbono carbonílico tiene carga parcial positiva, éste es un sitio electrófilo y es atacado por nucleófilos. A la inversa, el oxígeno carboxílico tiene carga parcial negativa y es un sitio nucleófilo (básico).
|
| Oxígeno nucleófilo; reacciona con ácidos y electrófilos
Carbono electrófilo; reacciona con bases y nucleófilos |
Otra consecuencia de la polaridad del enlace carbonílico es que las moléculas de aldehídos y cetonas se asocian débilmente, lo cual hace que tengan puntos de ebullición mayores que los alcanos con peso molecular semejante. Sin embargo, debido a que no pueden formar puentes de hidrógeno, los aldehídos y las cetonas tienen puntos de ebullición menores que los alcoholes correspondientes. El formaldehído, el aldehído más simple, es gaseoso a temperatura ambiente, pero todos los otros aldehídos y cetonas son líquidos.
Elaboración de Aldehídos y Cetonas.-
Uno de los mejores métodos para la síntesis de aldehídos es la oxidación de alcoholes primarios y ruptura oxidativa de alquenos. Para la síntesis de cetonas los métodos son análogos a los de aldehídos (véase capítulo de alcoholes y alquenos), en todo caso los resumimos en forma de tabla:
|
SÍNTESIS DE ALDEHÍDOS Y CETONAS |
EJEMPLOS
|
|
1.- Formación de aldehídos |
|
| (a).- Oxidación de alcoholes primarios
|
|
| (b).- Ozonólisis de alquenos
|
|
| (c).- Reducción parcial de ésteres
|
|
|
2.- Formación de cetonas |
|
| (a).- Oxidación de alcoholes secundarios
|
|
| (b).- Ozonólisis de alquenos
|
|
| (c).- Acilación de Friedel-Crafts
|
|
| (d).- Hidratación de alquinos
|
|
| (e).- Reacción de diorganocupratos con cloruros de ácidos
|
|
Oxidación de Aldehídos y Cetonas.-
Los aldehídos son rápidamente oxidados para producir ácidos carboxílicos, pero las cetonas no son reactivas hacia la oxidación excepto en condiciones muy vigorosas. Esta diferencia de comportamiento es consecuencia de las diferencias estructurales entre los dos grupos funcionales: Los aldehídos tienen un protón -CHO que puede ser extraído con facilidad durante la oxidación, pero no así las cetonas.
Muchos agentes oxidantes convierten aldehídos en ácidos carboxílicos, entre ellos el ácido nítrico caliente y el permanganato de potasio, pero el reactivo de Jones, CrO3 en ácido sulfúrico acuoso, es una elección más común a la pequeña escala del laboratorio. Las oxidaciones de Jones ocurren con rapidez a temperatura ambiente y tienen buenos rendimientos de productos.

Heptanal Ácido heptanoico (85%)
Un inconveniente de la oxidación de Jones es que las condiciones en que se realiza son ácidas, y las moléculas sensibles pueden experimentar descomposición catalizada por ácido. Cuando existe esta posibilidad de descomposición, con frecuencia las oxidaciones de aldehídos se realizan usando una solución diluida de óxido de plata, Ag2O, en amoniaco acuoso (reactivo de Tollens[1]).

Benzaldehído Ácido benzoico
Las cetonas son inertes a la mayoría de los agentes oxidantes comunes, pero experimentan con lentitud una reacción de ruptura cuando se tratan con KMnO4 alcalino caliente. El enlace carbono-carbono próximo al grupo carbonilo se rompe, y se producen fragmentos de ácidos carboxílicos. La reacción sólo es útil para cetonas simétricas como ciclohexanona, puesto que apartir de cetonas no simétricas se forman mezclas de productos.

Ciclohexanona Ácido hexanodioico (79%)
Reacciones de Adición Nucleofílica de Aldehídos y Cetonas.-
La reacción más importante de aldehídos y cetonas es la reacción de adición nucleofílica. Un nucleófilo ataca al átomo de carbono del grupo carbonilo, electrófilo, en una dirección aproximadamente perpendicular al plano de los orbitales sp2 del carbonilo. El carbono carbonílico experimenta una hibridación de sp2 a sp3, y se produce un ion alcóxido intermediario con configuración geométrica tetraédrica. El nucleófilo atacante puede tener carga negativa (Nu:-) o ser neutro (:Nu-H). Sin embargo, en este último caso suele tener un átomo de hidrógeno que puede ser eliminado posteriormente.
|
| HO- | ion hidróxido |
|
| H- | ion hidruro |
| algunos nucleófilos con carga negativa | R3C- | un carbanión |
|
| RO- | un ion alcóxido |
|
| NC- | ion cianuro
|
|
Algunos nucleófilos neutros | H2O ROH H3N RNH2 | agua un alcohol amoniaco una amina |
La adición nucleofílica a cetonas y aldehídos suele tener dos variantes. (1) El intermedio tetraédrico puede ser protonado para formar un alcohol, o (2) el átomo de oxígeno del carbonilo puede eliminarse (como HO- o como H2O) para formar un nuevo doble enlace carbono-nucleófilo.

(1) (2)
Dos posibles vías de reacción posterior a la adición de un nucleófilo a una cetona o un aldehído
Las principales se ilustran a continuación en la roseta:

Algunas reacciones de adición nucleófilica de cetonas y aldehídos
Reactividad Relativa de Aldehídos y Cetonas.-
Los aldehídos son en general más reactivos que las cetonas hacia la sustitución nucleofílica por razones tanto estéricas como electrónicas. Por razones estéricas, porque la presencia de dos sustituyentes relativamente grandes en las cetonas, contra un solo sustituyente grande en los aldehídos, hace que los neutrófilos atacantes puedan aproximarse con mayor facilidad a los aldehídos. Electrónicamente, el mayor grado de polaridad del grupo carbonilo de los aldehídos los hace más reactivos que las cetonas.
|
RESUMEN DE REACCIONES DE ADICIÓN NUCLEOFÍLICA
| |
| REACCIONES | EJEMPLOS |
| 1.- Adición de hidruro: Reducción
|
|
| 2.- Adición de reactivo de Grignard
|
|
| 3.- Adición de HCN: Cianohidrinas
|
|
| 4.- Adición de aminas primarias: Iminas
Iminas Por ejemplo: (a) Con hidroxilamina : NH2-OH se obtiene ; Oximas, R2C=NOH
(b) Con hidrazina, NH2-NHCONH2 se obtiene; semicarbazonas, R2C=N-NHCONH2
(c) 2,4-dinitrofenilhidrazina, NH2NH-C6H4(NO2)2 se obtiene la 2,4-dinitrofenilhidrazonas, R2C=NNH-C6H4(NO2)2
|
Butanona Imina de Butanona
Ciclohexanona Oxima de Ciclohexanona
|
|
Enaminas
|
|
| 6.- Reacción de Wolff-Kishner
|
|
| 7.- Adición de alcoholes: Acetales
|
|
| 8.- Adición de tioles: Tioacetales
|
|
| 9.- Desulfuración de tioacetales con niquel Raney
|
|
| 10.- Adición de iluros de fósforo: Reacción de Wittig
|
|
Adición Nucleofílica de H2O: Hidratación
Los aldehídos y cetonas reaccionan con agua para producir 1,1-dioles o dioles geminales (llamados comúnmente gem-dioles). La reacción de hidratación es reversible; los gem-dioles pueden eliminar agua para regenerar cetonas o aldehídos. La posición exacta del equilibrio entre gem-dioles y cetonas o aldehídos depende de la estructura del compuesto carbonílico. Aunque en la mayoría de los casos el equilibrio favorece fuertemente al compuesto carbonílico.
La adición nucleofílica de agua a cetonas y aldehídos es un proceso lento en agua pura, pero se cataliza tanto con ácido como con base. Si bien como en todas las reacciones catalizadas en ácido o en base no cambian la posición del equilibrio, influyen fuertemente en la velocidad de la reacción de hidratación.
|
El ion hidróxido como nucleófilo se une al grupo carbonilo de la cetona o del aldehído para producir un ion alcóxido como intermediario.
El ion alcóxido (básico) como intermediario extrae un protón (H+) del agua para formar un gem-diol como producto y regenerar el ion hidróxido que catalizó la reacción. |
|
El catalizador ácido protona al átomo del carbonilo, básico, haciendo de la cetona o aldehído un mucho mejor aceptor de nucleófilo.
La adición nucleofílica de agua, neutra, produce un gem-diol protonado.
La pérdida del protón regenera el catalizador ácido y forma como producto un gem-diol neutro. |
|
| Mecanismo de la hidratación catalizada por Base | Mecanismo de la hidratación catalizada por Ácido |
Adición Nucleofílica de HCN: Cianohidrinas.
Los aldehídos y las cetonas no impedidas reaccionan con HCN para producir cianohidrinas, RCH(OH)CN, por tratamiento con HCN, el benzaldehído forma la cianohidrina llamada mandelonitrilo, con un rendimiento del 88%.

Benzaldehído Mandelonitrilo (88%).
La reacción ocurre muy lentamente con HCN puro, pero es rápida cuando se agrega una cantidad mínima de base o ion cianuro. Es posible entender este resultado recordando que el HCN, es un ácido débil con pKa = 9.1, no se disocia ni es nucleófilo. Sin embargo, el ion cianuro es fuertemente nucleófilo, la adición a cetonas y aldehídos ocurre por la vía típica de adición nucleofílica. La protonación del intermediario tetraédrico aniónico produce la cianohidrina y regenera el ion cianuro:

La formación de cianohidrinas es útil debido a las reacciones posteriores que puede experimentar. Por ejemplo, los nitrilos (RCN) pueden reducirse con LiAlH4 para producir aminas primarias (RCH2NH2), y también hidrolizarse con ácido acuoso para formar ácidos carboxilicos. Por tanto, la formación de cianohidrinas constituye un método para transformar aldehídos o cetonas en otros grupos funcionales al mismo tiempo que alarga la cadena en un átomo de carbono.
|
|
2-Amino-1-feniletanol
Ácido mandélico (90%) |
Adición Nucleofílica de Reactivos de Grignard: Formación de Alcoholes.
La síntesis de alcoholes por reacción de reactivos de Grignard con cetonas y aldehídos es simplemaente una adición nucleofílica. Las adiciones de Grignard suelen ser irreversibles.

Carbonilo Alcohol
Para más detalles véase capítulo de alcoholes (cap. 12) y reactivos organometálicos (cap. 16).
Adición Nucleofílica de Hidruro: Reducción.
La reducción de aldehídos y cetonas para producir alcoholes es otra reacción de adición nucleofílica cuyo mecanismo ha sido estudiado en capítulo 12. para mayor información remítase a dicho tema.
Adición Nucleofílica de Aminas: Formación de Iminas y Enaminas.
Las aminas primarias, RNH2, experimentan adición a los aldehídos y las cetonas para producir iminas, R2C=NR. Las aminas secundarias hacen lo mismo para producir enaminas (-eno + -amina; amina insaturada).

Una imina Una enamina
|
El ataque nucleofílico a una cetona o un aldehído por el par electrónico de una amina forma un intermediario tetraédrico dipolar.
Luego se trnasfiere un protón del nitrógeno al oxígeno, lo que produce una carbinolamina neutra.
El catalizador ácido protona el oxígeno del hidroxilo
el electónico no compartido del nitrógeno libera agua, formando un ion iminio
La pérdida de H+ del nitrógeno genera la imina (en el caso de ser amina) como pruducto final |
| El grupo “G” puede ser:
G = H, (NH2-H) Amoniaco
G = -OH, (NH2-OH) Hidroxilamina
G = -NH2, (NH2-NH2) Hidracina
G = R, (NH2-R) Amina primaria
G = -NHC6H5 (NH2-NHC6H5) Fenilhidracina
G = -NHCONH2 (NH2-NHCONH2) Semicarbazida | El producto final reulta ser:
Imina
Oxima
Hidrazona
Imina
Fenilhidrazona
Semicarbazona
|
Mecanismo de la formación de imina (o derivado) por la reacción de una cetona o un aldehído con compuestos derivados del amoniaco.
Las enaminas se forman cuando una cetona o un aldehído reaccionan con una amina secundaria, R2NH. Hasta la fase del ion iminio, el proceso es idéntico al de formación de iminas, pero en este punto no existe un protón en el nitrógeno que pueda ser perdido para producir un producto neutro. En cambio, se pierde un protón del átomo de carbono alfa y se obtiene una enamina.
|
La adición nucleofílica de una amina secundaria a una cetona o un aldehído, seguida de la transferencia de un protón del nitrógeno al oxígeno, produce una carbinolamina intermediaria en la vía normal.
La protonación del hidroxilo por el catalizador ácido convierte aquél en un mejor grupo saliente.
La eliminación de agua por el par electrónico del nitrógeno genera un ion iminio intermediario.
La pérdida de un protón del átomo de carbono alfa forma la enamina como producto y regenera el catalizador ácido. |
|
Ejemplo:

Ciclohexanona Enamina de la ciclohexanona
Adición Nucleofílica de Hidrazina: Reacción de Wolff - Kishner.
Una variante importante de la formación de iminas anteriormente descritas es el tratamiento de una cetona o aldehído con hidrazina (H2N-NH2), en presencia de KOH. Esta reacción, descubierta independientemente en 1911 por Ludwig Wolff[2] en Alemania y por N. M. Kishner[3] en Rusia, es un método sintético en extremo valioso para la conversión de cetonas o aldehídos en alcanos, R2C=O ® R2CH2.
La reacción de Wolff - Kishner frecuentemente se realiza a 240ºC en dietilenglicol a ebullición como solvente, pero una modificación en la cual se usa dimetilsulfóxido como solvente permite que el proceso ocurra a temperatura cercana a la ambiental.
| La reacción de la cetona o el aldehído con la hidrazina produce una hidrazona en la forma normal.
La base extrae uno de los protones débilmente ácidos del -NH2, produciendo un anión hidrazona. Este anión tiene una forma de resonancia “alílica” que coloca la carga negativa en el carbono y el doble enlace entre los nitrógenos.
La protonación del anión hidrazona se realiza en el carbono y produce un intermediario neutro.
Entonces la pérdida del nitrógeno inducida por la base produce un carbanión, que se protona para formar un alcano neutro como producto.
Ejemplo:
Ciclopropano Metilciclopropano carbaldehído (72%) |
|

Reducción de Clemmensen:
Además de la reacción de Wolff-Kishner, existe un segundo proceso, llamado reducción de Clemmensen[4], que también realiza la conversión de cetonas o aldehídos a los alcanos correspondientes. La reducción de Clemmensen, cuyo mecanismo es complejo y no se comprende del todo, implica el tratamiento del compuesto carbonílico con amalgama de cinc, Zn(Hg) y HCl acuoso concentrado. Esta reacción se usa principalmente cuando la cetona o el aldehído iniciales son sensibles a las condiciones fuertemente básicas que se requieren para la reducción de Wolff-Kisner.

Propiofenona Propilbenceno (86%)
Adición Nucleofílica de Alcoholes: Formación de Acetales.
Cetonas y aldehídos reaccionan en forma reversible con alcoholes en presencia de un catalizador ácido para producir acetales, R2C(OR')2, antiguamente también llamados cetales.

Cetona/aldehído Un Acetal
La adición nucleofílica inicial del alcohol al grupo carbonilo produce un hidroxiéter llamado hemiacetal, análogo al gem-diol formado por la adición de agua. Los hemiacetales se forman de manera reversible, normalmente con el equilibrio en favor del compuesto carbonílico. Sin embargo, en presencia de ácido puede ocurrir una reacción posterior. La protonación del grupo hidroxilo, seguida por la pérdida de agua a través de un mecanismo tipo E1, forma un catión (un ion oxonio, R3O+) que une entonces un segundo equivalente de alcohol para producir el acetal.

Una cetona Un hemiacetal Un acetal
Mecanismo de la formación de un acetal catalizada por ácido mediante la reacción de cetona o aldehído con un alcohol.
|
La protonación del oxígeno carbonílico polariza fuertemente al grupo carbonilo, y..
..activa a éste para el ataque nucleofílico por el par no compartido del oxígeno del alcohol.
La pérdida de un protón produce un hemiacetal neutro como intermediario tetraédrico.
La protonación del hidroxilo del hemiacetal lo convierte en un buen grupo saliente.
La deshidratación produce un ion oxonio como intermediario.
La adición de un segundo equivalente de alcohol origina un acetal protonado.
La pérdida de un protón forma el acetal neutro como producto. |
|
Los acetales son compuestos extremadamente útiles, debido a que pueden actuar como grupos protectores de cetonas y aldehídos. Algunas veces sucede que el grupo funcional interfiere en las reacciones químicas que se intentan en otro lugar de una molécula compleja. Por ejemplo, si se deseara reducir solamente el grupo éster del 4-oxopentanoato de etilo, el grupo ceto interferiría. El tratamiento del cetoéster inicial con LiALH4 reduciría el grupo ceto como el grupo éster, para formar un diol como producto:

4-Oxopentanoato de etilo 5-Hidroxi-2-pentanona
El problema anterior, puede evitarse protegiendo al grupo ceto como un acetal.

El la práctica, es conveniente usar etilenglicol (HOCH2CH2OH) como el alcohol y así formar un acetal cíclico. El mecanismo de formación de un acetal cíclico usando un equivalente de etilenglicol es exactamente el mismo que cuando se usan dos equivalentes de metanol u otro monoalcohol. La única diferencia es que ahora los dos grupos alcohol están en la misma molécula y no en dos moléculas.
Adición Nucleofílica de Tioles: Formación de Tioacetales.
Los tioles, RSH, experimentan adición a aldehídos y cetonas por una ruta reversible catalizada por ácido para producir tioacetales, R'2C(SR)2. Como es de esperar, el mecanismo de formación de un tioacetal es idéntico en todos los aspectos al de formación de un acetal, con la excepción de que se usa un tiol en vez de un alcohol. A menudo se emplea etanoditiol; el tioacetal se forma rápidamente y con alto rendimiento.

3-Metilciclohexanona Un tioacetal (96%)
Los tioacetales son útiles debido a que experimentan desulfuración cuando se tratan con níquel pulverizado de preparación especial llamado níquel Raney[5] (Ni Raney). Dado que la desulfuración extrae azufre de una molécula reemplazándolo por hidrógeno, la formación de un tioacetal seguida de la desulfuración con níquel Raney es un excelente método para la reducción de cetonas o aldehídos a alcanos.
|
Cetona/Aldehído Tioacetal Alcano | Por ejemplo:
|
Adición Nucleofílica de Iluros de Fósforo: Reacción de Wittig.
Cetonas y aldehídos se convierten en alquenos por medio de la reacción de Wittig[6]. En este proceso, un iluro de fósforo, R2C=(C6H5)3, se une a una cetona o un aldehído para producir un intermediario dipolar llamado betaina. La betaína intermadiaria en la reacción de Wittig no se aisla; se descompone para producir un alqueno y óxido de trifenilfosfina. El resultado neto es el reemplazo del oxígeno del carbono por el fragmento orgánico que esencialmente estaba unido al fósforo.
Los iluros de fósforo necesarios para la reacción de Wittig se producen fácilmente por una reacción SN2 de halogenuros de alquilo 1º y algunos 2º (pero no terciarios) con trifenilfosfina, R3P, son excelentes nucleófilos en reacciones SN2, con altos rendimientos de sales cristalinas de tetraorganofosfonio. El protón en el carbono próximo al fósforo con carga positiva es débilmente ácido y puede extraerse con bases como hidruro de sodio o butil-litio (BuLi) para generar el iluro neutro. (reactivo de Wittig), Por ejemplo:

Trifenilfosfina Metilentrifenilfosforano
La reacción de Wittig es extremadamente útil, y a partir de combinaciones apropiadas de fosforanos y cetonas o aldehídos es posible elaborar una gran cantidad de alquenos mono, di- y trisustituídos. Sin embargo, no pueden elaborarse alquenos tetrasustituídos debido presumiblemente al impedimento estérico de la reacción.
Mecanismo de la reacción de Wittig entre una cetona o aldehído y un iluro de fósforo.

Reacción de Cannizzaro:
Cuando un aldehído sin hidrógenos en el carbono adyacente al grupo -CHO (como el benzaldehído) se calienta en presencia de ion hidróxido, ocurre una reacción de dismutación en la cual se producen un equivalente de ácido carboxílico y un equivalente de alcohol. La reacción fue descubierta en 1853 por S. Cannizzaro[7], a lo cual se debe su nombre reacción de Cannizzaro.

Benzaldehído Ácido benzoico Alcohol bencílico
La reacción de Cannizzaro ocurre por adición nucleofílica de ion hidróxido al aldehído para formar un intermediario tetraédrico, que libera ion hidruro como grupo saliente. Un segundo equivalente de aldehído acepte entonces el ion hidruro en otro paso de adición nucleofílica. El resultado neto es que una molécula de aldehído experimenta sustitución acílica de hidruro por hidróxido, de modo que se oxida para convertirse en un ácido, mientras que una segunda molécula de aldehído experimenta una adición de hidruro y, por tanto, se reduce para convertirse en un alcohol.

Intermediario tetraédrico
La reacción de Cannizzaro tiene pocas aplicaciones prácticas y se limita al formaldehído y los benzaldehídos sustituidos.
Reacción de Reformatsky: Preparación de b-hidroxiésteres.
Si se trata un éster a-bromado con cinc metálico en presencia de un aldehído o cetona se obtiene un b-hidroxiéster. Esta reacción, conocida como reacción de Reformastky, es la forma más importante de preparar b-hidroxiácidos y sus derivados.
El a-bromo éster y el cinc reaccionan en éter para generar un compuesto organometálico de cinc, que se adiciona al carbonilo del aldehído o la cetona.

Ejemplos:

Aldehídos y Cetonas con Iluros de azufre como reactivos de transferencia de metilenos:
Los iluros de azufre son nucleófilos y al igual que en la primera etapa de la reacción de Wittig, atacan al carbonilo de aldehído o cetona para dar betaínas azufradas. Sin embargo, a diferencia de las betaínas fosforadas en dichos aductos el sulfuro de dimetilo, que actúa como grupo saliente es desplazado por ataque nucleofílico del ion alcóxido con formación de un oxaciclopropano. De esta forma, el iluro de azufre actúa como agente de transferencia de metileno.

El iluro de azufre se prepara a partir de dimetilsulfuro y yoduro de metilo y posterior tratamiento básico con BuLi en THF, en un proceso análogo al reactivo de Wittig.

Ejemplos:

Ciclohexanona Betaína azufrada (82%)
Oxidación de Baeyer - Villiger.
El carbono carbonílico de los aldehídos y cetonas puede ser atacado por el grupo hidroxilo de un ácido peroxicarboxílico como si éste procediera de un alcohol. El resultado es un análogo de un hemiacetal con un grupo peróxido. Estos productos no son estables y se descomponen a través de un estado de transición de ocho electrones. En el aducto obtenido a partir de un aldehído, es el hidrógeno el que migra para dar dos ácidos carboxílicos. Uno se forma por oxidación del aldehído, siendo el otro el correspondiente al ácido peroxicarboxílico original. En el aducto obtenido a partir de las cetonas, un grupo alquilo migra de manera análoga para dar un éster. Esta transformación de denomina oxidación de Baeyer-Villiger[8].

Ejemplos:
|
Ciclohexanona e-lactona (90%) |
Butanona Acetato de etilo (72%) |
|
Butanal Ácido butanoico |
|
Con cetonas asimétricas es en principio posible obtener dos ésteres diferentes. A partir de una serie de experimentos se ha establecido una lista de “aptitudes migratorias”, la cual indica la facilidad relativa de migración de varios sustituyentes. Este orden depende de la estabilidad del carbocatión en el carbono que migra.
Aptitudes migratorias en la reacción de Baeyer-Villiger
H > terciario > ciclohexilo > secundario ~ fenilo > primario > metilo
ÉTERES
Un éter es una sustancia que tiene dos residuos orgánicos unidos al mismo átomo de oxígeno, R-O-R'. Los residuos orgánicos pueden ser alquílicos, arílicos o vinílicos, y el átomo de oxígeno puede formar parte ya sea de una cadena abierta o de un anillo. Tal vez el éter mejor conocido es el éter dietílico, una sustancia familiar que se ha usado en medicina como anestésico y se emplea mucho en la industria como disolvente.
En el laboratorio, los éteres normalmente se elaboran por Síntesis de Williamson o por una secuencia de alcoximercuración-desmercuración. Los éteres son inertes a la mayoría de los reactivos comunes, pero son atacados por ácidos fuertes para formar los productos de ruptura. Los epóxidos son éteres cíclicos con anillos de tres miembros que contienen oxígeno, difieren de los otros éteres cíclicos en su facilidad de ruptura.
Los sulfuros, R-S-R', son análogos azufrados de los éteres. Se producen por una reacción SN2 de tipo Williamson entre un anión tiolato y un halogenuro de alquilo primario o secundario.
ÉTERES.
Los éteres pueden considerarse derivados orgánicos del agua, en los cuales los átomos de hidrógeno han sido reemplazados por fragmentos orgánicos; es decir, H-O-H por R-O-R'. De este modo, los éteres tienen casi la misma configuración geométrica que el agua. Los enlaces R-O-R` tienen ángulos de enlace aproximadamente tetraédrico (112º en el éter dimetilíco), y el átomo de oxígeno tiene hibridación sp3.

Hibridación sp3
La presencia del átomo de oxígeno, electronegativo, hace que los éteres tengan un ligero momento dipolar y, por tanto, sus puntos de ebullición son un poco más altos que los alcanos correspondientes. En la Tabla 13.1 se comparan los puntos de ebullición de algunos éteres comunes con los de los hidrocarburos correspondientes en los que el átomo de oxígeno se ha sustituido por un -CH2-.
TABLA 13.1
Comparación de los puntos de ebullición de éteres e hidrocarburos.
| Éter | [Hidrocarburo] | Punto de ebullición (ºC) |
|
|
|
|
Las reacciones de los éteres serán presentadas en forma de tabla, y al final de la presentación se realizara un comentario de las más significativas.
RESUMEN DE LAS REACCIONES DE LOS ÉTERES.
| 1.- Formación de éteres.
(a) Síntesis de Williamson.
El halogenuro de alquilo debe ser primario
| Recuérdese que los alcóxidos se preparan desde los alcoholes por tratamiento básico y/o métales alcalinos.
|
| (b) Alcoximercuración-desmercuración.
Se observa orientación Markovnikov. (Adición Sin)
|
|
| (c) Epoxidación de alquenos con peroxiácidos.
|
|
| 2.- Reacciones de los éteres.
(a) Ruptura con HX.
Donde HX = HBr o HI
|
|
| (b) Apertura de anillos de epóxidos catalizada por base.
La reacción ocurre en el sitio de menor impedimento estérico (Adición Anti).
|
|
|
La reacción ocurre en el sitio de menor impedimento estérico (Adición Anti).
|
|
| (c) Hidrólisis de epóxidos catalizada por ácido.
La reacción ocurre en el sitio más impedido; se producen 1,2-dioles trans a partir de epóxidos cíclicos.
|
|
| (d) Apertura de anillos de epóxido inducida por ácido.
La reacción ocurre en el sitio más impedido (Adición Anti).
|
|
| 3.- Formación de sulfuros.
|
|
| 4.- Reacción de oxidación de sulfuros.
(a) Formación de sulfóxidos.
|
|
| (b) Formación de sulfonas.
|
|
Síntesis de Éteres de Williamson.
Los alcóxidos metálicos reaccionan con los halogenuros de alquilo primarios y con los tosilatos a través de una ruta SN2 para producir éteres, un proceso conocido como síntesis de éteres de Williamson[1] . Aunque se descubrió en 1850, la síntesis de Williamson es todavía el mejor método para elaborar éteres, tanto simétricos como asimétricos.

Ciclopentóxido de potasio Yodometano Éter ciclopentil metil (74%)
Los iones alcóxido necesarios de la síntesis de Williamson normalmente se obtienen de la reacción de un alcohol con una base fuerte como el hidruro de sodio, NaH. Una reacción ácido-base entre el alcohol y el hidruro de sodio genera la sal de sodio del alcohol:
ROH + NaH ® RO-Na+ + H2
Alcóxido
Otra forma de obtenerlos es empleando metales alcalinos:
ROH + Metal Alcalino (Na, K) ® RO-Na+ + H2
Alcóxido
Alcoximercuración - Desmercuración de Alquenos.
Una reacción de Alcoximercuración ocurre cuando se trata un alqueno con un alcohol en presencia de acetato de mercurio. (El trifluoroacetato de mercurio, Hg(OOCCH3)2, funciona aún mejor). La posterior desmercuración es inducida con borohidruro de sodio, produciendo un éter. Como lo muestran los siguientes ejemplos, el resultado neto es la adición Markovnikov del alcohol al alqueno:

Estireno 1-Metoxi-1-feniletano (97%).


Ciclohexeno Éter ciclohexil etílico (100%).
El mecanismo de la reacción de alcoximercuración-desmercuración se inicia con una adición electrofílica del ion mercúrico al alqueno, seguida de la reacción del catión intermedio con el alqueno. El desplazamiento de mercurio con el borohidruro de sodio completa el proceso.
Mecanismo:

Estireno ion mercúrico intermedio

1-Metoxi-1-feniletano
Es posible emplear una amplia variedad de alcoholes y de alquenos en la reacción de oximercuración.
Reacciones de los Éteres: Ruptura Ácida.
Los éteres son en su mayoría inertes a la totalidad de los reactivos utilizados en química orgánica, una propiedad que explica su amplio uso como disolventes inertes. Halógenos, ácidos suaves, bases y nucleófilos carecen de efecto sobre la mayoría de los éteres. De hecho, los éteres experimentan sólo una reacción de uso general: se rompen con ácidos fuertes. El HI acuoso es aún el reactivo preferido para la ruptura de éteres simples, aunque también puede usarse HBr.
Ejemplos:
|
Ácido 2-etoxipropanoico |
Éter etil isopropílico |
|
Éter etil fenilíco |
Éter terc-butil ciclohexílico |
Las rupturas ácidas de éteres son reacciones de sustitución nucleofílica típicas que transcurren por una ruta SN1 o por una ruta SN2, dependiendo de la estructura del éter. Los éteres alquílicos primarios y secundarios reaccionan por una ruta SN2 en la cual el ion yoduro o bromuro ataca al éter protonado en el sitio menos sustituido. Los éteres terciarios, bencílicos y alílicos tienden a romperse a través de un mecanismo SN1.

Éteres Cíclicos: Epóxidos.
En gran medida, los éteres cíclicos se comportan como los éteres acíclicos. La química de un grupo funcional éter es la misma, tanto si dicho grupo está en una cadena abierta como si se encuentra en un anillo. Por ejemplo, los éteres cíclicos comunes como el tetrahidrofurano y el dioxano a menudo se usan como disolventes debido a que son inertes, aunque pueden romperse con ácidos fuertes.
El único grupo de éteres cíclicos que se comportan de manera diferente de como lo hacen los éteres de cadena abierta es el formado por los anillos de tres miembros que contienen oxígeno, llamados epóxidos u oxiranos. La tensión en el anillo de éter de tres miembros ocasiona que los epóxidos sean reactivos y les confiere una reactividad química única.
En el laboratorio, los epóxidos normalmente se elaboran por tratamiento de un alqueno con un peroxiácido, RCO3H:

Pueden emplearse muchos peroxiácidos para la epoxidación. A escala de laboratorio, el ácido m-cloroperbenzoico (MCPBA) es el reactivo preferido. Los peroxiácidos transfieren oxígeno a través de un mecanismo complejo en un solo paso, sin intermedios. Sin embargo existen pruebas que demuestran que el oxígeno más alejado del grupo carbonilo es el que se transfiere.
Mecanismo:

Ciclohepteno Peroxiácido 1,2-Epoxicicloheptano Ácido
En otro método para la síntesis de epóxidos se emplean halohidrinas, producidas por adición electrofílica de HO-X a alquenos. Cuando las halohidrinas se tratan con base, se elimina HX y se produce un epóxido. Este método en realidad es una síntesis de éteres de Williamson intramolecular. El átomo de oxígeno (nucleófilo) y el átomo de carbono (electrófilo) están en la misma molécula.

Mecanismo:

Bromohidrina Sustitución intramolecular Epóxido
Reacciones de Apertura del Anillo de los Epóxidos.
Los anillos de epóxidos pueden romperse por tratamiento con ácido, de modo muy parecido a como ocurre con los éteres. La principal diferencia es que los epóxidos reaccionan en condiciones mucho más suaves debido a la tensión en el anillo. Un ácido mineral acuoso diluido a temperatura ambiente basta para provocar la hidrólisis de los epóxidos y formar los 1,2-dioles, también llamados glicoles vecinales. La apertura del anillo de epóxido catalizada por ácido procede por ataque SN2 de un nucleófilo sobre el epóxido protonado.
Ejemplo:

1,2-Epoxiciclohexano trans-1,2-Ciclohexanodiol (86%)
Los epóxidos protonados también pueden ser abiertos por otros nucleófilos, además del agua. Por ejemplo, si se emplea HX anhidro, los epóxidos pueden convertirse en halohidrinas trans.

Los epóxidos, a diferencia de los éteres, también pueden romperse con bases, la reactividad del anillo de tres miembros es suficiente para que los epóxidos reaccionen con ion hidróxido a temperaturas elevadas.

Una ruptura nucleofílica de anillo similar se observa cuando los epóxidos se tratan con reactivos de Grignard. El óxido de etileno se utiliza con frecuencia, y permite convertir un reactivo de Grignard en un alcohol primario con dos carbonos más que el halogenuro de alquilo de partida.

Bromuro de butilmagnesio 1-Hexanol (62%).
REGIOQUÍMICA DE LA APERTURA DEL ANILLO DE EPÓXIDO.
La dirección en la cual se abren los anillos de epóxidos asimétricos depende de las condiciones de reacción. Si se emplea un nucleófilo básico en una reacción SN2 típica, el ataque ocurre en el carbono menos impedido del epóxido. Sin embargo si se emplean condiciones ácidas la reacción sigue un curso distinto y el ataque del nucleófilo ocurre principalmente en el átomo de carbono más sustituido.
Éteres corona.
Los éteres corona, descubiertos a principios de la década de 1960 por Charles Pedersen[2] en la compañía Du Pont, constituyen una adición relativamente reciente a la familia de los éteres.

Éter 18-corona-6
La importancia de los éteres corona deriva de su extraordinaria capacidad de solvatar cationes metálicos, secuestrando el metal en el centro de la cavidad del poliéter. Diferentes éteres corona solvatan diferentes cationes metálicos, dependiendo de la compatibilidad entre el tamaño del ion y el tamaño de la cavidad. Por ejemplo, el 18-corona-6 es capaz de formar complejos muy estables con el ion potasio.

KMnO4, solvatado por 18-corona-6,
(este solvato es soluble en benceno)
Los complejos entre éteres coronas y sales inorgánicas son solubles en disolventes orgánicos no polares, lo que permite efectuar muchas reacciones en condiciones apróticas que de otra manera tendrían que llevarse a cabo en soluciones acuosas. Muchas sales inorgánicas, como KF, KCN, y NaN3, pueden hacerse solubles en disolventes orgánicos empleando éteres coronas. El efecto de su uso para disolver una sal en un disolvente aprótico polar, como DMSO, DMF o HMPA. En ambos casos, el catión metálico es fuertemente solvatado, dejando al anión desnudo. Así, la reactividad SN2 de un anión se incrementa en presencia de un éter corona.
SULFUROS.
Los sulfuros, R-S-R', son análogos azufrados de los éteres. Se nombran siguiendo las mismas reglas que para los éteres, usando el término sulfuro en vez de éter.

Sulfuro dimetílico Sulfuro metil fenílico 3-(Metiltio)ciclohexeno
Los sulfuros se elaboran por tratamiento de un halogenuro de alquilo primario o secundario con un anión tiolato, RS-. La reacción transcurre por un mecanismo SN2, Los aniones tiolatos son de los mejores nucleófilos que se conocen y los rendimientos que se obtienen suelen ser altos en estas reacciones de sustitución.

Bencenotiolato de sodio Sulfuro metil fenílico (96%)
Puesto que los electrones de valencia del azufre están más lejos del núcleo y son retenidos menos fuertemente que los del oxígeno existen algunas diferencias importantes entre la química de los éteres y la de los sulfuros. Por ejemplo, el azufre es más polarizable que el oxígeno, y por tanto los compuestos de azufre son más nucleófilos que sus análogos de oxígeno. A diferencia de los éteres dialquílicos, los sulfuros dialquílicos son nucleófilos tan eficaces que reaccionan rápidamente con halogenuros de alquilo primarios a través de un mecanismo SN2. Los productos de tales reacciones son las sales de trialquilsulfonio, R3S+.

Sulfuro dimetílico Yodometano Yoduro de trimetilsulfonio
Una segunda diferencia entre los sulfuros y los éteres es que los primeros se oxidan fácilmente. El tratamiento de un sulfuro con peróxido de hidrógeno, H2O2, a temperatura ambiente, produce el correspondiente sulfóxido (R2SO), y la oxidación posterior del sulfóxido con un peroxiácido produce una sulfona (R2SO2).

Sulfuro metil fenilíco Metil fenil sulfóxido Metil fenil sulfona
ÁCIDOS CARBOXÍLICOS
Los ácidos carboxílicos ocupan un lugar importante dentro de la química orgánica, dado que sirven para la construcción de derivados relacionados, como ésteres y amidas. También son importantes en la síntesis orgánica de muchas otras moléculas.
Algunos ejemplos importantes son el ácido cólico, uno de los principales componentes de la bilis humana, y los ácidos alifáticos de cadena larga como el ácido oleico y el ácido linoleico, precursores biológicos de grasas y otros lípidos. También se encuentran en la naturaleza muchos ácidos carboxílicos saturados simples. Por ejemplo, el ácido acético, CH3CO2H, es el principal componente orgánico del vinagre; el ácido butanoico, CH3CH2CH2CO2H, es el que da el olor a la mantequilla rancia, y el ácido hexanoico (ácido caproico), CH3(CH2)4CO2H, es la causa del inconfundible olor de las cabras y de los calcetines deportivos después de hacer ejercicios.
Ácidos carboxílicos: Estructura y Propiedades Físicas.
Cuando se une un grupo hidroxilo a un grupo carbonilo se forma un nuevo grupo funcional, el grupo carboxilo, dando lugar a los ácidos carboxílicos. Este nuevo grupo suele representarse como -COOH o -CO2H. Dado que el grupo funcional ácido carboxílico esta relacionado estructuralmente con las cetonas y con los alcoholes, podría esperarse ver algunas propiedades familiares a ellos. En efecto, los ácidos carboxílicos son similares a las cetonas y a los alcoholes en algunos aspectos, aunque también tienen grandes diferencias. Como en las cetonas, el carbono carboxílico tiene hibridación sp2, con ángulos de enlace de 120º aproximadamente. Al igual que los alcoholes, los ácidos carboxílicos están fuertemente asociados por puentes de hidrógeno entre las moléculas. Este hecho hace que los ácidos carboxílicos tengan un punto de ebullición bastante alto con respecto a los alcoholes de peso molecular comparable.
| Propiedades químicas de los Ácidos:
| Formación de dímeros (aumenta el p.eb.)
Dos puentes de hidrógeno |
Acidez y Basicidad de los Ácidos Carboxílicos:
Los ácidos carboxílicos tienen un pKa bajo (pH menor que 7.0) es decir son compuestos ácidos. Por lo tanto la desprotonación para dar carboxilato es relativamente fácil, mientras que la protonación es más difícil. Suelen reaccionar con bases como el hidróxido de sodio y bicarbonato de sodio para formar las sales correspondientes.

Un ácido carboxílico Una sal de ácido carboxílico
(insoluble en agua) (soluble en agua)
Los ácidos carboxílicos suelen disociarse ligeramente en soluciones acuosas para formar H3O+ y el anión carboxilato, RCOO-. Como en todo ácido, es posible definir una constante de acidez, Ka.
|
|
|
Casi en la mayoría de los ácidos carboxílicos, la constante de acidez Ka es del orden de 10-5, que corresponde a un pKa de 4.72.
Preparación de los Ácidos Carboxílicos:
De entre los métodos de síntesis de ácidos carboxílicos los más frecuentes son oxidación, hidrólisis de nitrilos y reacción de reactivos de Grignard con CO2. A continuación los ilustramos en forma de esquema con un respectivo ejemplo.
|
Formación de Ácidos Carboxílicos
| |
| Método sintético | Ejemplo
|
| a) Hidrólisis de otros derivados de ácidos carboxílicos
Donde X = -Cl, -OR', -OCOR', -NHR'.
|
|
| b) Oxidación de alquilbencenos
|
|
| c) Ruptura oxidativa de alquenos y alquinos
|
|
| d) Oxidación de alcoholes primarios o aldehídos
|
|
| e) Hidrólisis de nitrilos
|
|
| f) Transposición del ácido bencílico
|
|
| g) Síntesis malónica
|
|
| h) Reacción de Kolbe
|
|
| i) Carboxilación de reactivos organometálicos
|
|
| j) Oxidación de cetonas
|
|
Como puede verse, hay varios métodos para la síntesis de ácidos carboxílicos por oxidación, carbonatación e hidrólisis de precursores adecuados.
A continuación veremos las reacciones que dan los ácidos carboxílicos, las cuales pueden agruparse en cinco categorías: Sustitución alfa; Descarboxilación; Desprotonación; Reducción y Sustitución nucleofílica en el acilo.
|
REACCIONES DE LOS ÁCIDOS CARBOXÍLICOS
|
| |
| Método sintético | Ejemplo | |
| a) Desprotonación
|
| |
| b) Reducción a alcoholes primarios
|
| |
| c) Descarboxilación : Reacción de Hunsdiecker
|
| |
| d) Obtención de Haluros de ácidos
|
| |
|
e) Obtención de Anhídridos carboxílicos
Anhídridos cíclicos:
Favorecido en el caso de anillos de cinco o seis miembros.
|
| |
| f) Obtención de Esteres
Esteres cíclicos: (lactonas)
|
| |
| g) Obtención de Amidas
Imidas:
Amidas cíclicas: (lactamas)
|
| |
| h) Reacción con compuestos organometálicos
|
|
| i) Formación y reacción de dianiones de ácidos carboxílicos
Utilidad de la reacción:
|
|
| j) Bromación: Reacción de Hell-Volhard-Zelinsky
|
|
| k) Reacciones de desplazamiento de ácidos 2-bromo carboxílicos.
|
|
Los ácidos carboxílicos se pueden identificar fácilmente por métodos espectroscópicos convencionales. Así, exhiben absorciones características en el infrarrojo en la zona de 2500 y 3300 cm-1 (debido al OH) y a entre 1710 y 1760 cm-1 (debido al grupo C=O). En la RMN de 13C, los ácidos carboxílicos también presentan absorciones en el intervalo de 165 a 185 δ, y en la RMN de 1H absorben cerca de los 12 δ.
A continuación se comentarán los mecanismos más significativos de las reacciones anteriormente mencionadas en las tablas.
La mayoría de los métodos para la preparación de los ácidos carboxílicos, han sido mencionados con anterioridad en los capítulos precedentes, ejemplo oxidación de alquenos y alquinos (cap. 14 y 15); oxidación de alcoholes (cap. 12); organometálicos (cap. 16), etc. Por ésto que haremos un breve comentario de los nuevos métodos aquí comentados.
Hidrólisis de Nitrilos:
El grupo funcional nitrilo R-CðN, puede ser hidrolizado con ácidos o bases fuertes en solución acuosa para dar un ácido carboxílico. El método es bueno para producir ácidos carboxílicos a partir de halogenuros de alquilo (R-X → R-CðN → R-COOH). La síntesis funciona mejor con halogenuros primarios, ya que puede competir con reacciones de eliminación E2 con halogenuros secundarios o terciarios.

Mecanismo de la hidrólisis: vía una formación de amida
En medio ácido:

En medio básico:

Transposición del ácido bencílico:
Consiste en un reagrupamiento de una dicetona en medio básico, tal como se muestra en el siguiente mecanismo.
1) Adición de un ion hidróxido:

2) Transposición

3) Protonación

Ejemplo:

Síntesis malónica:
Consiste en la obtención de un ácido carboxílico a partir de un malonato de etilo o metilo, en presencia de una base y un halogenuro de alquilo, con posterior tratamiento en medio ácido y calor para dar una descarboxilación. Su mecanismo se ilustra a continuación en forma resumida.

Reacción de Kolbe:
Es un caso particular en la obtención de ácidos carboxílicos, dado que conduce solamente a ácidos benzoicos orto sustituidos con hidroxilo. En la reacción de Kolbe[1], el fenóxido ataca al dióxido de carbono para dar la sal del ácido 2-hidroxibencenocarboxílico. (ácido o-hidroxibenzoico). Su mecanismo se discutirá en el capítulo de aromáticos.

Reactividad del grupo carboxilo: Mecanismo de adición-eliminación.
Aparte de sus propiedades ácido-base, los ácidos carboxílicos muestran una reactividad en su grupo carbonilo muy similar a la de los carbonilo de aldehído y cetonas. El grupo carbonílico es susceptible al ataque nucleófilo, el oxígeno puede reaccionar con electrófilos y los hidrógenos vecinos son ácidos y enolizables. El grupo hidroxilo por si mismo o modificado puede actuar como grupo saliente dando lugar a otros derivados carbonílicos. En cualquier caso los ataques nucleofílicos han de seguir uno de los dos siguientes mecanismos, según las condiciones de la reacción.
A) ADICIÓN-ELIMINACIÓN CATALIZADA POR BASES:

B) ADICIÓN-ELIMINACIÓN CATALIZADA POR ÁCIDOS:

Descarboxilación de ácidos carboxílicos: Reacción de Hunsdiecker[2]:
La reacción consiste básicamente en una oxidación. Una sal de plata del ácido carboxílico se trata con un halógeno, normalmente bromo. El bromuro de plata precipita, se desprende dióxido de carbono y se forma un bromoalcano en el que el halógeno ocupa la posición del grupo carboxilo. Esta reacción permite la conversión de la sal de un ácido carboxílico en un bromoalcano que contiene un átomo de carbono menos. El mecanismo se ilustra a continuación:
| ETAPA 1) Formación del hipobromito
| ETAPA 2) Formación del radical RCOO·
|
| ETAPA 3) Descomposición del radical RCOO·
| ETAPA 4) Formación del haloalcano y RCOO·
|
Ejemplo:

Obtención de Haluros de ácidos a partir de ácidos carboxílicos:
Estas reacciones ocurren por un mecanismo similar al de los alcoholes al reaccionar con los reactivos de PBr3, PCl5 o SOCl2. Inicialmente se forma un derivado inorgánico del ácido, (formándose así un buen grupo saliente) susceptible de ataque nucleofílico por parte del halogenuro.
| Mecanismo de la formación del Cloruro de ácido con cloruro de tionilo (SOCl2) | Mecanismo de la formación del Bromuro de ácido con tribromuro de fósforo (PBr3) |
|
|
|
La obtención de los demás derivados de ácidos carboxílicos, Ésteres, Anhídridos y Amidas, suelen seguir uno de los dos mecanismo de adición-eliminación mencionados con anterioridad, dependiendo de las condiciones de reacción. Los ésteres por ejemplo se preparan en medio ácido, usando un ácido mineral como catalizador (sulfúrico o clorhídrico). Las amidas suelen prepararse con aminas y calentamiento.
Reacción de los Ácidos carboxílicos con compuestos organometálicos alquillitio:
Los ácidos carboxílicos con reactivos organometálicos, del tipo alquilitio dan cetonas, vía la formación del carboxilato correspondiente. A pesar de que el ataque nucleofílico sobre una especie cargada negativamente es difícil, los reactivos organolíticos pueden dar la adición nucleofílica sobre el grupo carbonilo del ion carboxilato. La reacción pasa por un intermedio del tipo dianión del diol geminal el cual es tratado con agua y la deshidratación de este da la correspondiente cetona.

Mecanismo:

Ejemplos:

Reacciones de los carbonos ð, vía la formación de un dianión:
Los ácidos carboxílicos, al igual que otros compuestos carbonílicos, pueden dar iones enolatos, que participen en reacciones de sustitución nucleófila (vía ion carboxilato). Los ácidos carboxílicos en presencia de una base fuerte, como lo es el diisopropilamiduro de litio, (LDA) y un codisolvente muy polar y aprótico, como la hexametilfosfotriamida, (HMPA) pueden perder un segundo protón para dar el dianión del ácido carboxílico, que es un potente nucleófilo y que puede dar lugar a alquilaciones, apertura de oxaciclopropanos y adiciones aldólicas, entre otras reacciones.
Ejemplo: Reacciones en el carbono ð del ácido 4-metilpentanoico, en presencia de una base y posteriormente un epóxido (óxido de ciclohexeno), un haluro de alquilo (Bromuro de etilo), y un cetona (3-pentanona).

Bromación de ácidos carboxílicos en el carbono ð: Reacción de Hell-Volhard-Zelinsky[3]:

Los ácidos carboxílicos pueden bromarse en el carbono ð, pero a diferencia de aldehídos y cetonas precisan de un catalizador especial, el fósforo. En lás condiciones de reacción el fósforo reaccionan rápidamente con el bromuro presente para dar el iniciador, PBr3 (alternativamente puede emplearse el PBr3 directamente). El mecanismo de esta reacción transcurre a través del bromuro de alcanoílo, formado por reacción del PBr3 con el ácido carboxílico, tal como se ilustra a continuación:
| ETAPA 1.- Formación del bromuro de alcanoílo
| ETAPA 2.- Enolización
|
| ETAPA 3.- Bromación
| ETAPA 4.- Intercambio
|
Ejemplos:
|
|
|
La importancia de la reacción de Hell-Volhard-Zelinsky radica en que el bromo-derivado obtenido puede dar lugar a otros derivados funcionalizados, por medio de una sustitución nucleófila.
Ejemplos: Sustitución del bromo, por -OH, -NH2 y -CN, del compuesto obtenido previamente.
a) Sustitución por -OH.

b) Sustitución por -NH2.

c) Sustitución por -CN.

Derivados de Ácidos Carboxílicos
Los ácidos carboxílicos y los derivados de ácidos carboxílicos son una clase de compuestos que se denominan en general Derivados de Acilo, R-CO-Y, donde el grupo acilo está unido a un sustituyente electronegativo -Y, que puede actuar como grupo saliente en diversas reacciones de sustitución.
|
Ácido carboxílico |
Halogenuro de ácido ( X = F,Cl, Br, I) |
Anhídrido de ácido
|
|
Éster |
Amida |
Nitrilo |
La reacciones químicas de los distintos derivados de ácidos carboxílicos están representadas por un tipo de reacción general: la reacción de sustitución nucleofílica en el acilo. Mecanísticamente, estas reacciones se realizan por medio de la adición de un nucleófilo al grupo carbonilo polar del derivado de ácido, seguida de la expulsión de un grupo saliente del intermediario tetraédrico:

donde Y = Cl, Br, I (halogenuro de ácido); OR' (éster); OCOR' (anhídrido) o NHR' (amida).
La reactividad de un derivado de ácido hacia la sustitución nucleofílica depende tanto del entorno estérico alrededor del grupo carbonilo como de la naturaleza electrónica del sustituyente, Y. De este modo, se he encontrado el siguiente orden de reactividad:
Halogenuro de ácido > Anhídrido > Éster > Amida.
Todos ellos pueden ser obtenidos de los respectivos ácidos carboxílicos, los cloruros de ácidos a su vez se pueden transformar en cualquier otro derivado de ácido y así con cada uno de ellos tal como se muestra a continuación en forma de esquema incluidos los nitrilos. Sus respectivas reacciones se mostraran en forma de resumen con un ejemplo, siguiendo la metodología expuesta para los otros grupos funcionales ya estudiados.

Algunas de las reacciones de sustitución nucleofílica en el acilo de los cloruros de ácido

Algunas de las reacciones de los anhídridos de ácido

Algunas reacciones de los ésteres

Algunas reacciones de las amidas

Algunas reacciones de los nitrilos
| RESUMEN GENERAL DE LAS REACCIONES |
|
Reacciones de los haluros de ácido |
Ejemplo |
| 1.-Hidrólisis
|
|
| 2.- Sales carboxílicas
|
|
| 3.- Alcohólisis
|
|
| 4.- Aminólisis
|
|
| 5.- Reacción de Grignard
|
|
| 6.- Reacción con diorganocupratos
|
|
| 7.- Reducción parcial
Reducción total
|
|
|
Reacciones de anhídrido de ácido |
Ejemplo |
| 1.- Hidrólisis
|
|
| 2.- Alcohólisis
|
|
| 3.- Aminólisis
|
|
| 4.- Reducción a alcoholes 1º
|
|
|
Reacciones de los ésteres |
Ejemplo |
| 1.- Hidrólisis
|
|
| 2.- Aminólisis
|
|
| 3.- Alcohólisis (Transesterificación)
|
|
| 4.- Pirolisis de ésteres
|
|
| 5.- Reactivos organometálicos
|
|
| 6.- Reducción parcial hacia aldehído
|
|
| 7.- Reducción total hacia alcoholes 1º
|
|
| 8.- Formación de enolatos con posterior tratamiento con un electrófilo
| |
| 9.- Condensación de Claisen
| |
|
Reacciones de las amidas |
Ejemplo |
| 1.- Hidrólisis
|
|
| 2.- Reducción parcial hacia aldehído
|
|
| 3.- Reducción total hacia aminas 1º
|
|
| 4.- Transposición de Hofmann
|
|
|
Reacciones de los nitrilos |
Ejemplo |
| 1.- Hidrólisis
|
|
| 2.- Con reactivos organometálicos
|
|
| 3.- Reducción parcial hacia aldehídos
|
|
| 4.- Reducción totall hacia aminas 1º
|
|
| 5.- Hidrogenación catalitica
|
|
| 6.- Desprotonación y alquilación en el Ca.
|
|
La mayoría de las reacciones de sustitución nucleofílica en los derivados de los ácidos carboxílicos aquí mencionadas ocurren en dos pasos: adición del nucleófilo y eliminación del grupo saliente. Aunque algunas veces ambos pasos pueden afectar la velocidad global de la reacción, suele ser el primero paso el limitante de la velocidad.

| Ocurre la adición de un nucleófilo al grupo carbonilo, lo que produce un intermedio tetraédrico | Un par de electrones del oxígeno desplaza al grupo saliente Y, lo cual genera un compuesto carbonílico como producto | El nucleófilo puede ser del tipo :Nu- o bien :Nu-H.
Y es un grupo saliente: -OR, -NR2, _-Cl, -OCOR'. |
El orden de reactividad es Halogenuro de ácido > Anhídrido > Éster > Amida. Una consecuencia importante de las diferencias de reactividad observadas es que suele ser posible transformar un derivado más reactivo en uno menos reactivo.

Casi la mayoría de las reacciones de los halogenuros de ácido ocurren por sustitución nucleofílica en el carbonilo. Por lo que no daremos grandes detalles de cada una de ellas, veamos el caso de la hidrólisis:

Un haluro Un ácido
de ácido carboxílico
Dado que durante la hidrólisis se genera HCl, a menudo la reacción se realiza en presencia de piridina o de NaOH como base para secuestrar el HCl e impedir que éste cause reacciones laterles. La alcohólisis presenta un mecanismo casi idéntico con la diferencia que el grupo atacante es el alcohol e igual cosa la aminólisis.
La reducción de los halogenuros de ácido, termina convirtiéndolos el alcoholes primarios cuando se emplean reductores fuertes (LiAlH4) y en aldehídos cuando se utilizan reductores suaves como por ejemplo el DIDAL , la reducción ocurre por un mecanismo típico de sustitución nucleofílica en el carbonilo en el cual el ion hidruro (H-) ataca al grupo carbonilo produciendo un intermediario tetraédrico que expulsa al ion cloruro, para formar un aldehído, el cual es rápidamente reducido por el LiAlH4 en un segundo paso para generar el alcohol primario.
Los halogenuros de ácido con reactivos de Grignard suelen producir alcoholes terciarios en los cuales los dos sustituyentes son idénticos, el mecanismo es igual a la reducción con LiAlH4, pasándose por una cetona intermedia, la cual reacciona rápidamente con el segundo equivalente de organometálico, para producir el alcohol, ejemplo:

Mecanismo:

La obtención de cetonas apartir de halogenuros de ácido, es posible empleando como agente organometálico un reactivo del tipo diorganocuprato, ejemplo:

La reacciones químicas de los anhídridos de ácido son muy similares a las de los halogenuros de ácido, con la única diferencia que sus reacciones son más lentas. Los ésteres sin embargo, son talvez los derivados de ácidos más importantes. Los ésteres pueden ser obtenidos partiendo de ácidos o anhídridos, aunque el método más amplio es partiendo de los cloruros de ácido.

Los ésteres presentan un comportamiento químico similar al descrito para los halogenuros de ácido y anhídridos, pero son menos reactivos hacia los nucleófilos que los anteriores; de ahí que las reacciones requieran de un catalizador que suele ser ácido o básico.
La hidrólisis de ésteres por ejemplo es realizada en medio ácido o básico para producir un ácido carboxílico más alcohol. La hidrólisis de ésteres en solución básica se llama saponificación (del latín sapo, saponis, jabón).
Analicemos un ejemplo: Mecanismo de hidrólisis mediante base

Al contrario de lo que ocurre con la hidrólisis catalizada por ácidos, esta reacción en sus últimas etapas no es de equilibrio, la etapa en la que el ácido se convierte en la sal del carboxilato, es esencialmente irreversible. Por lo tanto, se necesita al menos una cantidad estequiométrica de hidróxido (aunque frecuentemente se emplea un exceso).
Reacción de los ésteres con alcoholes: transesterificación
Esta reacción permite la conversión de un éster en otro sin necesidad de obtener el ácido libre. La transesterificación es una reacción de equilibrio. Para desplazar el equilibrio se utiliza normalmente un gran exceso de alcohol, muchas veces como disolvente. La reacción tiene utilidad dado que las lactonas (ésteres cíclicos) se abren mediante transesterificación a hidroxiésteres.
Ejemplo:

Amidas a partir de ésteres:
Los ésteres reaccionan con las aminas por un método típico de sustitución nucleofílica en el acilo para producir amidas. La reacción en si no necesita catalizador dado que las aminas, son buenos nucleófilos. Sin embargo, la reacción no tiene mucho uso debido a que se obtienen mayores rendimientos por la aminolisis de los cloruros de ácido.
Ejemplos:
|
Benzoato de metilo Benzamida |
3-Metilbutanoato de metilo 3-Metil-N-etilbutanoamida |
Reactivos de Grignard con ésteres producen alcoholes terciarios:
La reacción de los ésteres con dos equivalentes de un reactivo de Grignard, los transforma en alcoholes terciarios, mientras que los ésteres del ácido metanoico (fórmico) conducen a alcoholes secundarios. La reacción en si es una adición nucleofílica del organometálico a la función carbonílica para dar la sal de magnesio de un hemiacetal y formación de una cetona intermedia, a continuación tiene lugar otra adición de un segundo equivalente de reactivo de Grignard sobre el grupo carbonílico formado. Por ultimo, se obtiene el alcohol al añadir agua a la mezcla de reacción.
Ejemplo:

Mecanismo:

Reducción de ésteres a alcoholes:
Los ésteres se reducen fácilmente por tratamiento con hidruro de litio y aluminio (LiAlH4) para producir alcoholes primarios, el mecanismo consiste en la unión de un hidruro al grupo carbonilo, a lo cual sigue la eliminación del ion alcóxido para producir un aldehído como intermedio. La posterior adición de un hidruro al aldehído forma el alcohol primario.
Mecanismo:

Éster Aldehído Alcohol primario
Si en vez de LiAlH4 se usa DIBAL (hidruro de diisobutilaluminio) como agente reductor, es posible aislar el aldehído. Debe tenerse gran cuidado (usar un equivalente exacto de hidruro, y efectuar la reacción a -78ºC).
Ejemplo:

Formación de enolatos con posterior tratamiento con un electrófilo:
La acidez de los hidrógenos en a de los ésteres es suficiente para que se formen los enolatos de éster, cuando un éster reacciona con una base fuerte a baja temperatura. Los enolatos de éster reaccionan como enolatos de cetonas, dando lugar a alquilaciones, apertura de oxaciclopropanos y reacciones aldólicas.
Ejemplo:

Cuando los enolatos de éster atacan a otra molécula de éster se forma un producto de condensación de Claisen, dando lugar a un producto conocido como b-ceto-éster. Esto se debe a que los enolatos no deben estar presentes en cantidades estequiométricas, sino que pueden existir en concentraciones de equilibrio, como ee la reacción aldólica, Tanto el alcóxido (base) como el éster empleado deben ser derivados del mismo alcohol para evitar la una transesterificación.
Ejemplo:

Mecanismo:
1) Formación del enolato del éster

2) Adición nucleófila

3) Eliminación

La condensación de Claisen es esencialmente análoga a la aldólica, pero con un éster en lugar de un aldehído. En de estar presente ésteres de distinta naturaleza química se produce una condensación de Claisen cruzada, dando lugar a mezclas de productos, y en el caso de que una misma molécula posea dos grupos ésteres da lugar a una condensación de Claisen intramolecular, conocida con el nombre de condensación de Dieckmann[2].
Ejemplos:
a) Condensación de Claisen mixta

b) Condensación de Claisen intramolecular (Dieckmann)

Reacciones de las Amidas:
Las amidas son mucho menos reactivas que cloruros de ácido, anhídridos de ácido o ésteres. Por tanto, el enlace amida sirve como la unidad básica a partir de la cual se forman todas las proteínas.
Las amidas sufren hidrólisis para formar ácidos carbixílicos más aminas cuando se calientan con ácidos o bases en solución acuosa. Las condiciones que se requieren para la hidrólisis de amidas son más drasticas que para la hidrólisis de cloruros de ácido o ésteres, pero los mecamismos son similares.
Ejemplos:
(a) Hidrólisis ácida

(b) Hidólisis básica

Al igual que otros derivados de ácidos carboxílicos, las amidas pueden reducirse con LiAlH4 o bien LiAl(OR)3H, para obtener alcoholes o aldehídos respectivamente. El efecto neto de la reducción de una amida es la conversión del grupo carbonilo de la amida en un grupo metileno (C=O ® CH2). Este tipo de reacción es específico de las amidas y no ocurre con otros derivados de ácidos carboxílicos.
Ejemplos:

La reducción con hidruro de litio y aluminio es igualmente eficaz tanto para las amidas acíclicas como para las cíclicas (lactamas). La reducción de lactamas produce aminas cíclicas con buenos rendimientos, y constituye un método de síntesis valioso.
Ejemplo:

Una lactama Una amina cíclica
Las amidas se pueden transformar en aminas con un carbono menos respecto a las amida original mediante la transposición de Hofmann, la que será estudiada en el capítulo 27, dedicado a las aminas.
Reacciones de los Nitrilos:
La química de los nitrilos es similar en muchos aspectos a la química de los compuestos carbonílicos. Al igual que éstos, los nitrilos están fuertemente polarizados, lo que hace que el átomo de carbono sea electrófilo. Por tanto los nitrilos son atacados por nucleófilos para producir aniones imina con hibridación sp2 como intermedio, en una reacción análoga a la formación del ion alcóxido intermedio por adición nicleofílica a un grupo carbonilo.
Las dos reacciones más importantes de los nitrilos son la hidrólisis y la reducción. Además, los nitrilos pueden ser parcialmente reducidos e hidrolizados para producir aldehídos, y se pueden tratar con reactivos de Grignard para producir cetonas.
Los nitrilos pueden hidrolizarse en medio acuoso ácido o básico para dar los correspondientes ácidos carboxílicos. El mecanismo de estas reacciones procede a través de una amida intermedia e incluye etapas de adición-eliminación.
Mecanismo de la hidrólisis de nitrilos catalizada por ácidos:

Mecanismo de la hidrólisis de nitrilos catalizada por bases:

Las condiciones para la hidrólisis de nitrilos son normalmente drásticas, requiriendo altas concentraciones de ácido o base a elevadas temperaturas.
Los reactivos organometálicos reaccionan con los nitrilos para dar cetonas:
Los nucleófilos fuertes, como por ejemplo los reactivos organometálicos, se adicionan a los nitrilos para dar sales de aniones de imina. El tratamiento coc ácido acuoso conduce a la imina neutra, que se hidroliza rápidamente a cetona.
Ejemplo:

AMINAS
| Grupo funcional |
|
| Suffijo | -amina |
| Prefijo | Amino |
| Poosición en la Cadena | Cualquiera |
| Fórmula General | CnH2n+3N |
El sufijo o de los alcanos se cambia por amina.
Se usa la designación de amina primaria secundaria o terciaria para referirnos al número de grupos alquilos que están unidos al nitrógeno. Así, si la amina tiene un grupo alquilo y dos hidrógenos se le conoce como primaria, si tiene dos alquilos y un hidrógeno, secundaria y con tres grupos alquilo sin hidrógeno, terciaria. Debido a que tiene un par electrónico, puede formar compuestos tetrasustituidos, donde el átomo de nitrógeno queda cargado positivamente, y se les conoce como amina cuaternarias. Es importante notar que esta denominación se refiere al número de sustituyentes que tiene el átmo de nitrógeno y no como en el caso de los alcoholes al tipo de carbono sobre el cual se encuentra. En el caso de los alcoholes tendremos; alcoholes primario si el OH está sobre un carbono primario, alcohol secundario si se encuentra sobre un carbono secundario y alcohol terciario si está sobre un carbono terciario.
Las aminas las podremos nombrar cambiando el sufinjo o por amina o considerando la cadena de carbon como prefijo.
Aminas Primarias
| Estructura | Nombre de la IUPAC |
|
| Metanamina (Metilamina) |
|
| Etanamina (Etilamina) |
|
| 1-Propanamina (Propilamina) |
|
| 2-Propanamina (Isopropilamina) |
|
| 1,2-Etanodiamina (en este caso como el sufijo inicia con d se mantiene la terminación de alcano o) |
|
| Ciclopentanamina (Ciclopentilamina) |
Nota: En parentesis se muestran la nomenclatura cotidiana de estas aminas.
Aminas Secundarias
La cadena más larga de carbonos se considera como la base y la otra cadena se considera como sustituyente con el localizador N (en itálicas). El N se considera un localizador de menor prioridad que los numéricos por lo que antecede a los números.
| Estructura | Nombre de la IUPAC |
|
| N-metilmetanamina (dimetilamina) |
|
| N-metiletanamina (metiletilamina) |
|
| N-etiletanamina (dietilamina) |
|
| N-metil-3-pentanamina |
|
| N,3-dimetil-2-butanamina |
Aminas Terciarias
La cadena más larga de carbonos se considera como la base y la otras cadenas se consideran como sustituyentes con el localizador N, N (en itálicas). El N se considera un localizador de menor prioridad que los numéricos por lo que antecede a los números.
| Structure | IUPAC Name |
|
| N,N-dimetilmetanamina (trimetilamina) |
|
| N,N-dimetiletanamina |
|
| N-etil-N-metiletanamina |
|
| N-etil-N-metil-4-heptanamina |
PROPIEDADES FÍSICO - QUÍMICAS
Las alquilaminas forman un grupo bastante amplio de tensioactivos cosméticos. Estas sustancias se pueden dividir en dos subfamilias:
Por un lado, las alquilaminas (primarias, secundarias y terciarias) y sus sales tienen como grupo funcional el grupo amino, que es responsable de sus propiedades tensioactivas y de su solubilidad en agua. Poseen largas cadenas alquílicas que les dan un cierto carácter hidrófobo. Se suelen obtener por reducción de la correspondiente acilamida.
| También se incluyen en esta primera subfamilia sustancias con más de un átomo de nitrógeno, lo que hace que sean más polares que las anteriores y más usadas en cosmética como emulsionantes catiónicos. Se sintetizan haciendo reaccionar cloruro de ácido con un mol de diamina. Estos compuestos se conocen comúnmente como amido-aminas (fig1). |
Fig1. - Amido-amina | ||
La otra subfamilia son las aminas etoxiladas, cuya principal característica es que su solubilidad en agua y su aplicación en cosmética depende en gran parte de la cadena de polietilenglicol.
Estos compuestos precipitan con los tensioactivos aniónicos más usados.
Las aminas libres son sólidos céreos, mientras que las sales y las amido-aminas son sólidos de mayor punto de fusión. Presentan afinidad por las superficies cargadas negativamente.
REACCIONES DE SÍNTESIS DE LAS AMINAS
1.- Reducción de Nitrompuestos.

2.- Reacción de haluros de alquilo con amoniaco o aminas. Esta reacción tiene el inconveniente de que la amina formada puede volver a reaccionar con el haluro de alquilo, lo cual se evita añadiendo un exceso de amoniaco o de amina.

3.- Aminación reductiva. Consiste en reducir los compuestos que resultan de la condensación de cetonas o aldehídos con derivados nitrogenados.

4.- Reducción de nitrilos. Este procedimiento tiene buen rendimiento en la síntesis de aminas primarias.

5.- Degradación de Hoffmann. Da lugar a una amina con un átomo de carbono menos que la amida de la que deriva.

REACCIONES DE LAS AMINAS
1.- Reacciones de las aminas con ácido nitroso (Reacción de diazotación).

Esta reacción de diazotación solo la experimentan las aminas primarias y desde el punto de vista sintético solo tienen interés las sales de diazonio aromáticas ya que las sales de diazonio alifaticas se descomponen.


Las sales de diazonio se pueden utilizar como punto de partida para la obtención de diferentes compuestos reemplazando el grupo diazonio por otros grupos funcionales.
Hidrólisis.


Reacción de Sandmeyer. En este reacción se reemplaza el grupo diazonio por los grupos halogeno (F,Cl, Br y I) y el grupos ciano(- CN).

Reacción con HBF4 para formar los fluoruros.
Reacción con NaI para formar los yoduros.

Reemplazo del grupo diazonio por hidrógeno.

Reacción de copulación. Se produce esta reacción entre una sal de diazonio y un compuestos aromático activado.



2.- Reacciones de conversión a amidas. Ya hemos estudiado que las amidas reaccionan con los derivados reactivos de los ácidos carboxílicos dando las respectivas amidas.
3.- Reacciones con aldehidos y cetonas para dar Bases de Schiff.

Descargar
| Enviado por: | Marcelo |
| Idioma: | castellano |
| País: | Argentina |