Química
Enlaces
ENLACES POR FUERZAS DE VAN-DER-WAALS.
De todas las fuerzas que desempeñan un papel a nivel molecular, las llamadas fuerzas de Van der Waals, son, sin duda, las más débiles, pero probablemente las más universales. Asociadas con energías entre 0.4 y 40 kJ/mol, generalmente quedan enmascaradas por las fuerzas covalentes más fuertes, con energías típicas de 400 kJ/mol. Su acción solo resulta importante para explicar interacciones entre moléculas y átomos con orbitales saturados, donde no es probable la unión covalente adicional.
En 1873 Diderick Van der Waals describió la existencia de fuerzas débiles de atracción y repulsión entre las moléculas y las atribuyó a las desviaciones observadas de la ley de los gases ideales.
Anexo (4)
A diferencia del enlace covalente, que es efectivo a distancias internucleares pequeñas y está asociado con la interpretación e intercambio de electrones y, por consiguiente, con mayores energías, el enlace de Van der Walls puede operar a distancias en que hay poco o ningún intercambio o interpretación y, está asociado con energías menores.
Se ha establecido que muchas de las interacciones moleculares que no son debidas a los enlaces covalentes o iónicos corresponden a las llamadas fuerzas de Van der Waals en honor al científico holandés J.D. Van der Waals (1873).
En este tipo de fuerzas que se presentan entre las moléculas se han determinado 4 tipos de fuerzas.
1.- Orientación.
2.- Inducción.
3.- Dispersión.
4.- Repulsión.
1.- ORIENTACIÓN : Es la primera fuerza de tipo atractivo, conduce a lo que se llama energía de orientación y está presente en las agrupaciones moleculares, se presenta en moléculas con dipolo permanente orientandose de acuerdo a sus cargas como son HCl, NH3, H2O etc.
Anexo (5)
2.- INDUCCIÓN.- Este tipo de fuerza se presenta entre moléculas con dipolo permanente y otra sin dipolo permanente este último bajo la influencia del primero se distorciona y orienta con relación a la primera formando un dipolo inducido. Las cargas contrarias quedan orientadas como en el primer caso, pero la energía en este caso es de inducción. La interacción atractiva entre el dipolo permanente y el dipolo inducido proporciona la segunda contribución de Van der Waals.
3.- DISPERSIÓN.- Es la tercera clase de fuerza que conduce a la energía de dispersión, explica el comportamiento de los gases nobles y al mismo tiempo resulta ser el principal contribuyente a la atracción de Van der Waals. La energía de dispersión se atribuye a la atracción entre dos dipolos inducidos.
4.- REPULSION.- La cuarta fuerza necesariamente grande y repulsiva, se manifiesta cuando las nubes electrónicas saturadas de electrones empiezan a traslaparse. Está íntimamente relacionada con el principio de exclusión de Pauli y es la misma fuerza que en los cristales iónicos contrarresta la atracción electrostática a la distancia interiónica de equilibrio. Esta energía se conoce como energía de repulsión de LONDON y predominan sobre las energías anteriores. Es importante mencionar que las energías de orientación aumentan conforme lo hace el momento dipolar; por ejemplo en la serie HI,HBr,HCl. En la mayoría de los casos, predominan las energías de dispersión de London y para moléculas semejantes (HCl, HBr, HI) aumentan con el número de electrones de la molécula.
A diferencia del enlace covalente, la unión de Van der Waals no es direccional. El empaquetamiento de unidades que se mantienen juntas por enlaces de Van der Waals viene determinado, fundamentalmente, por la geometría y usualmente prevalece alguna variación de empaquetamiento compacto. Normalmente el enlace por fuerzas de Van der Waals se encuentra en las moléculas enmascarado, por enlaces ionicos o covalentes pero cobra importancia en el establecimiento de los estados sólidos, líquidos y gaseosos
.
FUERZAS INTERMOLECULARES
EL CARBONO Y SUS FORMAS ALOTROPICAS: EL DIAMANTE, EL GRAFITO Y EL FURELENO
Se conocen varias formas alotrópicas del carbono de las cuales las 3 más importantes son: El diamante, el grafito y el fureleno. Existen diferencias notables en estos compuestos si comparamos propiedades como: dureza, solubilidad etc. Estas características se encuentra directamente relacionadas con la estructura cristalina de tales formas alotrópicas y las fuerzas intermoleculares que presentan. Si observamos la estructura correspondiente al diamante con radios de VW. Se puede apreciar que las distancias entre los átomos son iguales.
Volvamos a una estructura de palos para visualizar la forma en que se encuentran unidos sus átomos Rotemos la estructura correspondiente al diamante
En el diamante tenemos que cada átomo se encuentra rodeado tetraédricamente por los otros átomos de carbono de la red cristalina, encadenandose entre si a lo largo de toda la red para dar un arreglo periódico. Hagamos un zoom y analicemos de cerca como se encuentran unidas entre sí y el tetraedro que presenta, regresemos al tamaño y modelo incial (En todo momento se pueden rotar las estrcuturas apretando el botón izquierdo del mouse y moviendo el puntero sobre la estructura. Con el botón derecho se entra al menú)
Los átomos de carbono se asocian mediante 4 enlaces sigma, estos enlaces son covalentes, son enlaces muy fuertes, es necesario invertir mucha energía para romperlos. Como todos los átomos de la red cristalina están unidos por enlaces covalentes, esto le proporciona su muy particular alta dureza. Se forman o presentan cadenas de carbono en 3 dimensiones, siempre unidos por enlaces fuertes como lo son los covalentes, dando como resultado su solubilidad, dureza y otras propiedades tanto físicas como químicas.
Regresemos al modelo incial
En la estructura del grafito visulizandola con el modelo de radios de VW, se observa una gran diferencia, con respecto a la del diamante, el GRAFITO muestra una estructura LAMINAR (o por capas). Las cuales estan separadas unas de otras por una distancia de 335.4 pm, Esta característica se puede obsevar cambiando el color de la primera capa observemos la separación que existe con otra capa
La distancia antes mencionada de 335.4 pm se considera que es una distancia suficientemente larga para que no exista un enlace químico formal entre las capas, es decir, las capas se encuentran interaccionando entre si a través de enlaces débiles. En este caso particular las fuerzas responsables son van der Waals e interacciones pi. A diferencia del diamante donde se forman cadenas en tres dimensiones para los átomos de carbono, para el caso del grafito se formaran dichas cadenas tan sólo en dos dimensiones, formando una estructura bidimensional.
Un ejemplo de lo anterior es cuando utilizar un lápiz, conforme lo deslizamos sobre una superficie, dejaremos diferentes capas en la misma, gracias a esto es que logramos marcar y dibujar con el làpiz.
En cada una de las capas, las uniones que se presentan entre los átomos de carbono son covalentes, siguiendo un patrón hexagonal plano entre ellos, cada átomo se encuentra situado a 141.5 pm de los otros, una estructura diferente con respecto al diamante donde encontramos a los átomos de carbono unidos tetraédricamente.
Para comprender con una mayor claridad como influyen las fuerzas intermoleculares en una estructura, es necesario ahcer una comparaciòn de las propiedades partículares para el diamante y el grafito:
|
| DIAMANTE | GRAFITO alfa y beta |
| Densidad (en g/cm3) a 25 °C | 3.514 | =2.266 |
| Dureza (Escala de Mohs *) | 10 | <1 |
| Tf / K | 4100 +- 200 (a 125 kbar) | 4100+- (a 9 kbar) |
| Resistencia Eléctrica ( en ohm * cm) a 298 K | = e 15 | = e -4 ; |
| Df Ho 298 ( kJ/mol ); | 1.90 | 0 Estado Normal de referencia |
| Df Go 298 (kJ/mol); | 2.90 | 0 Estado Normal de referencia |
| * Escala empírica de 1 a 10; |
|
|
Notese las grandes difrencias en varias de las propiedades con relación a estas dos estructuras, por ejemplo; la dureza, el punto de fusión, etc., cada una de ellas contribuye a que el diamante sea insoluble, presente alta resistencia o dureza, o bien, que el grafito sea blando tenga un punto de fusiòn muy bajo, etc. De todo esto y lo anterior son responsables las diferentes fuerzas intermoleculares.
Por último mencionaremos a los fulerenos que son moléculas en forma de jaula cuya fórmula es Cn con n = 44, 50, 58, 60, 70 ...., 350. La estructura correpondiente al C60 es bastante estable por lo que es el mejor, tiene la forma de un icosaedro truncado, uno de los 13 poliedros regulares, observemos su estructura en 3 dimensiones.
En esta estructura los enlaces entre los átomos de carbono también son covalentes, pero las uniones entre las esferas de los fulerenos se realizan por medio de fuerzas de Van der Waals.
Los compuestos iónicos forman redes gigantes, las cuales dan lugar a las sustancias que vemos (NaCl, CaCl2, NaOH,...) 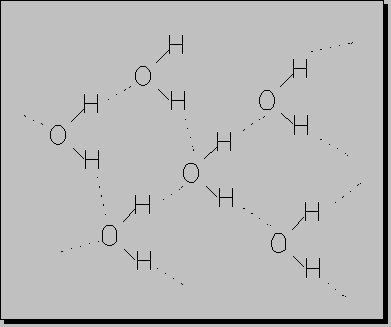
* Los compuestos covalentes están formados por moléculas (salvo unos casos concretos como la sílice y el diamante, que se verán más adelante), estas moléculas están aisladas en los gases, pero ¿cómo se unen para formar líquidos y sólidos?.
Las fuerzas que tienden a unir las moléculas de estos compuestos se denominan FUERZAS INTERMOLECULARES. Como las moléculas covalentes pueden ser polares y apolares a estas fuerzas se las clasifica de la siguiente forma:
* FUERZAS DIPOLO-DIPOLO. (para moléculas polares)
Ejem: etanol, metanol, acetona, ..
Un tipo particular de estas fuerzas (a veces denominadas "enlaces") lo constituye el enlace por puente de hidrógeno, se da cuando existen enlaces entre átomos muy EN y de pequeño volumen - F, O y N - con el H. Esto es los P. de H. se darán entre moléculas que contengan enlaces F-H, O-H o N-H.
* FUERZAS DE VAN DER WAALS (para moléculas apolares)
(o de dipolos instantáneos)
En las moléculas apolares (que originan habitualmente gases) si se las aproxima lo suficiente, se puede generar un desplazamiento de la carga que provoque al formación de dipolos instantáneos, los cuales posibilitan la atracción y la unión entre las moléculas.
Estas fuerzas aumentan con el volumen molecular, ya que si los volúmenes son grandes las moléculas son más fácilmente deformables (polarizables).
| Molécula | Punto de ebullición | Estado físico (1 atm) | *En términos relativos, si se da el valor 1 a la fuerza de unión de Van der Waals: V. der Waals............1 P de Hidrógeno.......10 Enlace covalente....100 |
| F2 | -188ºC | gas | |
| Cl2 | -34ºC | gas | |
| Br2 | 58,8ºC | líquido | |
| I2 | 184,5ºC | sólido |
* PROPIEDADES DE LOS COMPUESTOS CON ENLACES COVALENTES.
* Moléculas apolares: -Fuerzas entre moléculas débiles.
-Son generalmente gases. Si alguno es líquido o sólido, tendrá punto de ebullición o fusión bajo.
-Son poco solubles en agua y disolventes polares (alcoholes, ácidos orgánicos,..)puesto que las moléculas de agua se atraen entre sí y no con las de sólido o líquido, y en cambio son solubles en disolventes apolares (Cl4C, eter, benceno,...).
* Moléculas polares:-Son generalmente líquidos y algunos sólidos ( líquidos como los alcoholes, el agua, sólidos como los azúcares, grasas,...).
Cuanto más polares mayores puntos de ebullición o fusión. 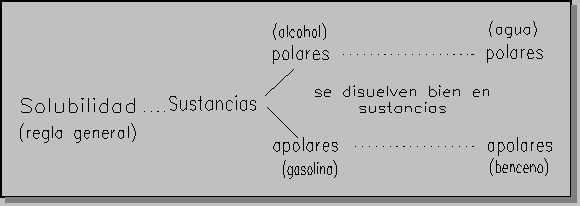
Todos son malos conductores del calor y la electricidad (los electrones están sujetos en el enlace).
En los casos anteriores (enlace covalente homonuclear) el par de electrones compartido está repartido por igual entre los átomos, SON ENLACES COVALENTES APOLARES. Pero si los átomos que se unen son diferentes, uno de ellos tendrá más tendencia a captar los electrones que el otro, desplazándose el par hacia el átomo que más lo atraiga constituyendo un ENLACE COVALENTE POLAR (se simboliza mediante una flecha dirigida hacia el átomo que más atrae el par de electrones). 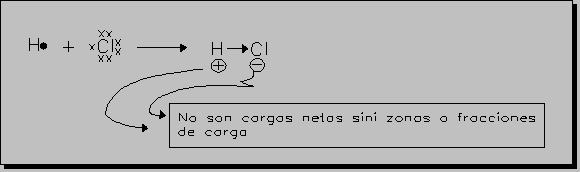
Ejem:
* Se considera que al aumentar la polaridad de el enlace aumenta el "carácter iónico" del enlace en cuestión, y que un enlace iónico sería uno covalente de polaridad máxima o sea un átomo atrae tanto al par de electrones, 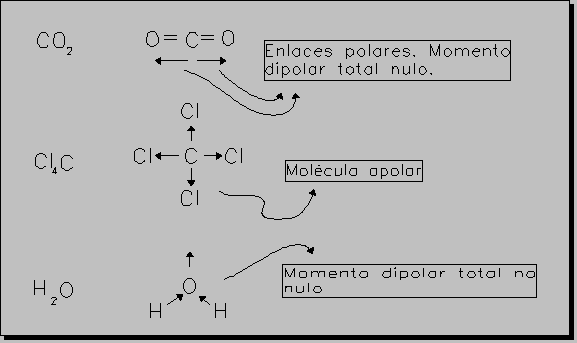
que "se queda con él".

* La polaridad de un enlace se mide con el momento dipolar (producto de la carga localizada por la distancia entre los núcleos de los átomos que forman el enlace; una unidad para medir los momentos dipolares es el Debay, los momentos dipolares oscilan de 0 a 11 Debyes)
* Si una molécula tiene varios enlaces con carácter polar, el momento dipolar será la suma vectorial de los momentos dipolares de cada enlace.
Esto puede suponer que moléculas que posean enlaces polares tengan momento dipolar TOTAL cero, debido a su geometría simétrica.
Cristales covalentes.
Distinguirlos de los cristales moleculares, en los que existen moléculas aisladas unidas por fuerzas intermoleculares).
Un tipo especial de compuestos covalentes son aquellos que forman redes gigantes de enlaces covalentes, en los que no existen moléculas.
El CO2 es un gas, estructura molecular (moléculas aisladas en el gas, o unidas unas a otras en el sólido).
El SiO2 es un sólido muy duro y de elevado punto de fusión, esto lo explica su estructura de red tridimensional en la que los átomos de silicio ocupan el centro de tetraedros estando los de oxígeno en los vértices (siendo cada átomo de oxígeno común a dos tetraedros), unidos estos átomos por enlaces covalentes conformando toda una red.
El diamante forma una red parecida a la de la sílice, en la que los tetraedros son todos átomos de carbono. El grafito también es carbono puro, pero la forma en la que están unidos los carbonos es diferente, resultando unas propiedades totalmente distintas.
Otro gran grupo de sustancias de gran interés con enlace covalente son las moléculas orgánicas, que conforman un gran apartado de la Química. (Hidrocarburos, hidratos de carbono, grasas, proteínas, plásticos,...).
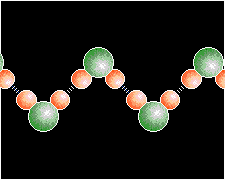
ENLACE POR PUENTE DE HIDRÓGENO:
Son interacciones polares y su intensidad es cerca de 5-10% de enlace covalente. En el enlace por puente de hidrógeno los tipos más importantes de fuerzas de atracción débiles y estos enlaces son los causantes de que el agua sea un líquido a temperatura ambiente en lugar de un gas. Es un enlace entre átomos neutros y moléculas. Latimer y Rodebasch (1920) determinaron la existencia del enlace por P.H. para explicar el comportamiento anormal de algunas sustancias. Esta anormalidad se refiere a características físicas principalmente que no siguen una secuencia de acuerdo a sus masas moleculares .
De esta manera se estableció que en muchas moléculas donde existe un hidrógeno unido a un elemento fuertemente electronegativo se establece una unión intermolecular precisamente entre el H de una molécula y el elemento fuertemente negativo de la otra.
Al revisar la T.P de los elementos químicos resulta fácil comprender que este enlace por P.H se presente en moléculas que tengan F, O, N, Cl unidos a un H el cuál servirá de puente.
Cuando dos ó más moléculas quedan unidas por P.H. se tiene en realidad una molécula gigante y su existencia se puede apreciar con el aumento del punto de ebullición, un ejemplo muy notable es el agua que debiendo tener una temperatura de ebullición inferior a -100 0C lo tiene a +100 0C en condiciones normales de presión o sea una atmósfera. Ese valor de -1000C correspondería a una molécula ideal y siguiendo la secuencia de las temperaturas de ebullición de los compuestos con H del mismo grupo. Cuando se sustituyen los H por radicales de hidrocarburos, se aprecia perfectamente que el descenso de las temperaturas de ebullición de los compuestos del mismo grupo sigue un descenso gradual.
Propiedades físicas que varían con el enlace por puente de hidrógeno :
-
Puntos de ebullición.
-
Puntos de fusión.
-
Viscosidad.
-
Densidad.
-
Calor de vaporización.
-
Presión de vapor.
-
Acidez
Anexo (1)
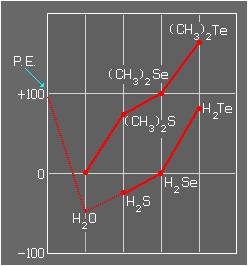
Puntos de ebullición de compuestos con hidrógeno y radicales alquilos del grupo VI y de compuestos con H.
Algo semejante ocurre con los compuestos del grupo V, con los elementos del N, P, As, y Sb. Sin embargo el amoniaco no tiene un punto de ebullición tan elevado como en el caso del agua y la razón está en que el par solitario del N en la molécula del amoniaco atrae a tres H de otras moléculas de amoniaco, mientras que en el caso del agua se forma una malla con múltiples enlaces de H.
Esto se explica por la presencia de enlaces de baja energía entre las moléculas, El Enlace por puente de hidrógeno aumenta el calor de vaporización de las sustancias que tienen este enlace porque inicialmente hay que vencer las fuerzas intermoleculares y posteriormente aportar la energía para la libre rotación de las moléculas gaseosas.
La solubilidad de los compuestos orgánicos, se puede explicar en función de los puentes de hidrógeno resultantes entre los dos compuestos.
Cuando dos o mas moléculas quedan unidas por puente de hidrógeno, se tiene en realidad una molécula gigante y su existencia se puede apreciar con el aumento del punto de ebullición. Un ejemplo muy notable es el agua, que debiendo tener una temperatura de ebullición de - 1000C la tiene de +1000C en condiciones normales de presión, correspondería a una molécula ideal.
Anexo (2)
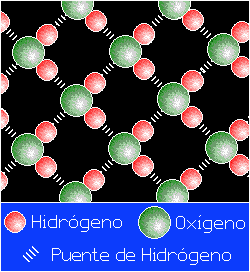
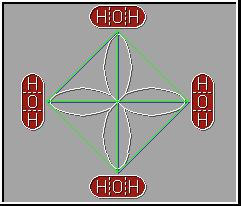
El enlace por puente de hidrógeno es responsable de controlar la orientación de las moléculas en el hielo lo que da lugar a una estructura de tipo cristalino muy abierta y esto hace que el hielo flote.
Anexo (3)
EXISTEN 2 TIPOS DE ENLACE POR PUENTE DE HIDRÓGENO.
INTERMOLECULAR E INTRAMOLECULAR.
Si el puente se establece entre dos moléculas diferentes ya sea de la misma o de diferente especie se le denomina enlace intermolecular, por ejemplo la molécula de agua, el ácido fluorhídrico etc.
Si el puente se estable entre dos elementos electronegativos de una misma molécula, el enlace se llama intramolecular, por ejemplo O- hidroxibenzaldehido, O- clorofenol etc.
Anexo (1)
Anexo(2)
|
|
|
|
Anexo (3)
Anexo (4)


Anexo(5)
18
Descargar
| Enviado por: | Bolt Crank |
| Idioma: | castellano |
| País: | México |