Química
Ácidos carboxílicos
ACIDOS CARBOXILICOS
INTRODUCCIÓN.
El grupo carboxilo, es uno de los grupos funcionales más abundantes en química y bioquímica. No sólo los ácidos carboxílicos son importantes en sí mismos, sino el grupo carboxilo es el grupo del cual se deriva una gran familia de compuestos.
ESTRUCTURAS
ACIDOS CARBOXILICOS.
Ar- R - COOH
FORMULA CONDENSADA
ACIDO DICARBOXILICO ALIFATICO:
HOOC - C - COOH
FORMULA CONDENSADA
ACIDO DICARBOXILICO AROMATICO:
Ar ( COOH )2
FORMULA CONDENSADA
NOMENCLATURA.
El hidrogeno, unido a un grupo arili o alquino puede unirse al grupo carboxili para producir la famili completa de acidos carboxilicos, las pruebas fisicas indican que los ácidos carboxilicos contienen tanto un enlace sencillo carbono oxígeno como un enlace doble carbono oxígeno
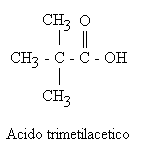
Los ácidos carboxílicos alifáticos se conocen desde hace mucho tiempo, por lo que tienen nombres triviales que se refieren a su origen que a sus estructuras químicas. Muchos ácidos carboxílicos tienen nombres comunes derivados de palabras griegas o latinas que indican una de sus fuentes naturales. El ácido metanoico se llama ácido fórmico (del latín , formica u hormiga). El ácido etanoico se llama ácido acético (del latín , acetum o vinagre). El ácido butanoico es uno de los compuestos responsables del olor de la mantequilla rancia, así pues, su nombre común es ácido butírico (del latín, caper o cabra).
Generalmente se considera como ácido matriz el de cadena carbonada más larga aunque algunos compuestos se nombran como derivados del ácido acético.
Los ácidos aromáticos, ArCOOH, generalmente se consideran como derivados del ácido benzoico, C6H5COOH. Los ácidos metilbenzoicos reciben los nombres especiales de ácidos toluicos.
SISTEMA UIQPA.
El sitema UIQPA requiere que se use la cadena continua mas larga de átomos de carbono que contiene el grupo carboxilo, como estructura original y se nombra reemplazando la o final del alcano correspondiente por la terminación oico y anteponiendo la palabra ácido;
por ejemplo:
CH3 CH2 CH2 CH2 COOH CH3 CH2 CH COOH CH3 CH = CH COOH
CH3
Acido pentanoico Acido 2-Metilbutanoico Acido 2-Butenoico
La posición de un substituyente se indica en forma usual, por medio de un número. Debemos observar que el carbono carbonílico siempre es considerado C-1, por lo que C-2 corresponde al de los nombres comunes, C-3 a y sucesivamente.
Nota: No mezcle letras griegas con nombres UIPAC o numerales árabes con nombres comunes.
El nombre de una sal de un ácido carboxílico consta del nombre del ácido, cambiándole la terminación ico por ato de, seguido por el del catión (sodio, potasio, amonio, etc.).
(CH3 COO)2 Ca HCOONH4 CH2 - CH - COOK
Br Br
Acetato de calcio. Formiato de amonio. , - Dibromopropionato de potasio
(2,3-Dibromopropanoato de potacio)
ESTRUCTURA.
De los compuestos orgánicos que presentan acidez apreciable, los ácidos carboxílicos son, los más importantes. Estas substancias con tienen el grupo carboxilo.
Si esta unido a un grupo alquilo (RCOOH), o a un grupo arilo (ArCOOH), o que se trate de un grupo alifático o aromático, saturado o no saturado, substituido o no, las propiedades del grupo carboxiloson esencialmente las mismas.
PROPIEDADES FISICAS DE LOS ACIDOS CARBOXILICOS
Sus estructuras hacen suponer que los ácidos carboxílicos sean moléculas polares y , tal como los alcoholes, pueden formar puentes de hidrógeno entre sí y con otros tipos de moléculas. Los ácidos carboxílicos se comportan en forma similar a los alcoholes en cuanto a sus solubilidades : los primeros cuatro son miscibles con agua, el ácido de cinco carbonos es parcialmente soluble y los superiores son virtualmente insolubles. La solubilidad en agua se debe a los puentes de hidrógeno entre el ácido carboxílico y el agua. El ácido aromático más simple, el benzoico, contiene demasiados átomos de carbono como para tener una solubilidad apreciable en agua.
Los ácidos carboxílicos son solubles en solventes menos polares, tales como éter, alcohol, benceno, etc. Los ácidos carboxílicos hierven a temperaturas aún más altas que los alcoholes. Estos puntos de ebullición tan elevados se deben a que un par de moléculas del ácido carboxílico se mantinen unidas no por un puente de hidrógeno sino por dos.
Los olores de los ácidos alifáticos inferiores progresan desde los fuertes e irritantes del fórmico y del acético hasta los abiertamente desagradables del butírico, valeriánico y caproico; los ácidos superiores tienen muy poco olor debido a sus bajas volatilidades.
Las sales de los ácidos carboxílicos son sólidos cristalinos no volátiles constituidos por iones positivos y negativos y su propiedades son las que corresponden a tales estructuras. Las fuerzas electrostáticas considerables que mantienen los iones en el retículo cristalino sólo pueden superarse por un calentamiento a temperatura elevada o por medio de un solvente muy polar. La temperatura requerida es tan alta que, antes de lograrla, se rompen enlaces carbono-carbono y se descompone la molécula, lo que sucede generalmente entre los 300-400°C. Raras veces es útil un punto de descomposición para la identificación de una substancia , puesto que, generalmente , refleja la rapidez del calentamiento que la identidad del compuesto.
Las sales de sodio y potasio de la moyoría de los ácidos carboxílicos son fácilmente solubles en agua. Es el caso de ácidos carboxilicos de cadena larga. Estas sales son los principales ingredientes del jabón.
Debido a la fácil interconversión de ácidos y sus sales, este comportamiento puede emplearse de dos modos importantes: para identificación y para separación.
PROPIEDADES QUIMICAS DE LOS ACIDOS CARBOXILICOS
Desde el punto de vista químico los ácidos carboxílicos reaccionan rápidamente con soluciones acuosas de hidróxido de sodio y bicarbonato de sodio formando sales de sodio solubles, y por lo tanto, para distinguir los ácidos carboxílicos insolubles en agua de los fenoles y alcoholes insolubles en agua pueden utilizarse pruebas de solubilidad y la insolubilidad de los últimos en base acuosa. Los ácidos carboxílicos insolubles en agua se disolverán en hidróxido de sodio acuoso o en bicarbonato de sodio acuoso. Una vez lograda la separación, podemos regenerar el ácido por acidulación de la solución acuosa. Si estamos trabajando con sólidos, simplemente agitamos la mezcla con base acuosa y luego filtramos la solución para separar el insoluble que son las substancias no ácidas; la adición del ácido al filtrado precipita el ácido carboxílico, el cual puede recogerse con un filtro. Si estamos trabajando con líquidos, agitamos la mezcla con base acuosa en un embudo de decantación y separamos luego la capa acuosa de la orgánica insoluble; la acidificación de la capa acuosa, nuevamente libera al ácido carboxílico el cual puede separarse del agua. Para que la separación sea completa y de fácil manejo , por lo general agregamos un solvente insoluble en agua, tal como el éter, a la mezcla acidificada: el ácido carboxílico es extraído del agua por el éter, en el cual es más soluble; el éter volátil se separa fácilmente por destilación ya que el ácido hierve a temperatura relativamente muy alta.
RCOOH + NaOH RCOONa + H2O
Acido mas fuerte Acido mas debil
insoluble en agua soluble en agua
Cuando la substancia desconocida es soluble en agua, queda comprobada su acidez por el burbujeó de CO2
RCOOH + NaHCO3 RCOONa + H2O + CO2
insoluble en agua soluble en agua
Los fenoles insolubles en agua se disuelven en hidróxido de sodio acuoso pero, a excepción de los nitrofenoles, no se disuelven en bicarbonato de sodio acuoso. El grupo nitro es un aceptor de electrones, que desactiva al anillo aromático hacia la reacción con los electrófilos y es un meta director. Por lo tanto, el grupo nitro en el ácido p-nitrobenzoico debe aumentar la acidez del compuesto arriba de la del benzoico. Los valores Ka del ácido benzoico y del p-nitrobenzoico son, 6.4 x 10-5 y 3.8 x 10-4.
ESTERIFICACION.
Los ácidos carboxílicos, y también los oxiácidos inorgánicos, reaccionan con los alcoholes con eliminación de una molécula de agua y formación de ésteres. Esta reacción se llama esterificación. Se ha formulado la reacción del ácido con el alcohol con el signo de reversibilidad, porque efectivamente el agua formada actúa sobre el éster hidrolizándolo y recuperando el ácido y el alcohol.
SAPONIFICACION.
La reacción inversa de la esterificación se llama hidrólisis o saponificación:
Esterificación
ácido + alcohol éster + agua
saponificación
Después de cierto tiempo de iniciada la reacción se alcanza el equilibrio, debido a que se iguala la velocidad en ambos sentidos. Se puede aplicar entonces la ley de las masas.
K = [ácido ] [alcohol]
[ éster ] [ agua ]
De esta ecuación se deduce que, siendo K constante, se favorece la esterificación aumentando la concentración de ácido y de alcohol o eliminando el agua mediante un deshidratante (ácido sulfúrico concentrado).
METODOS DE PREPARACION DE LOS ACIDOS CARBOXILICOS
La mayor parte de los ácidos de cadena lineal y algunos ácidos aromáticos se obtienen de fuentes naturales. Los ácidos con un número par de átomos de carbono son mucho más abundantes. Pueden prepararse otros ácidos caraboxílicos por los métodos que se exponen a continuación.
OXIDACION DE LOS ALCOHOLES PRIMARIOS.
La oxidación es el método más directo; algunos de los ácidos alifáticos inferiores se hacen con alcoholes disponibles y los ácidos aromáticos substituidos, a partir de toluenos substituidos. Sin embargo, los alcoholes de cadena normal carbonada con un número impar de átomos de carbono son tan escasos como los ácidos en las fuentes naturales.
Los alcoholes primarios pueden oxidarse a ácidos carboxílicos, RCOOH, generalmente calentando con KMnO4 acuoso. Una vez completada la reacción, se filtra la sal potásica soluble del ácido carboxílico para separar MnO2 , siendo liberado, a continuación el ácido con otro mineral más fuerte.
KMnO4 o K2Cr2O7
RCH2OH ---------------------------> Ar - COOH
KMnO4
CH3 CH CH2 OH --------------------> CH3 CH COOH
CH3 CH3
Alcohol isobutílico Acido isobutírico
OXIDACION DE LOS ALQILBENCENOS.
KMnO4 o K2Cr2O7
Ar - R --------------------------> Ar - COOH
K2Cr2O7 , H2SO4
O2N CH3 ------------------------------> O2N COOH
calor
Aunque los alcanos y el benceno son bastantes inertes frente a los agentes oxídantes usuales (KMnO4, K2Cr2O7, etc.), el anillo bencénico sensibiliza bastante las cadenas laterales alífaticas para la oxidación. La cadena lateral se oxida completamente, quedando sólo un grupo carboxilo (- COOH) para indicar la posición de la cadena original. Generalmente, se emplea permanganato de potasio para este fin, aunque también puede usarse dicromato de potasio o bien ácido nítrico diluido. Sin embargo, la oxidación de una cadena lateral es más difícil que la de un alqueno y requiere tratamiento prolongado con KMnO4 caliente.
KMnO4 caliente
CH2 CH2 CH2 CH3 ---------------------------> COOH y CO2
n- Butilbenceno Acido benzoico
Uno de los métodos más útiles para preparar un ácido carboxílico aromático comprende la oxidación del alquilbenceno adecuado.
METODOS COMUNES DE PREPARACION DE LOS ACIDOS CARBOXILICOS
METODO DE GRIGNARD.
Uno de los métodos más útiles para preparar ácidos carboxilicos alifaticos y aromaticos empieza con el aluro de alquilo correspondiente, el cual se convierte primero en el reactivo de Grignnard correspondiente y luego se deja reaccionar.
Mg CO2 H+
RX -----> RMg X -------> RCOOMgX -------> RCOOH (o Ar COOH)
La síntesis de Grignard de un ácido carboxílico se realiza burbujeando CO2 gaseoso por una solución etérea del reactivo, o bien virtiendo el reactivo de Grignard sobre hielo seco molido (CO2 sólido); en este último caso, el hielo seco no sólo sirve de reactivo, sino también de agente refrigerante.
El reactivo de Grignard se adiciona al doble enlace carbono-oxígeno, en la misma forma que en los aldehídos y las cetonas. El producto es la sal magnésica del ácido carboxílico, de la cual se libera por tratamiento con ácido mineral.
Para preparar el reactivo de Grignard se puede emplear halogenuros primarios, secundarios, terciarios o aromáticos; sólo queda limitado el método por la presencia de otros grupos reactivos, en la molécula.
CH3 CH3 CH3
Mg CO2 H+
C2H5-C-Cl ----> C2H5-C-MgCl -----> ----> C2 H5-C-COOH
CH3 CH3 CH3
Cloruro de t - pentilo Acido. Etildimetil-acético. (Acido 2,2-dimetilbutanoico)
HIDRÓLISIS DE NITRILOS.
Los nitrilos alifáticos se preparan por tratamiento de los halogenuros de alquilo con cianuro de sodio, en un solvente que disuelva ambos reaccionantes; en dimetilsulfóxido la reacción se realiza a temperatura ambiente con rapidez y exotérmicamente. Luego se hidroliza el nitrilo resultante, hirviendo con ácido o álcali acuosos para generar el ácido.
DERIVADOS FUNCIONALES DE LOS ACIDOS CARBOXILICOS
HALOGENUROS DE ACILO.
INTRODUCCIÓN.
Los compuestos derivados de los ácidos carboxilicos presentan un sustituyente que contiene oxígeno, nitrógeno o un átomo de halógeno unido al doble enlace carbono-oxígeno. Estos derivados son compuestos en los que el -OH de un grupo carboxilico ha sido reemplazado.
NOMENCLATURA.
Los halogenuros de acilo, que también se llaman halogenuros de ácido, se nombran de acuerdo con el sistema UIPAC y también en el sistema común, substituyendo la palabra ácido por la palabra halogenuro, según el halógeno correspondiente, y cambiando la terminación ico del ácido por ilo. La posición de los substituyentes se indica en igual forma que en el caso de los ácido; en el sistema de la IUPAC se emplean números y en el sistema común, letras griegas.
ESTRUCTURA.
Todos los derivados de los ácidos carboxilicos contienen el grupo acilo:
CLORURO DE ACILO.
Los cloruros de acilo forman su nombre al eliminar la terminación del ácido ico tanto en nombre común del ácido carboxilico correspondiente y agreagando la del cloruro ilo.
( Ar -) RCOCL
FORMULA CONDENSADA
ESTER:
Los esteres se sintetizan a partir de dos entidades orgánicas un ácido y un alcohol.
(Ar) RCOOR O (Ar) ROCOR
FORMULA CONDENSADA
AMIDA:
Las amidas toman su nombre al cambiar la terminación ico del nombre común del ácido carboxilico a - amida.
(Ar) RCOONR2
FORMULA CONDENSADA
ANHIDRIDO:
Los anidridos se forman a partir de dos moles de un ácido carboxilicos por eliminación de una molécula de agua.
(Ar) RCOOOCOR (Ar)
FORMULA CONDENSADA
PROPIEDADES FISICAS Y QUIMICAS
Los halogenuros de acilo no tienen hidrógenos ácidos, no se asocian por puentes de hidrógeno y tienen puntos de ebullición menores que los ácidos de los que provienen. Son solubles en la mayoría de los disolventes orgánicos y tienen olores irritantes que posiblemente se deban a que reaccionan fácilmente con la humedad del aire y experimentan la hidrólisis a fin de producir el ácido clorhídrico. Los halogenuros de acilo se hidrolizan con agua produciendo el ácido correspondiente. Frecuentemente esta reacción es exotérmica y muy rápida. Los halogenuros de ácidos aromáticos no reaccionan muy rápidamente con agua, a temperatura ambiente. Esto se debe, probablemente, a que la carga positiva sobre el carbono del acilo se puede dispersar, en parte, en el anillo aromático. Por lo que, el átomo de carbono del acilo de un halogenuro aromático es menos electrofílico que el de un halogenuro alifático.
Los alcoholes primarios y secundarios reaccionan fácilmente con los halogenuros de ácido formando ésteres. Este método es excelente para la preparación de ésteres.
Los alcoholes terciarios reaccionan con los halogenuros de acilo, en presencia de una base o un metal activo, tal como magnesio, produciendo ésteres. En ausencia de la base o del metal, los halogenuros de ácido transforman los alcoholes terciarios en alquenos o halogenuros de alquilo terciarios. Los halogenuros de acilo también reaccionan con los fenoles produciendo ésteres; los fenoles tienen un grupo oxhidrilo directamente unido a un anillo aromático.
Los halogenuros de ácido reaccionan con el amoníaco y también con aminas primarias y secundarias produciendo amidas.
Los ácidos reaccionan con halogenuros de ácido, en presencia de piridina, produciendo anhídridos. Los halogenuros de ácidos reaccionan con peróxido de sidio formando peróxidos orgánicos. Los peróxidos de acilo son inestables y se descomponen fácilmente produciendo radicales libres. Por esta razón los peróxidos de acilo se emplean como iniciadores de reacciones por radicales libres. Los reactivos organometálicos son fuertemente neuclofílicos y es de esperarse que reaccionen con los halogenuros de ácido. Aunque se han empleado reactivos organometálicos de muchos metales distintos para hacerlos reaccionar con los halogenuros de ácido, los más usados son los organocádmicos, los cuales reaccionan con halogenuros de ácido produciendo cetonas.
El fosgeno puede considerarse un cloruro de ácido derivado del ácido carbónico, H2CO3. El fosgeno se prepara mediante la reacción entre monóxido de carbono y cloro.
carbón
activado
Cl2 + CO ------------> Cl - C -Cl
200°-295°
Fosgeno
PREPARACION.
Los halogenuros de ácido se obtienen mediante la reacción del ácido respectivo con un agente halogenante de tipo ácido.
RCOH + SOCl2 , PCl3 , PCl5 ó PBr3 -------> RCX
Estos mimos halogenuros de ácidos inorgánicos se emplean para substituir un grupo de oxhidrilo de un alcohol mediante un halógeno. Los halogenos de hidrógeno, que pueden emplearse para obtener halogenuros de alquilo a partir de los alcoholes, no puede usarse para transformar los ácidos en halogenuros de ácilo.
ANHÍDRIDOS
INTRODUCCION.
Los anhídridos se forman a partir de dos moles de un ácido carboxílico por eliminación de una molécula de agua. Los anhídridos cíclicos se forman a partir de ciertos ácidos dicarboxílicos a través del cierre interno del anillo y la pérdida de agua.
NOMENCLATURA.
Los anhídridos forman su nombre al tomar ya sea el nombre común o el del sistema UIQPA del ácido o diácido y al cambiar la denominación ácido a anhídrido. Casi siempre se emplea el nombre común.
ESTRUCTURA.
(Ar- ) R - C - O - C - R (-Ar) ó (Ar) R COOCOR (Ar)
Fórmula estructural Fórmula condensada
AMIDAS
INTRODUCCION.
Las amidas resultan al sustituir los átomos de hidrógeno del amoniaco por radicales ácidos (orgánicos o inorgánicos), pudiendo ser primarios, secundarias y terciarias, según el número de átomos reemplazados.
NOMENCLATURA.
La nomenclatura de las amidas se hace derivar de los nombres de los correspondientes hidrocarburos, o bien se forman con la raíz del nombre del ácido y la palabra amida.
Los nombres de las amidas que no tienen sustituyentes en el nitrógeno se forman eliminando la terminación -ico del nombre común de ácido oico del nombre UIQPA y agregando la terminación amida.
O O
CH3 -C - NH2 CH3CH2C- NH2
Acetamida o etanamida Propananida
Cuando hay sustituyentes en el átomo de nitrógeno de las amidas estos reciben los nombres de los grupos alquilo y el nombre del sustituyente va precedido de N-, o N, N-.
ESTRUCTURA.
(Ar-) R- C - NR'2 o (Ar) R C ONR'2
Fórmula estructural Formula condensada
PREPARACION.
Cuando un cloruro de acilo reacciona con un exceso de amoniaco acuoso concentrado, frío, el cual se obtiene como hidróxido de amonio concentrado en el laboratorio, se produce una amida:
O H2O O
R - C - Cl + 2NH3 -------> R - C- NH2 + NH4+ + Cl -
Frío
concentrado
La molécula de amoniaco nucleofílica se adiciona al grupo acilo y forma el intermediario tetraédico, el cual se descompone para producir una amida protonada. Otra malécula de amoniaco actúa como base y abstrae un protón a partir de la amida protonada para dar lugar a una amida libre y a un ion amonio.
La reacción entre un cloruro de acilo y una amina es bastante general ya que la amina puede ser amoniaco o una amina primaria o secundaria (RNH2 o R2NH, respectivamente). No puede usarse las aminas terciarias.
O NH3 O
CH3 - C - Cl -------> CH3 - C- NH2
frío
Cloruro de etanoilo Etanamida
(Cloruro de acetilo) (acetamida)
ESTERES
INTRODUCCION.
Los ésteres se sintetizan a partir de dos entidades orgánicas: un ácido y un alcohol o un fenol. Estos derivados funcionales de los ácidos carboxílicos, guardan estrecha relación con estós y entre ellas mismas. De manera similar a los otros derivados. Son compuestos en los que el -OH de un grupo carboxilo ha sido reemplazado por -OR'.
NOMENCLATURA.
Tanto en el sistema de la UIQPA como en el sistema común, se enuncia primero el nombre del anión del ácido y a continuación el nombre del grupo alquilo del alcohol. El nombre de la parte ácida del éster se obtiene substituyendo la terminación ico por la terminación ato; las dos palabras se unen mediante la preposición de. La posición de los substituyentes en la parte ácida se designa en la misma forma que en los ácidos, considerando el carbono del carbonilo como el número uno. Los números de los substituyentes en la parte alcohólica son independientes de la numeración en la parte ácida; el átomo de carbono directamente unido al oxígeno alquílico lleva el número uno.
CH3 O OH O
CH3 - CH - C - O - CH2 - Cl CH3 - CH - CH2 -C - O CH3
3 2 1 1 2 4 3 2 1
2- Metilpropanoato de 2-cloroetilo 3-Hidrixibutanoato de metilo
(Isobutirato de - cloroetilo) ( - Hidroxibutirato de metilo)
ESTRUCTURA.
La fórmula general de los ésteres tiene el mismo rasgo estructural común: el doble enlace carbono-oxígeno, ya que el ácido carboxílico es el compuesto original.
O
(Ar-) R -C - OR' o (Ar) RCOOR' o (Ar) ROCOR'
Fórmula estructural Fórmula condensada
PREPARACION.
Los ésteres pueden prepararse mediante varios métodos uno de los cuales es la reacción entre un cloruro de acilo y un alcohol o fenol.
El método más importante para preparar un éster es la reacción catalizada por ácido entre un ácido y un alcohol, el cual recibe el nombre de estereficación de Fischer.
O H+ calor O
(Ar-) R - C -OH + R'OH -----------> (Ar-) R - C - OR' + H2O
<-------------
Acido Alcohol Ester
Este método es particularmente versátil debido a que la mayoría de los alcoholes pueden conseguirse en el marcado y son poco costosos. En términos experimentales, la reacción se lleva a cabo usando un gran exceso de alcohol con una pequeña cantidad de ácido sulfúrico como catalizador. El alcohol a menudo sirve como disolvente para la reacción .
HIDROXIACIDOS
INTRODUCCION.
El estudio de compuestos que tienen más de un grupo funcional afecta el comportamiento de otro. Estas interacciones de los distintos grupos funcionales se explican mediante los distintos grupos funcionales, mediante los conceptos de resonancia, efectos inductivos, efectos estéricos o una combinación de éstos. El estudio de los ácidos con substituyentes oxhidrilo, halógeno o carbonilo, tiene interés, debido a que puede ocurrir interacciones de tipo químico entre dichos grupos funcionales; además estos compuestos tienen utilidad en procesos de síntesis.
NOMENCLATURA.
Debido a que en la nomenclatura el grupo carboxilo tiene preferencia sobre el grupo oxhidrilo, la presencia de la función alcohol en un hidroxiácido o hidroxíester se indica mediante el prefijo hidroxi, olvidando el sufijo ol. En el sistema de la UIQPA la posición del grupo oxhidrilo se indica mediante números; en el sistema común, mediante letras griegas.
CH3 CH OO CH3 - CH3 CH2 CH COOH
OH OH
2 - Hidroxipropionato de metilo Acido 2 - Hidroxi- 4 - fenilbutanoico
- Hidroxipropianato de metilo Acido - hidroxi - - fenilbutírico.
PREPARACION.
Los hidroxiácidos se encuentran frecuentemente como productos naturales. Existen algunos métodos de preparación como:
1.- Condensación aldólica seguida de oxidación selectiva (para obtener - hiroxiacidos).
H R OH
OH- [ O ]
2RCH2 -C- O ------> R - CH2 - CH - CH - CHO -----> R CH2 CH CH COOH
reactivo
OH de Tollens OH
La condensación aldólica origina un - Hidroxialdehido. Si el aldehido original tiene dos átomos de hidrógeno podrá ser fácilmente sustraido por la base y podrá ocurrir una segunda condensación aldólica. Sin embargo, existe una reacción que puede competir con ésta última, la eliminación del protón en , seguida de la perdida del grupo oxhidrilo en formándose un aldehido insaturado. Se puede pensar que el par de electrones que retenía el átomo de hidrogeno , se desplaza, formando un enlace con el átomo de carbono y forzando la salida del grupo oxhidrilo.
Si se elimina agua se obtendrá un aldehido , no saturado, en el que existe un doble enlace conjugado con el grupo carbonilo, encontrándose estabilizados por resonancia. Por lo tanto los aldoles perderán agua en forma espontanea, produciendo un aldehido insaturado como producto de la reacción, en vez del aldol esperado.
2.- Mediante la síntesis de cianohidrinas, seguida de hidrólisis para - hidroxiácidos.
O OH R'
NaCN H2O
R - C - R' + HCN --------> R - C - R' -------> R - C - COOH + NH4+
H+
CN OH
El cianuro de hidrógeno adiciona a la mayoría de los aldehidos y a muchas cetonas, produciendo cianhidrinas. En una técnica de síntesis común se trata el compuesto carbonilico con cianuro de sodio o potasio. Algunas veces, para evitar el manejo del cianuro de hidrógeno líquido (excesivamente tóxico) se emplea cianuro de sodio y un ácido para producir el HCN.
AMINOÁCIDOS
INTRODUCCION.
En particular, se presenta la química de los - aminoácidos, aquéllos en los cuales el grupo amino (-NH2) y el grupo carboxilo (-COOH) se enlazan al mismo átomo de carbono.
ESTRUCTURA.
El término aminoácido, en su sentido más general se refiere a cualquier molécula que contenga tanto un grupo amino (-NH2) como un grupo carboxilo (-COOH). Sin embargo, por convención el término generalmente denota un miembro de la familia de los - aminoácidos, moléculas en las que el grupo amino se encuentra en el átomo de carbono al carbono del carboxilo. La estructura general de la mayoría de los -aminoácidos es:
H O
R - C - C - OH
NH2
NOMENCLATURA.
Los aminoácidos que se obtienen en la hidrólisis de proteínas son - aminoácidos. Estos compuestos pueden nombrarse de acuerdo con las reglas de la UIPAC, pero más frecuentemente se emplean los nombres comunes. Aun cuando estos aminoácidos existen como iones dipolares, RCH(NH3+)COO- , por razones históricas se nombran en el sistema de la UIPAC como si tuvieran la fórmula RCH(NH2)COOH.
PREPARACION.
De los muchos procedimientos desarrollados para sintetizar aminoácidos, sólo se estudiará uno: la aminación de ácidos - halogenados. Considerando sus diversas modificaciones, probablemente sea el de utilidad más general, aunque al igual que otros métodos no es aplicable a la síntesis de todos los aminoácidos.
A veces se somete un -cloro o -bromoácido a una amonólisis directa con un gran exceso de amoniaco acuoso concentrado
Br2, NH3(exceso)
CH3CH2COOH --------> CH3CHCOOH -----------------> CH3CHCOO
Br NH3
Acido propiónico Acido -bromopropionico Alanina
La síntesis de un péptido o una proteína requiere aminoácidos como materiales iniciales. El cuerpo humano puede obtener la mayoría de los aminoácidos que requiere, mediante una variedad de caminos metabólicos empezando por los carbohidratos o lípidos. El nitrógeno necesario para la conversión, puede obtenerse de muchas formas, a menudo como ion amonio, el cual se origina a su vez de la degradación de la proteína ingerida por los organismos. La conversión de -cetoglutarato a L-glutamato mediante la acción de la enzima NADH es un ejemplo de un proceso de este tipo.
Descargar
| Enviado por: | María Gabriela Randazzo |
| Idioma: | castellano |
| País: | España |
