Química
Cinética química
TEMA 9: CINÉTICA QUÍMICA
-
INTRODUCCIÓN
-
LEY DE VELOCIDAD
1. EXPRESIÓN DE LA VELOCIDAD DE REACCIÓN.
INFLUENCIA DE LA NATURALEZA DE LOS REACTIVOS.
INFLUENCIA DE LA CONCENTRACIÓN DE LOS REACTIVOS.
ECUACIONES INTEGRALES DE VELOCIDAD.
Reacciones de primer orden.
Reacciones de segundo orden.
-
ORDEN DE REACCIÓN Y MOLECULARIDAD.
-
ENERGÍA DE ACTIVACIÓN: EFECTO DE LA Tª.
-
CATALISIS.
INTRODUCCIÓN.
![]()
: Reacción espontánea.
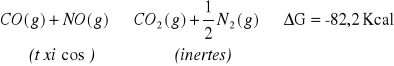
Esta reacción es muy lenta.
![]()
También es muy lenta.
Velocidad de reacción: Medida de la rapidez con que se forman los productos y se consumen los reactivos.
Equilibrio dinámico: Estado de equilibrio en el que se forman productos a partir de los reactivos y viceversa, a la misma velocidad.
Equilibrio químico: Nos da una idea de la extensión donde ocurre una reacción, donde sólo nos interesan los estados inicial y final.
Mecanismo de una reacción: Secuencia de reacciones intermedias que sufren los reactivos para dar los productos.
Cinética química: Rama de la química que estudia las velocidades de reacción y los mecanismos.
FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN:
Naturaleza de los reactivos.
Concentración de los reactivos.
Temperatura.
Presencia de catalizadores.
LEY DE VELOCIDAD.
Expresión de la velocidad de reacción ![]()
Existen dos formas de medida:
Velocidad de desaparición de los reactivos.
![]()
(velocidad instantánea)
Velocidad de formación de los productos.
![]()
(velocidad instantánea)
![]()
Naturaleza de los reactivos:
Las reacciones se dan rompiendo unos enlaces para formar otros.
![]()
![]()
En general, los reactivos iónicos producen reacciones mucho más rápidas que los compuestos moleculares.
Las reacciones entre iones de carga opuesta son mucho más rápidas; si además tienen la carga con distribución esférica, todavía será más rápida.
Si los iones son pequeños, la velocidad será mucho mayor; para iones grandes: IMPEDIMENTO ESTÉRICO.
Superficie específica: Los sólidos finamente divididos, debido a su mayor superficie, reaccionan más rápidamente, por tanto, la velocidad de reacción depende de la superficie de contacto efectiva.
Concentración de los reactivos:
Ley de velocidad para una reacción: ![]()
(1)
![]()
![]()
(2) ![]()
![]()
K : Constante específica de velocidad y, que tiene en cuenta la naturaleza de los reactivos, la temperatura y los posibles catalizadores.

cuando colisiona en la reacción, el nº de colisiones posibles es:
![]()
como ![]()
(si se dan todas las colisiones)
![]()
Ecuaciones integradas de velocidad:
Reacciones de primer orden:
![]()
![]()
![]()
Ecuación integrada.
![]()
![]()
Reacción de primer orden (![]()
va elevado a 1).
Reacciones de segundo orden:
![]()
Si ![]()
Ecuación integrada: ![]()
ORDEN DE REACCIÓN Y MOLECULARIDAD.
Orden de reacción: Magnitud experimental que representa el exponente con el que los reactivos intervienen en la ley de velocidad.
-
Primer orden:

![]()
exponente 1: orden total.
-
Segundo orden:

![]()
exponente 1+1 = 2 : orden total.
-
Tercer orden:

![]()
exponente 2+1 = 3 : orden total.
Orden de reacción total: Suma de los exponentes a los que están elevados los reactivos en la ley de velocidad, o lo que es lo mismo, suma de los órdenes parciales de cada reactivo.
Molecularidad: Es un concepto teórico que indica el nº de partículas individuales que participan en un paso elemental del mecanismo de reacción.
En los procesos (pasos) elementales del mecanismo de reacción pueden coincidir orden y molecularidad.
![]()
: proceso unimolecular: ![]()
![]()
: proceso bimolecular: ![]()
![]()
: proceso bimoñecular: ![]()
![]()
: proceso trimolecular: ![]()
CATALISIS.
La catálisis es el proceso por el cual una sustancia añadida a los reactivos es capaz de modificar la velocidad de la reacción, sin reaccionar ni con los reactivos ni con los productos (CATALIZADOR).
Existen dos tipos de catalizadores:
Catalizadores positivos: Aquellas sustancias que aceleran la reacción.
Catalizadores negativos o inhibidores: Sustancias que retardan la reacción.
-
Selectividad: Eficacia del catalizador para acelerar o retardar una reacción.
Los catalizadores actúan disminuyendo la ![]()
.
![]()
: si ![]()
.
Hay dos teorías para explicar como se produce una reacción:
Teoría de las colisiones: Sólo aquellas moléculas con energía![]()
, podrían dar lugar a choques efectivos.
Teoría del complejo activado: Los reactivos con suficiente ![]()
se combinan para dar lugar a la formación de un complejo intermedio de alta energía (COMPLEJO ACTIVADO).
Existen dos tipos de catálisis positivas:
Catálisis homogénea: Aquélla en la que el catalizador se encuentra en la misma fase que los reactivos.
Catálisis heterogénea: Aquélla en la que el catalizador se encuentra en una fase diferente a los reactivos.
En general, el catalizador será sólido.
Adsorción: Adhesión en la superficie del sólido.
-
Procesos básicos de la catálisis heterogénea:
1. Difusión de los reactivos hacia la superficie del catalizador.
2. Adsorción de los reactivos sobre el catalizador.
3. Reacción del complejo de adsorción para producir los productos.
4. Desorción de los productos del catalizador.
5. Difusión de los productos fuera del catalizador.
El catalizador puede cambiar el curso de una reacción.
![]()
: en condiciones normales se produce esta reacción.
![]()
: se produce si utilizamos un catalizador Pt-Rh (Platino-Rhodio).

Descargar
| Enviado por: | Mariano Julia |
| Idioma: | castellano |
| País: | España |
