Salud
Cáncer de endometrio
CÁNCER DE ENDOMETRIO
ÍNDICE
Pag.
1.- Concepto y frecuencia 3
2.- Epidemiología 4
3.- Anatomía patológica 10
4.- Etiopatogenia 21
5.- Historia natural 23
6.- Clínica 24
7.- Diagnóstico 25
8.- Estadificación 33
9.- Extensión 33
10.- Tratamiento 37
11.- Caso clínico 50
Bibliografía 55
1. CONCEPTO Y FRECUENCIA
El cáncer de endometrio es el cáncer más frecuente en los países industrializados después del de mama, pulmón y colon.
En EEUU, en el año 1996, se estima que se diagnosticaron 34.000 nuevos casos y se produjeron 6.000 muertes.
Más del 95 % de los cánceres de endometrio derivan del epitelio de las glándulas endometriales y aproximadamente un 3 % son sarcomas derivados del estroma.
La incidencia varía mucho de unos países a otros, oscilando entre el 22,2 por 100.000 mujeres, entre las de raza blanca de San Francisco, y el 0,4 de China.
La frecuencia varia también con la raza: entre las mujeres norteamericanas de los Ángeles es más frecuente en las blancas, seguidas de las latinas, japonesas, negras y chinas. Por último, la frecuencia varía con la edad: a los 40 años es de 12 por 100.000 y a los 60, de 84 por 100.000.
En las últimas décadas se viene señalando un incremento de su frecuencia en los países industrializados, que para unos es real y para otros es la consecuencia de la prolongación de la vida. El tratamiento de las mujeres menopausicas con estrógenos sin gestágenos es también otro factor que ha podido influir en el aumento de su incidencia.
2. EPIDEMIOLOGÍA
Aproximadamente el 50 % de las mujeres que padecen un cáncer de endometrio tiene una serie de características comunes, siendo el porcentaje aún mayor en las que tienen tumores bien diferenciados con lesiones previas de hiperplasia.
Edad
Como ya se ha indicado, es más frecuente en mujeres mayores. La edad media de aparición son los 60 años, con un pico de máxima frecuencia entre los 55 y 69 años. Sólo el 5 % de las enfermas con cáncer de endometrio tiene menos de 40 años.
Obesidad
Normalmente se asocia el cáncer de endometrio a la obesidad, existiendo muchos estudios en los que se señala esta relación.
Se estima que entre el 25 y el 70 % de las mujeres con cáncer de endometrio son obesas, pero el porcentaje de obesas que padecen un cáncer de endometrio es pequeño. El desarrollo del adenocarcinoma en las obesas depende de los estrógenos endógenos que se sintetizan en el tejido adiposo donde se aromatiza la androstendiona transformándose en estrona.
Hipertensión
La incidencia de hipertensión en posmenopáusicas con adenocarcinoma de endometrio oscila entre el 27 y 65 %, y para las premenopáusicas alrededor del 19%. La alta incidencia de hipertensión podría estar asociada a la obesidad.
Diabetes
Aunque hay trastorno del metabolismo de la glucosa que se relaciona con el adenocarcinoma de endometrio, este hecho no está completamente aclarado, debido a la metodología utilizada en los trabajos realizados sobre esta materia. Los criterios para definir el trastorno del metabolismo hidrocarbonado son muy dispares, no siempre se tiene en cuenta el peso y suelen ser trabajos de revisión. No hay un trabajo donde se haya demostrado en la autopsia de mujeres con adenocarcinoma de endometrio una mayor incidencia de lesiones diabéticas.
Actividad física
Recientes trabajos llegan a la conclusión de que las mujeres con una gran actividad física tienen menor riesgo de padecer adenocarcinoma de endometrio que las que hacen una vida sedentaria.
Anomalías menstruales y paridad
El riesgo de cáncer de endometrio aumenta en las mujeres con menarquia precoz y menopausia tardía. También se consideran factor de riesgo los trastornos menstruales y, sobre todo, los ciclos anovulatorios. Para las mujeres con anovulación crónica el riesgo se eleva. Existen también numerosos trabajos en los que se relaciona con la paridad, de tal forma que la esterilidad e hipofertilidad serían factores de riesgo.
Enfermedades hepáticas
Se ha descrito un aumento del riesgo de adenocarcinoma de endometrio en mujeres con ictericia. Esta relación se podría explicar a través de un aumento de los niveles de estrógenos derivados de una insuficiencia hepática incapaz de metabolizar de forma adecuada los estrógenos.
Antecedentes de radiación pélvica
Aunque en los trabajos realizados no se ha tenido en cuenta la posible interacción de otros factores, se ha encontrado un aumento del riesgo de adenocarcinoma en mujeres irradiadas por patología endometrial benigna u otro tipo de enfermedad pelviana.
En los cánceres de cérvix tratados solamente con radioterapia se ha descrito un aumento de la incidencia de un segundo tumor primario de endometrio.
Hábitos dietéticos
Se ha descrito un incremento del riesgo entre las consumidoras de carne poco hecha, mientras que este incremento no existía entre las que comían carne cocida. El riesgo no aumenta o disminuye en las mujeres cuya alimentación es a base de vegetales y pescado.
A la vitamina A y a los carotenos se les atribuye una acción protectora del endometrio.
Tabaquismo
Se considera el tabaquismo como un factor protector del cáncer de endometrio. Esta acción protectora se produciría a través de los estrógenos, bien porque acelera su metabolismo o porque disminuye su producción. Este efecto protector no parece existir en el caso de las mujeres premenopáusicas, en las que algunos han descrito un aumento del riesgo.
Estrógenos
La relación entre estrógenos y cáncer de endometrio es conocida y admitida desde hace varias décadas.
Las mujeres que presentan tumores productores de estrógenos, como son los de células de la granulosa y teca, padecen con mucha frecuencia hiperplasia de endometrio y cáncer de endometrio, que oscila entre el 3,5 y 18 % en las premenopáusicas y entre el 12 y 28 % en las posmenopáusicas. Estas variaciones en cuanto a la frecuencia se relacionan con la duración de la enfermedad (tiempo que ha estado expuesta a los estrógenos) y la cantidad de estrógenos producidos por la tumoración.
Estrógenos de origen extraovárico
El adenocarcinoma se da fundamentalmente en mujeres posmenopáusicas justo en la época de insuficiencia ovárica, cuando el ovario no produce estrógenos. Parece contradictorio que estas mujeres sean las que padezcan hiperplasia y adenocarcinoma de endometrio cuando tienen niveles de estrógenos muy inferiores a los de las mujeres jóvenes. La estimulación endometrial en las mujeres posmenopáusicas se produce por los estrógenos de origen extraovárico. Estas mujeres, a partir de la androstendiona sintetizada en las suprarrenales y de otros andrógenos de origen ovárico, sintetizan estrógenos por aromatización en la masa muscular y, sobre todo, en la grasa.
Estos hechos demuestran cómo las mujeres posmenopáusicas pueden desarrollar hiperplasia y cáncer de endometrio debido a la acción de los estrógenos de origen extragonadal que, aunque en cantidades no elevadas, actúan durante mucho tiempo sobre el endometrio sin tener el efecto moderador de la progesterona cíclica.
Estrogenoterapia
La relación entre estrogenoterapia y patología endometrial es evidente. Hay tres circunstancias en las que es frecuente el tratamiento con estrógenos: en las disgenesias gonadales, como método anticonceptivo y en el tratamiento hormonal sustitutivo de la menopausia. A éstas hay que sumar tratamientos en oncología que, como el tamoxifeno, tienen una acción estrogénica en el endometrio.
• La estrogenoterapia sin la combinación de un gestágeno en mujeres con disgenesia gonadal, en las que es obligado el tratamiento prolongado, aumenta el riesgo de adenocarcinoma
endometrial.
• Anticoncepción: los anticonceptivos orales secuenciales aumentan el riesgo de cáncer de endometrio; este tipo de anticoncepción ya no se usa y su acción debe atribuirse al elevado efecto estrogénico que tenían estos preparados, con una leve acción gestágena. Los anticonceptivos orales combinados utilizados en la actualidad disminuyen el riesgo de adenocarcinoma de endometrio hasta en un 50 %.
• Estrogenoterapia en la menopausia. El riesgo de adenocarcinoma en mujeres menopáusicas tratadas con estrógenos es conocido desde los años cincuenta. Se demuestra cómo la THS solamente con estrógenos aumenta el riesgo de cáncer de endometrio y que este aumento está relacionado con su duración.
Los cánceres que se producen son muy diferenciados, menos agresivos y tienen un porcentaje de curación muy alto. El riesgo de padecer cáncer endometrial se mantiene hasta pasados 10 años después de dejar el tratamiento.
La adición de progesterona u otro gestágeno a la THS con estrógenos disminuye el riesgo de cáncer de endometrio hasta equipararse con el de las mujeres no tratadas.
3. ANATOMÍA PATOLÓGICA
Características macroscópicas
Macroscópicamente el carcinoma endometrial puede aparecer en úteros de tamaño normal o bien pequeños, en mujeres menopáusicas con atrofia uterina, o en úteros discreta o moderadamente aumentados de tamaño. Tras la apertura del útero aparece básicamente bajo dos formas:
_ Como un tumor localizado, bien circunscrito a una pequeña zona en la que aparece una mucosa discretamente prominente (los carcinomas incipientes), o como una masa poliposa más o menos grande.
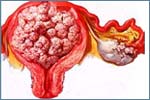
_ Como un tumor difuso que afecta a gran parte o toda la superficie de la cavidad uterina. Su consistencia suele ser blanda, frecuentemente friable. A menudo la masa tumoral rellena la totalidad de la cavidad uterina, distendiéndola. Su color es grisáceo y frecuentemente rojizo por las hemorragias que en él se producen. Su origen más frecuente es la región fúndica. El carcinoma crece exofíticamente e invade en profundidad el miometrio. La invasión del miometrio no siempre es evidente a la inspección macroscópica y no parece existir una correlación entre el grado de crecimiento exofítico y el infiltración del miometrio
Características histológicas
Actualmente se reconoce una serie de subvariedades de carcinoma endometrial que básicamente divide en dos grupos:
1, relacionado con los estrógenos;
2, no relacionado con los estrógenos.
Carcinoma endometrioide (relacionado con los estrógenos)
Son los carcinomas de endometrio más frecuentes (aproximadamente el 85 %) y se ha demostrado relación con el hiperestronismo y con la hiperperplasia de endometrio.
La hiperplasia de endometrio consiste en un crecimiento excesivo y continuo de las glándulas endometriales debido a un estímulo también erosivo y continuo de tipo estrogénico. Histológicamente presenta variados aspectos.
Actualmente se distinguen dos grupos: la hiperplasia de bajo grado y la de alto grado. Las hiperplasias de bajo grado comprenden la hiperplasia simple y la hiperplasia compleja. La hiperplasia simple muestra un endometrio con alteraciones de la arquitectura de las glándulas de intensidad variable, que presentan un patrón histológico irregular y pueden contener formaciones glandulares quísticas, dando la imagen de queso suizo (hiperplasia glandular quística de las clasificaciones antiguas). Los epitelios de las glándulas son semejantes a los del endometrio proliferativo, aunque las mitosis no suelen ser tan abundantes. El estroma es celular y aparece incrementado.
La hiperplasia compleja se caracteriza por un aumento del número y tamaño de las glándulas endometriales, lo que da lugar a una mayor densidad glandular y a un estroma más escaso entre ellas.
Característicamente los epitelios glandulares producen evaginaciones digitiformes (gemaciones) que se insinúan en el estroma circundante. Los epitelios glandulares suelen mostrar una mayor estratificación de los núcleos que en la hiperplasia simple, pero su entorno se mantiene regular y no existe atipia citológica.
Las hiperplasias de alto grado muestran características de las hiperplasias simples o complejas, pero adicionalmente presentan atipia citológica, que es lo que las caracteriza y distingue de las hiperplasias de bajo grado.
Esta clasificación de las hiperplasias ha supuesto un gran avance en el conocimiento del desarrollo del adenocarcinoma endometrioide. En primer Jugar, porque es mucho más fácilmente reproducible y en segundo lugar, porque se ha encontrado una relación entre sus diversos grados y La progresión a carcinoma. Así, la hiperplasia simple se ha visto que progresa tan sólo en el 1 % de los casos a carcinoma, regresa en el 80% y persiste en el 19%, y la hiperplasia compleja progresa a carcinoma en el 3 %, regresa en el 80% y persiste en el 17%. Sin embargo, en las hiperplasias de alto grado, la hiperplasia simple atípica progresa a carcinoma en el 8 % de los casos, regresa en el 70 % y persiste en el 23 %, y la hiperplasia compleja atípica progresa a carcinoma en el 29 %, regresa tan sólo en el 57 % y persiste en el 14%. Estas diferencias en la evolución a carcinoma entre las diferentes variantes de hiperplasia son estadísticamente significativas y naturalmente tienen implicaciones pronosticas.
El adenocarcinoma endometrioide se caracteriza histológicamente por presentar formaciones pseudoglandulares, mejor o peor definidas, revestidas por células cilíndricas que muestran estratificación y atipia nuclear, aumento del número de mitosis, así como mitosis atípicas y escaso estroma fibroso con infiltración de células de la inflamación entre las formaciones glandulares.
La agresividad del carcinoma endometrioide es variable y está en relación con su grado de diferenciación. Por ello, el carcinoma endometrioide debe ser evaluado histológicamente en grados. Siguiendo a la FIGO se reconocen tres grados: G-l, carcinoma endometrioide bien diferenciado, que presenta formaciones pseudoglandulares fácilmente reconocibles; G-2, moderadamente diferenciado, con formaciones pseudoglandulares bien formadas entremezcladas con áreas de crecimiento sólido de células atípicas; y G-3, carcinoma endometrioide mal o pobremente diferenciado, constituido por sábanas y nidos de células epiteliales atípicas sin que se encuentren luces de formaciones pseudoglandulares.
Entre los carcinomas endometrioides pueden distinguirse las siguientes variedades:
Adenoacantoma
El adenoacantoma constituye el 25 % de los adenocarcinomas con patrón endometrioide. Se caracteriza histológicamente porque presenta focos más o menos amplios de metaplasia escamosa, por lo que también se le denomina adenocarcinoma con metaplasia escamosa. Los focos de metaplasia escamosa aparecen como islotes de células escamosas que no muestran atipia, y se sitúan intraluminalmente en las formaciones pseudoglandulares (las llamadas mórulas de Dutra), o como metaplasia escamosa más o menos difusa.
Las células escamosas se hallan frecuentemente en estrecha relación con las formaciones pseudoglandulares y muestran un citoplasma eosinófilo y amplio. A menudo se observan espinas intercelulares e incluso queratinización, no presentando sus núcleos atipia alguna. La falta de atipia celular en el componente escamoso diferencia a este subtipo de adenocarcinoma del carcinoma adenoescamoso, mucho menos frecuente y todavía con peor pronóstico, en el que las células escamosas son malignas y, por tanto, citológicamente atípicas.
Adenocarcinoma mucinoso
Se caracteriza por la presencia de formaciones pseudoglandulares, revestidas por células columnares altas, mucosecretoras, con núcleos que muestran escasas atipias situados en el polo basal. Frecuentemente presentan áreas papilares. Histológicamente se asemeja a los adenocarcinomas mucinosos de otras localizaciones, como intestino grueso, ovario y cérvix, por lo cual se debe excluir para su diagnóstico un adenocarcinoma cervical.
Adenocarcinoma secretor
Se distingue porque sus células contienen vacuolas situadas por encima o por debajo de los núcleos, o en ambos polos celulares, y por presentar secreción en las luces pseudoglandulares, incluso en pacientes menopáusicas. El aspecto de las formaciones pseudoglandulares recuerda al del endometrio secretor de 3 a 8 días tras la ovulación, mostrando sus células una buena diferenciación.
Carcinoma de células ciliadas
Se pueden observar ocasionalmente células ciliadas entre las células del adenocarcinoma endometrioide. Se considera adenocarcinoma endometrial de esta variante cuando al menos el 75 % de sus células son ciliadas. El problema es su diagnóstico diferencial histológico con una hiperplasia compleja atípica.
Carcinoma papilar villoglandular
Es un carcinoma usualmente bien diferenciado, que muestra un patrón histológico papilar, de papilas regulares con superficies rectas y lisas. Los núcleos tienen escasas atipias y las mitosis son asimismo escasas.
Carcinoma endometrial (no relacionado con los estrógenos)
Los cánceres endometriales en los que no se ha demostrado una relación con el hiperestronismo, ni que se desarrollen a partir de un endometrio hiperplásico, tienen un mal pronóstico. Se clasifican en:
1, carcinoma adenoescamoso
2, adenocarcinoma papilar seroso
3, carcinoma de células claras
4, carcinoma de células escamosas
Carcinoma adenoescamoso
Se caracteriza histológicamente porgue presenta dos componentes, uno de patrón pseudoglandular y otro escamoso, siendo las células de ambos a típicas y, por tanto, malignas, a diferencia del adenoacantoma, en el que el componente escamoso es benigno.
Siempre se encuentra un predominio del componente pseudoglandular, y el componente escamoso presenta células grandes, no queratinizadas con escasos puentes intercelulares. Ambos componentes no aparecen profundamente imbricados, como ocurre en el adenoacantoma, hallándose usualmente separados por tejido conjuntivo, aspecto histológico a tener en cuenta en el diagnostico diferencial entre ambos tumores. Se ha descrito un subtipo de esta variante que se ha denominado carcinoma de células de aspecto vítreo (glassy cell carcinoma), en el que las células son grandes, dispuestas en sábanas que no muestran un patrón determinado, y presentan amplios citoplasmas eosinófilos de aspecto vítreo y núcleos grandes centrales, de escasa cromatina, y con nucléolos prominentes.
Las mitosis son muy numerosas y los casos referidos han mostrado un pronostico poco favorable.
El origen del componente escamoso es muy discutido. Parece ser que ambos tipos de diferenciación, glandular y escamosa, ocurren al mismo tiempo a partir de una célula indiferenciada. El hecho de que se hayan observado tumores en los que el componente glandular era diploide y el escamoso aneuploide confirma esta hipótesis.
Los carcinomas adenoescamosos comprenden el 5-17 % (según las estadísticas) de los carcinomas endometriales, y las pacientes suelen ser algo mayores que las que padecen un adenocarcinoma endometrioide. El pronóstico es peor que en el adenocarcinoma endometrioide, habiéndose referido una supervivencia entre el 35 y el 67 % a los cinco años.
Carcinoma papilar seroso
Supone aproximadamente el 5 % de los carcinomas endometriales, pero no es el único carcinoma endometrial con un patrón papilar, ya que el carcinoma villoglandular lo presenta y el carcinoma de células claras que se describe a continuación también puede presentarlo. El carcinoma papilar seroso se caracteriza histológicamente porque muestra múltiples tallos fibrovasculares arborizados que a veces forman penachos, revestidos por cúmulos de células atípicas epiteliales de núcleos pleomórfícos, y porque en el 10-30 % de los casos aparecen cuerpos de psamoma, asemejándose en todo al carcinoma seroso papilar ovárico. El carcinoma papilar seroso de endometrio tiene un pronóstico sombrío, con una supervivencia del 50 % a los cinco años y del 46 % a los diez años, y es muy propenso a la diseminación peritoneal.
Carcinoma de células claras
Comprende el 5,7 % de los carcinomas endometriales y es el carcinoma de endometrio de peor pronóstico, con una supervivencia a los cinco años de tan sólo el 40 %. Se ha demostrado que tiene un origen paramesonéfrico y no mesonéfrico. Dicho tumor aparece también en la vagina, el cérvix y el ovario, y en los cuatro puntos tiene idénticas características histológicas. Aunque denominado carcinoma de células claras, éstas se encuentran en proporciones muy variables e incluso pueden no hallarse, por lo cual el diagnóstico no sólo se basa en su presencia, sino en las características de los patrones histológicos que se pueden hallar.
Estos son cuatro, que en orden de frecuencia son:
papilar
glandular
sólido
túbuloquistico.
Generalmente se observan al menos dos patrones de adenocarcinoma endometrioide convencional. Las células claras contienen glucógeno o mucina, que se puede encontrar también en la luz de las formaciones pseudoglandulares. Las células epiteliales que revisten las luces de los quistes en las áreas túbuloquísticas suelen aparecer aplanadas y contener muy escaso citoplasma, que presenta un núcleo grande, haciendo prominencia en la superficie como una tachuela, por lo que se las denomina células en tachuela. Además, muchas células contienen cuerpos hialinos redondos, PAS positivos resistentes a la digestión con diastasa.
Carcinoma de células escamosas (carcinoma epidermoide)
Es un tumor extraordinariamente raro, por lo que para hacer este diagnóstico debe excluirse la existencia de un carcinoma escamoso de cérvix o de un adenocarcinoma de endometrio, en cuyo caso se tratará de un carcinoma adenoescamoso. Ocurre en mujeres de edades avanzadas, no habiéndose descrito en mujeres premenopáusicas, y muchas enfermas han sufrido de infecciones prolongadas y piometra.
Se suele diagnosticar en un estado bastante avanzado.
4. ETIOPATOGENIA
El factor etiopatogénico primario asociado al desarrollo de un adenocarcinoma endometrial es la estimulación del endometrio por estrógenos, sin el efecto compensador de los progestágenos. Este estímulo puede ser exógeno o endógeno, y el resultado de su acción sobre el tejido varía desde la hiperplasia simple al adenocarcinoma.
Este esquema simplista sólo explicaría los casos de tumores asentados sobre un endometrio hiperplásico y asociados a un perfil hiperestrogénico, es decir, aquellos tumores que hemos definido como de tipo I, pero no explicaría la etiopatogenia de los tumores tipo II, de aquellos tipos histológicos más agresivos y de peor pronóstico, ni tampoco por qué no todas las mujeres sometidas a un estímulo hiperestrogénico desarrollan un adenocarcinoma endometrial. Como veremos más adelante, existe una asociación entre hiperplasia y cáncer de endometrio, lesiones ambas relacionadas con el hiperestronismo.
De lo expuesto hasta aquí se deduce que la relación causa-efecto, estrógenos-carcinoma endometrial, está demostrada, pero desconocemos los mecanismos nucleares subyacentes, que posiblemente expliquen las cuestiones pendientes.
En todo proceso neoplásico el sustrato básico fundamental es la pérdida de los mecanismos de control celular, desencadenándose un proceso proliferativo incontrolado.
En el desencadenamiento y evolución de esta secuencia hay agentes que actúan como carcinógenos o iniciadores del proceso, en tanto que otros actúan como promotores del mismo.
Los estrógenos pueden intervenir en el proceso a través de ambos mecanismos, tanto estimulando la proliferación ya inducida por otro agente genotóxico, como induciendo una mutagénesis, secundaria a mitogénesis.
En el proceso carcinogenético propiamente dicho lo que se produce es una ruptura del equilibrio del genoma de la célula normal hasta dar lugar a una célula fenotípicamente maligna.
En este juego intervienen dos tipos de genes: protooncogenes o estimulantes del proceso y genes supresores del tumor.
Algunos de estos protooncogenes y genes supresores del tumor codifican factores de crecimiento y sus receptores. Estos factores de crecimiento, a través de sus receptores, inducen la proliferación celular y pueden contribuir a la inducción del fenotipo neoplásico.
Los estrógenos pueden actuar como cancerígenos mediante tres mecanismos:
induciendo la expresión de genes en un momento inadecuado
modulando la expresión de genes normalmente no regulada por los estrógenos pero que, gracias a una mutación, se hacen estrogenodependientes.
induciendo una mayor actividad proliferativa y, por su efecto prolongador, aumenta el riesgo de neoplasia.
5. HISTORIA NATURAL
Se admite que, al igual que sucede con la mayoría de los cánceres de cuello, la enfermedad comienza por una hiperplasia que puede evolucionar a un adenocarcinoma in situ y, posteriormente, a un cáncer invasor de endometrio. Por razones obvias
esta secuencia no ha podido ser demostrada, aunque hay datos indirectos de que pueda ser así. Tampoco sabemos el porcentaje de lesiones premalignas que progresa hasta transformarse en cáncer invasor.
El adenocarcinoma de endometrio suele permanecer varios años confinado en el endometrio hasta que comienza la invasión del miometrio. Después, por continuidad, invade cuello, trompas y ovarios.
En ocasiones hay tumores de útero y de ovario con una histología similar siendo muy difícil determinar su origen. La cuarta parte de los adenocarcinomas endometrioides se acompañan de otro tumor endometrioide de ovario primario y sincrónico con el del endometrio; cuando esto sucede, el tumor primario de ovario es pequeño y unilateral, y el de endometrio es bien diferenciado y no invade el miometrio.
Al tiempo que se produce la invasión por continuidad tiene lugar la invasión linfática, afectándose en principio los ganglios de las cadenas hipo-gástricas e ilíacas seguidos por los ganglios paraaórticos. Las metástasis a distancia vía hemática son muy raras y pueden afectar al pulmón, hígado y huesos. La afectación peritoneal es rara, pero relativamente frecuente en los casos de adenocarcinoma papilar seroso de endometrio.
6. CLÍNICA
La clínica suele ser llamativa y en muchas ocasiones aparece en el estadio de lesión premaligna. La hemorragia posmenopáusica es el síntoma más frecuente, dado que entre un 70-75 % de las portadoras de este tumor son pacientes menopáusicas; como se trata de un síntoma muy claro para la mujer, si ésta tiene una formación sanitaria adecuada, hace que acuda pronto al médico.
Ocasionalmente, en casos de estenosis del canal cervical, la enfermedad puede debutar con un cuadro de piometra o hematometra, asociado a pseudoabdomen agudo más o menos intenso. El dolor es síntoma de enfermedad más avanzada, al igual que la presencia de tumoración en el hipogastrio.
7. DIAGNÓSTICO
Diagnóstico clínico o de sospecha
La paciente suele acudir refiriendo en la mayoría de los casos un cuadro de metrorragia peri o posmenopáusica. A la exploración con espéculo o valvas se visualiza que la sangre fluye por el orificio cervical externo, procedente de la cavidad. La exploración bimanual suele ser poco orientadora; en ocasiones, puede palparse un útero aumentado de tamaño y blando.
Citología vaginal
La precisión de este procedimiento, en el diagnóstico del adenocarcinoma endometrial, es escasa, y en menos de la mitad de los casos pueden verse las típicas células malignas en forma de, sello de anillo. Indirectamente puede haber signos que hagan sospechar la existencia de un adenocarcinoma de endometrio; se han señalado como tales la existencia de un frotis estrogénico (alto índice cariopicnótico y eosinófilo), la presencia de histiocitos y el hallazgo de células endometriales normales, cuando el frotis no se hace en días próximos a la regla y la mujer no es portadora de un DIU.
Citología endometrial
La toma directa de células endometriales puede realizarse por varios métodos: lavado, aspirado o cepillado.
La precisión global de este procedimiento oscila entre el 60-80%, y debe ser siempre complementado con una muestra para estudio histológico. En algunos casos de adenocarcinoma de endometrio se obtiene abundante material que puede ser estudiado histológicamente como una biopsia.
Tanto la citología vaginal como la endometrial están actualmente en desuso en el protocolo diagnóstico de este tipo de procesos, habiendo sido superadas por otros procedimientos.
Ecografía
Para el diagnóstico del cáncer de endometrio debe realizarse siempre ecografía transvaginal con sondas de alta frecuencia (5,5-7,5 Mhz). La cavidad uterina se ve como un eco denso lineal que corresponde a los ecos de la interfase que forma el epitelio de superficie de la cara anterior y de la posterior. Rodeando esta línea aparece una zona más o menos ecogénica que corresponde al endometrio. La unión entre endometrio y miometrio suele distinguirse como un pequeño halo. El grosor se mide desde la interfase miometrio-endometrio de la cara anterior hasta la interfase endometrio-miometrio de la cara posterior; es decir, el grosor que se mide es doble: el del endometrio de la cara anterior más el de la cara posterior.
El primer signo de sospecha de patología endometrial, sobre todo en una mujer menopáusica, es el aumento de grosor del endometrio. El límite de la normalidad se establece entre 2,5 y 5 mm para las mujeres posmenopáusicas sin THS ni tamoxifeno, y entre 5 y 8 mm para las premenopáusicas o con THS. Con estos criterios la eficacia diagnóstica de la ecografía es alta. Hablamos de patología endometrial incluyendo en ella los pólipos, las hiperplasias y el cáncer endometrial.
Otra posibilidad de la ecografía es el diagnóstico del grado de invasión miometrial, y aunque no siempre es fácil establecer el límite entre cáncer y miometrio, se ha señalado entre el 80 y 90 % de correlación empleando sondas de 7,5 Mhz. La utilización de Doppler color, así como el estudio de la fluxometría de las arterias uterinas y miometriales constituyen una ayuda más en el diagnóstico eco-gráfico.
No obstante, hay que tener siempre presente que la ecografía, por muy esclarecedora que sea, nunca puede dar el diagnóstico de
certeza; éste debe hacerse mediante biopsia.
Tomografía computerizada (TC)
Sin utilizar contraste, muestra solamente la extensión de la lesión en la superficie de la cavidad; es decir, si es focal o difusa. Cuando se emplea contraste puede verse mejor el límite con el miometrio, debido a la baja atenuación del tumor en comparación con el miometrio.
La concordancia de la TC varía entre el 84 y 88 %, tanto para los estadios precoces como para los tardíos. En el estudio de las recurrencias puede ser también de gran utilidad. El inconveniente de la TC es la dificultad de discernir entre invasión, inflamación, fibrosis posquirúrgica o posradiación.
Resonancia magnética (RM)
El endometrio da una señal alta (como la grasa); el miometrio, una intermedia y la unión endometrio-miometrio, una señal baja. Estas características facilitan la identificación de la invasión miometrial, pero en muchas mujeres posmenopáusicas la zona de unión endometrio-miometrio puede no ser visible, lo que impide conocer la profundidad de la invasión miometrial.
El tumor se ve como una señal fuerte en el endometrio, se considera imagen sospechosa cuando es mayor de 1 cm en mujeres en edad reproductora, y superior a 3-5 mm en posmenopáusicas. La existencia de líquido en la cavidad puede atenuar la señal y hacer más difícil el diagnóstico.
La RM con contraste intravenoso acentúa los límites entre el tumor y el miometrio, facilitando el diagnóstico de tumoraciones pequeñas y de la invasión miometrial. En la estadificación del cáncer de endometrio. La RM no desplaza a la TC para la estadistificación porque es menos sensible para detectar metástasis extrauterinas, requiere más tiempo, la paciente la admite peor y es más cara.
Microlegrado
Consiste en la toma de una muestra de endometrio mediante una legra muy fina; se han utilizado con este fin la legra de Agüero o la de Novak. El procedimiento tiene la ventaja de que se puede realizar sin anestesia y en la consulta. Pero tiene un alto porcentaje de falsos negativos en los casos de tumores muy localizados.
Legrado total
Se hace bajo anestesia, situación que se aprovecha para realizar una exploración ginecológica. Previa histerometría y dilatación del cuello se legra la totalidad de la cavidad uterina. En los casos típicos suele obtenerse un abundante material que se enviará al patólogo.
Legrado fraccionado
Este procedimiento se efectúa bajo anestesia e incluye el legrado del canal cervical lo más completo posible; el producto que se obtenga se ha de enviar como muestra endocervical. A continuación se procede a la dilatación del orificio cervical interno y al legrado total de la cavidad. Si bien hoy en día puede quedar desplazado o sustituido por la histeroscopia, sigue siendo un método válido, aceptado y que permite establecer tanto el diagnóstico anatomopatológico como el estadio prequirúrgico, al confirmar la existencia o no de invasión cervical.
Histeroscopia
Es un método que permite la visualización del canal endocervical y de la cavidad uterina; además, los modernos histeroscopios tienen una vaina para el paso de una pequeña pinza de biopsia que permite realizar una biopsia dirigida.
Las indicaciones de la histeroscopia son las siguientes:
_ metrorragias en mujeres peri y posmenopáusicas;
_ mujeres con citología vaginal o endometrial positiva o sospechosa;
_ pacientes con alto riesgo de padecer cáncer endometrial;
_posmenopáusicas con un grosor endometrial por ecografía transvaginal superior a 6 mm;
_ Cuando la biopsia obtenida por microlegrado o legrado fraccionado ofrece un diagnóstico no concluyente.
La existencia de enfermedad inflamatoria en la vagina, útero o trompas, en fase aguda o latente, s una contraindicación absoluta ante la posibilidad de poder diseminarla. Es una contraindicación relativa la falta de permeabilidad del cérvix. En el 10 ó 15% de las mujeres menopausicas para hacer la histeroscopia es precisa una dilatación previa. Se ha señalado que la histeroscopia supone un riesgo en mujeres con cáncer de endometrio, dada la posibilidad de producir la diseminación a las trompas y posteriormente al peritoneo. Sin embargo, la práctica ha demostrado sobradamente que esta posibilidad es más teórica que real cuando la insuflación se hace con CO2 y no se sobrepasa la presión recomendada.
La imagen histeroscópica del cáncer de endometrio puede ser una lesión exofítica o ulcerada afectando a una superficie más o menos extensa de la cavidad uterina. La lesión suele tener un aspecto abollonado o polipoide con vasos gruesos, dilataciones, trayecto irregular y distribución no graduada. Las zonas de hemorragia no son raras. La exploración histeroscópica ha de ser completa, observándose toda la cavidad, los ostia tubáricos, el istmo y el canal cervical. Debe hacerse una biopsia dirigida de todas las zonas sospechosas.
En la actualidad se considera el procedimiento mejor para el diagnóstico del cáncer de endometrio, siempre y cuando se utilice junto con la biopsia dirigida. Tiene la ventaja de poder identificar lesiones muy pequeñas y poco accesibles, diagnostica la extensión en superficie y su localización y, por último, informa del estado del canal cervical. La sensibilidad del método en manos expertas es prácticamente del 100%.
A pesar de ser un procedimiento invasivo, la histeroscopia diagnóstica se realiza en la consulta en más del 80 % de las mujeres perimenopáusicas, porcentaje que puede aumentar a casi el 95 % si la noche anterior se coloca un comprimido de misoprostol en la vagina.
Cuando el cérvix no permita el paso del histeroscopio hay que recurrir a la anestesia, que puede ser paracervical.
8. ESTADIFICACIÓN
Hasta 1988, la estadificación del adenocarcinoma endometrial establecida por la FIGO se basa en la extensión del proceso, y en caso de que el tumor estuviera limitado al útero se valoraba el tamaño del mismo y el grado de diferenciación histológica. Es la denominada clasificación clínica. En 1988, la FIGO estableció una nueva clasificación en la que se valora el grado de afectación miometrial y la invasión ganglionar. Es la denominada clasificación quirúrgica. En 1993 recomienda también la clasificación clínica cuando la quirúrgica no es posible.
9. EXTENSIÓN
El adenocarcinoma de endometrio se disemina por continuidad y a distancia.
Extensión por continuidad: lo hace invadiendo las estructuras vecinas afectando en primer lugar al epitelio endocervical o el tubárico; posteriormente, puede invadir el estroma del cérvix y toda la pared de la trompa. La invasión de ovario, recto y vejiga es menos frecuente y se da en estadios finales. Dentro de la extensión por continuidad la invasión del miometrio puede producirse muy precozmente, sobre todo en los tumores muy agresivos, siendo considerada como un factor de mal pronóstico.
Extensión a distancia: suele hacerse por vía linfática, por la cual tiene una especial afinidad. Los ganglios invadidos dependen de las características del drenaje linfático del útero y de la zona del cuerpo uterino afectado. Las principales vías de drenaje son las cadenas uteroováricas (infundibulopélvicas), hipogástricas, ilíacas externas, ilíaca común y presacros. La afectación de las cadenas paraaórticas debe ser considerada como metástasis. Las metástasis por vía hemática son muy poco frecuentes. Especial mención merecen las metástasis en vagina que se han achacado a implantes de células tumorales desprendidas (al operarse el tumor), pero que probablemente se producen por vía linfática.
Clasificación clínica de la FIGO
Estadio O Hiperplasia abdominal atípica, carcinoma in situ.
Imágenes histológicas sospechosas de malignidad.
Los casos estadio O no deben incluirse en ninguna estadística de tratamiento.
Estadio I El carcinoma está confinado al útero.
Estadio la La longitud de la cavidad uterina es menor o igual a 8 cm.
Estadio Ib La longitud de la cavidad uterina es mayor de 8 cm.
Estadio II El carcinoma se ha extendido al cuello uterino pero no fuera del útero.
Estadio III El carcinoma se ha extendido fuera del útero, pero no de la pelvis.
Estadio IV El carcinoma se ha extendido fuera de la pelvis, o está invadida la mucosa de vejiga o recto. La existencia de edema ampollar no permite catalogar él caso como estadio IV.
Estadio IVa Extensión a órganos adyacentes, como vejiga, recto, sigmoide o intestino delgado.
Estadio IVb Extensión a órganos a distancia.
Clasificación Quirúrgica de la FIGO. 1995.
Estadio I Limitado al cuerpo.
Estadio la Limitado al endometrio.
Estadio Ib Invasión < l/2 del miometrio.
Estadio Ic Invasión > V2 del miometrio.
En cada caso debe establecerse el grado de diferenciación: G1-G2-G3.
El grado debe establecerse teniendo en cuenta los anomalías nucleares y/o citoplasmáticas, no sólo las morfológicas.
Estadio II Afectación del cérvix. Estadio Ha Sólo afectación glandular.
Estadio Ilb Afectación del estroma cervical.
En cada caso debe establecerse el grado de diferenciación: Gl, G2, G3.
Estadio III Diseminación fuera del útero, confinado a la pelvis (no se incluye la afectación de recto y/o vejiga).
Estadio Illa Afectación de la serosa uterina y/o anejos, o citología peritoneal positiva.
Estadio I Ilb Metástasis vaginal.
Estadio Vle Metástasis pélvicas y/o ganglios paraórticos.
En cada caso debe establecerse el grado de diferenciación: Gl, G2S G3.
Estadio IV Afectación de la vejiga, recto o diseminación a distancia.
Estadio IVa Afectación de la mucosa vesical y/o rectal.
Estadio IVb Metástasis a distancia, incluidas las intraabdominales y/o los ganglios inguinales
10. TRATAMIENTO
El tratamiento del adenocarcinoma de endometrio depende de las características del tumor y las de la enferma. Existen varias posibilidades terapéuticas: cirugía, radioterapia, hormonoterapia y quimioterapia, que se pueden utilizar de forma aislada o combinadas.
Tratamiento quirúrgico
La cirugía ha sido, de todas las posibilidades terapéuticas la más utilizada en el tratamiento del cáncer de endometrio. Se discute el tipo de histerectomía que debe realizarse y la conveniencia de la linfadenectomía. Se han propuesto la histerectomía total con doble anexectomía, la histerectomía radical y la histerectomía vaginal.
Histerectomía abdominal
La histerectomía con doble anexectomía por vía abdominal, sola o acompañada de radioterapia, es el tratamiento más recomendado para los estadios I. Se aconseja extirpar un amplio manguito vaginal para evitar las recidivas vaginales. También con este fin se ha propuesto el cierre del cérvix con puntos, taponamiento con gasas impregnadas en yodo u otros procedimientos más complicados. Aunque parece lógico que si se evita la salida de las células neoplásicas por el cuello, debería disminuir la incidencia de recidivas en la vagina, esto no ha sido demostrado.
A la histerectomía total se le critica que, al no extirpar los ganglios ni el tejido de alrededor del istmo uterino y de la porción superior de la vagina, la incidencia de recidivas podría ser mayor y la supervivencia menor que cuando se realiza una histerectomía ampliada tipo Wertheim-Meigs. No obstante, los resultados en los estadios I son buenos. el resto de las recidivas ocurrieron en los casos que presentaban una invasión miometrial superior al 50%. en ambos grupos, la supervivencia a los cinco años fue del 86 %.
La histerectomía total parece la opción quirúrgica para el estadio 1 con ninguna o poca invasión miometrial y grado de diferenciación Gl. En el resto de los estadios I debe añadirse la radioterapia.
Histerectomía ampliada
La histerectomía ampliada con linfadenectomía parece lógica en los estadios II, dado que si el tumor invade el cérvix la propagación y, por tanto, el tratamiento quirúrgico serán similares a los del cáncer de cuello. En los estadios I, sobre todo cuando hay invasión de miometrio y en los G3 algunos aconsejan también este tipo de cirugía ya que la incidencia de ganglios positivos supera el 11%.
Se cuestiona este tipo de cirugía porque posiblemente cuando hay afectación ganglionar la enfermedad ya es sistémica, pero cuando los ganglios son negativos los resultados en cuanto a supervivencia son similares a los conseguidos con histerectomía total más radioterapia. A esto hay que añadir que la morbilidad de este tipo de intervención en mujeres por lo general mayores, obesas y con patología asociada, es mucho más elevada. A pesar de todo, en los estadios II, cuando las características de la enferma lo permitan, este tipo de cirugía puede estar indicado.
Histerectomía vaginal
La histerectomía vaginal puede estar indicada en algunos casos de estadio 1 en mujeres muy obesas y riesgo quirúrgico elevado, o en casos de prolapso uterino.
Dada la dificultad en algunos casos, para extirpar los anejos por vía vaginal, algunos proponen la realización de una histerectomía vaginal ayudada por laparoscopia. Tendría además la ventaja de poder efectuar el lavado peritoneal, explorar la pelvis, ver el tamaño del útero, la existencia o no de adherencias, e incluso se podría hacer una exploración de los ganglios y una linfadenectomía selectiva.
Linfadenectomía
La existencia de ganglios positivos cambia el estadio, según la clasificación quirúrgica de la FIGO, y con ello el pronóstico e incluso el tipo de tratamiento. Por ello, muchos proponen la linfadenectomía sistemática incluso en los estadios I, dado que en el 10 % de estos casos hay ganglios positivos.
La mayoría se inclina por la linfadenectomía en los casos de riesgo, el cual vendría dado por la invasión miometrial y el grado histológico. Parece evidente la conveniencia de la linfadenectomía en los estadios I cuando la profundidad de la invasión sobrepasa el 50 % o se trata de un G3.
La linfadenectomía puede ser completa o selectiva: los defensores de la linfadenectomía completa argumentan que hay casos con ganglios afectados a pesar de ser éstos de tamaño muy pequeño.
La linfadenectomía pélvica y paraaórtica, a pesar de que algunos grupos señalan que no aumentan significativamente la morbimortalidad, constituye una complicación adicional sobre todo en mujeres obesas y con patología asociada. La linfadenectomía paraórtica difícilmente puede defenderse, por dos razones: la primera, la baja incidencia de afectación paraórtica aislada; sólo en el 2 % de los casos de nódulos paraórticos positivos no hay ganglios pélvicos afectados. En segundo lugar, no parece que cambien mucho las posibilidades de sobrevivir.
A la vista de lo expuesto anteriormente, el tratamiento quirúrgico podría indicarse en el estadio I será suficiente la histerectomía total con doble anexectomía. La duda está en los casos de riesgo moderado, en los que cabe preguntarse si la linfadenectomía está justificada sabiendo que la incidencia de ganglios positivos es del 9%.
Lavado peritoneal
Resulta imprescindible para investigar la presencia de células malignas en la cavidad peritoneal, ya que es uno de los parámetros que se valoran en la clasificación quirúrgica de la FIGO.
Tratamiento radioterápico
El tratamiento con radioterapia del cáncer de endometrio se puede efectuar mediante radioterapia intracavitaria o externa. Para el tratamiento intracavitaro suele utilizarse el empaquetado de Hey-man. Éste consiste en la introducción en la cavidad uterina de cápsulas de radium a las que suele unirse un tándem rígido (soporte con fuente radiactiva); el empaquetado se completa colocando colpostatos en la vagina. Mediante esta técnica se logra una adecuada radiación del tumor e incluso de los ganglios pélvicos. Es obvio que esta técnica sólo se utiliza cuando no se efectúa tratamiento quirúrgico. La dosis recomendada es de casi 8.000 rads. Pueden utilizarse también las técnicas de poscarga o carga diferida, pero cuando el útero es grande es preferible el packing de Heyman.
La radioterapia externa puede ser el complemento del tratamiento quirúrgico o de la radioterapia de contacto. La dosis a toda la pelvis debe ser al menos de 4.000 rads.
No se puede demostrar que los resultados de la cirugía sean mejores que los de la radioterapia, dada la imposibilidad de encontrar dos grupos comparables. Puesto que se cree que los resultados son mejores con la cirugía, complementada o no con la radioterapia, las enfermas tratadas solamente con radioterapia suelen ser las de mayor edad y con las que mayor frecuencia padecen enfermedades sistémicas. En la actualidad se tiene el convencimiento de que la cirugía, complementada o no con radioterapia, da mejores resultados que el tratamiento exclusivo con radioterapia, siempre y cuando las características y el riesgo quirúrgico de las pacientes lo permita.
Durante cuatro décadas se ha utilizado la radioterapia pre o posoperatoria en el cáncer de endometrio por creer que mejoraba los resultados. Sobre todo disminuyen las recidivas en la vagina y en los ganglios pélvicos.
En la actualidad se sabe que las enfermas que más se benefician de la radioterapia son las que tienen tumores poco diferenciados (G2 y G3); también aquellos casos en que está invadido el miometrio y cuando hay metástasis ganglionares. La supervivencia a los cinco años de las mujeres tratadas con cirugía y radium intravaginal es muy superior a la de los grupos tratados con cirugía sola o cirugía más radioterapia externa. Estos resultados hay que tomarlos con reserva, ya que no se tuvo en cuenta la invasión en profundidad y en muchos casos la radioterapia externa se indicó por estar afectados los ganglios pélvicos.
Hormonoterapia
Dado que el adenocarcinoma de endometrio es un tumor hormonodependiente y basándose en casos clínicos concretos, hubo un momento en que se despertó un gran entusiasmo por el tratamiento con gestágenos. El tratamiento con gestágenos a altas dosis sólo se reserva en la actualidad para estadios muy avanzados y recidivas, siendo los resultados muy discutibles.
Algunos grupos han utilizado el tamoxifeno durante más de tres años en casos de adenocarcinoma de pronóstico desfavorable. Teóricamente el tamoxifeno evitaría la sensibilización del tumor a los gestágenos impidiendo la regulación negativa (down-regulation) que éstos producen sobre los receptores de progesterona.
Los análogos de la GnRH, administrados de forma continua, también han sido propuestos, basándose en la teoría de que el hipoestronismo que producen induciría una regresión del tumor. No existen aún trabajos clínicos que demuestran su eficacia.
Quimioterapia
Hasta el momento actual, los agentes quimioterápicos como la doxorrubicina y el cisplatino sólo se han utilizado en pacientes diagnosticadas de recidiva o metástasis. Hasta ahora se desconoce si su utilización como tratamiento coadyuvante tras la cirugía, en pacientes de alto riesgo, aportaría algún beneficio en la supervivencia o en el período libre de enfermedad.
Como resumen de todo lo expuesto en el tratamiento pueden marcarse las siguientes directrices:
1. El tipo de cirugía en los estadio I estaría en función de los factores de riesgo. En los estadios la y Ib grado Gl, la histerectomía total con doble anexectomía sería suficiente.
2. En pacientes estadios la y Ib con grado G2 y G3 y los Ic, la histerectomía total con doble anexectomía y la linfadenectomía selectiva o completa. Si hay ganglios positivos, radioterapia completa de la pelvis.
3. En los estadio II, histerectomía ampliada tipo Whertein-Meigs, y si hay ganglios positivos, radioterapia externa completa de la pelvis.
4. El tratamiento postoperatorio con gestágenos no ha demostrado mejorar los resultados.
En un intento de individualizar los casos, el esquema terapéutico del Cuadro 12-23 puede servir de guía. Es evidente que este esquema está sujeto a las características de la paciente y de forma muy especial a su riesgo quirúrgico.
Resultados
La supervivencia global para este proceso, según los datos del Annual Report, vol. XXII, es del 77,3 %. Mientras que para el estadio I la supervivencia es del 86 % a los 5 años, en el estadio IV es del 16%. Aun para el mismo estadio la supervivencia varía; así, en el estadio I, la supervivencia oscila entre el 96 % para el la y el 73 % para el Ic G3.
En cualquier caso, la supervivencia global es aceptable, y ello se debe fundamentalmente al elevado porcentaje de pacientes diagnosticadas en estadio I, que se sitúa en un 73 %.
Recidivas y metástasis
Aunque ocasionalmente se han diagnosticado incluso transcurridos 10 años del tratamiento inicial, lo habitual es que aparezcan en los primeros 5 años. Los tumores más indiferenciados suelen recurrir antes, y lo hacen en el tercio vaginal inferior o a distancia. Los tumores bien diferenciados, en caso de recurrir, lo hacen en la porción superior de la vagina o en la pelvis.
El tratamiento de la recidiva dependerá fundamentalmente de su localización y del tratamiento anterior.
Se incluirá la cirugía, radioterapia, hormonoterapia y quimioterapia.
Las recidivas locales o locorregionales, no radiadas con anterioridad, serán susceptibles de tratamiento radioterápico.
Se han utilizado diversas dosis y pautas de hormonoterapia, en casos de recidivas locales o metástasis de estos tumores. La ventaja de este tratamiento es su tolerancia y los escasos efectos secundarios; pero el índice de respuesta, tanto con acetato de medroxiprogesterona (MAP) 1.000 mg/día como con acetato de megestrol 320 mg/día, no ha superado el 18 %.
Con la utilización de terapias combinadas con MAP + tamoxifeno o con megestrol + tamoxifeno, el índice de respuesta ha sido algo más elevado, llegando al 33 %.
En el momento actual están en el mercado otros agentes hormonales, como los inhibidores de aromatasa, o nuevos antiestrógenos, como el toremifeno, cuyo papel en el tratamiento de este proceso está por demostrar
La quimioterapia, generalmente utilizando 2-3 fármacos y asociada a hormonoterapia, tampoco ha conseguido respuestas superiores al 36 % (megestrol + doxorrubicina + ciclofosfamida + 5 fluorouracilo) con una toxicidad superior.
Control después del tratamiento
Las recidivas del cáncer de endometrio suelen ser en la cúpula vaginal, pulmón y hueso; por ello, el control postratamiento debe estar dirigido fundamentalmente a detectar este tipo de recidivas.
Los controles se efectuarán cada tres meses una vez terminado el tratamiento durante los dos primeros años, a partir de los cuales se harán anualmente. Este calendario puede variar en función de las características del tumor, de la enferma y del tipo de tratamiento realizado.
El control consistirá en una anamnesis detallada, inspección de la vagina y cúpula con valvas, junto con la citología vaginal.
Asimismo, se realizará exploración bimanual vaginal y tacto rectal. Debe incluirse también la palpación abdominal y de las cadenas ganglionares. El 75 % de las recurrencias son sintomáticas y se diagnostican fácilmente con la exploración física.
A esta exploración convencional debe añadirse una radiografía de tórax cada seis meses durante el primer año, y en los siguientes cinco años cada 12 meses. Se calcula que casi el 50 % de las recurrencias asintomáticas se diagnosticarán con esta radiografía. No parece imprescindible la tomografía axial computadorizada ni la urografía descendente como métodos de rutina en el control postratamiento.
Se discute la utilidad del CA 125, aunque hay varios trabajos en los que se demuestra su elevación en caso de recidiva. Estas recidivas suelen ser clínicas y de gran volumen. Se admite su utilidad en los casos de adenocarcinoma papilar seroso.
Cáncer de endometrio y tratamiento hormonal sustitutivo
Dado que la mayoría de estas mujeres son menopáusicas o perimenopáusicas, se ha planteado la posibilidad de este tipo de tratamiento cuando existen síntomas neurovegetativos, o como profilaxis de la osteoporosis y de la enfermedad cardiovascular. Dado que el adenocarcinoma de endometrio es un tumor estrogenodependiente, se ha señalado siempre como una contraindicación absoluta el empleo de estrógenos en mujeres que han padecido un cáncer de endometrio. En los últimos años se cuestiona por algunos esta contraindicación absoluta y determinados grupos la recomiendan en casos concretos.
Los casos de pacientes tratadas de adenocarcinoma endometrial con estadios avanzados o con sospecha o evidencia de persistencia de la enfermedad, si tienen síntomas neurovegetativos, pueden tratarse con gestágenos (acetato de medroxiprogesterona, 10 mg diarios). También se puede recurrir a tratamientos no hormonales, como la clonidina. En un futuro próximo se vislumbra la posibilidad de utilizar los nuevos moduladores de la respuesta de los receptores estrogénicos, con acción antiestrogénica en el endometrio y acción estrogénica en el hueso y el metabolismo lipídico.
11. CASO CLÍNICO
HISTORIA CLÍNICA
Se trata de una paciente de 65 años, nulípara, que consulta por pérdidas serosanguinolentas desde hace 2 meses. Refiere en sus antecedentes personales una menarquia a los 12 años con un tipo menstrual 3-4/28, apareciendo la menopausia a los 53 años.
Explica la paciente que durante mucho tiempo fue tratada con preparados inductores de la ovulación, como tratamiento de su esterilidad, pero no alcanzó buenos resultados. A la edad de 47 años se le practicó un legrado biopsia, por presentar, tras un período de amenorrea de 3 meses, una metrorragia persistente, siendo el resultado de la biopsia de hiperplasia glandular. Entre los antecedentes patológicos tenemos que destacar el tratamiento actual de su hipertensión y de su diabetes, las cuales se controlan con dieta adecuada. No presenta ninguna otra sintomatología, sobre todo ni digestiva ni urinaria.
EXPLORACIÓN
A la exploración sistémica hay que destacar una TA de 180/110 y una obesidad muy marcada en relación a la altura de la paciente. No aparece ninguna alteración a nivel de la cabeza ni del cuello. No se palpan adenopatías cervicales, súpraclaviculares ni axilares. El examen cardíaco demuestra una hipertrofia ventricular en relación con su hipertensión. La exploración pulmonar y mamaria se encuentran dentro de los límites de la normalidad.
A la exploración abdominal hay que destacar la obesidad, muy marcada, del abdomen; no obstante, no se aprecia ninguna zona dolorosa, tumoraciones u organomegalias .
Al examen ginecológico se aprecian unos genitales externos de apariencia trófica a pesar de la edad de la paciente. La vagina presenta una mucosa normal. El cuello uterino es de aspecto normal. Se practica, en este momento de la exploración, la triple toma citológica. La colposcopia también demuestra un epitelio escamoso normal. Se observa una discreta pérdida hemática a través del orificio cervical externo. Se practica entonces una histerometría, que resulta ser de 8 cm.
Al tacto vaginoabdominal se aprecia un útero ligeramente aumentado de volumen. La exploración de los anejos es completamente normal.
El tacto rectovaginal no revela ninguna infiltración de los parametrios, siendo el cuello uterino completamente móvil.
FACTORES DE RIESGO
La paciente de nuestra historia clínica tendría, por tanto, varios factores de riesgo de padecer un cáncer de endometrio: nuliparidad, menopausia tardía a los 53 años, antecedentes de ciclos anovuladores, cuadros de hiperplasia glandular, hipertensión, obesidad y diabetes.
Además cuanto más avanzada es la edad de la paciente, es decir cuanto mayor tiempo ha transcurrido desde la menopausia, y cuanto mayor es la histerometría, son superiores los riesgos de presentar un carcinoma de endometrio en las mujeres con hemorragias posmenopáusicas.
Debe también tenerse en cuenta el origen de la metrorragia que, en nuestro caso, es intrauterina, ya que la exploración de genitales externos, vagina y cuello uterino son completamente normales, descartando, pues, otros procesos neoplásicos capaces de producir hemorragia, así como procesos atrofíeos. Por consiguiente, el proceso más probable que padece la paciente es un cáncer de endometrio.
DIAGNÓSTICO
El diagnóstico de seguridad sólo puede hacerse mediante el estudio histológico del endometrio.
El material obtenido para estudio histológico debe recogerse mediante legrado uterino fraccionado, es decir de todo el endocérvix y de la cavidad corporal, poniendo especial atención en los cuernos uterinos.
La biopsia de endometrio, obtenida de una pequeña porción de éste, tanto si se utiliza la succión como el raspado, es un método menos exacto para establecer el diagnóstico, ya que el adenocarcinoma puede ser de pequeñas dimensiones y puede no obtenerse tejido de la zona neoplásica. Estas pequeñas biop-sias sólo tienen valor en caso positivo; y en ocasiones no permiten descartar con seguridad la existencia de un carcinoma endometrial.
Pueden aplicarse otras técnicas diagnósticas, aunque de carácter secundario, como la histerografía, la citología y la histeroscopia. Algunos autores consideran este último método de gran utilidad para dirigir la toma del tejido para biopsia. Puede también ser útil sobre todo para descartar otras lesiones que producen hemorragias.
Una vez determinado por el estudio histológico que se trata de un adenocarcinoma de endometrio se debe someter a la paciente a otras exploraciones para determinar el grado de extensión y la existencia de posibles metástasis.Una vez hecha la exploración, con los datos anteriores se puede establecer el estadio de la enfermedad.
ETIQUETA DIAGNÓSTICA: ADENOCARCINOMA DE ENDOMETRIO. ESTADÍO II. GRADO II.
PRONÓSTICO
En 1/3 de los casos hacen metástasis de los ganglios pelvianos. Tienen mejor pronóstico cuando la lesión es microscópica variando la supervivencia entre el 50 y el 80% a los 5 años dependiendo de las características de la lesión.
El grado II tiene una superviviencia del 60,4% a los 5 años.
TRATAMIENTO
_ Radioterapia pelviana externa combinada con una aplicación posterior de Cs/Ra intracavitaria.
_ A las 4 - 6 semanas histerectomía total abdominal con anexectomía bilateral y biopsia de ganglios paraaórtcos.
_Terapia con progestágenos.
BIBLIOGRAFÍA
1_ Tratado de obstetricia y ginecología. Vol II. J.A. Usandizaga, P. De la Fuente. Ed. Mc Graw-Hill Interamericana. Madrid. 1998.
2_ Obstetricia y Ginecología. Serie salvat de casos clínicos. CC 10. Juan Balasch Cortina. Ed. Salvat. Barcelona 1991.
2
Descargar
| Enviado por: | Franfernanca |
| Idioma: | castellano |
| País: | España |
