Química
Redes cristalinas
REDES CRISTALINAS
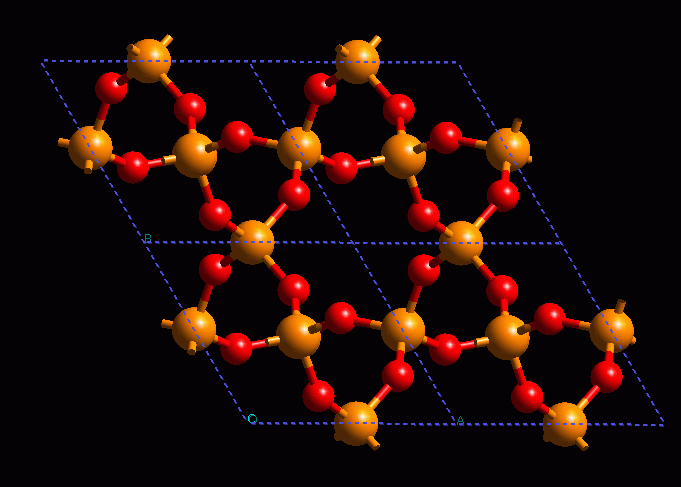
Estructura cristalina de un material orgánico: cianamida
En las proteínas también existen unidades moleculares como en los materiales orgánicos, pero mucho más grandes. Las fuerzas que unen estas moléculas son también similares, pero su empaquetamiento en los cristales deja muchos huecos que se rellenan con agua no ordenada y de ahí su extrema inestabilidad.
|
|
Los distintos modos de empaquetamiento en un cristal dan lugar a las llamadas fases polimórficas (fases alotrópicas para los elementos), que confieren a los cristales (a los materiales) distintas propiedades. Por ejemplo, de todos son conocidas las distintas apariencias y propiedades del elemento químico Carbono, que se presenta en la Naturaleza en dos formas cristalinas muy diferentes, el diamante y el grafito:
|
|
|
El grafito es negro, blando y un lubricante excelente, lo que sugiere que sus átomos deben estar distribuidos (empaquetados) de un modo que puedan entenderse sus propiedades. Sin embargo, el diamante es transparente y muy duro, por lo que debe esperarse que sus átomos estén muy fijamente unidos. En efecto, sus estructuras sub-microscópicas (a nivel atómico) dan cuenta de sus diferencias:
|
|
|
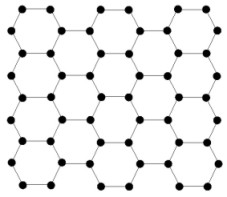
En el diamante, cada átomo de carbono está unido a otros cuatro en forma de una red tridimensional muy compacta (cristales covalentes), de ahí su extrema dureza y su caracter aislante. Sin embargo, en el grafito los átomos de carbono están distribuidos en forma de capas paralelas separadas entre sí mucho más de lo que se separan entre sí los átomos de una misma capa. Debido a esta unión tan debil entre las capas atómicas del grafito, los deslizamientos de unas frente a otras ocurre sin gran esfuerzo, y de ahí su capacidad lubricante, su uso en lapiceros y su utilidad como conductor.
Y, hablando de conductores, en los cristales metálicos los átomos de metal se estructuran de forma que hay electrones deslocalizados que dan cohesión al conjunto y que son responsables de sus propiedades eléctricas.
|
|
Donde sí se distinguen claramente unidades aisladas, es en los llamados materiales orgánicos, en donde aparece el concepto de entidad molecular (molécula), formada por átomos enlazados entre sí, pero en donde la unión entre las moléculas, dentro del cristal, es mucho más débil (cristales moleculares). Son generalmente materiales más blandos e inestables que los inorgánicos.
|
|
|
Sin embargo la materia no es totalmente ordenada o desordenada (cristalina o no cristalina) y nos podemos encontrar con toda una degradación contínua del orden (grados de cristalinidad) en los materiales, que nos lleva desde los perfectamente ordenados (cristalinos) hasta los completamente desordenados (amorfos). Esta pérdida gradual de orden que se da en los materiales, es equivalente a lo que podemos observar en los pequeños detalles de esta formación gimnástica, que siendo en cierto modo ordenada, sin embargo hay unas personas con pantalones, otras con falda, con posturas algo distintas o ligeramente desalineados ...
La mayor parte de los sólidos de la naturaleza son cristalinos lo que significa que los átomos, moléculas o iones
Que los forman se disponen ordenados geométricamente en el espacio. Esta estructura ordenada no se aprecia
En muchos casos a simple vista porque están formados por un conjunto de microcristales orientados de
Diferentes maneras formando una estructura policristalina, aparentemente amorfa.
Este "orden" se opone al desorden que se manifiesta en los gases o líquidos. Cuando un mineral no presenta
Estructura cristalina se denomina amorfa.
La cristalografía es la ciencia que estudia las formas y propiedades fisicoquímicas de la materia en estado
Cristalino.
Las redes cristalinas se caracterizan fundamentalmente por un orden o periodicidad. La estructura interna de
Los cristales vienen representados por la llamada celdilla unidad que se repite una y otra vez en las tres direcciones
Del espacio. El tamaño de esta celdilla viene determinado por la longitud de sus tres aristas (a, b, c), y la forma
Por el valor de los ángulos entre dichas aristas (a,b,g).
El conjunto de elementos de simetría de un objeto que pasan por un punto, definen la simetría total del objeto
(Grupo puntual de simetría). Hay muchos grupos puntuales, pero en los cristales éstos han de ser compatibles
Con la periodicidad (repetitividad por traslación) por lo que hay sólo 32 posibles grupos puntuales que se denominan
Clases cristalinas. Combinando las dos traslaciones y el ángulo que forman entre sí, sólo hay cinco posibles formaciones de redes
Planas: paralelogramo, rectángulo, cuadrado, hexágono y rombo.
Si formamos una red espacial apilando estas redes planas, sólo existen catorce posibles formaciones que
Representan las formas más sencillas en que puede descomponerse la materia cristalina sin que por ello pierdan
Sus propiedades originales, son las llamadas redes de Bravais.
Los cristales presentan formas más o menos regulares con definición de aristas, caras y vértices. Internamente,
Están constituidos por partículas que guardan entre sí relaciones y distancias fijas; estos parámetros internos
Se estudian mediante rayos X, mientras que los externos se realizan midiendo los ángulos que forman sus caras.
Tipos de Redes Cristalinas. Red cúbica simple
Los átomos ocupan únicamente esquinas de un cubo
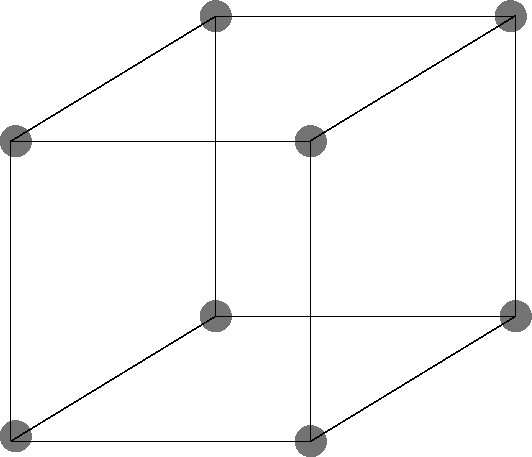
Red cúbica centrada en el cuerpo
Los átomos ocupan las esquinas y el centro del cubo
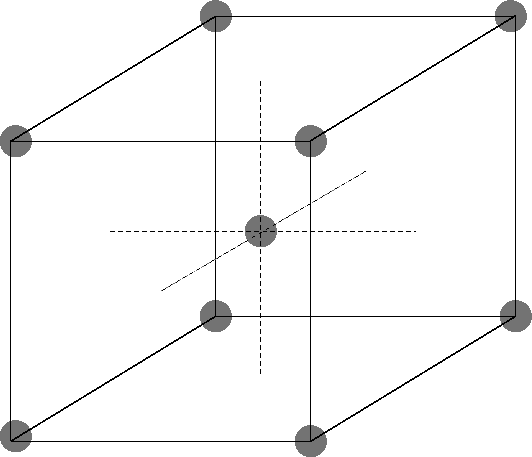
Red cúbica centrada en las caras
Los átomos ocupan las esquinas y el centro de las caras del cubo

Estructuras tipo en cristales iónicos
Estructura tipo cloruro de cesio:
- Los iones cloruro ocupan las posiciones de una red cúbica simple
- Los iones cesio ocupan el centro del cubo
- Se trata de dos redes cúbicas simples ínter penetradas
- Cada ión cesio está rodeado de 8 iones cloruro (y viceversa)

Estructura tipo cloruro sódico:
-Los iones cloruro ocupan las posiciones de una red cúbica centrada en las caras
-Los iones sodio ocupan los centros de las aristas y el centro del cubo
- Se trata de dos redes cúbicas centradas en las caras ínter penetradas
- Cada ión sodio está rodeado de 6 iones cloruro y viceversa

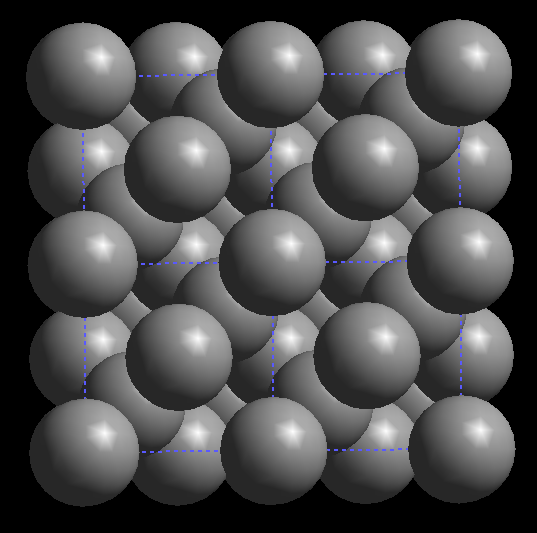
Empaquetamiento compacto
El empaquetamiento compacto se caracteriza por la coordinación de sus átomos, que
toma el valor máximo posible, 12. Las redes compactas se forman mediante apilamiento
de láminas compactas:

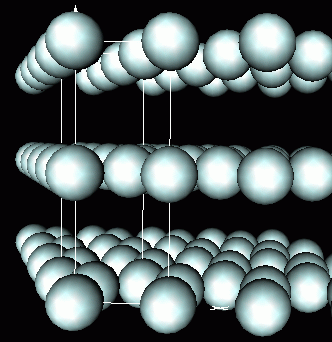
Empaquetamiento hexagonal compacto
El apilamiento A-B-A-B da lugar al empaquetamiento hexagonal compacto, al que le corresponde una red hexagonal centrada en el cuerpo.

Empaquetamiento cúbico compacto
El apilamiento A-B-C-A-B-C da lugar al empaquetamiento cúbico compacto, al que le corresponde una red cúbica centrada en las caras.

Descargar
| Enviado por: | Karlos |
| Idioma: | castellano |
| País: | México |