Ingeniero Químico
Reactores fotoquímicos
1. INTRODUCCIÓN TEÓRICA
Los fundamentos teóricos sobre los que se basa la realización de la práctica se encuentran explicados en los anexos.
2. PROCEDIMIENTO EXPERIMENTAL
El objeto principal de la práctica reside, conceptualmente, en familiarizarse con las características relevantes de los reactores fotoquímicos, y numéricamente, en la determinación de la cantidad de energía lumínica presente en el reactor y su perfil en el interior del mismo. El conocimiento de todos estos datos permitirá explicitar la ecuación de velocidad con vistas a la predicción de conversiones.
3. RESULTADOS Y DISCUSIÓN
3.1. Calcula la concentración inicial de la solución madre de ácido oxálico. Para ello es necesario factorizar el permanganato utilizando como patrón ácido oxálico.
Tabla 1. Estandarización del permanganato con el patrón de ácido oxálico.
| P (H2C2O4) (g) | V (KMnO4) (ml) | Vmedio (KMnO4) (ml) | C (KMnO4) (mol/l) |
| 0,01 | 14,0 | 13,95 +/- 0,025 | 0,149 +/- 0,001 |
| 0,01 | 14,0 | ||
| 0,012 | 13,9 |
F= Conc,exp/Conc,teor = 1,
En la tabla 1 se muestran los datos necesarios para el cálculo de la concentración del permanganato y para, posteriormente, factorizarlo (fórmula 1). Se observan también los errores respectivos de los volúmenes gastados así como el arrastrado para calcular la concentración. Resultan ser poco significativos. El factor respecto a la concentración de permanganato resulta un poco por encima de lo que debiere probablemente debido a una mala manipulación durante la experimentación. En cualquier caso, su relevancia es nula, pues se utilizará la concentración encontrada para cálculos posteriores, no la propuesta.
Tabla 2. Cálculo de la concentración inicial de la solución de ácido oxálico.
| V (H2C2O4) (ml) | V (KMnO4) (ml) | Vmedio (KMnO4) (ml) | C(H2C2O4) (mol/l) |
| 5,0 | 3,5 | 3,53 +/- 0,025 | 0,05 +/- 0,002 |
| 5,0 | 3,5 | ||
| 5,0 | 3,6 |
En la tabla 2 figuran los datos y pasos necesarios para el cálculo de la concentración inicial de ácido oxálico así como los correspondientes errores asociados.
3.2. Determina la conversión alcanzada para los distintos tiempos de operación.
Las concentraciones calculadas en cada intervalo de tiempo, juntamente con la inicial, son necesarias para el cálculo posterior de la conversión en cada tiempo medido mediante la fórmula (2).
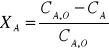
(2)
Tabla 3. Conversión de ácido oxálico alcanzada para los tiempos de operación.
| t (min) | CA (eq/l) | Error CA (eq/l) | XA | Error XA |
| 0 | 0,05 | 0,001 | 0,000 | 0,000 |
| 1 | 0,05 | 0,0000 | 0,00 | 0,024 |
| 3 | 0,049 | 0,0000 | 0,005 | 0,032 |
| 5 | 0,048 | 0,0000 | 0,006 | 0,045 |
| 7 | 0,046 | 0,002 | 0,061 | 0,065 |
| 9 | 0,045 | 0,0015 | 0,071 | 0,045 |
| 11 | 0,043 | 0,003 | 0,073 | 0,039 |
| 13 | 0,043 | 0,002 | 0,074 | 0,050 |
Obsérvese como la conversión en el tiempo 0 es 0, pues la reacción no puede tener lugar sin aportación de energía fotoquímica; su error correspondiente es, lógicamente, 0. Con el paso del tiempo la conversión va aumentando, siempre lentamente, lo cuál nos indica la lenta cinética de la reacción. Existe la hipótesis de que la lámpara que proporcionaba la energía no funcionara de forma correcta. Se podía intuir mediante la rejilla de la caja que contenía el reactor fotoquímico que la lámpara respondía intermitentemente a las señales del interruptor que la activaban. Por este motivo se estuvo especialmente atento al correcto funcionamiento de la lámpara aunque de cualquier forma no se puede asegurar que ésta proporcionara una intensidad de energía constante. Aún con esto, se puede intuir una tendencia lineal creciente con el tiempo que corroboramos a posteriori.
Especial atención merecen los errores asociados a cada una de las conversiones calculadas. Si bien es cierto que el error asociado a las concentraciones es más que aceptable (en algunos casos llega a ser nulo por la correcta manipulación del material de laboratorio y por la correcta ejecución de la valoración), no lo es así el asociado a las conversiones que en algunos casos, como en las dos primeras conversiones, alcanzan valores alarmantes, pues suponen más del 100% de error en las conversiones calculadas. Podemos extraer que los dos primeros valores de conversión son los que mayor error poseen. Aún con esto, estos elevados errores asociados no deberían extrañar demasiado, pues la conversión está calculada a partir de dos datos (concretamente dos concentraciones: la inicial y la relativa a cada tiempo de operación), ambas siempre con un error asociado. Una medida calculada a partir de dos valores con error tendrá un error asociado mayor que los errores asociados a cada uno de los valores a partir de los cuales ha sido calculada. Las conversiones calculadas tienen un importante error asociado y, por tanto, son fiables con relación a este error. Quizás lo más significativo resultan ser los valores de las conversiones (que en todo caso son calculados a partir de medias) y sí pueden proporcionarnos datos aproximados.
3.3 Ajusta las conversiones experimentales al modelo lineal radial y estimar b1.
En la figura 1 (página siguiente) se aprecia el ajuste lineal de la conversión frente al tiempo de operación según el modelo lineal radial. Se procede a su ajuste para poder extraer la constante b1. Para ello se ha decidido eliminar los dos últimos puntos por un motivo a saber: en un reactor fotoquímico la conversión queda determinada, además de por la concentración de los reactivos, por la intensidad, la cantidad y la longitud de onda de la luz suministrada. Con la observación del reactor fotoquímico y concretamente de la lámpara que proporcionaba la energía se podía observar como ésta tenía la longitud aproximada del recipiente que contenía la solución reactante, esto es propiamente, el reactor. Este hecho implica que, a medida que la solución que contiene los reactivos va disminuyendo en volumen, la cantidad de luz que recibe la solución va disminuyendo, pues según el modelo lineal radial, la energía emitida por encima de la solución no llega a ésta y se pierde. Como la teoría indica, la conversión depende también de la cantidad de luz suministrada. Por lo tanto, a menor cantidad de luz, menor conversión. Por esto para determinar el factor de intensidad, se eliminarán estos dos últimos puntos para poseer un ajuste lineal que corresponda más fielmente la realidad del reactor fotoquímico. Existe la posibilidad también de que, por el mal funcionamiento contrastado de la lámpara, ésta se apagará ocasionalmente en alguno de los dos últimos periodos o en los dos. En cualquier caso, resultan ser los dos puntos que mayor se alejan de una tendencia lineal, con lo cual se eludirán.
Figura 1. Conversión frente al tiempo
según el modelo lineal radial
XA = b1·t (3)
Según la ecuación (3) y por comparación:
b1 = 0,001 (4)
3.4. Calcula Iw conociendo b1 y R1 = 3 cm; Ro = 5,6 cm; L = 3 cm; V = 423 cm3; ![]()
mols/eins (el eins es la abreviatura de Einstein, que corresponde con el número de Avogadro de fotones: 6,023·1023).
![]()
(5)
![]()
(6)
Iw = 0,1346 eins / m2·min
A priori, este valor parece ser bastante pequeño, aunque no es de extrañar, pues las conversiones obtenidas son también de pequeño orden (no llegan al 3%). Para corroborar este valor se usarán datos facilitados de otra experimentación, esta vez totalmente fiables y podremos concluir acerca de la intensidad de energía lumínica Iw emitida por la lámpara por unidad de tiempo.
Dicho resultado encontrado de intensidad permite concluir que, o bien el funcionamiento de la lámpara durante la experimentación no era correcto, o bien que la intensidad de energía proporcionada era menor sin más. Se observa como las conversiones alcanzadas ahora acaban oscilando el 20%, lo cual es un valor razonablemente alto. Luego se contrasta que la intensidad para dicha conversión es proporcional, más del doble que la anteriormente calculada.
4. ERRORES EXPERIMENTALES
-
La lámpara que proporciona la energía lumínica funciona intermitentemente. Como ésta no se puede mirar directamente y solo se puede intuir, posibles apagados fueron posibles.
-
La extracción de muestras del reactor se realiza a partir de una salida que posee una válvula que se puede abrir, no sin cierta pérdida de muestra. Además, existe la posibilidad de que en el tubo de la salida queden restos de muestra anterior puesto que la agitación no llega a dicho tubo.
-
Al no tener una bureta de 10 mililitros, las valoraciones se realizaron con una bureta de 25 mililitros, lo cual conlleva un error mayor. Pese a esto, se realizó el posterior tratado de errores que resultaron ser poco significativos.
5. POSIBLES MEJORAS DE LA PRÁCTICA
-
La goma que soporta el sistema de agitación está bastante desgastada y puede quebrar. Se propone su cambio.
-
El fallo ocasional de la lámpara puede distorsionar los resultados. Se propone un revisado de ésta así como un ajuste en la intensidad de la energía lumínica proporcionada.
-
El sistema de extracción del reactor provoca pérdidas y contaminación de muestras posteriores. Un cambio de dicho sistema o un recorte en la longitud del tubo de salida además del cambio de válvula sería interesante.
-
Un baño termóstatico proporcionaría mayor facilidad para realizar las valoraciones en caliente.
6. PROPUESTAS PARA SIGUIENTES EXPERIMENTACIONES
-
Realizar el experimento con diferentes longitudes de onda para ver como este hecho puede influir en la conversión alcanzada.
7. CONCLUSIONES
-
La conversión de una reacción fotoquímica depende, además de la concentración de los reactivos, de la intensidad, cantidad y longitud de onda de luz suministrada.
-
La conversión de la reacción aumenta con la cantidad e intensidad de la energía lumínica suministrada.
-
La energía lumínica suministrada por ciertas longitudes de onda de la luz son del orden de las energías de activación de muchas reacciones químicas, por tanto, provocan la reacción. En un rango de estas energías se centra la fotoquímica. Sin la citada energía lumínica, la reacción no tiene lugar.
-
Según el modelo lineal radial, la intensidad recibida por la solución no es función de la coordenada axial.
-
Una medida calculada a partir de dos valores con error tendrá un error asociado mayor que los errores asociados a cada uno de los valores a partir de los cuales ha sido calculada.
8. BIBLIOGRAFÍA
-
Dossier electrónico.
-
O. Levenspiel. Ingeniería de las reacciones químicas. Editorial Reverté.
Descargar
| Enviado por: | Costa Lopez |
| Idioma: | castellano |
| País: | España |
