Química
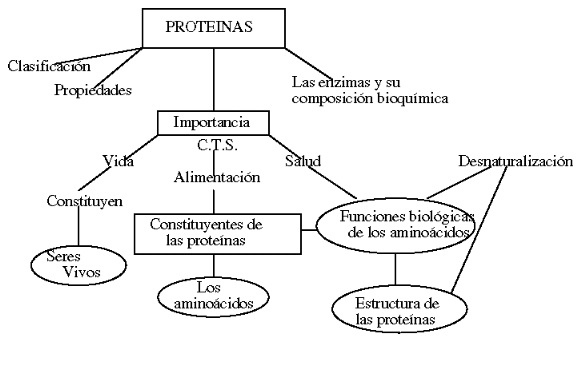
Proteínas
INTRODUCCIÓN
La síntesis orgánica como ciencia es relativamente joven no obstante sus orígenes ancestrales. Su inicio con la síntesis de la urea fue seguido por un lento desarrollo, en el que tuvieron un papel relevante la síntesis de la tropinona y la quinina, entre otros. Recién después de la segunda guerra mundial ingresa en una etapa de florecimiento junto con la síntesis total de los productos naturales.
Los países económicamente estables y avanzados industrialmente deben parte de su éxito a los grandes progresos que se hicieron en esta rama de la ciencia. En ellos se han desarrollado excelentes métodos para producir comercialmente sustancias de origen natural usadas en medicina, agricultura y en la vida cotidiana. Se pueden citar como ejemplos el mentol, un terpeno de amplio uso, y el ya célebre taxol, que es usado en el tratamiento del cáncer. Por otro lado, numerosas industrias, como las de fármacos, detergentes, polímeros, fertilizantes, pesticidas, cosméticos, pinturas, etc., dependen fundamentalmente de la síntesis orgánica para su desarrollo.
Hoy en día los científicos de otras disciplinas como la biología, bioquímica, física, ciencia de los materiales, etc. Necesitan de la cooperación interdisciplinaria con especialistas en síntesis orgánica para sus investigaciones. Al mismo tiempo, en el diseño de una síntesis orgánica suelen intervenir actualmente varias disciplinas, entre ellas la inorgánica y la biología molecular.
La síntesis orgánica se mueve en el campo de la bioquímica. Lo que diferencia a la bioquímica de la química es:
1.- Las moléculas son muy largas, pero contrariamente a un polímero sintético, un biopolímero tiene una secuencia y un número fijo de unidades de monómero y, a menudo, una forma tridimensional estable.
2.- Las clases de moléculas están basadas principalmente en su estructura, pero también en su función en las células vivas.
3.- Las reacciones acontecen a temperaturas moderadas; son extremadamente sensibles a los catalizadores que intervienen, llamados enzimas; y la energía para llevar a cabo una reacción puede provenir de la energía desprendida de alguna reacción conjunta.
4.- En todo el reino animal y vegetal hay poca o ninguna diferencia en la estructura de las moléculas escogidas por la naturaleza para tener un función biológica.
Los Aminoácidos
Los aminoácidos se caracterizan por poseer un grupo carboxilo (-COOH) y un grupo amino (-NH2).

Las otras dos valencias del carbono se saturan con un átomo de H y con un grupo variable denominado radical R.
Según éste se distinguen 20 tipos de aminocidos
COMPORTAMIENTO QUÍMICO
En disolución acuosa, los aminoácidos muestran un comportamiento anfótero, es decir pueden ionizarse, dependiendo del pH, como un ácido liberando protones y quedando (-COO'), o como base , los grupos -NH2 captan protones, quedando como (-NH3+ ), o pueden aparecer como ácido y base a la vez. En este caso los aminoácidos se ionizan doblemente, apareciendo una forma dipolar iónica llamada zwitterion
EL ENLACE PEPTÍDICO
Los péptidos están formados por la unión de aminoácidos mediante un enlace peptídico. Es un enlace covalente que se establece entre el grupo carboxilo de un aa. y el grupo amino del siguiente, dando lugar al desprendimiento de una molécula de agua.
El enlace peptídico tiene un comportamiento similar al de un enlace doble, es decir, presenta una cierta rigidez que inmoviliza en un plano los átomos que lo forman.
PROPIEDADES:
Isomería espacial y óptica: El átomo de C que ocupa la posición es asimétrico en todos los aminoácidos (salvo en la glicina), ya que poseen 4 radicales distintos. Este hecho los hace ópticamente activos, de modo que en disolución desvían el plano en que vibra un haz de luz polarizada.
A su vez como los enlaces de los átomos de C poseen una configuración tetraédrica, serán posibles 2 configuraciones distintas para cada aminoácido, que serán imágenes especulares o estereoisómeros.
Propiedades ácido-base: en disoluciones próximas a 7, los aminoácidos están ionizados. En este caso el grupo amino capta un protón, actuando como base, y el grupo carboxilo cede un protón actuando como ácido. Los aminoácidos a Ph neutro se encuentran en estado de iones híbridos. Formando dipolos. Son por tanto anfóteros ya que pueden actuar tanto como ácido como base.
c) Solubilidad: La bipolaridad de los aminoácidos y la presencia del radical explica su solubilidad.
CLASIFICACIÓN.
-
Según las características que presentan sus cadenas laterales (R) se dividen en:
Ácidos:
R aporta grupo carboxilo.
Bases:
R aporta grupos Amino.
Neutros polares:
R contiene grupos polares capaces de formar puentes de H con otros compuestos polares.
Neutros apolares:
R posee grupos hidrófobos que interaccionan con otros grupos hidrófobos mediante fuerzas de Van Der Waals.
En la naturaleza se conocen alrededor de 200 aminoácidos, o más, pero solo 20 forman parte de las proteínas. Estos últimos son los denominados ácidos protéicos, frente al resto que se denominan aminoácidos no protéicos. De estos 20 aminoácidos protéicos hay 9 que nuestro organismo no puede sintetizar, por eso los tenemos que ingerir en la dieta, son los denominados aminoácidos esenciales, frente a los aminoácidos no esenciales, que son aquellos que nuestro organismo puede sintetizar.
Proteína
Es el nombre que recibe cualquiera de los numerosos compuestos orgánicos constituidos por aminoácidos unidos por enlaces peptídicos; forman los organismos vivientes y son esenciales para su funcionamiento. Las proteínas se descubrieron en 1838 y hoy se sabe que son los ingredientes principales de las células y suponen más del 50% del peso seco de los animales. El término `proteína' deriva del griego proteios, que significa primero.
Las moléculas proteicas van desde las largas fibras insolubles que forman el tejido conectivo y el pelo hasta los glóbulos compactos solubles, capaces de atravesar la membrana celular y desencadenar reacciones metabólicas. Son siempre grandes, de peso molecular comprendido entre unos miles de unidades y más de un millón, y específicas de cada especie y de cada uno de sus órganos. Se estima que el ser humano tiene unas 30.000 proteínas distintas, de las que sólo un 2% se han descrito en profundidad. Las proteínas de la dieta sirven sobre todo para construir y mantener las células, aunque su descomposición química también proporciona energía, con un rendimiento de 4 kilocalorías por gramo, similar al de los hidratos de carbono.
Además de intervenir en el crecimiento y el mantenimiento celulares, las proteínas son responsables de la contracción muscular. Las enzimas digestivas son proteínas, al igual que la insulina y casi todas las demás hormonas, los anticuerpos del sistema inmunológico y la hemoglobina, que transporta oxígeno en la sangre. Los cromosomas, que transmiten los caracteres hereditarios en forma de genes, están compuestos por ácidos nucleicos y proteínas.
Están integradas por los elementos C, H, O, N, P y S y tal vez un metal. El contenido en N oscila de 14 a 19%. Sus moléculas son gigantes y tienen un peso que oscila entre 15000 y un número indefinidamente grande. Las proteínas por Hidrólisis sufren un fraccionamiento que se puede resumir de la siguiente manera:
H2O H2O H2O H2O
Proteínas ---------- proteosa ------------- peptona ----------- polipéptido ------- péptido
H2O
más sencillo --------- aminoácidos
Nutrición
Las proteínas, desde las humanas hasta las que forman las bacterias unicelulares, son el resultado de las distintas combinaciones entre veinte aminoácidos distintos, compuestos a su vez por carbono, hidrógeno, oxígeno, nitrógeno y, a veces, azufre. En la molécula proteica, estos aminoácidos se unen en largas hileras (cadenas polipeptídicas) mantenidas por enlaces peptídicos, que son enlaces entre grupos amino (NH2) y carboxilo (COOH). El número casi infinito de combinaciones en que se unen los ácidos y las formas helicoidales y globulares en que se arrollan las hileras o cadenas polipeptídicas, ayudan a explicar la gran diversidad de funciones que las proteínas desempeñan en la materia viva.
Para sintetizar sus proteínas esenciales, cada especie necesita disponer de los veinte aminoácidos en ciertas proporciones. Mientras que las plantas pueden fabricar sus aminoácidos a partir de nitrógeno, dióxido de carbono y otros compuestos por medio de la fotosíntesis, casi todos los demás organismos sólo pueden sintetizar algunos. Los restantes, llamados aminoácidos esenciales, deben ingerirse con la comida. El ser humano necesita ocho aminoácidos esenciales para mantenerse sano: leucina, isoleucina, lisina, metionina, fenilalanina, treonina, triptófano y valina. Todos ellos se encuentran en las proteínas de las semillas vegetales, pero como las plantas suelen ser pobres en lisina y triptófano, los especialistas en nutrición humana aconsejan complementar la dieta vegetal con proteínas animales de carne, huevos y leche, que contienen todos los aminoácidos esenciales.
Casi todas las dietas, en especial en los países desarrollados donde se consume un exceso de proteínas animales, contienen todos los aminoácidos esenciales. El kwashiorkor, una enfermedad debilitante que afecta a los niños del África tropical, se debe a la deficiencia en uno de los aminoácidos esenciales. La ingesta de proteínas recomendada para adultos es de 0,79 g por kg de peso corporal al día; para los niños y lactantes que se encuentran en fase de crecimiento rápido, este valor debe multiplicarse por dos y por tres, respectivamente.
Interacciones entre proteínas
Las cadenas de polipéptidos se organizan en secuencia y se arrollan de forma que los aminoácidos hidrófobos suelen mirar hacia el interior, para dar estabilidad a la molécula, y los hidrófilos hacia el exterior, para poder interaccionar con otros compuestos y, en particular, con otras proteínas. Las enzimas son proteínas; en algunos casos necesitan para llevar a cabo su función un componente no proteico llamado cofactor, éste puede ser inorgánico (ion metálico) o una molécula orgánica; en este caso el cofactor se denomina coenzima. En otras ocasiones unas proteínas se unen a otras para formar un conjunto de proteínas necesario en la química o la estructura celulares.
Químicamentes las proteínas son polímeros de masa molar elevada (104 hasta 107) cuyos monómeros son ácidos a - aminocarboxílicos.
H3NCHCO------ --- (NHCHCO)n --- NHCHCOO -
R R R
Como observamos, la molécula de proteínas contiene ciertos y aún miles de unidades de aminoácidos, unidos por enlaces peptídicos.
Las proteínas de los seres vivos se construyen con algo más de 20 aminoácidos los que combinados forman proteínas tan diferentes como la queratina de las uñas, la fibra muscular o la albúmina del huevo.
En un dipéptido existen dos posibilidades de unión entre los aminoácidos, dependiendo de cual sea el grupo de carboxilo y aminos que formen el enlace peptídico. Si se trata de un tripéptido se pueden encontrar 6 estructuras diferentes y, si es un tetrapéptido, puede tener 24 estructuras diferentes; un hexapéptido 720; un decapéptido sobrepasa los 3.6 millones de ordenamientos diferentes. Aún más, una proteína típica contiene entre 100 y 300 unidades de aminoácidos, unidos entre sí en una secuencia definida, y se estima que el organismo humano contiene alrededor de 100 mil proteínas diferentes. La complejidad en el potencial aumenta con rapidez fantástica a medida que se incorporan más y más aminoácidos a un polipéptido. complejidad que se complica aún más al determinar la disposición espacial de la cadena proteínica.
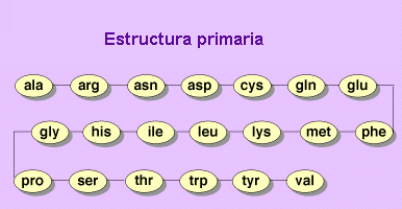
Estructura primaria: Corresponde a la secuencia específica de los aminoácidos en la cadena proteica.
Estructura secundaria: Dice relación con la manera cómo estas cadenas se disponen en el espacio para formar espigas, láminas o esferas compactas.
Existen dos tipos de estructura secundaria:
la a(alfa)-hélice
la conformación beta
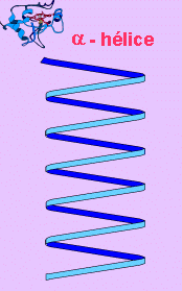
Esta estructura se forma al enrollarse helicoidalmente sobre sí misma la estructura primaria. Se debe a la formación de enlaces de hidrógeno entre el -C=O de un aminoácido y el -NH- del cuarto aminoácido que le sigue.
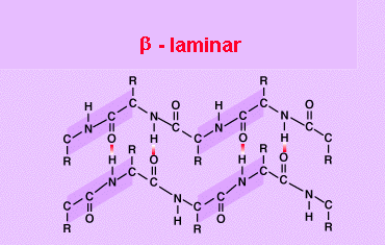
En esta disposición los aas. no forman una hélice sino una cadena en forma de zigzag, denominada disposición en lámina plegada.
Presentan esta estructura secundaria la queratina de la seda o fibroína.
Estructuras terciarias: Se refiere a la forma en que se disponen las unidades estructurales secundarias en la proteína natural que está plegada y replegada.
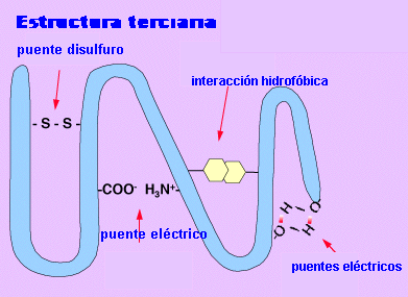
Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los radicales R de los aminoácidos. Aparecen varios tipos de enlaces:
el puente disulfuro entre los radicales de aminoácidos que tiene azufre.
los puentes de hidrógeno
los puentes eléctricos
las interacciones hifrófobas.
Estructura Cuaternaria : Esta estructura informa de la unión , mediante enlaces débiles ( no covalentes) de varias cadenas polipeptídicas con estructura terciaria, para formar un complejo proteico. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero.
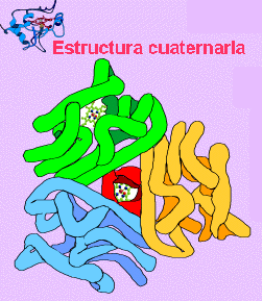
El número de protómeros varía desde dos como en la hexoquinasa, cuatro como en la hemoglobina, o muchos como la cápsida del virus de la poliomielitis, que consta de 60 unidades proteícas.
Las proteínas se pueden clasificar según su forma, composición y función fisiológica.
Según su forma:
Proteínas fibrosas:
Tienen forma de hilos largos. las cadenas de péptidos se mantienen juntas mediante puentes de H intermoleculares. Son insoluble en agua.
Se encuentran en tejidos animales. A continuación se describen las principales proteínas fibrosas: colágeno, queratina, fibrinógeno y proteínas musculares.
Colágeno
El colágeno, que forma parte de huesos, piel, tendones y cartílagos, es la proteína más abundante en los vertebrados. La molécula contiene por lo general tres cadenas polipeptídicas muy largas, cada una formada por unos mil aminoácidos, trenzadas en una triple hélice siguiendo una secuencia regular que confiere a los tendones y la piel su elevada resistencia a la tensión. Cuando las largas fibrillas de colágeno se desnaturalizan por calor, las cadenas se acortan y se forma gelatina.
Queratina
La queratina, que constituye la capa externa de la piel, el pelo y las uñas en el ser humano y las escamas, pezuñas y plumas en los animales, se retuerce o arrolla en una estructura helicoidal regular llamada hélice a. La queratina protege el cuerpo del medio externo y es por ello insoluble en agua. Sus numerosos enlaces disulfuro le confieren una estabilidad extremada que resiste a la acción de las enzimas proteolíticas (que hidrolizan a las proteínas).
Fibrinógeno
El fibrinógeno es la proteína plasmática de la sangre responsable de la coagulación. Bajo la acción catalítica de la trombina, el fibrinógeno se transforma en la proteína insoluble fibrina, que se unen entre sí para formar trombos o coágulos de sangre.
Proteínas musculares
La miosina, que es la principal proteína responsable de la contracción muscular, se combina con la actina, y ambas actúan en la acción contráctil del músculo esquelético y en distintos tipos de movimiento celular.
Proteínas globulares
A diferencia de las fibrosas, las proteínas globulares son esféricas y muy solubles en agua o soluciones salinas. Las cadenas de péptidos están plegadas y las cadenas se estabilizan a través de puentes de H. Desempeñan una función dinámica en el metabolismo corporal. Son ejemplos la albúmina, la globulina, la caseína, la hemoglobina, y las hormonas proteicas. Albúminas y globulinas son proteínas solubles abundantes en las células animales, el suero sanguíneo, la leche y los huevos. La hemoglobina es una proteína respiratoria que transporta oxígeno por el cuerpo; a ella se debe el color rojo intenso de los eritrocitos. Se han descubierto más de cien hemoglobinas humanas distintas, entre ellas la hemoglobina S, causante de la anemia de células falciformes.
Enzimas
Todas las enzimas son proteínas globulares que se combinan con otras sustancias, llamadas sustratos para catalizar las numerosas reacciones químicas del organismo. Estas moléculas, principales responsables del metabolismo y de su regulación, tienen puntos catalíticos a los cuales se acopla el sustrato igual que una mano a un guante para iniciar y controlar el metabolismo en todo el cuerpo.
Hormonas proteicas
Estas proteínas, segregadas por las glándulas endocrinas, no actúan como las enzimas, sino que estimulan a ciertos órganos fundamentales que a su vez inician y controlan actividades importantes, como el ritmo metabólico o la producción de enzimas digestivas y leche. La insulina, segregada por los islotes de Langerhans en el páncreas, regula el metabolismo de los hidratos de carbono mediante el control de la concentración de glucosa. La tiroglobulina, segregada por la glándula tiroidea, regula el metabolismo global; la calcitonina, también producida en el tiroides, reduce la concentración de calcio en sangre.
Anticuerpos
Los anticuerpos, también llamados inmunoglobulinas, agrupan los miles de proteínas distintas que se producen en el suero sanguíneo como respuesta a los antígenos (sustancias u organismos que invaden el cuerpo). Un solo antígeno puede inducir la producción de numerosos anticuerpos, que se combinan con diversos puntos de la molécula antigénica, la neutralizan y la precipitan en la sangre.
Microtúbulos
Las proteínas globulares pueden también agruparse en diminutos túbulos huecos que actúan como entramado estructural de las células y, al mismo tiempo, transportan sustancias de una parte de la célula a otra. Cada uno de estos microtúbulos está formado por dos tipos de moléculas proteicas casi esféricas que se disponen por parejas y se unen en el extremo creciente del microtúbulo y aumentan su longitud en función de las necesidades. Los microtúbulos constituyen también la estructura interna de los cilios y flagelos, apéndices de la membrana de los que se sirven algunos microorganismos para moverse.
b) Según su composición:
Encontramos proteínas sencillas debido a que por hidrólisis proporcionan sólo aminoácidos. En cambio las proteínas conjugadas dan, por hidrólisis, aminoácidos y otros productos como azúcares, ácido fosfórico, fosfolípidos y ácidos nucleicos.
c) Según su función en los seres vivos:
Proteínas Estructurales:
Están presentes en la piel, huesos, cartílagos, etc.
Proteínas Contractiles:
Se encuentran en los músculos por ejemplo la miosina y la actina.
Proteínas Hormonas:
Operan como mensajeras humorales entre órganos y tejidos. Ej: insulina.
Proteínas Enzimas:
Sirven de catalizadores en las múltiples reacciones químicas. Ej: pepsina, tripsina.
Proteínas anticuerpos:
Eliminan las especies invasoras en el cuerpo. Ej: Gammaglobulina de la sangre.
Proteínas de la sangre:
Mantienen la presión osmótica, transporte de oxígeno, coagulación. Ej: Fibrinógeno, albúmina y hemoglobina.
Propiedades de las proteínas:
Las propiedades de las proteínas dependen sobre todo de los radicales R libres y de que éstos sobresalgan de la molécula y tengan la posibilidad de reaccionar con otras moléculas. El conjunto de aminoácidos de una proteína cuyos radicales poseen la capacidad de unirse a otras moléculas y de reaccionar con éstas se denomina centro activo de la proteína.
·- Solubilidad :
La solubilidad de estas moléculas se debe a los radicales R, que, al ionizarse, establecen puentes de hidrógeno con las moléculas de agua.
- Especificidad :
En su secuencia de aminoácidos, las proteínas presentan sectores estables y sectores variables, en los que algunos aminoácidos pueden ser sustituidos por otros distintos sin que se altere la funcionalidad de la molécula. Ello ha dado lugar, durante el proceso evolutivo, a una gran variabilidad de moléculas proteicas, lo que permite que cada especie tenga sus proteínas específicas.
- Hidrólisis :
Al tratar los péptidos y proteínas con un ácido mineral en caliente ocurre su hidrólisis, obteniéndose los aminoácidos constituyentes.
H2O
Proteínas -------------- aminoácidos
H+
La hidrólisis alcalina ocasiona racemización de los aminoácidos resultantes.
- Desnaturalización :
Consiste en la precipitación irreversible de las proteínas. esta acción puede ser ocasionada por la calefacción, irradiación de luz ultravioleta, o por tratamiento con diversos solventes o radiactivos: alcohol, acetona, yoduro de potasio diluido. Los polipéptidos no sufren desnaturalización, quizás porque sus moléculas son más pequeñas que las de proteínas.
Un ejemplo clásico de desnaturalización se tiene en los cambios que ocurren al calentar ovoalbumina.
Compuestos químicos y condiciones que causan desnaturalización :
| Agente desnaturalizante | Cómo puede operar el agente |
| Calor | Rompe puentes de hidrógeno y salinos, haciendo que las moléculas vibren demasiado violentamente. Produce coagulación, como cuando su fríe un huevo |
| Soluciones de urea O (NH2 - C -- NH2) | Rompen puentes de hidrógeno. Puesto que es semejante a una amida, la urea puede formar puentes de hidrógeno compitiendo con los existentes en la proteína. |
| Radiación ultravioleta | Parece operar en la misma forma que el calor (quemaduras del sol) |
| Solventes orgánicos (alcohol etílico, acetona, alcohol isopropílico) | Pueden interferir con los puentes de Hidrógeno de las proteínas, ya que las moléculas de alcohol pueden formarlos. Desnaturaliza rápidamente a las proteínas de las bacterias, y las mata (la acción desinfectante del alcohol etílico, solución al 70%) |
| Ácidos o bases fuertes | pueden romper puentes de Hidrógeno y salinos La acción prolongada de ácidos o bases acuosos lleva a la hidrólisis propiamente dicha de las proteínas |
| detergentes | Pueden afectar los puentes salinos (formando otros, ellos mismos) o pueden afectar a los puentes de Hidrógeno |
| Sales de metales pesados (sales de los iones Hg2+, Ag+, Pb2+ | pueden romper puentes salinos (formando ellas mismas otros distintos). Estos iones precipitan casi siempre a las proteínas (coagulación) |
| reactivos de los alcaloides (ácidos tánico, pícrico y fosfomolíbdico | Puede afectar tanto a los puentes salinos como a los de hidrógeno. Estos reactivos precipitan las proteínas. |
| Agitaciones o sacudimientos violentos | En las soluciones de proteínas pueden formar películas superficiales de proteína desnaturalizada (como al batir claras de huevo para hacer merengue) |
- Punto isoeléctrico:
En las cadenas péptidas existen cadenas laterales que tienen grupos ácidos (-COOH, ácido aspártico, ácido glutámico) o grupos básicos (-NH2 lisina, histidina). a causa de estas cadenas laterales se tendrán grupos cargados positiva y negativamente a lo largo de la cadena peptídica. En consecuencia, el comportamiento de una proteína en un campo eléctrico quedará determinado por el número relativo de estas cargas positivas o negativas, las que a su vez son afectadas por la acidez de la solución (pH). En el punto isoeléctrico (pl) se equilibran exactamente las cargas opuestas, por lo tanto, la proteína no demuestra migración neta; generalmente, su solubilidad es mínima en este punto.
Por debajo del punto isoeléctrico las cargas positivas exceden a las negativas, por lo que la proteína se dirige hacia el cátodo, por encina de él, las negativas predominan sobre las positivas y las proteínas se mueven hacia el ánodo. esta diferencia en el comportamiento de las proteínas en un campo eléctrico es la base de un método de separación de ellas, conocido como electroforesis.
· Capacidad amortiguadora.
Las proteínas, al estar constituidas por aminoácidos, tienen un comportamiento anfótero. Tienden a neutralizar las variaciones de pH del medio, ya que pueden comportarse como un ácido o una base y, por tanto, liberar o retirar protones (H+) del medio.
Reacciones que caracterizan a las proteínas:
En el laboratorio se emplean pruebas de caracterización que se basan en la formación de compuestos coloreados entre ciertos reactivos y los aminoácidos de las proteínas. Las principales reacciones de reconocimiento son:
reacción de Bioret: Consiste en el agregado de solución de sulfato cúprico a una solución alcalina de una proteína. aparece una coloración azul-violeta o rosada.
Reacción de Millon : Esta reacción es positiva si la proteína contiene el aminoácido tirosina. El reactivo se compone de una mezcla de nitratos mercúricos y mercurioso. Al calentarlo con una proteína, se forma un precipitado blanco que, al ser nuevamente calentando, vira al rojo.
Reacción de Xantoproteica : Esta prueba resulta positiva si la proteína contiene aminoácidos aromáticos. El reactivo es ácido nítrico concentrado y aparece una coloración amarilla; al agregar un hidróxido , el color cambia a anaranjado.SIGUE ABAJO
SIGUE ABAJO SIGUE ABAJO SIGUE ABAJO SIGUE ABAJO
Síntesis de proteínas
enlace peptídico
CH3 O CH2OH O CH3 O CH2OH O
H2N ---- CH --- C --- OH + H2N --- CH --- C --- OH H2N --- CH --- C --- NH ----- CH ------ C --- OH + H20
dipéptido
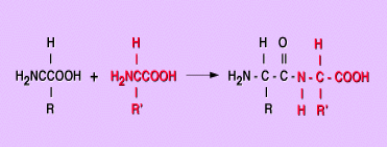
El grupo amino de un aminoácido puede combinarse con el grupo carboxilo de otro aminoácido, como vemos en la figura. Se obtiene un compuesto llamado dipéptido. El nuevo enlace formado recibe el nombre de unión o enlace peptídico. Desde el punto de vista químico la unión peptídica corresponde a un grupo amido. El enlace peptídico es un enlace de tipo amida secundaria, que se establece entre el grupo carboxilo de un aminoácido y el grupo amino del otro, liberándose una molécula de agua y formándose un dipéptido
Se puede observar que el dipéptido formado sigue poseyendo los grupos reactivos -NH2 y -COOH, por lo que el proceso de adición de aminoácidos puede continuar por ambos extremos formándose tripéptidos, tetrapéptidos, etc. Cuando se unen más de 10 aminoácidos, la cadena formada se denomina polipéptido. Si el número de aminoácidos enlazados es mayor a 100 entonces se habla de una proteína.
La Formación de amidas es la reacción típica de condensación enzimática por deshidratación, en la que el grupo carboxilo de un aminoácido se combina con el grupo amino del siguiente. Este enlace se llama también peptídico porque el polímero que se genera, es decir, la proteína, también puede llamarse polipéptido o péptido a secas.
En otras palabras, el grupo amino (NH2 ) y el grupo Carboxilo (COOH) se incorporan, formando - en este caso - NH, CO y liberando H2O.
Grupo amino : Cada uno de los compuestos orgánicos que se forman por sustitución de uno o más hidrógenos del amoníaco por radicales alquilo.
Grupo Carboxilo : radical orgánico monovalente, combinación de un grupo carbonilo y otro hidroxilo, caracteríatico de los ácidos orgánicos, de fórmula - COOH.CONCLUSIÓN :
Las proteínas constituyen el grupo de moléculas más grande de la materia viva; son sumamente importantes en la estructura y funcionamiento de las organismos. La clave para comprender su papel es entender la estructura de la molécula. La secuencia de los aminoácidos en la molécula es de importancia fundamental. Los dobleces y rizos de la cadena de aminoácidos son ocasionados por los grupo R o ramificaciones en cada aminoácido. Actualmente, las proteínas son de gran interés en las investigaciones de ingeniería genética con la producción de hormonas a nivel industrial que tienen gran uso en la medicina.
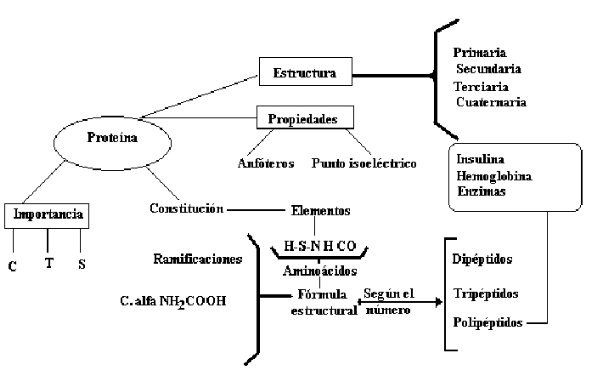
mapa conceptual de las proteínas.
Descargar
| Enviado por: | Frada |
| Idioma: | castellano |
| País: | Chile |
