Química
Proteínas
Trabajo
De
Química
TEMA : “Las Proteínas”
NOMBRE :
CURSO : IIº Medio
FECHA : 8 - 05 - 2001
.
INDICE: Página
-
Presentación......................................................................................... 2
-
Introducción......................................................................................... 3
-
Desarrollo “Las Proteínas”
-
Concepto y Definición................................................................ 4
-
Clasificación de Proteínas
-
Fibrosas......................................................................... 4
-
Globulares..................................................................... 5
-
Tipos de Proteínas
-
Heteroproteínas.............................................................. 5
-
Fuentes Naturales de Proteínas.................................................. 5-6
-
Alimentos ricos en Proteínas
-
El pescado, fuente de proteínas...................................... 6
-
Proteínas de la leche con funciones defensivas............... 6-7
-
Estructura de las Proteínas
-
Estructura Primaria...................................................... 8
-
Estructura Secundaria.................................................. 8
-
Estructura Terciaria...................................................... 9
-
Estructura Cuaternaria................................................. 9
-
Reacciones Químicas en las Proteínas...................................... 10
-
Funciones de las Proteínas en los Seres Vivos.......................... 11
-
Síntesis de Proteínas
-
Traducción................................................................... 12-13
-
Etapas de la Síntesis.................................................... 13-14
-
Digestión de Proteínas............................................................. 14-15
-
Conclusión......................................................................................... 16
-
Vocabulario........................................................................................ 17-18-19
-
Listado de Preguntas.......................................................................... 20
-
Bibliografía......................................................................................... 21
-
Indice Temático.................................................................................. 22
Presentación:
El Trabajo que presentaremos a continuación, se solicitó el día Martes 20 de Marzo, por el profesor de Química Vicente Tiraferri, para ser entregado el día 8 de Mayo, al profesor. Luego, el próximo semestre, especificamente, será presentado, y acompañado de una disertación. A nosotras, sus integrantes; Daniela Acuña, Constanza Alvarez, Mercy Labra, María José Lillo, Natalia Sobarzo y Nicole Zamora; nos corresponde el tema “Las Proteínas”. Es de nuestro completo agrado realizarlo, ya que queremos conocemos mas de este campo, la Química que a la vez se relaciona con la Biología, en esta materia. Creemos que este rubro abarca bastante campo y nos servirá para bastantes cosas y sobretodo para futuro, además que estamos realizando y estudiando la misma materia, o parecida con el profesor de Biología, Eduardo Castillo. Por esto nos resultó lo suficientemente importante como para desarrollar el trabajo. A decir verdad, elegimos este, ya que indagaríamos por el gran campo de la Química -Biología, el cual es muy extenso, y hay muchas cosas que aprender.
Este trabajo consistirá principalmente en un Indice, una pequeña Introducción, luego un extenso Desarrollo del tema, ya que para entender nuestro trabajo, es estrictamente necesario, y luego, desarrollando la investigación veremos diferentes ideas respecto a distintos aspectos de las Proteínas, en cuanto a Nutrición, Biología, Genética, Química, etc. Por último expresaremos nuestras palabras finales en una Conclusión, un Vocabulario con los conceptos que usamos en el trabajo y desarrollaremos un listado de preguntas para compartir y desarrollar con el curso. Luego, una pequeña reseña bibliográfica y para terminar, un índice Temático alfabéticamente ordenado. Esperamos que sea de su agrado.
.
Introducción
En el siguiente trabajo, daremos a conocer, todo tipo de información acerca de una Proteína. Iremos explicando por temas. Y trataremos de ser muy específicas y tener todo muy bien definido.
Empezaremos por un Indice, luego una pequeña Presentación acerca de este, para empezar desarrollando el tema paso por paso. Primero partiremos, como todo trabajo, dando una definición de Proteína, sus componentes y clasificación. Luego pasaremos a mencionar las Fuentes Naturales de Proteínas y Alimentos ricos en ellas. Después definiremos y explicaremos cada una de las estructuras de las Proteínas y en conexión con la Química, las reacciones que se producen en ellas. A continuación, clasificaremos y definiremos las variadas y múltiples funciones de las proteínas en el cuerpo humano. Posteriormente, veremos un tema muy importante, incluso un poco mas que los otros temas, trataremos la Síntesis de Proteínas y su relación con el ADN y a su vez, con Genética. Y por último (en cuanto a temas se refiere), pero no menos importante, explicaremos, la digestión de Proteínas, sus procedimientos, sus colaboradores, y el proceso en general; todo esto con imágenes y definiciones. Luego, agregaremos una especie de Vocabulario con conceptos importantes y complejos que estén contenidos en el trabajo. Luego un listado de preguntas acerca de las Proteínas, para compartir y desarrollar con nuestros compañeros, el cual será incluido en el trabajo y dictado para que todos trabajemos en este. Posteriormente, aplicaremos a nuestro trabajo una respectiva Bibliografía con información acerca del origen de nuestro trabajo. Y por último un Indice Temático con los temas del trabajo, alfabéticamente ordenados.
Así se compondrá el trabajo que viene a continuación.
.
LAS PROTEÍNAS
-
DEFINICIÓN Y CONCEPTO
Las proteínas son cualquiera de los numerosos compuestos orgánicos constituidos por aminoácidos unidos por enlaces pesticidas que intervienen en diversas funciones vitales esenciales, como el metabolismo, la contracción muscular o la respuesta inmunología. Se descubrieron en 1938 y hoy se sabe que son los componentes principales de las células y que suponen mas de 50% del peso seco de los animales. El término proteína deriva del griego proteico, que significa primero.
Las moléculas proteicas van desde las largas fibras insolubles que forman el tejido conectivo y el pelo, hasta los glóbulos compactos solubles, capaces de atravesar la membrana celular y desencadenar reacciones metabólicas.
Tienen un peso molecular elevado y son específicas de cada especie y de cada uno de sus órganos. Se estima que el ser humano tiene unas 30.000 proteínas distintas, de las que un 2% se ha descrito con detalle. Las proteínas sirven sobre todo para construir y mantener las células, aunque su descomposición química también proporciona energía, con un rendimiento de 4 kilocalorías por gramo, similar al de los hidratos de carbono.
Además de intervenir en el crecimiento y el mantenimiento celulares, son responsables de la contracción muscular. Las enzimas son proteínas al igual que la insulina y casi todas las demás hormonas, los anticuerpos del sistema inmunológico y la hemoglobina, que transporta oxigeno en la sangre. Los cromosomas, que transmiten los caracteres hereditarios en forma de genes, están compuestos por ácidos nucleicos y proteínas.Las proteínas son biomoléculas formadas básicamente por carbono, hidrogeno, oxigeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre entre otros elementos.
Pueden considerarse polímeros de unas pequeñas moléculas que reciben el nombre de aminoácidos y serian por lo tanto los monómeros unidad. Los aminoácidos están unidos mediante enlaces peptídicos. La unión de un bajo numero de aminoácidos da lugar a un péptido; si el N= n° de aminoácidos. Lo que forma la molécula N si esta es mayor de 10, es un polipéptido; se denomina oligopéptido, si N es superior a 50 aminoácidos. Se habla ya de proteína cuando N es mayor a 100 aminoácidos.
-
CLASIFICACIÓN DE LAS PROTEÍNAS
PROTEÍNAS FIBROSAS: A continuación se describen las principales proteínas Fibrosas: colágeno, queratina, Fibrinógeno y proteínas musculares.
-
COLAGENO: El colágeno, que forma parte de huesos, piel, tendones y cartílagos, es la proteína más abundante de los vertebrados. La molécula contiene por lo general tres cadenas polipeptídicas muy largas, cada una formada por unos 1.000 aminoácidos, trenzadas en una triple hélice siguiendo una secuencia regular que confiere a los tendones y a la piel su elevada resistencia a la tensión. Cuando las largas fibrillas de colágeno se desnaturalizan por calor, las cadenas se acortan y se convierten en gelatina.
-
QUERATINA: La queratina, que constituye la capa externa de la piel, el pelo y las uñas en el ser humano y las escamas, pezuñas, cuernos y plumas en los animales, se retuerce o arrolla en una estructura helicoidal regular llamada hélice á. La queratina protege el cuerpo del medio externo y es por ello insoluble en agua. Sus numerosos enlaces disulfuros le confiere una gran estabilidad y le permiten resistir la acción de las enzimas proteolíticas (que hidrolizan a las proteínas).
-
FIBRINOGENO: El fibrinógeno, es la proteína plasmática de la sangre responsable de la coagulación. Bajo la acción catalítica de la trombina, el fibrinógeno se transforma en la proteína insoluble fibrina, que es el elemento estructural de los coágulos sanguíneos.
-
PROTEINAS MUSCULARES: La miosina, que es la principal proteína responsable de la contracción muscular, se combina con la actina, y ambas actúan en la acción contráctil del músculo esquelético y en distintos tipos de movimiento celular.
PROTEINAS GLOBULARES: A diferencia de las fibrosas, las proteínas globulares son esféricas y muy solubles. Desempeñan una función dinámica en el metabolismo corporal. Son ejemplos las albúminas, la globulina, la caseína, la hemoglobina, todas las enzimas y las hormonas proteicas. Albúminas y globulinas son proteínas solubles abundantes en las células animales, el suero sanguíneo, la leche y los huevos. La hemoglobina es una proteína respiratoria que transporta oxígeno por el cuerpo; a ella se debe el color rojo intenso de los eritrocitos. Se han descubierto más de 100 hemoglobinas humanas distintas, entre ellas la hemoglobina S, causante de la anemia de células falciformes.
-
ENZIMAS: Todas las enzimas son proteínas globulares que se combinan con otras sustancias llamadas sustratos, para catalizar las numerosas reacciones químicas del organismo. Estas moléculas, principales responsables del metabolismo y de su regulación, tienen puntos catalíticos a los cuales se acopla el sustrato igual que una mano a un guante para iniciar y controlar el metabolismo en todo el cuerpo.
-
HORMONAS PROTEICAS: Estas proteínas segregadas por las glándulas endocrinas, no actúan como las enzimas, sino que estimulan a ciertos órganos fundamentales que a su vez inician y controlan actividades importantes como el ritmo metabólico o la producción de enzima digestivas y de leche. La insulina, segregada por los islotes de Langerhans en el páncreas regula el metabolismo de los hidratos de carbono mediante el control de la concentración de glucosa. La tiroxina, segregada por el tiroides regula el metabolismo global; y la calcitonina, también producida por el tiroides, reduce la concentración de calcio en la sangre, y estimula la mineralización ósea.
-
ANTICUERPOS: Los anticuerpos, también llamados inmunoglobulina, agrupan las miles de proteínas distintas que se producen en el suero sanguíneo como respuesta a los antígenos (sustancias u organismos que invaden el cuerpo). Un solo antígeno puede inducir la producción de numerosos anticuerpos, que se combinan con diversos puntos de la molécula antigénica, la neutraliza y la precipitan en la sangre.
-
MICROTUBULOS: las proteínas globulares pueden también agruparse en diminutos túbulos huecos que actúan como entramado estructural de las células y, al mismo tiempo transportar sustancias de una parte de la célula a otra. Cada uno de éstos microtúbulos está formado por dos tipos de moléculas protéicas casi esféricas que se disponen por parejas y se unen en el extremo creciente del microtúbulo y aumentan su longitud en función de las necesidades. Los microtúbulos constituyen también la estructura interna de los cilios y flagelos, y apéndices de la membrana de los que se sirven algunos microorganismos para moverse.
Tipos De Proteínas
Las Heteroproteínas, están formadas por una fracción proteínica y por un grupo no proteínico, que se denomina "grupo prostético”.
HETEROPROTEÍNAS
| Glucoproteínas | Ribonucleasa. Mucoproteínas. Anticuerpos. Hormona luteinizante. |
| Lipoproteínas | De alta, baja y muy baja densidad, que transportan lípidos en la sangre. |
| Nucleoproteínas | Nucleosomas de la cromatina, Ribosomas. |
| Cromoproteínas | Hemoglobina, hemocianina, mioglobina, que transportan oxígeno; Citocromos, que transportan electrones |
-
FUENTES NATURALES DE PROTEÍNAS
Las Proteínas son obtenidas tanto a partir del reino animal, como del reino vegetal. De los 20 tipos de aminoácidos que suelen participar en nuestra alimentación, nueve de ellos son los llamados aminoácidos esenciales, de los que el cuerpo ha de disponer siempre en nuestra dieta diaria.
De ahí que no baste con que en la ración alimenticia haya el mínimo necesario, también a de aportarse la suficiente cantidad de estos aminoácidos esenciales.
Este es uno de los argumentos para combatir las dietas estrictas, como por ejemplo, la dieta vegetariana (en las plantas o vegetales es donde los aminoácidos esenciales se encuentran en franca minoría o simplemente faltan). Aproximadamente la mitad de las proteínas necesarias para nuestra alimentación, son de origen animal, siendo la leche y sus productos derivados, los más completos ya que contienen
casi todos los aminoácidos esenciales. Los niños, en edad de crecimiento precisan en su dieta, proporcionalmente, una mayor cantidad de proteínas que los adultos.
-
ALIMENTOS RICOS EN PROTEÍNAS
Dosis de Proteínas en alimentos de la dieta diaria
| Materia Alimenticia Vegetal | % Proteínas | Materia Alimenticia Animal | % Proteínas | |
| Legumbres | 24% | Carne Magra | 20% | |
| Harina de Trigo | 11% | Carne Grasa | 15% | |
| Pan | 8% | Leche de Vaca | 3% | |
| Patatas, Col | 2% | Huevos | 13% | |
| Frutas | 2% | |||
La carne, el pescado y los huevos aportan todos los aminoácidos esenciales que el cuerpo necesita para ensamblar sus propias proteínas. La carne contiene un 20% de proteína, 20% de grasa y 60% de agua. Las vísceras son fuentes ricas en vitaminas y minerales. Todos los pescados contienen un alto porcentaje de proteínas, y los aceites de algunos de ellos son ricos en vitaminas D y A. La clara del huevo es la forma más concentrada de proteína que existe.
Las legumbres o leguminosas abarcan una amplia variedad de frijoles o judías, chícharos o guisantes, lentejas y granos, e incluso el maní. Todos ellos son ricos en almidón, pero aportan bastante más proteína que los cereales o tubérculos. La proporción y el tipo de aminoácidos de las leguminosas es similar a los de la carne. Sus cadenas de aminoácidos a menudo complementan a las del arroz, el maíz y el trigo, que constituyen los alimentos básicos de muchos países.
La leche y sus derivados incluyen la leche entera, el queso, el yogur y los helados, todos ellos conocidos por su abundancia en proteína, fósforo y en especial calcio. La leche también es rica en vitaminas pero no contiene hierro y, si es pasteurizada, carece de vitamina C. Aunque la leche es esencial para los niños, su excesivo consumo por parte de los adultos puede producir ácidos grasos saturados que se acumulan en el sistema circulatorio.
El pescado, fuente de proteínas
Las proteínas son sustancias esenciales para nuestro organismo, ya que podemos decir que todas las células de nuestro cuerpo las necesitan para desarrollarse y reproducir. Por lo que si no hay un aporte de proteínas suficiente al día el desarrollo de nuestro cuerpo podría verse perjudicado. Los alimentos aportan esta fuente de proteínas, pero a veces, contienen a su vez, muchas grasas y calorías. Hoy podemos afirmar que el pescado presenta un elevado contenido en proteínas y muy pocas grasas lo que no podemos decir de la leche, la carne y los huevos que tradicionalmente se habían valorado mucho.
Proteínas de la leche con funciones defensivas
La leche es el alimento de todos los mamíferos durante las primeras etapas tras el nacimiento. Su composición resulta muy notable, ya que la mayoría de sus componentes se sintetizan especialmente para formar parte de ella, y no se encuentran en ninguna otra parte del organismo. Así, la lactosa, que es el azúcar de la leche, no se encuentra en cantidad significativa en ningún otro tejido, animal o vegetal. Por lo que respecta a las proteínas, sucede lo mismo; las más abundantes son también exclusivas de la leche, aunque algunas aparecen en ella transferidas desde la sangre.
Mediante la leche, la madre suministra a su cría todos los nutrientes que necesita, tanto para cubrir sus necesidades de energía (en forma de azúcares o grasa), como de proteínas, vitaminas y minerales. También le suministra sustancias biológicamente activas, como enzimas, factores de crecimiento y agentes protectores frente a los microorganismos.
Hay que tener en cuenta que en los momentos inmediatamente posteriores al nacimiento, la cría no tiene todavía establecidos sus mecanismos inmunológicos de defensa, ni siquiera una flora intestinal propia, por lo que la leche contiene factores que favorecen la proliferación de la flora beneficiosa e impiden la proliferación de una flora patógena.
El color blanco de la leche se debe en parte a la grasa que contiene, pero fundamentalmente a una familia especial de proteínas, exclusivas de la leche y que son las que más abundan en ella, las caseínas. Estas proteínas se encuentran asociadas entre sí y con iones de calcio, formando estructuras relativamente grandes que dispersan la luz. Sin embargo, algunas otras proteínas de la leche tienen colores particularmente vistosos: la lactoferrina es roja, mientras que la lactoperoxidasa es verde, en ambos casos debido a la presencia de iones de hierro asociados, aunque en distinta forma en cada una de ellas. En estos casos, la baja concentración en la que se encuentran en la leche hace que sus peculiares colores sean inapreciables si estas proteínas no se aíslan y se concentran previamente.
Muchas de las proteínas que se encuentran en la leche tienen funciones biológicas especializadas. Algunas de ellas actúan en la glándula mamaria, participando en la elaboración de componentes como la lactosa y la grasa. Otras facilitan la asimilación por el lactante de algunos componentes de la leche, o intervienen en la protección de la glándula mamaria o del recién nacido frente a los microorganismos causantes de infecciones. Aunque estas proteínas se encuentran en pequeñas cantidades, su función biológica es pues claramente muy importante. Algunas de ellas pueden extraerse y emplearse en productos destinados a la mejora de la salud humana.
Evidentemente, la leche más adecuada es la de la propia especie, ya que cada una nace con diferente grado de desarrollo, con diferentes necesidades de protección y, en muchos casos, utiliza para ello distintos mecanismos. En consecuencia, la mejor leche para un niño en sus primeros meses de vida es la leche materna, y así lo recomiendan todos los expertos.
Cuando se utilizan leches artificiales, elaboradas a partir de leche de vaca, es necesario modificar muchos parámetros de su composición, reduciendo el contenido de sales minerales, modificando las proporciones de las diferentes proteínas, sustituyendo la grasa de la leche de vaca por otra más insaturada y añadiendo algunas vitaminas. Aún con todos estos cambios, la leche artificial sigue siendo inferior a la humana; en particular carece absolutamente de todos los sistemas de defensa que la madre transmite a través de la secreción láctea, y que son importante sobre todo frente a los microorganismos causantes de diarreas. Carece también de un enzima que se encuentra exclusivamente en la leche humana, la lipasa activada por las sales biliares, que facilita la digestión de la grasa de la leche.
El organismo humano produce aminoácidos "no esenciales" y requiere la ingestión de ocho o nueve aminoácidos "esenciales". Estos se encuentran en los productos animales o vegetales como los huevos, leche, pescado, (que ya mencionamos), carne, aves, soja y frutos secos. Las proteínas de alta calidad como los huevos, la carne o el pescado, proporcionan todos los aminoácidos esenciales que se necesitan en la dieta y se denominan "proteínas completas". Las "proteínas incompletas" aportan sólo unos cuantos aminoácidos esenciales y necesitan tomarse en combinación con otros productos proteicos para mantener el equilibrio. Por ejemplo, un bocadillo de crema de cacahuete: el pan es rico en metionina y la crema de cacahuete es rica en lisina.
Como en la mayoría de los alimentos, demasiada proteína en la dieta puede causar problemas. Un exceso de proteínas acaba con la energía del organismo (después de la utilización de los hidratos de carbono y de las grasas), o, si no se utiliza, se transforma en grasa. Una dieta alta en proteínas animales aumenta la pérdida de calcio. También cantidades excesivas de proteínas pueden producir deshidratación, diarrea y agravar enfermedades de hígado o de riñón. Sólo el ejercicio puede desarrollar músculos, no la ingestión de más proteínas o suplementos proteínicos.
-
ESTRUCTURA DE LAS PROTEÍNAS
La organización de una proteína viene definida por cuatro niveles estructurales denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria. Cada una de estas estructuras informa de la disposición de la anterior en el espacio.
ESTRUCTURA PRIMARIA
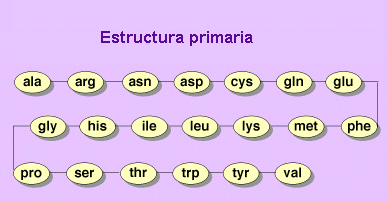
La estructura primaria es la secuencia de aminoácidos de la proteína. Nos indica qué aminoácidos componen la cadena polipeptídica y el orden en que dichos aminoácidos se encuentran. La función de una proteína depende de su secuencia y de la forma que ésta adopte.
ESTRUCTURA SECUNDARIA
La estructura secundaria es la disposición de la secuencia de aminoácidos en el espacio. Los aminoácidos, a medida que van siendo enlazados durante la síntesis de proteínas y gracias a la capacidad de giro de sus enlaces, adquieren una disposición espacial estable, la estructura secundaria.
Existen dos tipos de estructura secundaria:
La a(alfa)- hélice
La conformación beta
Esta estructura (Alfa Hélice) se forma al enrollarse helicoidalmente sobre sí misma la estructura primaria. Se debe a la formación de enlaces de hidrógeno entre el -C=O de un aminoácido y el -NH- del cuarto aminoácido que le sigue.
En esta disposición (Conformación Beta), los aminoácidos no forman una hélice sino una cadena en forma de zigzag, denominada disposición en lámina plegada. Presentan esta estructura secundaria la queratina de la seda o fibroína.
ESTRUCTURA TERCIARIA
La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular.
En definitiva, es la estructura primaria la que determina cuál será la secundaria y por tanto la terciaria.
Esta conformación globular facilita la solubilidad en agua y así realizar funciones de transporte.
Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los radicales R de los aminoácidos. Aparecen varios tipos de enlaces:
El puente disulfuro entre los radicales de aminoácidos que tiene azufre.
Los puentes de hidrógeno
Los puentes eléctricos
Las interacciones hifrófobas.
ESTRUCTURA CUATERNARIA
Esta estructura informa de la unión, mediante enlaces débiles (no covalentes) de varias cadenas polipeptídicas con estructura terciaria, para formar un complejo proteico. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero.
El número de protómeros varía desde dos como en la hexoquinasa, cuatro como en la hemoglobina, o muchos como la cápsida del virus de la poliomielitis, que consta de 60 unidades proteícas.
-
REACCIONES QUIMICAS EN LAS PROTEINAS
Si a una Proteína se le somete a cambios de temperatura (huevo cocido o frito), cambios de pH, concentraciones salinas elevadas, etc., se rompen los enlaces que constituyen las estructuras secundaria, terciaria y cuaternaria.
A este fenómeno se le denomina Desnaturalización y en algunos casos puede ser reversible, o sea la proteína puede volver a adoptar la configuración primitiva, al cesar la acción del o los agentes desnaturalizantes a este fenómeno se le llama Renaturalización. Todas las proteínas desnaturalizadas tienen la misma conformación, muy abierta y con una interacción máxima con el disolvente, por lo que una proteína soluble en agua cuando se desnaturaliza se hace insoluble en el agua y precipita.
Las proteínas de por sí son una reacción química, ya que estas grandes moléculas se forman a través de reacciones de polimeración de aminoácidos.
Cuando las moléculas de dos productos, colisionan puede ser que reaccionen dando lugar a la aparición de un nuevo compuesto. Es lo que se denomina reacción química. Así, los dos aminoácidos anteriores pueden reaccionar entre sí, entonces, la unión entre dos aminoácidos se origina por la reacción entre el grupo amino de uno de ellos, con el grupo carboxilo del otro, liberándose una molécula de agua. El enlace formado recibe el nombre de Peptídico. El enlace Peptídico tiene un comportamiento similar al de un enlace doble, es decir, presenta una cierta rigidez que inmoviliza en un plano los átomos que lo forman.
Al ya conocer las fórmulas químicas de los dos aminoácidos y del agua, no es difícil deducir la del nuevo producto resultante: [N(H2)]-[C(H2)]-(CO)-(NH)-CH[C(H3)]-(COOH). Se trata de una molécula con 20 átomos, cuyo nombre genérico es este Péptido.
La unión de dos aminoácidos, por lo tanto, origina un dipéptido, la unión de tres un tripéptido y así sucesivamente formándose los polipéptidos. Cuando un polipéptido está constituido por mas de 100 unidades de aminoácidos o su peso molecular es superior a 5.000, se le considera una Proteína.
Pero, de la sencilla reacción entre los dos aminoácidos mencionados también podría surgir un péptido diferente al de la formula anterior. El antes representado es el péptido glicocola-alanina (aminoácidos). Y el otro que podría resultar es el péptido alanina-glicocola, cuya fórmula es [N(H2)]-CH[C(H3)]-(CO)-(NH)-[C(H2)]-(COOH).
La reacción entre dos aminoácidos siempre puede generar dos dipéptidos. En uno de ellos, uno de los aminoácidos aporta el grupo amino al enlace y el otro interviene con el grupo ácido, mientras que en el otro dipéptido sucede a la inversa. Por ello pueden surgir dos estructuras diferentes.
Así con los veinte más frecuentes, llamados aminoácidos proteicos, por ser los que precisamente se encuentran en las proteínas, se podrían formular 399 dipéptidos diferentes, y el número crecería por un factor de 20 para tripéptidos, y así sucesivamente. De esta manera podríamos imaginarnos la variedad y cantidad de posibilidades cuando hablamos de Proteínas. Con estos antecedentes, la fórmula química de una proteína sería una larga sucesión de aminoácidos unidos.
-
FUNCIONES DE LAS PROTEÍNAS EN LOS SERES VIVOS
Las funciones de las Proteínas son muy variadas y de acuerdo con su función se pueden clasificar en varios grupos:
-
Estructurales: Forman Parte de los músculos, pelo, uñas, ligamentos y sustancias intercelulares.
-
Catalizadoras: Corresponden a este grupo, las Enzimas, que son proteínas y cumplen la función de controlar las reacciones biológicas.
-
Inmunológicas: Los anticuerpos son proteínas y ejercen una función defensiva.
-
Mediadoras: Estas proteínas juegan un papel esencial como enzimas en la transmisión de los impulsos nerviosos. Otros fabrican hormonas como la insulina , y otras transportan oxígeno (la hemoglobina) u otras sustancias
Dentro de estas funciones, las proteínas son importantes en los seres vivos ya que: dan forma a las células, las enzimas catalizan las reacciones químicas; algunas actúan como mensajeros: anticuerpos, hormonas. En el sistema nervioso central los péptidos y proteínas tienen además funciones específicas en la neurotransmisión. Nuestro interés se ha centrado en la acetilcolinesterasa enzima que hidroliza el neurotransmisor acetilcolina y a la cual se le han asignado también funciones no colinérgicas. La Distrofina es la protéina ausente en los músculos de los pacientes con miopatía tipo Duchenne y Backer. La Utrofina existe también en el sistema nervioso central, así como también se han encontrado promotores gliales y neuronales de esta proteína, no obstante su función se desconoce. Para explorar su función hemos decidido purificar las Distrofinas de músculo de conejo y de órgano eléctrico de torpedo para producir anticuerpos monoclonales que se utilizarán para la caracterización de tales proteínas.
La función primordial de la proteína es producir tejido corporal y sintetizar enzimas, algunas hormonas como la insulina, que regulan la comunicación entre órganos y células, y otras sustancias complejas, que rigen los procesos corporales. Las proteínas animales y vegetales no se utilizan en la misma forma en que son ingeridas, sino que las enzimas digestivas (proteasas) deben descomponerlas en aminoácidos que contienen nitrógeno. Las proteasas rompen los enlaces de péptidos que ligan los aminoácidos ingeridos para que éstos puedan ser absorbidos por el intestino hasta la sangre y reconvertidos en el tejido concreto que se necesita.
Es fácil disponer de proteínas de origen animal o vegetal. Como ya hemos mencionado, de los 20 aminoácidos que componen las proteínas, ocho se consideran esenciales es decir: como el cuerpo no puede sintetizarlos, deben ser tomados ya listos a través de los alimentos. Si estos aminoácidos esenciales no están presentes al mismo tiempo y en proporciones específicas, los otros aminoácidos, todos o en parte, no pueden utilizarse para construir las proteínas humanas. Por tanto, para mantener la salud y el crecimiento es muy importante una dieta que contenga estos aminoácidos esenciales. Cuando hay una carencia de alguno de ellos, los demás aminoácidos se convierten en compuestos productores de energía, y se excreta su nitrógeno. Cuando se ingieren proteínas en exceso, lo cual es frecuente en países con dietas ricas en carne, la proteína extra se descompone en compuestos productores de energía. Dado que las proteínas escasean bastante más que los hidratos de carbono aunque producen también 4 calorías por gramo, la ingestión de carne en exceso, cuando no hay demanda de reconstrucción de tejidos en el cuerpo, resultan una forma ineficaz de procurar energía. Los alimentos de origen animal contienen proteínas completas porque incluyen todos los aminoácidos esenciales. En la mayoría de las dietas se recomienda combinar proteínas de origen animal con proteínas vegetales. Se estima que 0,8 gramos por kilo de peso es la dosis diaria saludable para adultos normales.
Muchas enfermedades e infecciones producen una pérdida continuada de nitrógeno en el cuerpo. Este problema debe ser compensado con un mayor consumo de proteína dietética. Así mismo, los niños también precisan más proteína por kilogramo de peso corporal. Una deficiencia de proteínas acompañada
de falta de energía da origen a una forma de mal nutrición proteico-energética conocida con el nombre de marasmo, que se caracteriza por pérdida de grasa corporal y desgaste de músculos.
-
TRADUCCIÓN: SÍNTESIS DE PROTEÍNAS
El ARN mensajero es el que lleva la información para la síntesis de proteínas, es decir, determina el orden en que se unirán los aminoácidos.
Esta información está codificada en forma de tripletes, cada tres bases constituyen un codón que determina un aminoácido. Las reglas de correspondencia entre codones y aminoácidos constituyen el código genético.
En esta maqueta se ha representado el ARN mensajero como una varilla con los codones (juego de tres colores). El ribosoma está fijado al filamento, y las moléculas de ARN transferencia, con los anticodones unidos a los codones del ARNm . En la parte superior se observan tres aminoácidos unidos.
La síntesis de proteínas o traducción tiene lugar en los ribosomas del citoplasma. Los aminoácidos son transportados por el ARN de transferencia, específico para cada uno de ellos, y son llevados hasta el ARN mensajero, dónde se aparean el codón de éste y el anticodón del ARN de transferencia, por complementariedad de bases, y de ésta forma se sitúan en la posición que les corresponde.
Los ARNt desempeñan un papel central en la síntesis de las proteínas. La síntesis proteica tiene lugar en el ribosoma, que se arma en el citosol a partir de dos subunidades riborrucleoproteicas provenientes del nucléolo. En el ribosoma el ARN mensajero (ARNm) se traduce en una proteína, para lo cual se requiere también la intervención de los ARN de transferencia (ARNt). El trabajo de los ARNt consiste en tomar del citosol a los aminoácidos y conducirlos al ribosoma en el orden marcado por los nucleótidos del ARN, que son los moldes del sistema.
La síntesis de las proteínas comienza con la unión entre sí de dos aminoácidos y continúa por el agregado de nuevos aminoácidos - de a uno por vez- en uno extremos de la cadena. Como se sabe la clave de la traducción reside en el código genético, compuesto por combinaciones de tres nucleótidos consecutivos -o tripletes- en el ARNm. Los distintos tripletes se relacionan específicamente con tipos de aminoácidos usados en la síntesis de las proteínas.
Cada triplete constituye un codón: existen en total 64 codones, 61 de los cuales sirven para cifrar aminoácidos y 3 para marcar el cese de la traducción. Tal cantidad deriva de una relación matemática simple: los cuatro nucleótidos (A, U, C y G)se combinan de a tres, por lo que pueden generarse 64 (43).
Dado que existen más codones, (61) que tipos de aminoácidos (20), casi todos pueden ser reconocidos por más de un codón, por lo que algunos tripletes a como "sinónimos". Solamente el triptófano y la metionina -dos de los aminoácidos menos frecuentes en las proteínas - son codificados, cada uno, por un solo codón tercer nucleótido. La baja especificidad de este nucleótido ha llevado a decir que existe una "degeneración" en tercera base de la mayoría de los codones. Resta agregar que el número de codones en el ARNm determina la longitud de la proteína.
Existen 31 tipos diferentes de ARNt. Las moléculas intermediarias entre los codones del ARNm y los aminoácidos son los ARNt, los cuales tienen un dominio que se liga específicamente a uno de los 20 arninoácidos y otro que lo hace, específicamente también, con el codón apropiado. El segundo dominio consta de una combinación de tres nucleótidos -llamada anticodón - que es complementaria de la del codón.
Cada tipo de ARNt lleva antepuesto el nombre del aminoácido que transporta. por ejemplo, leucinil-ARNt para el aminoacil-ARNt de la leucina, lisinil-ARNt para el de la lisina, fenilalanil-ARNt para el de la fenilalanina, metionil-ARNt para el de la metionina, etcétera.
Si bien teóricamente pueden existir 61 tipos de ARNt diferentes, sólo hay 31. El déficit se resuelve por la capacidad que tienen algunos ARNt de reconocer a más de un codón. Lo logran porque sus anticodones suelen poseer la primera base "adaptable", es decir, que puede unirse con una base no complementaria situada en la tercera posición del codón (recuérdese la "degeneración" de esta base).
Así, la G en la primera posición del anticodón puede aparearse tanto con una C -es lo habitual - como con una U del codón (fig. A-1). Similarmente, la U en la primera posición del anticodón puede hacerlo con una A -es lo habitual - o con una G. Por otra parte, la inosina (I) -una de las bases inusuales se encuentra en la primera posición del anticodón en varios ARNt y es capaz de aparearse con cualquier base (excepto con una G) localizada en la tercera posición del codón.
El proceso de síntesis de proteínas se realiza de la siguiente manera:
LAS ETAPAS DE LA SÍNTESIS DE PROTEÍNAS
La síntesis de las proteínas se divide en tres etapas, llamadas de Iniciación, de Alargamiento o Elongación y de Terminación.
Iniciación: La subunidad ribosómica más pequeña se une al extremo 5´ de una molécula de ARNm. La primera molécula de ARNt, que lleva el aminoácido modificado fMet, se enchufa en el codón iniciador AUG de la molécula de ARNm. La unidad ribosómica más grande se ubica en su lugar, el ARNt ocupa el sitio P (peptidico). El sitio A (aminoacil) está vacante. El complejo de iniciación está completo ahora.
b) Alargamiento. Un segundo ARNt con su aminoácido unido se mueve al sitio A y su anticodón se enchufa en el mRNA. Se forma un enlace peptidico entre los dos aminoácidos reunidos en el ribosoma. Al mismo tiempo, se rompe el enlace entre el primer aminoácido y su ARNt. El ribosoma se mueve a lo largo de la cadena de ARNm en una dirección 5´ a 3´ y el segundo ARNt, con el dipéptido unido se mueve al sitio P desde el sitio A, a medida que el primer ARNt se desprende del ribosoma. Un tercer ARNt se mueve al sitio A y se forma otro enlace peptÍdico. La cadena peptídica naciente siempre está unida al tRNA que se está moviendo del sitio A al sitio P, y el ARNt entrante que lleva el siguiente aminoácido siempre ocupa el sitio A. Este paso se repite una y otra vez hasta que se completa el polipéptido.
c) Terminación: Cuando el ribosoma alcanza un codón de terminación (en este ejemplo UGA), el polipéptido se escinde del último ARNt y el ARNt se desprende del sitio P. El sitio A es ocupado por el factor de liberación que produce la disociación de las dos subunidades del ribosoma
Una vez finalizada la síntesis de una proteína, el ARN mensajero queda libre y puede ser leído de nuevo. De hecho, es muy frecuente que antes de que finalice una proteína ya está comenzando otra, con lo cual, una misma molécula de ARN mensajero, está siendo utilizada por varios ribosomas simultanéamente.
Si las proteínas que son producidas por las células de nuestro organismo llegaran a otro lugar en vez del sitio al que están destinadas, pueden producir desórdenes y enfermedades. Conocer la manera como las proteínas recién sintetizadas llegan al lugar correcto le valió al alemán Günter Blobel el Premio Nobel de Fisiología.
Ese descubrimiento puede incidir en la fabricación de nuevos medicamentos. Por ejemplo, la insulina es elaborada a partir de proteínas, y conocer sus señales podría traducirse en mejores rendimientos. Además, enfermedades hereditarias como la fibrosis quística y la hiperoxaluria son causadas por factores en los que las proteínas no alcanzan el destino adecuado. Otra característica relevante que distingue este hallazgo es que la descripción de esos mecanismos también se aplica a las células de levadura, plantas y animales.
-
DIGESTIÓN DE PROTEÍNAS
La mayoría de los aminoácidos ingeridos en la dieta de los vertebrados, se hallan principalmente en forma de proteínas. Los aminoácidos sólo pueden incorporarse a las rutas metabólicas en forma libre por ello, las proteínas y péptidos ingeridos en la dieta, son hidrolizados primeramente por enzimas proteolíticas en el tracto intestinal. Estas enzimas son secretadas por el estómago, páncreas e intestino delgado. Como las cantidades proteínas de la dieta son demasiado grandes para ser absorbidas por las células del proceso de digestión, , son degradados en elementos mas simples gracias a los mecanismos de acción de las enzimas, los cuales son altamente específicos. En el caso de las proteínas, estas enzimas, degradan proteínas en aminoácidos, para que las células del intestino las absorban y se provoque una buena digestión. Prácticamente la totalidad de estas enzimas son proteínas.
La digestión de proteínas comienza en el estómago. La entrada de proteínas al estómago estimula la secreción de gastrina, la cual a su vez estimula la formación de HCl; esta acidez actúa como un antiséptico y mata a la mayoría de los entes patógenos que ingresan al tracto intestinal. Las proteínas globulares se desnaturalizan a pHs ácidos, lo cual ocasiona que la hidrólisis de la proteína sea más accesible.
En el estómago, la pepsina (MW 33kD), de una sola cadena, es secretada en forma de su zimógeno, el pepsinógeno (MW 40kD) por las células de la mucosa gástrica. El pepsinógeno se convierte en pepsina por el corte (catalizado por la misma enzima) de 42 residuos del extremo amino-terminal, proceso que es favorecido por el pH ácido del jugo gástrico. La pepsina no es muy específica, hidroliza los enlaces en los que intervienen aminoácidos aromáticos, aunque también lo hace donde hay Met y Leu. El producto de la catálisis de esta enzima son péptidos de tamaño variable y algunos aminoácidos libres. A este tipo de proteasa, se le denomina endopeptidasa para diferenciarla de las enzimas que cortan desde cualquiera de los extremos de la cadena que se denominan exopeptidasas.
A medida que los contenidos ácidos del estómago pasan al intestino delgado, se dispara la síntesis de la hormona secretina a la sangre. Esta enzima estimula al páncreas para secretar bicarbonato en el intestino delgado para neutralizar el pH alrededor de 7.0. La entrada de los aminoácidos en la parte superior del intestino (duodeno) induce la liberación de la hormona colecistocinina, que estimula la liberación de muchas enzimas pancreáticas cuya actividad catalítica se realiza entre 7 y 8 unidades de pH. El jugo pancreático secretado al intestino delgado aporta los zimógenos de tripsina, quimotripsina, tripsinogeno, carboxipeptidasas A y B y elastasa.
Por ejemplo, el quimotripsinógeno (MW 24kD) da origen a la quimotripsina por separación de 2 dipéptidos. Este precursor es una cadena de 245 aminoácidos que se mantiene unida por dos puentes disulfuro intracatenarios. Su conversión a alfa-quimotripsina se debe a la hidrólisis enzimática de 4 enlaces peptídicos por acción de la tripsina y quimotripsina consecutivamente:
-
La pancreatitis, condición dolorosa y a menudo fatal, se caracteriza por la activación prematura de proteasas secretadas por el páncreas.
-
La quimotripsina hidroliza enlaces peptídicos que contiene grupos carbonilo de aminoácidos aromáticos.
-
El tripsinógeno (MW 24kD), da origen a la tripsina por separación de un hexapéptido del amino-terminal por acción de la enterocinasa. La tripsina hidroliza enlaces en los que intervienen Arg y Lys.
-
Carboxipeptidasa A (MW 34kD), contiene Zn2+, hidroliza casi todos los tipos de enlaces peptídicos en los cuales intervengan carboxilos terminales.
Como resultado de la acción de la pepsina en el estómago seguida de la acción de las proteasas pancreáticas, las proteínas se convierten en péptidos cortos de diversos tamaños y aminoácidos libres. Los péptidos se degradan para dar aminoácidos libres por acción de las peptidasas de la mucosa intestinal, particularmente la leucin-amino-peptidasa, que también contiene Zn2+, y separa los restos amino-terminales de los péptidos. Los aminoácidos libres resultantes, son excretados al torrente sanguíneo, de ahí alcanzan el hígado en donde tiene lugar la mayoría del metabolismo ulterior, incluida su degradación.
Las proteínas endógenas también tienen que degradarse, al parecer después de un tiempo (que depende de la velocidad con la que catalizan su reacción y dependiendo si son o no enzimas constitutivas), poco a poco adquieren señales como desaminación o metilación que indican a las proteasas el momento de la degradación.
.
.
.
.
Conclusión:
Para finalizar el presente trabajo, podríamos agregar que nos interesó y a la vez, nos ayudó y enseñó muchas cosas, entre ellas a trabajar como un grupo, mas bien, a trabajar EN EQUIPO.
Si pudiéramos criticarlo (no necesariamente negativo), diríamos que es un trabajo que abarca mucho campo, es por esto que nos fue un poco difícil distribuir la información y posteriormente, ordenarla. Pero eso no nos impidió aprender e imaginarnos, que es muy importante, como se compone una Proteína o el aspecto de ella, creemos que eso lo hemos logrado, porque lo importante de una presentación como ésta y su importancia, no es escribir y escribir, es tener el conocimiento de lo que estamos diciendo, y ser lo mas específicas posibles para que no sólo nosotras lo entendamos, sino que todo aquel que vea y lea nuestro trabajo.
No fue difícil encontrar información sobre este tema, ya que, como dijimos, abarca mucho campo, Alimentación, Nutrición, Biología, Genética, etc., lo difícil, fue, exactamente lo contrario a lo que teníamos pensado, ordenar los montones y montones de libros, hojas, enciclopedias, papeles, artículos y revistas que teníamos en conjunto. Y lo peor era que todo decía lo mismo, todos tenían la misma definición pero a veces, con diferentes fundamentos. Es por ésto que decidimos empezar a leer todo, y por supuesto, entenderlo, ya que es estrictamente necesario para tener claro que cosas hay que agregar y que cosas no. Esto nos ayudó mucho, es mas, pensamos que fue la base de nuestro trabajo. Esta vez no fue sólo copiar y copiar de manera exacta, sino que dimos nuestra propia opinión y definición de cada tema que incluimos en nuestro procedimiento.
Bueno, en general, quisiéramos decir que nos instruimos mucho gracias a este trabajo, además, fue de gran apoyo, la materia que actualmente aplicamos en Biología, la Genética, un rubro muy importante, y que a la vez, está en conexión con las Proteínas, como mencionamos en el trabajo. Por esto, tuvimos mucho apoyo, en cuanto a investigar se refiere.
Para terminar, el trabajo fue de nuestro completo agrado, ya que es un asunto que nos interesa y esta “de moda”. Si, pensamos esto, ya que nos pudimos dar cuenta, que las proteínas están en cualquier parte el cuerpo, y por esto, es muy importante, saber del tema, profundizar.
VOCABULARIO
-
Ácido: hay muchas posibles acepciones para este concepto; la más elemental hace referencia a toda sustancia que al disolverse en agua proporciona un sabor agrio.
-
Adn: ácido desoxirribonucleico; polímero de desoxiribonucleótidos. Componente de cada célula que lleva la información genética o hereditaria de un individuo.
-
Alanina: en su forma de alfa-alanina es un aminoácido presente en las proteínas. Fue sintetizado químicamente antes de ser descubierto en un material biológico. Se aisló a partir de la seda.
-
Amina: compuesto derivado del amoníaco.
-
Aminoácido: compuesto que tiene un grupo ácido del tipo -COOH y un grupo amino del tipo -NH2.
-
Aminoácidos Proteicos: son todos los aminoácidos que pueden estar presentes en una proteína. En concreto son veinte: ácido aspártico, asparagina, treonina, serina, ácido glutámico, glutamina, prolina, glicocola, alanina, valina, cisteina, metionina, isoleucina, leucina, tirosina, fenilalanina, histidina, lisina, arginina y triptófano.
-
Anticodón: este es una combinación de tres nucleótidos, complementaria al codón.
-
Anticuerpo: substancia que se produce en el organismo, natural o artificialmente, y que se opone a la acción de ciertos elementos (toxcinas, bacterias,etc.)
-
Arn: sigla de ácido ribonucleico.
-
Átomo: es la menor cantidad de un elemento químico que tiene entidad propia. Está formado por una serie de partículas elementales, de las que las más importantes son el electrón (con carga eléctrica negativa), protón (con carga positiva) y neutrón (carente de carga eléctrica).
-
Azufre: elemento químico que es abundante en los minerales llamados piritas y calcopiritas.
-
Carbono: elemento químico muy abundante en los seres vivos, que da lugar a la llamada Química del Carbono, debido a la gran variedad de compuestos en cuya estructura participa.
-
Catalizar: transformación química ocasionada por cuerpos que cuando termina la reacción aparecen inalterados.
-
Cisteina: aminoácido proteico que contiene un átomo de azufre. Se aisló a partir de un cálculo extraído de una vejiga urinaria.
-
Codón: Unidad constructiva del código genético del ADN (ácido desoxirribonucleico) cromosómico. Este cumple dos funciones: señala el sitio de comienzo de la traducción (codón de iniciación) y cuando se halla en otras localizaciones en el ARNm codifica a las metioninas del interior de las moléculas proteicas.
-
Colágeno: substancia albunoidea que existe en los catílagos y en los huesos y que se transforma en gelatina por efecto de la cocción.
-
Cromosoma: es la estructura física del genoma; está formado por adn y también por proteínas asociadas.
-
Elemento químico: sustancia que no se puede descomponer en otra más sencilla por métodos químicos.
-
Enzima: Como las cantidades de hidratos de carbono, proteínas y lípidos etc., de la dieta son demasiado grandes para ser absorbidas por las células del intestino, son degradados en elementos más simples gracias a los mecanismos de acción de las enzimas, los cuales son altamente específicos. En el caso de las proteínas, estas enzimas, degradan proteínas en aminoácidos, para que las células del intestino las absorban y se provoque una buena digestión.
-
Eritrocito: corpúsculo componente de la sangre conocido también como glóbulo rojo; consiste básicamente en un depósito de hemoglobina.
-
Fórmula Química: representación de la composición y estructura de un compuesto.
-
Gen: unidad de herencia. Es una porción del adn que generalmente contiene la información codificada para una proteína.
-
Glicocola: el aminoácido proteico más sencillo. También se denomina glicina, e inicialmente se denominó azúcar de gelatina.
-
Hidrógeno: es el elemento químico más simple. Forma moléculas constituidas por dos átomos y constituyen el gas hidrógeno, muy inflamable.
-
Metabolismo: Corresponde al nivel de energía mínimo necesario para mantener sus funciones vitales. En términos científicos, conjunto de reacciones químicas mínimas para mantener la homeostasis del organismo.
-
Molécula: agrupación estable de átomos.
-
Nitrógeno: elemento químico que genera moléculas formadas por dos átomos, que se presentan bajo la forma de un gas inerte abundante en la atmósfera.
-
Nutrición: aumento de la substancia del cuerpo animal o vegetal por medio del alimento, esto incluye el conjunto de procesos mediante los cuales los principales energéticos que toma el exterior de un ser vivo son utilizados para el mantenimiento de la vida.
-
Oligopéptido: se denomina oligopéptido, si el número de aminoácidos de una molécula, es superior a 50 péptidos.
-
Oxígeno: es el elemento químico más abundante en la corteza terrestre.
-
Péptido: molécula resultante de la unión de aminoácidos.
-
Polímero: macromolécula formada por la unión de muchas moléculas idénticas (monómeros) mediante el mismo tipo de enlace.
-
Polipéptido: denominación genérica de un péptido que contenga hasta alrededor de cien aminoácidos.
-
Proteína: molécula de naturaleza polipeptídica que desempeña una función característica en los seres vivos, en los que puede haber miles de ellas diferentes.
-
Sintetizar: formar un compuesto a partir de sus elementos.
-
Queratina: substancia albuminoidea, rica en azufre, que constituye la parte fundamental de los pelos, plumas, uñas, cuernos y pezuñas y de la capa más externa de la epidermis.
-
Reacción química: transformación desde un estado inicial a otro final que implique un cambio en la naturaleza química de las sustancias presentes.
-
Símbolo químico: representación del átomo de un elemento. Se trata de una letra mayúscula, seguida de una minúscula en aquellos casos en los que hay una coincidencia en la primera.
.
Listado de Preguntas:
1.- ¿Cómo se clasifican las proteínas?
2.- Señala las funciones que cumplen proteínas.
3.- ¿Qué presentan en común todos los aminoácidos?
4.- Indica el nombre de 5 aminoácidos.
5.- Indica cuantas proteínas contiene el cuerpo humano y que % ya ha sido descrito con detalle.
6.- Define Enlace Peptídico.
7.- ¿Porqué se dice que las proteínas son Polipéptidos?
8.- ¿Qué información obtienes al conocer la estructura primaria de una proteína?
¿Y al conocer la estructura secundaria?
9.- Confeccione un listado con los alimentos que contienen proteínas.
(De mayor a menor cantidad).
10.- ¿Cómo se realiza el proceso de Síntesis de Proteínas? (Quién? Cómo? Dónde? Cuando? Para qué?)
.
Bibliografía:
-
Libro Biología Editorial Mc Graw Hill II Medio
-
Libro Química Editorial Arrayán II Medio
-
Internet Explorer
-
Web Universidad de Chile- Biología
-
Web buscador Google
-
Web Instituto Biológico de EEUU
-
Web Encarta2001.com
-
Web Dyscoveryespañol.com
-
Web Bica.com.ar/fundac/taller_1/anatomia/
-
Web Science/biologist.institute/Proteins.com
-
Web biologia.arizona.edu/human/act/proteins/proteins.html
-
Web Ornl.gov/prots.proteins/hgmis
-
Enciclopedia Encarta 2000
-
Enciclopedia Juvenil de las Ciencias Naturales Tomo IV “Nuestro Cuerpo”
-
Enciclopedia Ilustrada Larousse Edición “Cuerpo Humano y Salud”
-
Enciclopedia Hispánica. Tomo 12
Indice Temático
-
Alimentos Ricos en Proteínas................................................................. 6-7
-
Bibliografía............................................................................................ 21
-
Clasificación de Proteínas...................................................................... 4-5
-
Conclusión............................................................................................ 16
-
Definición de Proteína.......................................................................... 4
-
Digestión de Proteínas........................................................................... 14-15
-
Estructura de una Proteína................................................................... 8-9
-
Etapas de la Síntesis de Proteínas......................................................... 13-14
-
Fuentes Naturales de Proteínas............................................................. 5-6
-
Funciones de las Proteínas en los Seres Vivos....................................... 11
-
Indice General....................................................................................... 1
-
Introducción......................................................................................... 3
-
Listado de Preguntas............................................................................. 20
-
Presentación......................................................................................... 2
-
Reacciones Químicas en las Proteínas................................................... 10
-
Síntesis de Proteínas............................................................................. 12-14
-
Vocabulario.......................................................................................... 17-19
22
Descargar
| Enviado por: | Nicole |
| Idioma: | castellano |
| País: | Chile |
