Química
Prácticas de laboratorio
Pràctiques de Laboratori
Pràctica 1 2n de Batxillerat
_______________________________________________________________
PRÀCTICA 1
REACCIONS DE TUBS D'ASSAIG : DESCOMPOSICIÓ, DESPLAÇAMENT
I PRECIPITACIÓ IÒNICA.
Resum :
L'objectiu d'aquesta pràctica consisteix en realitzar tres reaccions diferents en tubs d'assaig per tal d'estudiar els tipus de reaccions que tenen lloc entre els reactius que emprarem.
Introducció :
Una reacció química és un canvi químic que consisteix en el fet que els àtoms dels reactius s'organitzen d'una altra manera i obtenim els productes que conserven el mateix nombre d'àtoms. Hi ha molts tipus de reaccions químiques:
-
Reaccions de síntesi , és la combinació de diversos reactius per tal de donar lloc a un producte.
-
Reaccions de descomposició, un reactiu amb una aportació energètica es transforma en dues substàncies o més.
-
Reaccions de desplaçament, reacció entre un compost i un element. Aquest element s'integra al compost i s'allibera un altre element que formava part del compost inicial. Són reaccions utilitzades per obtenir metalls a partir dels deus compostos.
-
Reaccions de doble descomposició o doble substitució, consisteix en la reacció entre dos compostos amb doble intercanvi entre cations i anions.
-
Reaccions de combustió de productes orgànics, els productes orgànics que tenen només C i H (hidrocarburs) o bé C, H i O fan la combustió formant diòxid de carboni i aigua.
En aquesta pràctica estudiarem les reaccions de descomposició, desplaçament i de precipitació .
Pràctiques de Laboratori
Pràctica 1 2n de Batxillerat
_______________________________________________________________
Les reaccions de precipitació són aquelles en les quals ions de diferents dissolucions interaccionen per formar com a mínim un producte sòlid (insoluble).
Disseny experimental
Material: Reactius necessaris:
-
tubs d'assaig CuSO4 · 5H2O (s)
Paper indicador universal NH4Cl (s)
Bec de bunsen Solució NaOH 10M
H2SO4 concentrat
Precaucions : HCl concentrat
CuSO4 (aq) 0,5 M
Solució NH4OH 6 M
NH4Cl (aq)
Procediment:
Reacció de descomposició
Agafem una petita quantitat de CuSO4 · 5H2O (s) i la posem en un tub d'assaig , escalfem gradualment i observem els canvis que es produeixen. Comprovem que es tracta d'una reacció reversible afegint una gota d'H2O al producte blanc obtingut.
Reacció de desplaçament.
En un tub d'assaig posem uns 2ml de solució de NH4Cl. Afegim 0,5ml de solució de NaOH 10M i escalfem lleugerament. Una vegada escalfat noteu l'olor de l'amoníac i comproveu que la reacció és bàsica apropant a la boca del tub d'assaig una tira de paper indicador lleugerament humit.
Pràctiques de Laboratori
Pràctica 1 2n de Batxillerat
_______________________________________________________________
En un altre tub d'assaig posem una petita quantitat de NH4Cl (s) , afegiu 5 gotes de H2SO4 concentrat, escalfeu lleugerament. Comproveu l'olor de l'HCl i la reacció àcida del gas format amb paper indicador.
Reacció de precipitació iònica.
Poseu 2ml de solució de CuSO4 (aq) 0,5 M en dos tubs d'assaig diferents i a cadascun d'ells afegiu-hi una gota de solució NaOH 10M. Observeu l'aparició de precipitats blaus.
En els dos tubs d'assaig afegiu mes NaOH (aq) fins que la precipitació és completa cosa que comprovareu quan el líquid que queda sobre el precipitat és transparent.
En un dels tubs afegiu solució de HCl concentrat i a l'altre tub afegiu una solució d'amoníac 6M. Observeu el que succeeix a cada un dels tubs.
5 . Recollida i anàlisi de dades.
a) Reacció de descomposició
CuSO4 · 5H2O (s) CuSO4(s) + 5H2O (v)
Quan escalfem es produeix la descomposició del CuSO4 · 5H2O (s) . Aquest canvi químic es fa palesa mitjançant l'observació detallada del que succeeix a ull nu. El CuSO4 · 5H2O (s) en forma de cristalls de color blaus passa a ser una mena de pols de color blanc - gris, color característic del CuSO4(s).
Això es degut a l'evaporació de l' H2O contingut en la sal hidratada que ara ho veien quan el vapor es condensa en entrar en contacte amb les parets fredes del tub d'assaig.
Després, comprovem que es tracta d'una reacció reversible perquè en afegir unes gotes d'aigua el CuSO4(s) torna a ser una sal hidratada adquirint el seu color blau característic.
Pràctiques de Laboratori
Pràctica 1 2n de Batxillerat
_______________________________________________________________
b) Reacció de desplaçament.
1.
Té lloc aquesta reacció de desplaçament. Mitjançant aquesta reacció es desprèn amoníac gas cosa que amb això comprovem el seu caràcter bàsic ja que l' indicador es torna de color blau.
2.
En escalfar la solució inicial que conté els reactius té lloc el desplaçament, al doble des composició, i es forma l'HCl gasós i podrem comprovar el seu caràcter àcid quan el paper indicador s'ha tornat de color vermell.
c)Precipitació iònica
En afegir una gota de NaOH 10M en cadascun dels tubs d'assaig observem l'aparició d'uns precipitats blaus de CuSO4(aq). Però podem notificar que el color no és pas el blau característic sinó que és un blau marí.
Precipita el ió sulfat.
.
Quan afegim a una de les reaccions H2SO4 es produeix la següent reacció i el precipitat es dissol.
Quan s'afegeix hidròxid d'amoni el precipitat també es dissol i el Cu2+ en reaccionar amb l'amoníac forma el ió tretraamminacoure(II), d'un color blau marí.
Pràctiques de Laboratori
Pràctica 2 2n de Batxillerat
_______________________________________________________________
PRÀCTICA 2
DETERMINACIÓ DEL CONTINGUT D'ÀCID ACETILSALICÍLIC D'UNA ASPIRINA.
Resum :
A les farmàcies trobem diversos medicaments amb el mateix principi actiu. Aquest és el cas de l'àcid acetilsalicílic, compost present en molts medicaments, que ha esdevingut famós a causa de la seva presència en un medicament conegut comercialment amb el nom d'aspirina.
Introducció:
Aquest principi actiu el trobem en el mercat en diferents formes farmacèutiques (comprimits, sobres, etc.,) que, a més de l'àcid acetilsalicílic, tenen altres substàncies anomenades excipients.
En aquest assaig determinarem la quantitat d'àcid acetilsalicílic que conté l'aspirina, mitjançant una valoració per retrocés.
L 'àcid acetilsalicílic reacciona amb l'hidròxid de sodi per formar ions acetat i ions salicilat, d'acord amb la reacció següent:
CH3COOC6H4COOH + 2 NaOH HOC6H4COONa + CH3COO- + H2O
L' excés d'hidròxid de sodi es valora amb una dissolució d'àcid clorhídric.
Disseny experimental
Material
-
Bureta
-
Matràs d'Erlenmeyer
-
Placa calefactora
-
Matràs aforat de 100 ml
-
Pipeta
Reactius necessaris
-
Aspirina
-
NaOH (aq) 1M
-
HCL (aq) 1M
-
Fenolftaleïna
Pràctiques de Laboratori
Pràctica 2 2n de Batxillerat
_______________________________________________________________
Procediment.
Col·loquem en un matràs d'Erlenmeyer 25 cm3 d'aigua destil·lada i 25 cm3 de dissolució de NaOH 1M, i hi afegim 1,5 g d'aspirina.
Escalfem lleugerament la mescla durant 10 minuts.
La deixem refredar. Quan la mescla s'hagi refredat l'aboquem en un matràs aforat de 250 cm3 i arrasem amb aigua destil·lada.
Mentre la mescla reposa, omplim la bureta amb solució d'HCL 0,1 M
Mesurem 25 cm3 de la dissolució del matràs aforat i als aboquem en un Erlenmeyer.
Afegim a la solució de l'Erlenmeyer 3 gotes de fenolftaleïna. Observem que la solució adquireix un color fúcsia.
En fem la valoració, que donarem per acabada quan l'indicador viri a incolor.
Mesurem els cm3 de HCL (aq) consumits.
Recollida i anàlisi de dades.
1. Justifica el motiu pel qual l'indicador ha virat.
La fenolftaleïna ha virat a incolora ja que la reacció de neutralització de l'NaOH en excés amb HCl concentrat ha arribat al punt d'equivalència, quan l'indicador vira, és a dir, que s'ha completat la neutralització.
2. A l'inici de la pràctica l'indicador té color fúcsia. A quin tipus de dissolució correspon aquest color ?
Correspon a una solució bàsica.
3. Determinar la concentració d'àcid acetilsalicílic d'aspirina:
La diferència entre els mols de NaOH que hem afegit i els mols de HCL consumits corresponen als mols d'àcid acetilsalicílic:
Mol àcid acetilsalicílic = mol NaOH - mol HCL
-
Tenint en compte que la massa molecular de l'àcid acetilsalicílic és de 180 g/mol, calcula els grams d'aquest compost que hi ha en una aspirina.
-
Expressa la concentració en %
Pràctiques de Laboratori
Pràctica 2 2n de Batxillerat
_______________________________________________________________
6. CONCLUSIONS
1. Què signifiquen les paraules acidimetria i alcalimetria ?
Acidimetria: part de la volumetria que comprèn els mètodes d'anàlisi de substàncies de caràcter bàsic per valoració amb una solució d'un àcid de concentració coneguda.
Alcalimetria: part de la volumetria que inclou els mètodes d'anàlisi de substàncies àcides per valoració amb una solució d'una base de concentració coneguda.
2. Què és una reacció de neutralització ?
S'anomena neutralització la reacció que es produeix entre els ions hidròxid d'una base i els ions hidrogen d'un àcid per formar molècules d'aigua.
3. En el punt final d'una reacció àcid-base, el pH assoleix sempre el valor 7 ?
No, dependrà de la sal que es forma.
4. Quin serà aproximadament el pH al final de la valoració de l'aspirina ?
El pH serà neutre, 7.
5. Què és un indicador àcid-base ?
Són substàncies generalment orgàniques, amb caràcter àcid feble o base feble, que posseeixen la propietat de presentar una coloració diferent segons el pH del medi en què es troben. S'utilitzen per conèixer el valor aproximat del pH d'una dissolució o, simplement, per saber si la dissolució té caràcter àcid o bàsic.
6. Quin interval de pH és mesurable per l'indicador fenolftaleïna ?
L'interval 8-9, 5.
Pràctiques de Laboratori
Pràctica 3 2n de Batxillerat
_______________________________________________________________
PRÀCTICA 3
TERMOQUÍMICA : DETERMINACIÓ EXPERIMENTAL DELS CANVIS D'ENTALPIA I COMPROVACIÓ DE LA LLEI DE HESS.
Resum:
L'objectiu d'aquesta experiència és la determinació experimental dels canvis d'entalpia de reaccions químiques i de processos físics com ara els de dissolució i així comprovar si es compleix la llei de Hess mitjançant tres reaccions experimentals que ens han servit per extreure conclusions sobre el treball al laboratori, com ara el marge d'error , la importància de la precisió, etc.
Introducció:
Tota reacció química comporta el trencament d'uns enllaços (reactius) i la formació de nous enllaços (productes), procés que comportarà una absorció o bé un alliberament d'energia generalment en forma de calor. Si l'energia que cal donar per trencar els enllaços dels reactius és superior a l'alliberada en la formació dels enllaços dels productes, el procés serà ENDOTÈRMIC ( augmenta el contingut calorífic, absorció d'energia), mentre que si succeeix el contrari, el procés serà EXOTÈRMIA (alliberament d'energia).
Definim el calor de reacció com el calor transferida en una reacció química realitzada a temperatura constant (generalment s'estudien a 25ºC) i per unitat de quantitat de substància. Si el procés té lloc a pressió constant, el calor de la reacció coincideix amb el canvi d'entalpia i (H), i si té lloc a volum constant amb el canvi d'energia interna (); en cas de referir-ho a 25ºC i en condicions estàndard ( 1 atm de pressió), el canvi d'entalpia se simbolitza com a (298K) i generalment s'expressa en Kj· mol-1.
En aquesta experiència haurem de determinar els canvis d'entalpia dels processos següents:
1.
2.
Pràctiques de Laboratori
Pràctica 3 2n de Batxillerat
_______________________________________________________________
3.
D'acord amb la llei de Hess que afirma que qualsevol reacció química que sigui la suma algebraica d'altres reaccions, el seu canvi d'entalpia, al ser una funció d'estat és a dir que no depèn el camí que segueix la reacció , sinó només els estats inicials i final, és també la suma algebraica de les entalpies de les altres reaccions ; haurem de comprovar si es compleix i si no es compleix analitzar l'error , la següent expressió :
= +
Disseny experimental
Reactius necessaris
Preparació de HCl 2M. PRECAUCIONS:
Preparació de NaOH 2M
Hidròxid de sodi en llenties.
Material
Vasos de precipitats 250ml
Termòmetres
Proveta de 100ml
Vidre de rellotge
Balança
Procediment
Determinació del canvi d'entalpia del procés 1.
Mesurem amb una proveta 100mL d'àcid clorhídric 2M, i en una altra proveta 100mL de NaOH 2M, submergim un termòmetre en cada proveta i anotem les temperatures inicials. En cas de no coincidir les temperatures es pren la mitjana com a temperatura inicial.
Mesurem així mateix la massa d'un vas de precipitats de 250mL, hi col·loquem una de les dissolucions amb el termòmetre corresponent i hi aboquem l'altra dissolució. La temperatura començarà a pujar fins que s'assoleixi el valor màxim. Anotarem la temperatura màxima assolida.
Pràctiques de Laboratori
Pràctica 3 2n de Batxillerat
_______________________________________________________________
Determinació del canvi d'entalpia del procés 2.
Mesurem 200mL d'aigua en una proveta i els col·loquem en un vas de precipitats de 250mL de massa coneguda, en mesurem amb un termòmetre la temperatura inicial.
Amb un vidre de rellotge prèviament tarat amb la balança, mesurem 8 g de NaOh sòlid (0,2mols) i els aboquem dins del vas. HO remenarem suaument amb el mateix termòmetre fins ala dissolució total de l'hidròxid de sodi, i mesurarem la màxima temperatura assolida.
Determinació del canvi d'entalpia del procés 3.
Mesurarem 200mL de dissolució 2M d'àcid clorhídric amb una proveta i l'aboquem dins d'un vas de precipitats de 250mL de massa coneguda, en mesurem la temperatura inicial. En un vidre de rellotge prèviament tarat amb la balança, hi mesurem 8g d'hidròxid de sodi sòlid que afegirem al vas. Ho remenem suaument amb el termòmetre fins a una dissolució completa de l'hidròxid i anotarem la màxima temperatura assolida.
Recollida i anàlisi de dades.
Procés 1
Volum d'àcid clorhídric = 100mL
Volum d'hidròxid de sodi = 100mL
Massa total aproximada de les dissolucions = 200g
Temperatura inicial = 21ºC.
Massa del vas = 77,97g.
Temperatura final = 34ºC
Calor específica de la dissolució = 4,18J/gK.
Calor específica del vidre = 0,836J/gK
Calor guanyada pel líquid = m · c · ðt = 200g x 4,18J/gK x 13K = 10868J= 10,868KJ.
Calor guanyada pel vas = m' · c' · ðt = 77,97g x 0,836J/gK x 13 = 847,38J=0,84773 KJ.
Calor total guanyada = 11,715 KJ.
Calor total alliberada = 11,715 KJ.
Pràctiques de Laboratori
Pràctica 3 2n de Batxillerat
_______________________________________________________________
Mols d'aigua formats =
Calor total alliberada per mol d'aigua = 58,575 KJ/mol
= -58,575 KJ/mol
Procés 2.
Volum d'aigua = 200mL
Massa d'aigua = 200g
Temperatura inicial = 22ºC.
Massa del vas = 77,97g.
Massa d'hidròxid = 8g (0,2mols).
Temperatura final= 31ºC.
Calor guanyada per la dissolució = 208g x 4,18J/gK x 9 = 7824,96J = 7,82496KJ.
Calor guanyada pel vas = m' · c' · ðt = 77,97g x 0,836J/gK x 9 = 586,65 J = 0,58665 KJ.
Calor total guanyada = 8,4116KJ.
Calor total alliberada = 8,4116KJ.
Calor total alliberada per mol de NaOH = 42,058 KJ.
= -42,058 KJ.
Procés 3.
Volum d'àcid = 200mL.
Massa de la dissolució = 208g
Temperatura inicial = 25ºC.
Massa del vas = 77,97g.
Massa de NaOH = 8g (0,2 mols) reactiu limitant.
Temperatura final = 46,5ºC.
Calor guanyada per la dissolució = 208g x 4,18J/gK x 21,5 = 18692,96J=18,692KJ.
Pràctiques de Laboratori
Pràctica 3 2n de Batxillerat
_______________________________________________________________
Calor guanyada pel vas = m'· c' · ðt = 1401,4328J = 1,401KJ
Calor total guanyada = 20,09KJ.
Calor total alliberada = 20,09KJ.
Calor total alliberada per mol d'aigua format = 100,45 KJ.
= -100,45kJ/mol
Conclusions.
Quant val ? -100,6 KJ.
Quant val ? -100,45KJ.
Es compleix la llei de Hess ? Sí podem comprovar que es compleix ja que ens dóna una xifra pràcticament igual.
Pràctiques de Laboratori
Pràctica 4 2n de Batxillerat
_______________________________________________________________
PRÀCTICA 4
Principi de Le Chatelier. Estudi de l'efecte dels canvis de temperatura i dels canvis de concentració sobre els equilibris.
Resum :
L'objectiu de l'experiència és estudiar l'efecte dels canvis en la temperatura i dels canvis en la concentració sobre el desplaçament dels equilibris químics.
Introducció :
En tota reacció química reversible s'assoleix a una determinada temperatura un estat d'equilibri caracteritzat per una composició constant del sistema, que s'expressa mitjançant la corresponent constant d'equilibri.
Per a cada reacció reversible i a cada temperatura, hi ha moltes composicions constants del sistema compatibles amb l'equilibri, però una única constant d'equilibri. Així, per a una reacció reversible:
~,
A(g) + B(g) <=> C(g)
Caracteritzada a 25°C per una constant d'equilibri de valor 4
Kc = [C] / [A]'[B] = 4
Fonamentació teòrica:
Material
-
Tubs d'assaig amples amb tap.
-
Erlenmeyers de 100 ml amb tap.
-
Tubs d'assaig amb gradeta.
-
Vasos de 500 ml
-
Aparell productor de gasos
Productes
-
Àcid nítric 13 M
-
Àcid clorhídric concentrat 12M
-
Cromat de potassi 0,1M
-
Amoníac 0,1M
-
Hidròxid de sodi sòlid
Pràctiques de Laboratori
Pràctica 1 2n de Batxillerat
_______________________________________________________________
- Coure
-
Clorur d'amoni
- Fenolftaleïna a l'1%
Procediment
Efecte dels canvis de concentració sobre l'equilibri.
1.1. En un tub d'assaig, hi col·loquem 5 ml de dissolució 0,1M de cromat de potassi i, a continuació, unes gotes de dissolució concentrada d'àcid clorhídric.
1.2. En un tub d'assaig, hi col·loquem 5 ml de dissolució 0,1 M d'amoníac i tres gotes de fenolftaleïna.
En un segon tub d'assaig col·loquem 5 ml d'amoníac 0,1 M i una punta d'espàtula de clorur d'amoni, ho agitem bé fins a dissolució de la sal, i hi afegim també tres gotes de fenolftaleïna.
5. Recollida i anàlisi de dades
En el procés 1.1. primer s'observa un canvi de color, de groc a taronja. Després, en afegir un parell de llenties d'hidròxid de sodi, s'observa que el color torna a l'inicial.
En el primer tub d'assaig del procés 1.2. s'observa un canvi de color, canvia a magenta.
En el segon tub d'assaig també s'observa un canvi de color, canvia a rosa pàl·lid.
Pràctiques de Laboratori
Pràctica 4 2n de Batxillerat
_______________________________________________________________
6. Conclusions
1. Un sistema en equilibri a 25ºC corresponent a la reacció:
CH3-COOH(l) + CH3OH(l) CH3-COOCH3(l) + H2O(l)
conté 0,8 mols d'acetat de metil, 0,8 mols d'aigua, 0,4 mols d'àcid acètic i 0,4 mols de metanol. Quant val la constant d'equilibri ?
Ke
2. D'acord amb la reacció anterior, quants mols d'àcid acètic caldria afegir per a aconseguir que en un nou equilibri, la quantitat d'acetat de metil fos d'un mol a la mateixa temperatura ?
Ke S'hauran de posar 0,5mols per tant se n'afegirien 0,1.
3. Què passaria amb la composició de l'equilibri:
N2O4 (g) 2 NO2 (g)
en augmentar la pressió?
En augmentar la pressió l'equilibri del sistema es desplaça cap al sentit en què es redueix el nombre total de mols de gasos, per tant es formaran més reactius.
4. De quines maneres podem augmentar el rendiment en amoníac en el procés Haber-Bosch ?
N2 (g) + 3 H2 (g) - 2 NH3 (g) H < 0
- Disminuir la temperatura, ja que l'equilibri es desplaça cap al sentit exotèrmic, la formació de productes.
- Augmentar la pressió o disminuir el volum per que l'equilibri es desplaci cap a la formació de productes, ja que es redueix el nombre total de mols de gasos.
Pràctiques de Laboratori
Pràctica 4 2n de Batxillerat
_______________________________________________________________
-
Augmentar la concentració dels reactius perquè es desplaci cap a productes.
5. Com evoluciona l'equilibri:
CN1-(aq) + H2O (l) HCN(aq) + OH1-(aq)
en afegir àcid al sistema ?
L'equilibri evolucionarà cap a reactius tal com diu Le Chatelier, per contrarestar l'efecte de l'augment d'àcid a productes.
Pràctiques de Laboratori
Pràctica 5 2n de Batxillerat
_______________________________________________________________
PRÀCTICA 5
ACCIÓ DELS ÀCIDS SOBRE ELS METALLS
Resum :
Comprovar experimentalment el comportament dels àcids, HCl, H2SO4, HNO3, en actuar sobre metalls, Cu , Pb, Al, Zn i Fe.
Introducció :
Els metalls tenen tendència a oxidar-se i formar cations degut a la seva estructura electrònica. Davant dels àcids, els metalls es poden comportar de diverses maneres com són:
Metalls actius: reaccionen amb els àcids no oxidants desprenen H2.
M. nobles: reaccionen amb àcids oxidants però no desprenen H2.
M. molt nobles (Au, Pl) no reaccionen amb cap àcid, només són atacats per “aigua règia” que és una mescla d'àcids.
En alguns casos, el producte que es forma en la reacció, recobreix el metall i impedeix un posterior atac de l'àcid, es diu , que el metall es “passiva”.
Disseny experimental:
Material
-
Gradeta amb tubs d'assaig
-
HCl concentrat
-
H2SO4 concentrat
-
HNO3 concentrat
-
Ferro
-
H2SO4 (dil)
-
Coure
-
Plom
Pràctiques de Laboratori
Pràctica 5 2n de Batxillerat
_______________________________________________________________
-
Zinc
-
Al
-
Vas precipitats
Procediment.
1)S'agafen 5 tubs d'assaig i a cadascun posem un trosset de cada metall.
2)Afegeix amb una HCl (con) a cadascun dels tubs fins cobrir el metall.
3)Pren nota de les següents observacions:
-
Reacció lenta o ràpida?
-
Gas color o incolor?
-
Solució colora o no?
-
Si hi ha producció de bombolles
-
Atac intens ?
-
Superfície del metall canvia de color ?
-
Altres.
4)Si no has observat cap canvi prova d'escalfar el tub d'assaig submergint-lo en un bany d'aigua. Anota les observacions.
5)Dilueix el contingut de cada tub d'assaig amb aigua destil·lada i pren nota de tot el que observis.
6)Neteja els tubs i conserva els trossos de metall que no han reaccionat.
7)Fes els mateixos passos amb el HNO3
8)Fes els mateixos passos amb el H2SO4
Recollida i anàlisi de dades.
Hem recollit les dades en una taula :
Pràctiques de Laboratori
Pràctica 5 2n de Batxillerat
_______________________________________________________________
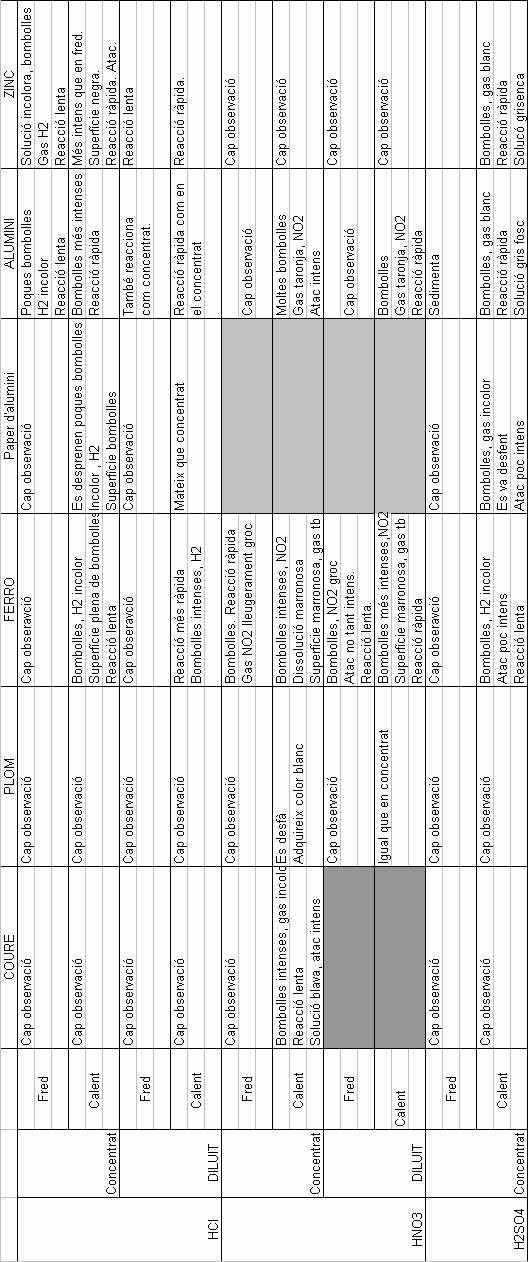
Pràctiques de Laboratori
Pràctica 5 2n de Batxillerat
_______________________________________________________________
Conclusions
Reaccions :
ÀCID CLOHÍDRIC amb :
Cu : No hi ha reacció.
Pb : No hi ha reacció
Ferro : No es produeix reacció en fred , però sí en calent es produeix una reacció lenta amb despresa de gas hidrogen incolor.
Fe(s) + 2HCl(aq) FeCl2(aq) + H2(g)
Alumini : Reacciona tant en fred com en calent, però en calent es produeix un atac més intens i més ràpid, es desprèn gas hidrogen incolor.
Al(s) + 3HCl (aq) AlCl2(aq) + 3/2 H2(g).
Zinc : es el metall que es presenta més actiu davant la corrosió del clorhídric, reacciona intensament , canvia la superfície del metall . Això és nou, no ho havíem observat fins ara.
Zn(s) + 2HCl(aq) >ZnCl2(aq) + H2(g).
ÀCID NÍTRIC amb :
Cu : Presenta reacció amb l'àcid nítric. La solució agafa un color blavós i es desprèn gas NO2.
Cu(s) + 4HNO3 Cu(NO3)2 + 2NO2(g) + 2H2O(v).
Pb :El plom es desfà adquirint un color blanquinós.
Pb(s) + 4HNO3 Pb(NO3)2 +2 NO2(g) + 2H2O(v).
Fe: És dels que presenten major atac. Es desprèn diòxid de nitrogen que és un gas tòxic.
Fe(s) + 4HNO3 Fe(NO3)2 + NO2(g) + 2H2O(v).
Al: Reacció i atac intens en calent.
Al(s) + 6HNO3 Al(NO3)3 + 3NO2(g) + 3H2O(v).
Zn : No hi ha cap observació. No reacciona.
Pràctiques de Laboratori
Pràctica 5 2n de Batxillerat
_______________________________________________________________
ÀCID SULFÚRIC :
Cu:En calent hauria de reaccionar i desprendre CuSO4 i SO2 . Segurament l'error es deu a la falta de més concentració de l'àcid.
Pb: No hi ha reacció.
Fe : El ferro reaccina en calent però presenta un atac poc intens i una reacció lenta. Es desprèn un gas, el diòxid de sofre (tòxic, causant de la pluja àcida.).
Fe(s) + 2H2SO4 (aq) FeSO4(aq) + SO2(g) +2H2O(v).
Al: Es produeix una reacció ràpida i la superfície és grisenca. Atac intens.
Al(s) + 3H2SO4 (aq) Al(SO4)3(aq) +3H2(g)
Zn: Es produeix un gas blanc, reacció ràpida. Atac intens.
Zn(s) + 2H2SO4 (aq) ZnSO4(aq) + SO2(g) +2H2O(v).
Classificació dels metalls :
Metalls actius
Alumini pols
Zinc
Fe
Metalls passivats
Cu
Pb
Descargar
| Enviado por: | Laberin |
| Idioma: | catalán |
| País: | España |
