Ciencias de la Salud
Patógenos
DIFTERIA
Enfermedad infecciosa aguda causada por Corynebacterium diphtheriae que se caracteriza por la formación de una seudomembrana fibrinosa, por lo general sobre la mucosa respiratoria, y por la lesión del tejido miocárdico y nervioso, secundaria a la exotoxina.
ETIOLOGÍA Y EPIDEMIOLOGÍA
Existen tres biotipos de C. diphtheriae (mitis, intermedius y gravis). Sólo las cepas toxigénicas producen exotoxina, capacidad que se debe a la infección de la bacteria por un bacteriófago. Las cepas no toxigénicas pueden provocar una difteria sintomática, pero de evolución, en general, más leve. La diseminación se produce sobre todo por las secreciones de las personas infectadas, bien directamente o bien a través de fomites contaminados. El hombre es el único reservorio conocido de C. diphtheriae. Los casos esporádicos suelen ser consecuencia de la exposición a portadores que tal vez nunca desarrollaron una enfermedad evidente. La infección puede producirse en personas vacunadas, siendo más frecuente y grave en las inmunizadas parcialmente. En las personas no tratadas, la contagiosidad suele durar 2 sem o menos. En los pacientes tratados con los antimicrobianos adecuados la contagiosidad suele limitarse a 4 d. Algunas personas se hacen portadores crónicos tras el tratamiento antibiótico.
La difteria cutánea (infección de la piel) puede aparecer cuando cualquier rotura del tegumento es colonizada por C. diphtheriae. Las heridas, abrasiones, úlceras, quemaduras y otras lesiones pueden ser reservorios potenciales del microorganismo. El estado de portador cutáneo de C. diphtheriae es otro posible reservorio silente de infección. La escasa higiene personal y comunitaria contribuyen a la propagación de la difteria cutánea. Parece que los climas cálidos favorecen la infección; sin embargo, ésta no se limita a las zonas tropicales, pues se han descrito grandes brotes en climas templados. En EE. UU., los adultos indigentes y los grupos empobrecidos como los nativos americanos que viven en áreas endémicas están particularmente expuestos al riesgo.
ANATOMÍA PATOLÓGICA
En general, los microorganismos se alojan en las amígdalas o en la nasofaringe y, a medida que se multiplica, C. diphtheriae toxigénico puede producir exotoxinas letales para las células adyacentes. En ocasiones, la localización primaria es la piel o la mucosa de alguna otra región del cuerpo. La exotoxina, transportada por la sangre, lesiona células de órganos distantes, provocando lesiones en las vías respiratorias, la orofaringe, el miocardio, el sistema nervioso y los riñones.
El miocardio puede mostrar degeneración grasa o fibrosis. Las alteraciones degenerativas de los nervios craneales o periféricos afectan sobre todo a las fibras motoras. En los casos graves, las astas anteriores y las raíces posteriores de la médula pueden mostrar una lesión que es proporcional a la duración de la infección antes de la administración de la antitoxina. Los riñones pueden desarrollar una nefritis intersticial reversible, con amplia infiltración celular.
El bacilo de la difteria destruye en primer lugar la capa del epitelio superficial, generalmente en placas, y el exudado resultante se coagula para formar una seudomembrana grisácea que contienen bacterias, fibrina, leucocitos y células epiteliales necróticas. Sin embargo, las áreas de multiplicación bacteriana y de absorción de la toxina son más amplias y más profundas de lo que podría pensarse por el tamaño de la membrana, formada inmediatamente después de la diseminación de la infección.
SÍNTOMAS Y SIGNOS
El período de incubación oscila entre 1 y 4 d y va seguido de un período prodrómico de 12 a 24 h. Inicialmente, los enfermos con difteria amigdalar o de las fauces sólo presentan un dolor de garganta leve, disfagia, fiebre escasa con una frecuencia cardíaca aumentada y leucocitosis polimorfonuclear creciente. Las náuseas, los vómitos, los escalofríos, las cefaleas y la fiebre son más frecuentes en los niños.
La membrana característica suele ser amigdalina, pero puede aparecer también en otras áreas (p. ej., la nasofaringe), es de color gris sucio, dura y fibrinosa y suele estar firmemente adherida, por lo que su extracción causa una hemorragia. Según la duración de la infección, la membrana puede ser puntiforme o extensa y de color gris amarillento o cremoso. En los niños pequeños, que pueden no presentar signos hasta que la enfermedad se halla bien establecida, la membrana suele encontrarse ya en la primera exploración. En los niños mayores y en los adultos, las molestias de garganta y la fatiga preceden a menudo a la aparición de la membrana y algunos enfermos nunca llegan a desarrollarla.
La enfermedad puede persistir en forma leve. Cuando progresa, la disfagia, los signos de toxemia y la postración son llamativos. El edema de la faringe y la laringe dificulta la respiración. Si la membrana afecta a la laringe o la tráquea y los bronquios, puede obstruir parcialmente la vía aérea o desprenderse de forma repentina y causar una obstrucción completa. Los ganglios linfáticos cervicales aumentan de tamaño. En los casos graves, la difusión de la exotoxina hacia los tejidos del cuello provoca un edema intenso («cuello de toro»). La afectación nasofaríngea puede manifestarse por una secreción nasal serosanguinolenta, a menudo unilateral.
Morfológicamente, las lesiones cutáneas de la difteria son inespecíficas, tienden a aparecer en las extremidades y, si no se tratan, pueden producir zonas de anestesia debidas a la infiltración por la exotoxina, si bien el dolor, la sensibilidad, el eritema y la exudación son típicos. En estas lesiones suelen encontrarse también estreptococos ð -hemolíticos del grupo A, Staphylococcus aureus o ambos, mientras que las seudomembranas son raras. Entre el 20 y el 40% de los pacientes con difteria cutánea tienen también una infección nasofaríngea concomitante por el mismo biotipo.
La infección ocular por C. diphtheriae es rara y puede asociarse o no a lesiones cutáneas. El microorganismo puede infectar además otras localizaciones mucocutáneas como el oído (otitis externa) y el aparato genital (vulvovaginitis ulcerosa y purulenta).
COMPLICACIONES Y DIAGNÓSTICO
Si no se aplica rápidamente la antitoxina una vez hecho el diagnóstico clínico e incluso antes de que se conozcan los resultados de los cultivos, las complicaciones graves son probables (v. más adelante). En el 20 al 30% de los pacientes se observan cambios poco importantes del ECG; sin embargo, la disociación auriculoventricular, el bloqueo cardíaco completo y las arritmias ventriculares tienen una elevada mortalidad. La miocarditis suele manifestarse después de 10 a 14 d, si bien puede hacerlo en cualquier momento entre la 1.ª y la 6.ª sem. A continuación puede aparecer una insuficiencia cardíaca que cause una muerte brusca. Durante la primera semana de la enfermedad, el paciente puede experimentar disfagia y regurgitación nasal debidas a la parálisis bulbar; las parálisis de los nervios periféricos se manifiestan tras 3 a 6 sem de evolución, con resolución espontánea lenta a lo largo de muchas semanas. Ni la administración de corticosteroides ni la de antitoxina en una fase tardía mejoran la miocarditis ni las parálisis.
El aspecto clínico de la membrana indica el diagnóstico, aunque la confirmación la dará un cultivo positivo. La tinción con Gram de la membrana puede mostrar bacilos grampositivos con tinción metacromática (arrosariada) con la clásica configuración parecida a los caracteres chinos. El material para el cultivo debe obtenerse bajo la membrana o puede enviarse una porción de la propia membrana. Para el aislamiento primario del microorganismo los mejores medios son los de Loeffler y el de agar telurita. Hay que comunicar al laboratorio la sospecha de difteria. En los pacientes que desarrollan lesiones cutáneas durante un brote de difteria respiratoria debe pensarse en una infección cutánea por C. diphtheriae. En áreas geográficas remotas, las torundas o las muestras de biopsia pueden colocarse en un envase con gel de sílice para su envío a un laboratorio de referencia.
PROFILAXIS Y TRATAMIENTO
La inmunización activa con vacuna DTP debe realizarse de forma sistemática en todos los niños y contactos susceptibles (v. Vacunaciones infantiles,). En los contactos previamente inmunizados, basta con administrar una dosis de refuerzo de tipo adulto de los toxoides tetánico y diftérico adsorbidos (Td).
Los pacientes sintomáticos deben ser hospitalizados en una UCI. La antitoxina diftérica ha de administrarse lo antes posible, ya que sólo neutraliza a la toxina que aún no se ha unido a las células. Su administración debe iniciarse inmediatamente, en el momento de hacer el diagnóstico clínico, sin esperar a la confirmación por el cultivo. Precaución: la antitoxina diftérica procede del suero de caballos; por tanto, su administración siempre debe ir precedida de la práctica de una prueba cutánea o conjuntival para descartar una posible sensibilización (v. comentario sobre la enfermedad del suero en Hipersensibilidad medicamentosa,). Si a los 30 min no ha aparecido eritema ni se ha formando un área eritematosa plana <0,5 cm alrededor del lugar de la inyección de la prueba cutánea, podrá administrarse la antitoxina. La dosis, que oscila entre 20.000 y 100.000 U, se decide de forma empírica. Los pacientes con faringitis diftérica de sintomatología moderada necesitan 20.000 a 40.000 U, mientras que los que tienen síntomas más graves o presentan complicaciones requieren dosis mayores.
La antitoxina puede administrarse por vía i.m. o i.v. Las dosis >20.000 se pueden añadir a 200 ml de solución de cloruro sódico al 0,9% administrándola i.v. lentamente a lo largo de 30 a 45 min para facilitar la inyección del gran volumen. En los casos leves pueden administrarse 40.000 U, en los moderados 80.000 U y en los graves 120.000 U.
Una roncha urticariforme como respuesta a la prueba cutánea indica la presencia de sensibilización y obliga a mantener una precaución extremada mientras se administra la antitoxina. En primer lugar, hay que proceder a la desensibilización del paciente con antitoxina diluida, administrada en dosis progresivas, tal como se describe en Hipersensibilidad medicamentosa, en el capítulo 148. Si aparecen síntomas indeseables, deberán administrarse de inmediato 0,3-1 ml de adrenalina 1:1.000 (0,01 ml/kg) por vía subcutánea, i.m. o i.v. lentamente. En los pacientes muy sensibilizados, la administración de antitoxina está contraindicada.
Son necesarios tanto el reposo en cama como los cuidados intensivos de enfermería, insistiendo en la nutrición, la ingesta de líquidos, la oxigenación, la observación constante para detectar signos indicativos de la necesidad de una intubación endotraqueal o de una traqueostomía, la monitorización continua de los problemas cardíacos y frecuentes exploraciones del SNC. Como es fácil que las membranas de desplacen, el tratamiento de urgencia de la vía aérea es la traqueostomía.
Para erradicar al microorganismo y evitar su propagación, es necesario instaurar un tratamiento antimicrobiano, que en ningún caso sustituirá a la antitoxina. En los adultos puede administrarse penicilina G procaína en dosis de 600.000 U i.m. cada 12 h durante 10 d o 250 a 500 mg de eritromicina con revestimiento entérico o 400 mg de etilsuccinato de eritromicina ambas v.o., cada 6 h durante 14 d. Los niños con menos de 10 kg de peso deben recibir penicilina G procaína, 25.000 a 50.000 U/kg/d, i.m. en 2 dosis, o 40 a 50 mg/kg/d de eritromicina (máximo 2 g/d) v.o. o i.v. fraccionados en 4 dosis. No se recomienda usar cefalosporinas orales. La erradicación del microorganismo debe confirmarse mediante 2 cultivos negativos de faringe consecutivos realizados tras completar el tratamiento antibiótico.
La recuperación de una difteria grave es lenta y debe recomendarse a los pacientes que no reanuden sus actividades demasiado pronto. Incluso un esfuerzo físico normal puede perjudicar a un paciente que no esté aún completamente recuperado de la miocarditis.
En el caso de la difteria cutánea se recomienda una limpieza cuidadosa de la lesión con agua y jabón junto a la administración de antimicrobianos por vía general.
TRATAMIENTO DE UN BROTE
Todos los pacientes sintomáticos han de ser aislados. Además de los procedimientos habituales, en los pacientes con difteria faríngea se recomiendan las precauciones para evitar las gotitas (es decir, habitaciones individuales y uso de mascarillas por todas las personas situadas a 1 m a la redonda del paciente). Asimismo, se recomiendan las precauciones sobre contactos (es decir, habitaciones individuales, uso de guantes en todo momento, lavado de las manos con un agente antibacteriano, uso de bata en todo momento). Los pacientes deben ser tratados de la forma antes descrita hasta dos cultivos faríngeos (o cutáneos, en los casos pertinentes) obtenidos a las 24 y 48 h de la interrupción de los antibióticos resulten negativos para C. diphtheriae. Si tras la recuperación clínica los cultivos siguen siendo positivos, deberá efectuarse un nuevo tratamiento con eritromicina durante 10 d (2 g/d v.o., fraccionados en 4 dosis en el caso de los adultos y 50 mg/kg/d en los niños). Para evitar la alteración de la absorción provocada por los alimentos, debe utilizarse succinato de eritromicina en presentaciones con revestimiento entérico. Con los actuales tratamientos antibióticos ya no está indicada la amigdalectomía para erradicar los focos persistentes.
Todos los cultivos de C. diphtheriae deben ser enviados al departamento local de sanidad para su biotipificación y determinación de la toxigenicidad. En una comunidad pueden coexistir biotipos toxigénicos y no toxigénicos. El análisis de los patrones enzimáticos de restricción del ADN y los patrones de hibridación con sondas de ADN de los cultivos permiten caracterizar epidemiológicamente los brotes epidémicos.
Deben obtenerse cultivos de nasofaringe y de garganta de todos los contactos cercanos de los pacientes con difteria, sea cual sea su estado de inmunización. Es necesario examinar la garganta y el tegumento y hospitalizar a los pacientes sintomáticos para tratarlos de la forma ya descrita, en tanto se esperan los resultados de los cultivos. Los contactos asintomáticos con cultivos faríngeos positivos para C. diphtheriae («portadores») deben permanecer en sus casas, sin recibir visitas, durante toda la duración del tratamiento, que consistirá en 250 a 500 mg de eritromicina cada 6 h v.o. en los adultos o 50 mg/kg/d fraccionados en 4 dosis en los niños. Los portadores no deben recibir antitoxina. Después de 3 d de tratamiento, el cabeza de familia puede volver al trabajo, aunque continúe tomando antibióticos. Los cultivos se repetirán un mínimo de 2 sem después de la terminación del ciclo antibiótico. Los fracasos de los tratamientos con eritromicina se deben en general a la falta de cumplimiento del protocolo, más que a la resistencia de los microorganismos. No obstante, en EE. UU. se han descrito casos ocasionales de resistencia de C. diphtheriae a este agente. Si el tratamiento fracasa, se harán antibiogramas. Por razones de cumplimiento, los contactos a los que sea imposible mantener bajo vigilancia deben recibir penicilina G benzatina y no eritromicina, además de una dosis de DTP, vacuna pertusis acelular (DTaP) o difteria-tétanos (DT), dependiendo de la edad y del estado de inmunización.
En todos los contactos, incluido el personal hospitalario, debe actualizarse la vacunación, para lo que se usarán los toxoides del tétanos y difteria de tipo adulto (Td). Si han pasado más de 5 años desde la última dosis de recuerdo, no puede confiarse en que los niveles de inmunidad sean protectores. Si no se conoce es el estado de inmunización, deberá procederse a la vacunación con DTP o DP, dependiendo de la edad.
Tanto desde un punto de vista de la salud personal como de la pública, las personas con cultivos negativos y vacunación completa están a salvo del contagio.
BACTERIEMIA OCULTA
Presencia de bacterias patógenas viables en el torrente sanguíneo de niños pequeños febriles que no presentan un foco de infección evidente y que parecen tener un estado general lo suficientemente bueno como para ser tratados en régimen ambulatorio.
ETIOLOGÍA Y EPIDEMIOLOGÍA
En el 65 a 75% de los casos, la bacteriemia oculta se debe a Streptococcus pneumoniae; el resto está causado por otras bacterias, entre las que se encuentran Neisseria meningitidis, Salmonella sp. y Streptococcus aureus. La incidencia de bacteriemia por Haemophilus influenzae tipo b (Hib) ha disminuido notablemente en los países que disponen de la vacuna conjugada Hib para la vacunación sistemática de los niños.
La bacteriemia oculta se detecta en alrededor del 4 a 17% de los lactantes y niños pequeños febriles de 1 a 24 meses de edad, aunque la gran mayoría de los casos afectan a niños de 6 a 24 meses. Los niños con un estado general suficientemente bueno como para permitir un tratamiento ambulatorio pero que más tarde presentan una bacteriemia suelen ser menores de 2 años. La incidencia no varía con el sexo o la raza.
SÍNTOMAS, SIGNOS Y DIAGNÓSTICO
En la mayor parte de los casos, la bacteriemia oculta se asocia a una infección de las vías respiratorias superiores (IVRS), faringitis o fiebre aislada; sin embargo, el porcentaje de lactantes que presentan una de estas entidades y desarrollan bacteriemia es muy bajo.
Dado que el diagnóstico depende del aislamiento de las bacterias de la sangre, no existe un método exacto para establecer el diagnóstico en la primera visita del niño. Los cultivos suelen tardar de 24 a 48 h en hacerse positivos y es frecuente que las muestras estén contaminadas por microorganismos cutáneos. Las técnicas disponibles para el diagnóstico rápido (p. ej., velocidad de sedimentación globular, proteína C reactiva) no son lo bastante sensibles como para ser útiles en la clínica.
Las pruebas inespecíficas pueden ayudar a determinar el riesgo de bacteriemia de un niño determinado. La mayoría de los bacteriémicos presentan leucocitosis, por lo que se trata de una prueba sensible; sin embargo, sólo el 10% de los niños con recuentos leucocitarios superiores a 15.000/ml son bacteriémicos (especificidad baja). Los reactantes de fase aguda como la VSG y la proteína C reactiva apenas añaden información. Un análisis de orina con <5 leucocitos/campo de gran aumento y ausencia de nitritos y de esterasa leucocitaria ayudará a descartar una infección urinaria (IU). La combinación de algunos factores de riesgo -como una edad de 1 a 24 meses, una temperatura superior a 38,5 °C, leucocitosis >15.000/ml con >5.000 cayados/ml y un análisis de orina anormal- aumenta las probabilidades de bacteriemia, pero sólo entre el 10 y el 25%. Se han desarrollado varios sistemas de puntuación clínica, por ejemplo los criterios de Rochester para un riesgo bajo de infección bacteriana grave en los lactantes (v. tabla 265-1).

La bacteriemia oculta debe distinguirse de la sepsis, la sepsis neonatal y el shock séptico. (Para la descripción de estas infecciones, y Sepsis neonatal y Meningitis neonatal en Infecciones neonatales,).
PRONÓSTICO Y TRATAMIENTO
Tanto si los niños reciben antibióticos antes de que se confirme la bacteriemia como en caso contrario, el 10 a 15% acaban por desarrollar una meningitis. Casi todos los tratados con antibióticos antes de la confirmación de la bacteriemia mejoran clínicamente, pero la bacteriemia persiste en algunos. Por el contrario, de los niños que no reciben antibióticos antes de que se confirme la bacteriemia, sólo una minoría mejora clínicamente y el porcentaje de los que terminan por desarrollar una infección bacteriana localizada, fiebre continua y bacteriemia persistente es similar al de los tratados con antibióticos antes de la confirmación.
Algunos autores defienden iniciar un tratamiento con ceftriaxona i.m. o con amoxicilina oral a la espera de los resultados de los hemocultivos en los lactantes de 3 a 24 meses con fiebre >40 °C y leucocitosis >15.000/ml. Otros creen que cuando se mantiene una observación meticulosa no es necesario iniciar el tratamiento. En todo caso, tanto si se establece un tratamiento como en caso contrario, es imprescindible mantener una estrecha vigilancia, especialmente durante las primeras 72 h.
Alrededor del 50% de los pacientes ambulatorios con sospecha de bacteriemia tienen una infección tratable, sobre todo una otitis media o una neumonía, por lo que es casi seguro que estén recibiendo antibióticos v.o. cuando se confirme la bacteriemia.
GASTROENTERITIS INFECCIOSA AGUDA
Síndrome de vómitos y diarrea causado por microorganismos patógenos, que puede provocar deshidratación y desequilibrio electrolítico.
Se calcula que en el mundo se producen anualmente alrededor de 1.000 millones de episodios de gastroenteritis aguda, la mayoría en países en desarrollo y en niños <5 años, con 5 millones de muertes provocadas por la deshidratación. Casi todas las muertes podrían evitarse con una rehidratación rápida. En muchos países en vías de desarrollo, los niños menores de 2 años que sufren 6 a 10 episodios anuales de diarrea y vómitos no tratados tienen muchas probabilidades de desarrollar una malnutrición grave.
Son muchas las bacterias, virus y parásitos que pueden producir una gastroenteritis aguda (v. tabla 265-3). Los estudios analíticos adecuados permiten identificar al agente causal en el 60 al 80% de los casos.

SÍNTOMAS, SIGNOS Y DIAGNÓSTICO
La epidemiología, duración, carácter y frecuencia de los vómitos y la diarrea en relación con la edad del niño pueden indicar tanto la causa como la gravedad de la enfermedad. En general, al menos un miembro de la familia o un contacto íntimo han sufrido recientemente síntomas de gastroenteritis o de infección respiratoria. Los lactantes <6 meses pueden desarrollar deshidratación y desequilibrio electrolítico en tan sólo 24 h. Sin embargo, la deshidratación grave y la acidosis metabólica pueden desarrollarse en 24 h a partir del comienzo de la enfermedad en pacientes de cualquier edad, siempre que existan vómitos rebeldes, diarrea explosiva o descienda drásticamente la ingesta de líquidos. La exploración física permite descartar las causas extraintestinales y determinar el estado de deshidratación. Los signos de deshidratación son letargia, oliguria y pérdida de peso continuada (v. tabla 265-4).

En los lactantes mayores, en los niños con sobrepeso y en los que tienen hipernatremia, algunos signos pueden permanecer ocultos hasta que la deshidratación se hace intensa. Los pacientes con deshidratación hipernatrémica pueden mostrar irritabilidad y fiebre y la piel puede aparecer pastosa, lo que constituye una característica distintiva. La deshidratación isotónica es más frecuente y tiende a asociarse, aunque no siempre, con piel seca y escasa turgencia de los tejidos. Los signos habituales de deshidratación consisten en hundimiento de la fontanela anterior y de los globos oculares con ausencia de lágrimas, mucosa oral seca, succión débil o ausente y letargia (v. tabla 265-4).
El Hto y los electrólitos séricos pueden reflejar el estado de hidratación y del equilibrio electrolítico. La densidad urinaria ayuda a valorar el estado de hidratación y el examen microscópico de la orina para buscar bacterias ayuda a establecer una posible IU (causa frecuente de síntomas similares a los de la gastroenteritis).
Los coprocultivos ayudan a diferenciar las gastroenteritis bacterianas de las víricas y los antibiogramas sirven para orientar el tratamiento antibiótico específico. Cuando existe infección bac-teriana, la tinción con Wrigth, Gram o azul de metileno de una muestra de heces acuosas suele mostrar abundantes PMN.
TRATAMIENTO
La clave del tratamiento de la diarrea y los vómitos de cualquier causa consiste en la administración de los líquidos y electrólitos adecuados. Antes de iniciar el tratamiento, es necesario valorar clínicamente el grado de deshidratación, pues éste es el factor que indica las necesidades de líquidos y electrólitos para la rehidratación, el mantenimiento y la reposición de las pérdidas que se están produciendo por las heces (v. tabla 265-4).
Rehidratación. Los lactantes sin signos de deshidratación no necesitan ser rehidratados. Sin embargo, sí deben recibir una cantidad de líquidos similar a la recomendada para los pacientes con deshidratación durante la fase de mantenimiento, con el fin de reponer las pérdidas fecales. Hay que incitarlos a beber líquidos (p. ej., sopa, agua de arroz, cocimientos de cereales).
La solución de rehidratación oral recomendada por la OMS se viene utilizando en todo el mundo durante más de 20 años. Esta solución contiene (en ð mol/l), 90 de Na, 20 de K, 80 de Cl, 30 de bicarbonato y 111 de glucosa; se fabrica añadiendo 1 litro de agua a 3,5 g de cloruro sódico, 2,5 g de bicarbonato sódico, 1,5 g de cloruro potásico y 20 g de glucosa. Resulta eficaz en todos los pacientes con diarrea aguda sean cuales sean su edad, su causa y el tipo de desequilibrio electrolítico (hiponatremia, hipernatremia o isonatremia). Una vez rehidratado el niño, la solución de rehidratación oral puede complementarse con agua corriente o con bajo contenido en Na.
Si no se dispone de solución de rehidratación oral, durante la rehidratación y el mantenimiento puede utilizarse una solución de azúcar/sal de composición similar, que se prepara añadiendo 1 litro de agua a 15 ml (1 cucharada) de azúcar y 2 ml (media cucharada) de sal. Aunque la solución de azúcar/sal es menos efectiva que la solución de rehidratación oral, suele bastar para tratar adecuadamente la diarrea.
En los niños que no toleran los líquidos orales puede ser necesario recurrir a los líquidos i.v. (Ringer lactato o soluciones similares).
Al final del período de rehidratación (unas 4 h), debe hacerse una nueva valoración del paciente. Si persisten los signos de deshidratación, deberá repetirse el tratamiento de rehidratación hasta corregir por completo el trastorno.
Mantenimiento. Las pérdidas continuas por las heces deben reponerse con solución de rehidratación oral en cantidad igual a la de aquéllas. Si se desconoce cuál es la magnitud de las pérdidas, se administrarán unos 10 ml/kg o 0,5 a 1 taza (120 a 240 ml) de solución de rehidratación oral por cada deposición diarreica.
Los niños con diarrea que no están deshidratados pueden recibir una dieta adecuada a su edad. Los deshidratados debe comenzar con una dieta adecuada a su edad tan pronto como hayan sido rehidratados. Los lactantes alimentados con leche materna que tienen diarrea deben continuar mamando. Los alimentados con fórmulas artificiales suelen tolerar la leche animal completa o las fórmulas basadas en ella cuando la diarrea es leve y autolimitada. Si desarrollan signos o síntomas de malabsorción, deberán recibir una fórmula sin lactosa. Si no se dispone de este tipo de alimento, puede diluirse a la mitad la leche que el niño consume habitualmente. Los niños mayores y los adultos pueden tomar los líquidos que consumen normalmente en la cantidad que deseen.
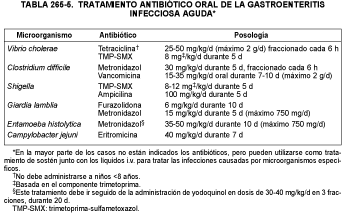
Antibióticos. Sólo deben usarse en indicaciones precisas, como se muestra en la tabla 265-5. Los antibióticos no influyen en la evolución de la gastroenteritis por Salmonella; cuando se administran, la excreción fecal del microorganismo se prolonga y, además, se facilita el surgimiento de cepas resistentes. Sin embargo, cuando Salmonella invade el torrente sanguíneo o se localiza fuera del intestino, se administran ampicilina, ceftriaxona, cefotaxima o cloranfenicol i.v., dependiendo de los resultados de los antibiogramas, sobre todo en lactantes <6 meses o niños inmunodeprimidos, incluidos los que tienen drepanocitosis. La gastroenteritis por Yersinia suele ceder sin tratamiento antibiótico. La gastroenteritis por Vibrio cholerae debe tratarse con tetraciclina o trimetoprima-sulfametoxazol. Las enterocolitis por Campylobacter jejuni suficientemente graves como para requerir hospitalización deben ser tratadas con eritromicina. La trimetoprima-sulfametoxazol puede usarse en la shigellosis resistente a la ampicilina.
SÍNDROME DE SHOCK TÓXICO
El síndrome de shock tóxico es una infección generalmente causada por estafilococos que rápidamente puede empeorar hasta convertirse en un shock grave, que no responde a tratamiento.
En 1 978, el síndrome de shock tóxico fue reconocido por primera vez como un síndrome especial en varios niños de entre 8 y 17 años de edad. En 1 980, aparecieron muchos más casos, principalmente en mujeres jóvenes que, casi siempre, usaban tampones. En 1 981, después de una gran publicidad y la eliminación del mercado de las variedades “super- absorbentes” de tampones, la incidencia de este síndrome disminuyó drásticamente. Aún siguen dándose casos en algunas mujeres que no usan tampones, después de la cirugía o de dar a luz. Alrededor del 15 por ciento de los casos se producen en varones que han sido sometidos a cirugía. Los casos leves son bastante frecuentes.
A pesar de que se conoce perfectamente la variedad de estafilococo que causa la mayoría de los casos de síndrome de shock tóxico, aún se ignora qué suceso desencadena este síndrome. La presencia de un tampón puede impulsar a las bacterias a producir una toxina que penetra en la sangre a través de pequeños cortes en el revestimiento vaginal o bien a través del útero hasta llegar a la cavidad abdominal. Esta toxina aparentemente es la que causa los síntomas.
SÍNTOMAS Y DIAGNÓSTICO
Los síntomas comienzan de forma repentina con fiebre de 38,5 a 40,5 ºC. Es característico el desarrollo rápido de fuerte dolor de cabeza, dolor de garganta, ojos enrojecidos, cansancio extremo, confusión, vómitos, diarrea acuosa profusa y una erupción cutánea similar a una quemadura de sol por todo el cuerpo. A las 48 horas se pueden sufrir desvanecimientos y entrar en estado de shock. Entre el tercero y el séptimo día se desprende la piel, sobre todo de las palmas de las manos y las plantas de los pies.
El síndrome provoca anemia. Las lesiones del riñón, hepáticas y musculares son muy frecuentes, especialmente durante la primera semana. También pueden aparecer problemas de corazón y pulmones. Los órganos, generalmente, se recuperan completamente una vez que los síntomas desaparecen.
El diagnóstico suele basarse en los síntomas que presenta el paciente. A pesar de que no existen pruebas de laboratorio que identifiquen específicamente el síndrome de shock tóxico, se suelen realizar análisis de sangre para excluir otras posibles causas que produzcan una sintomatología similar.
PREVENCIÓN, TRATAMIENTO Y PRONÓSTICO
Es difícil proponer recomendaciones precisas para evitar el síndrome de shock tóxico. En términos generales, las mujeres deberían evitar el uso continuado de tampones durante la menstruación. Los tampones superabsorbentes, que son los que más posibilidades tienen de causar síndrome de shock tóxico, no deben utilizarse.
Si se sospecha que un individuo tiene este síndrome, es necesario hospitalizarlo de inmediato. El tratamiento comienza con la retirada del tampón, el diafragma u otro objeto extraño y se administran antibióticos lo antes posible.
Alrededor del 8 al 15 por ciento de las personas con síndrome de shock tóxico completo mueren. Los episodios recurrentes son frecuentes entre las mujeres que continúan usando tampones en los 4 meses posteriores a un episodio de éstos, a menos que el tratamiento antibiótico haya eliminado los estafilococos.
CANDIDIASIS
(Moniliasis)
Infecciones de la piel (sobre todo de zonas húmedas, intertriginosas, ocluidas), de los anejos cutáneos o de las mucosas, causadas por levaduras del género Candida.
La candidiasis se suele limitar a la piel y las mucosas, siendo poco frecuentes las infecciones sistémicas que originan lesiones viscerales con riesgo vital para el paciente..
PATOGENIA Y ETIOLOGÍA
Candida albicans es una levadura ubicua, generalmente saprofita, que se puede convertir en patógeno en un entorno favorable o cuando las defensas alteradas del huésped permiten que el organismo prolifere. Las áreas intertriginosas y mucocutáneas, en las que el calor y la maceración determinan un ambiente favorable, resultan las más susceptibles a la infección. Otros factores que aumentan la susceptibilidad a esta infección son los tratamientos antibacterianos, esteroideos o inmunosupresores sistémicos, el embarazo, la obesidad, la diabetes mellitus y otras endocrinopatías, las enfermedades debilitantes, las discrasias sanguíneas y las deficiencias inmunológicas.
SÍNTOMAS Y SIGNOS
Las infecciones intertriginosas, el tipo más frecuente, aparecen como placas eritematosas bien delimitadas, a veces pruriginosas, exudativas, de morfologías y tamaños diversos. Estas lesiones suelen mostrar un ribete de pápulas y pústulas de base rojiza y se localizan en las axilas, la región submamaria, el ombligo, las nalgas y los pliegues glúteos (eritema del pañal) y entre los dedos de las manos y de los pies. La candidiasis perianal produce prurito anal y maceración blanquecina.
La paroniquia candidiásica debuta en la uña en forma de una tumefacción roja y dolorosa, en la que posteriormente se desarrolla pus. Se puede deber a manicuras mal realizadas y resulta frecuente en los trabajadores de las cocinas y otros profesionales que tienen que tener las manos en agua continuamente. Las infecciones subungueales se caracterizan por la separación distal de una o más uñas (onicólisis), con coloración blanca o amarillenta de la zona subungueal.
Los defectos en las respuestas inmunes mediadas por células (que en los niños pueden ser genéticos) pueden determinar una candidiasis mucocutánea crónica, que se caracteriza por unas placas rojas pustulosas y costrosas engrosadas, que recuerdan a la psoriasis, localizadas sobre todo en la nariz y lafrente, y que se asocian con una moniliasis oral crónica en todos los casos. En los pacientes inmunosuprimidos se pueden producir otras lesiones candidiásicas o candidiasis sistémicas.
DIAGNÓSTICO
Se puede demostrar la presencia de Candida encontrando esporas o seudohifas en muestras teñidas con Gram o en raspados de la lesión tratados con hidróxido de potasio. Como este germen es un comensal del hombre, se debe interpretar con cuidado su aislamiento en cultivos de piel, boca, vagina, orina, esputo o heces. Para confirmar el diagnóstico se necesita una lesión clínica característica, exclusión de otras causas y, en ocasiones, evidencia histológica de invasión tisular.
TRATAMIENTO
La nistatina tópica, los imidazoles y el ciclopirox suelen resultar eficaces y permiten eliminar tanto las infecciones por dermatofitos como por Candida. Se debe elegir el tratamiento en función del lugar de infección y se debe administrar tres o cuatro veces al día. Cuando se desea conseguir un efecto antipruriginoso y antiinflamatorio, se deben aplicar cantidades iguales de crema antimicótica y esteroides de baja potencia (hidrocortisona) mezclados o por separado. El fármaco no se absorbe y no se puede administrar por vía oral para tratar una candidiasis cutánea. Habitualmente se administran 200 mg/d de itraconazol v.o. durante 2 a 6 sem.
En el caso de exantema del pañal asociado a cándidas, se debe mantener seca la piel cambiando los pañales con frecuencia y aplicando polvos de nistatina o una crema de imidazol dos veces al día; en los casos graves se deben evitar los pañales desechables y las bragas de goma. El tratamiento de las infecciones paroniquiales se comenta en el capítulo 112. El itraconazol oral resulta eficaz en las formas agudas y crónicas de candidiasis mucocutánea (incluida la vaginal).
PITIRIASIS VERSICOLOR
Una infección caracterizada por múltiples placas, habitualmente asintomáticas, descamativas, de coloración blanca a parda y producida por Pityrosporum orbiculare (antes denominada Malassezia furfur).
SÍNTOMAS Y SIGNOS
La pitiriasis versicolor es frecuente en adultos jóvenes. Las lesiones pardas o blancas, muy poco descamativas y con tendencia a la coalescencia, se localizan en el tórax, el cuello y el abdomen, afectando en algunas ocasiones a la cara. La descamación puede no resultar evidente salvo que se produzca rascado de la lesión. El paciente puede notar esta enfermedad solamente en verano, porque las lesiones no se broncean, sino que aparecen como manchas solares hipopigmentadas de diversos tamaños. El prurito es poco frecuente y se suele producir cuando el paciente tiene demasiado calor.
DIAGNÓSTICO
Este proceso se suele diagnosticar clínicamente y por la presencia de grupos de esporas e hifas gruesas y cortas en el estudio microscópico del raspado de la lesión. El grado de afectación se puede determinar mediante fluorescencia dorada o los cambios de pigmentación con luz de Wood. Para el diagnóstico no es necesario cultivar el microorganismo, algo difícil sin medios de cultivo especiales.
TRATAMIENTO
Entre los numerosos tratamientos tópicos útiles contra la pitiriasis versicolor destacan el sulfuro de selenio, los imidazoles, la piritiona de cinc y los compuestos de ácido salicílico-azufre. El champú de sulfuro de selenio al 2,5% (advertencia: se debe mantener fuera del alcance de los niños) se aplica en todas las zonas afectadas -incluido el cuero cabelludo, pero evitando el escroto- durante 3 o 4 d en el momento de acostarse, y se aclara por la mañana. Si se produce irritación, es preciso aclarar el sulfuro de selenio a los 20 a 60 min o interrumpir el tratamiento durante unos días. Si la irritación fuera grave, se pueden aplicar champús de piritiona de cinc al 2% o azufre micropulverizado al 2% y ácido salicílico al 2% a la hora de acostarse, durante 2 sem, o bien administrar imidazoles tópicos (v. Infecciones por dermatofitos, más atrás) 2/d durante 2 sem.
El tratamiento corto con itraconazol oral (200mg/d durante 7 d) es eficaz y se tolera bien. El ketoconazol oral también es eficaz, pero el tratamiento sistémico prolongado de esta enfermedad, que suele ser banal, generalmente no está indicado, dado el riesgo de toxicidad. Sin embargo, en algunos estudios la administración de un comprimido de 200 mg/d durante 1 a 5 d elimina con eficazmente la pitiriasis versicolor durante varios meses.
Las lesiones pueden no volver a pigmentarse hasta que se elimine el hongo y el paciente se exponga al sol. La recaída es constante, ya que el germen causal habita en la piel normal. El cuero cabelludo suele ser el reservorio.
COCCIDIOIDOMICOSIS
La coccidioidomicosis (fiebre de San Joaquín, fiebre del valle) es una infección causada por el hongo Coccidioides immitis, que generalmente afecta a los pulmones.
La coccidioidomicosis se produce tanto como una afección pulmonar leve que desaparece sin tratamiento (la forma aguda primaria), como una infección grave y progresiva que se extiende por todo el organismo y a menudo es mortal (la forma progresiva). Ésta suele ser un signo de que el enfermo posee un sistema inmunitario deficiente, generalmente debido al SIDA.
Las esporas de Coccidioides se encuentran en el suelo de ciertas áreas de Norteamérica, América Central y América del Sur. Los granjeros y otras personas que trabajan la tierra están más expuestos a inhalar las esporas y resultar infectados. Quienes se infectan durante un viaje quizás no presenten los síntomas de la enfermedad hasta después de haber dejado la zona.
SÍNTOMAS
Los afectados por coccidioidomicosis aguda primaria, generalmente, no presentan sintomatología. Si aparecen síntomas, lo hacen de una a tres semanas después de que se ha producido la infección. Éstos son leves en la mayoría de los casos y pueden consistir en fiebre, dolor en el pecho y escalofríos. También puede expectorar esputos y ocasionalmente sangre. Algunas personas desarrollan el llamado reumatismo del desierto, una enfermedad que consiste en la inflamación de la superficie del ojo (conjuntivitis) y de las articulaciones (artritis) y la formación de nódulos en la piel (eritema nudoso).
La forma progresiva de la enfermedad es muy inusual y puede desarrollarse a lo largo de semanas, meses o incluso años después de producida la infección aguda primaria, o bien tras haber vivido en una zona en la cual la misma es frecuente. Los síntomas incluyen fiebre leve, pérdida de apetito, adelgazamiento y disminución de la fuerza. La infección pulmonar puede empeorar, causando una mayor dificultad para respirar. La infección puede extenderse de los pulmones a los huesos, las articulaciones, el hígado y el bazo, a los riñones, el cerebro y las membranas que lo recubren.
DIAGNÓSTICO
El médico puede sospechar la presencia de coccidioidomicosis si alguien que vive en una zona endémica o acaba de regresar de allí presenta estos síntomas. Se toman muestras de esputo o pus del paciente y se envían al laboratorio. Los análisis de sangre pueden revelar la presencia de anticuerpos contra el hongo. Estos anticuerpos aparecen al principio del proceso pero desaparecen en la forma aguda primaria de la enfermedad; en la forma progresiva persisten.
PRONÓSTICO Y TRATAMIENTO
La forma aguda de coccidioidomicosis suele desaparecer sin tratamiento y la recuperación generalmente es completa. Sin embargo, los afectados de la forma progresiva se tratan con anfotericina B intravenosa o fluconazol oral. Otra posibilidad es administrar itraconazol o ketoconazol. A pesar de que el tratamiento con fármacos puede ser eficaz en ciertas infecciones localizadas, como por ejemplo las de la piel, los huesos o las articulaciones, una vez que se suspende el tratamiento suelen producirse recaídas. Las variedades más importantes de coccidioidomicosis progresiva diseminada suelen ser mortales, especialmente la meningitis (infección de las membranas del cerebro y la médula espinal). Si un enfermo tiene meningitis, se recurre al fluconazol; también es posible inyectar anfotericina B en el líquido de la médula espinal. El tratamiento debe mantenerse durante años, a menudo durante el resto de la vida. La meningitis que no recibe tratamiento es siempre mortal.
PALUDISMO (MALARIA)
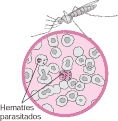
El paludismo (malaria) es una infección de los glóbulos rojos causada por el Plasmodium, un organismo unicelular.
El paludismo se transmite a través de la picadura del mosquito Anopheles hembra infectado, por una transfusión de sangre contaminada o bien por una inyección aplicada con una aguja previamente utilizada por una persona infectada. Existen cuatro especies de parásitos (Plasmodium vivax, Plasmodium ovale, Plasmodium falciparum y Plasmodium malariae) que pueden infectar a los humanos y causar paludismo.
Los fármacos y los insecticidas han hecho que el paludismo sea muy raro en los países más desarrollados, pero la infección sigue siendo frecuente en los países tropicales. Las personas originarias de los trópicos en visita a otros países o los turistas que regresan de dichas áreas en ocasiones están afectados y posiblemente causen una pequeña epidemia.
El ciclo de vida del parásito del paludismo comienza cuando un mosquito hembra pica a un individuo infectado. El mosquito succiona sangre que contiene parásitos de paludismo y llegan hasta sus glándulas salivales. Cuando el mosquito pica a otra persona, inyecta parásitos junto con su saliva. Una vez dentro de la persona, los parásitos se depositan en el hígado, donde se multiplican. Maduran en el curso de 2 a 4 semanas y luego abandonan el hígado e invaden los glóbulos rojos. Los parásitos se multiplican dentro de los glóbulos rojos, lo que finalmente hace que éstos se rompan.
Plasmodium vivax y Plasmodium ovale pueden permanecer en las células del hígado mientras periódicamente liberan parásitos maduros hacia el flujo sanguíneo, provocando ataques con síntomas de paludismo. Plasmodium falciparum y Plasmodium malariae no permanecen en el hígado. Sin embargo, si la infección no se trata o recibe un tratamiento inadecuado, la forma madura de Plasmodium falciparum puede persistir en el flujo sanguíneo durante meses y la forma madura de Plasmodium malariae durante años, provocando repetidos ataques con síntomas de paludismo.
SÍNTOMAS Y COMPLICACIONES
| Anopheles |
|
|
Los síntomas suelen comenzar entre 10 y 35 días después de que un mosquito inyecta el parásito a la persona. Por lo general, los primeros síntomas son fiebre leve e intermitente, dolor de cabeza y dolor muscular, escalofríos junto con una sensación de enfermedad (malestar general). A veces los síntomas comienzan con escalofríos y temblores seguidos de fiebre, los cuales duran entre 2 y 3 días y con frecuencia se confunden con la sintomatología de la gripe. Los síntomas subsiguientes y los patrones que sigue la enfermedad varían para cada tipo de paludismo.
En el paludismo por Plasmodium falciparum puede producirse una alteración de la función del cerebro, complicación llamada malaria cerebral. Los síntomas consisten en fiebre de al menos 40 °C, intenso dolor de cabeza, vértigo, delirio y confusión. El paludismo cerebral puede ser mortal. Por lo general afecta a los niños, las mujeres embarazadas y los turistas que se dirigen a zonas de alto riesgo. En el paludismo por Plasmodium vivax puede haber delirio cuando la fiebre es alta, pero, si no es así, los síntomas cerebrales no son frecuentes.
En todas las variedades de paludismo, el número total de glóbulos blancos suele ser normal, pero el número de linfocitos y monocitos, dos tipos específicos de glóbulos blancos, aumenta. Por lo general, si el paludismo no se trata aparece una ictericia leve, el bazo y el hígado aumentan de tamaño. Es frecuente que la concentración de azúcar en sangre (glucosa) disminuya aún más en las personas que tienen gran cantidad de parásitos. Los valores de azúcar en sangre pueden descender ulteriormente en quienes son tratados con quinina.
A veces el paludismo persiste a pesar de que en la sangre sólo aparecen bajas cifras de parásitos. Los síntomas incluyen apatía, dolores de cabeza periódicos, sensación de malestar, falta de apetito, fatiga y ataques de escalofríos y fiebre. Los síntomas son considerablemente más leves y los ataques no duran tanto como el primero.
Si un individuo no recibe tratamiento, los síntomas del paludismo por Plasmodium vivax, por Plasmodium oval o por Plasmodium malariae remiten espontáneamente en 10 a 30 días, pero pueden recurrir con intervalos variables. El paludismo por Plasmodium falciparum es mortal hasta en el 20 por ciento de los afectados.
La fiebre hemoglobinúrica es una rara complicación del paludismo causada por la rotura de una gran cantidad de glóbulos rojos. A continuación se libera un pigmento rojo (hemoglobina) en el flujo sanguíneo. La hemoglobina que luego es excretada con la orina, hace que ésta presente un color oscuro. Esta fiebre ocurre casi exclusivamente en los enfermos con malaria crónica por Plasmodium falciparum, especialmente los que han sido tratados con quinina
DIAGNÓSTICO
El médico sospecha que un individuo presenta malaria cuando éste tiene ataques periódicos de escalofríos y fiebre sin causa aparente. La sospecha es mayor si durante el año anterior la persona visitó alguna zona en la cual el paludismo es frecuente y además si su bazo ha aumentado de tamaño. El hecho de identificar el parásito en una muestra de sangre confirma el diagnóstico. Es posible que se necesite más de una muestra para establecer el diagnóstico porque el valor de parásitos en sangre varía con el paso del tiempo. El informe del laboratorio identifica la especie de Plasmodium encontrado en la sangre, porque el tratamiento, las complicaciones y el pronóstico varían según la especie.
Prevención y tratamiento
Las personas que viven en zonas endémicas o bien que viajan a ellas deben tomar precauciones. Pueden utilizar insecticidas con efectos de larga duración tanto dentro de sus casas como en las zonas anexas, colocar pantallas en puertas y ventanas, usar mosquitero sobre sus camas y aplicarse repelente contra mosquitos sobre la piel. También deben usar ropa suficiente, particularmente después de la caída del sol, protegiendo la piel lo máximo posible contra las picaduras de los mosquitos.
Es posible iniciar algún tipo de medicación para prevenir el paludismo durante un viaje a una zona endémica. El fármaco comienza a tomarse una semana antes, se continúa durante toda la estancia y se extiende durante un mes más después de haber abandonado la zona. El fármaco más frecuentemente utilizado es la cloroquina. Sin embargo, muchas zonas del mundo tienen especies de Plasmodium falciparum que son resistentes a este fármaco. Otras medicaciones incluyen mefloquina y doxiciclina. Sin embargo, la doxiciclina no puede ser tomada por niños menores de 8 años o mujeres embarazadas.
Ninguna terapia es completamente eficaz a la hora de prevenir la infección. Los turistas que tienen fiebre mientras se encuentran en una zona infestada de malaria deberían ser examinados por un médico de inmediato. El individuo puede comenzar a tomar pirimetamina-sulfadoxina, una combinación de fármacos, por cuenta propia hasta que consiga ayuda médica.
El tratamiento depende del tipo de malaria y de si en la zona geográfica en concreto existen especies de parásitos resistentes a la cloroquina. Para un ataque agudo de malaria por P. falciparum en una zona de la cual se sabe que tiene especies resistentes a la cloroquina, la persona puede tomar quinina o recibir quinidina intravenosa. En otros tipos, la resistencia a la cloroquina es menos frecuente y, en consecuencia, la persona afectada suele tomarla seguida de primaquina.
PEDICULOSIS
Infestación por piojos.
La pediculosis puede afectar a la cabeza (Pediculus humanus capitis), el cuerpo (P. humanus corporis) o la zona genital (Phthirus pubis). Los piojos de la cabeza y del pubis (ladillas) viven directamente en el huésped, mientras que el piojo del cuerpo vive en la ropa. La infestación es masiva en los medios superpoblados o en personas con una mala higiene corporal o sin ropas limpias. Los piojos corporales son vectores importantes de organismos responsables del tifus epidémico, la fiebre de las trincheras y la fiebre recurrente.
SÍNTOMAS, SIGNOS Y DIAGNÓSTICO
El P. humanus capitis se transmite por contacto personal y por objetos como los sombreros y los peines. Cualquiera que sea el nivel social, resulta más frecuente en escolares y menos frecuente en los pacientes de raza negra. Aunque se suele localizar en el cuero cabelludo, puede afectar a las cejas, las pestañas y la barba. El prurito es grave y se pueden producir escoriaciones en el cuero cabelludo, con posible sobreinfección bacteriana secundaria. Son frecuentes las adenopatías posterocervicales de tamaño moderado. En los niños la infestación limitada al cuero cabelludo puede determinar una dermatitis generalizada inespecífica. Se debe explorar el cuero cabelludo, si es posible con una lupa de aumento, y se reconocen las liendres (huevos) -de morfología ovoide, tamaño pequeño y coloración grisácea- fijadas a los pelos, a veces en gran cantidad. A diferencia de la caspa, no se pueden desprender y maduran, llegando al estado de piojo en 3 a 14 d. Los piojos se observan (con menos frecuencia que las liendres) alrededor del occipucio y detrás de las orejas.
El P. humanus corporis es poco frecuente cuando la higiene es buena. Se encuentran con facilidad las liendres y los piojos en la ropa interior porque los piojos habitan en las costuras de la ropa que se lleva pegada a la piel. Las liendres sepueden encontrar en los vellos corporales y en las fibras de la ropa. Siempre se produce prurito.Las lesiones son muy frecuentes en los hombros, las nalgas y el abdomen. La exploración demuestra presencia de puntos rojos pequeños producidos por las picaduras, que se suelen acompañar de marcas lineales por rascado, urticaria o infecciones bacterianas superficiales. Una complicación posible es la forunculosis.
El P. pubis se suele transmitir por vía venérea. Los piojos genitales (ladillas) suelen infectar el vello anogenital, pero pueden afectar otras zonas, sobre todo en las personas con mucho vello. Se debe explorar con cuidado la zona anogenital en busca de piojos, que pueden ser escasos y se parecen a las pequeñas costras de la dermatitis por rascado. A veces se observan los piojos en las pequeñas manchas azuladas de la piel, sobre todo del tronco. Las ladillas suelen estar unidas a la piel en la base del pelo. Un signo de infestación es la presencia de pequeñas manchas pardas oscuras diseminadas (excrementos del piojo) en la ropa interior, en las zonas de contacto con la región anogenital. Se pueden desarrollar con rapidez escoriaciones y dermatitis secundaria, a menudo por automedicación.
PREVENCIÓN Y TRATAMIENTO
La prevención de la pediculosis y la reinfestación incluye la enseñanza de una buena higiene a los niños y los adultos y evitar compartir los peines, cepillos, gorros, bufandas y ropa. En los adultos un comportamiento sexual responsable reduce el riesgo de infestación por ladillas, entre otras infecciones de transmisión sexual.
Igual que en la escabiosis, los miembros de la familia y los contactos sociales próximos deben recibir tratamiento. En la actualidad el tratamiento de elección es la crema de permetrina al 5%, cuya seguridad en el tratamiento de la escabiosis se ha demostrado. En la pediculosis se debe mantener el contacto con el fármaco durante 6 a 12 h antes de aclarar. La permetrina en concentraciones menores no resulta tan eficaz como la crema al 5%. Los piojos y las liendres se puedeneliminar mecánicamente con un peine en la mayoría de los casos. Se está produciendo un aumento en las resistencias a este fármaco. La ivermectina oral (dosis única de 200 mg/kg), que se está usando de modo experimental, ha resultado eficaz.
La tasa de fracasos con lindane (hexacloruro de g-benceno) y su neurotoxicidad siguen constituyendo un problema. La loción de malatión al 0,5%, un pediculicida eficaz, no se ha comercializado en Estados Unidos durante unos años. Los champús queratolíticos que contienen ácido salicílico pueden ayudar en el tratamiento de la pediculosis de la cabeza.
La infestación de los párpados y las pestañas puede ser más difícil de tratar; en general hay que eliminar los piojos con pinzas. Las aplicaciones de vaselina pueden matar o debilitar a los piojosde las pestañas. Se deben descontaminar las fuentes de infestación (peines, gorras, ropa de cama y de vestir) con aspiradora, lavado y planchado a presión o limpieza en seco. Las recaídas son frecuentes.
AMEBIASIS
| Amebiasis |
|
|
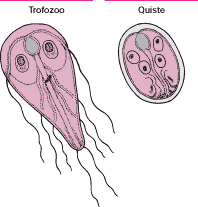
La amebiasis es una infección del intestino grueso causada por la Entamoeba histolytica, un parásito unicelular.
La Entamoeba histolytica existe en dos formas durante su ciclo de vida: el parásito activo (trofozoito) y el parásito inactivo (quiste). Los trofozoitos viven entre el contenido intestinal y se alimentan de bacterias o bien de la pared del intestino. Cuando se inicia la infección, los trofozoitos pueden causar diarrea, lo cual hace que salgan fuera del cuerpo. Una vez fuera, los frágiles trofozoitos mueren. Cuando el enfermo no tiene diarrea, suelen convertirse en quistes antes de abandonar el intestino. Los quistes son muy resistentes y pueden diseminarse tanto directamente de persona a persona, como indirectamente a través de los alimentos o el agua.
La transmisión directa se produce a través del contacto con heces infectadas. Es más probable que la amebiasis se propague entre los que viven en instituciones y tienen una higiene incorrecta que entre los que no viven de ese modo; también se hace más probable su contagio por contacto sexual, particularmente entre varones homosexuales, más que por un contacto eventual o fortuito. La transmisión indirecta de los quistes es más frecuente en las zonas con malas condiciones sanitarias, como los campos de trabajo no permanentes. Las frutas y verduras pueden contaminarse cuando crecen en tierra fertilizada con abono humano, se lavan con agua contaminada o las prepara alguien que está infectado.
SÍNTOMAS
Generalmente, los infectados, en particular los que viven en climas templados, no presentan síntomas. En ciertos casos, los síntomas son tan leves que casi pasan desapercibidos. Pueden consistir en diarrea y estreñimiento intermitentes, una mayor cantidad de gas (flatulencia) y retortijones abdominales. El abdomen puede ser doloroso al tacto y es posible que las heces contengan moco y sangre. Puede haber poca fiebre. Entre un ataque y otro, los síntomas disminuyen hasta limitarse a retortijones recurrentes y heces líquidas o muy blandas. El adelgazamiento (emaciación) y la anemia son muy frecuentes.
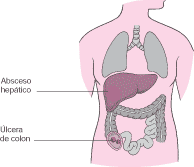
Cuando los trofozoitos invaden la pared intestinal es posible que se forme un gran bulto en la misma (ameboma) que puede obstruir el intestino y ser confundido con un cáncer. En ocasiones, los trofozoitos dan lugar a una perforación intestinal. La liberación del contenido intestinal dentro de la cavidad abdominal causa un gran dolor en la zona además de infección (peritonitis), la cual requiere atención quirúrgica inmediata.
La invasión por parte de los trofozoitos del apéndice y el intestino que lo rodea puede provocar una forma leve de apendicitis. Durante la cirugía de apendicitis se pueden esparcir por todo el abdomen. En consecuencia, la operación puede ser retrasada entre 48 y 72 horas con el fin de eliminar los trofozoitos mediante un tratamiento con fármacos.
En el hígado puede formarse un absceso lleno de trofozoítos. Los síntomas consisten en dolor o malestar en la zona que se encuentra por encima del hígado, fiebre intermitente, sudores, escalofríos, náuseas, vómitos, debilidad, pérdida de peso y ocasionalmente ictericia leve.
En ciertos casos, los trofozoitos se diseminan a través del flujo sanguíneo, causando infección en los pulmones, el cerebro y otros órganos. La piel también resulta infectada en ocasiones, especialmente alrededor de las nalgas y los genitales, al igual que las heridas causadas por cirugía o por lesiones.
DIAGNÓSTICO
La amebiasis se diagnostica en el laboratorio examinando las heces de un individuo infectado; para establecer el diagnóstico suele ser necesario analizar entre 3 y 6 muestras. Para observar el interior del recto y obtener una muestra de tejido de cualquier úlcera que se encuentre puede utilizarse un rectoscopio (tubo flexible de visualización).
Los enfermos con un absceso hepático casi siempre tienen en la sangre valores elevados de anticuerpos contra el parásito. Sin embargo, como estos anticuerpos pueden permanecer en el flujo sanguíneo durante meses o años, el hallazgo de valores elevados de anticuerpos no necesariamente indica que exista un absceso. En consecuencia, si el médico piensa que se ha formado un absceso, puede prescribir un fármaco que elimine las amebas (un amebicida). Si el fármaco resulta eficaz, se da por sentado que la amebiasis era el diagnóstico correcto.
TRATAMIENTO
Varios fármacos amebicidas que se ingieren por vía oral (como el iodoquinol, la paromomicina y la diloxanida) eliminan los parásitos del intestino. Para los casos graves y en las infecciones localizadas fuera del intestino se administra metronidazol o deshidroemetina. Las muestras de heces se vuelven a examinar al cabo de 1, 3 y 6 meses después del tratamiento para asegurarse de que el enfermo está curado.
GIARDIASIS
| Giardia lamblia: parásito intestinal |
|
|
La giardiasis es una infección del intestino delgado causada por Giardia lamblia, un parásito unicelular.
La giardiasis ocurre en todo el mundo y es especialmente frecuente entre los niños y en sitios en que las condiciones sanitarias son deficientes. En algunos países desarrollados, la giardiasis es una de las infecciones parasitarias intestinales más frecuentes. Es más frecuente entre los varones homosexuales y en quienes han viajado a países en vías de desarrollo. También es más frecuente entre las personas que tienen un bajo contenido ácido en el estómago, en aquellas a las que se les ha extirpado quirúrgicamente, en quienes padecen pancreatitis crónica y en las personas cuyo sistema inmunitario es deficiente.
El parásito se transmite de una persona a otra mediante quistes que se eliminan por las heces. La transmisión puede producirse directamente entre niños o parejas sexuales, o bien de forma indirecta, a través de alimentos o agua contaminados.
SÍNTOMAS Y DIAGNÓSTICO
Los síntomas, que suelen ser leves, incluyen náuseas intermitentes, eructos, una mayor cantidad de gas (flatulencia), molestias abdominales, heces voluminosas y con mal olor, y diarrea. Si la afección es grave, es posible que el enfermo no consiga absorber los nutrientes más importantes de los alimentos y como resultado pierde mucho peso. Se desconoce el motivo por el cual la giardiasis interfiere con la absorción de nutrientes
Los síntomas orientan al médico hacia el diagnóstico. Éste se confirma mediante los análisis de laboratorio que revelan la presencia del parásito en las heces o en las secreciones del duodeno. Debido a que las personas que han sido infectadas durante mucho tiempo tienden a excretar los parásitos a intervalos impredecibles, puede ser necesario realizar exámenes seriados de las heces.
TRATAMIENTO
La quinacrina por vía oral es muy eficaz contra la giardiasis. Sin embargo, puede causar malestar gastrointestinal y, en muy raras ocasiones, puede inducir un comportamiento extremadamente anormal (psicosis tóxica). El metronidazol también es eficaz y tiene menos efectos colaterales, pero en algunos países no está aprobado como tratamiento de la giardiasis. La furazolidona es menos eficaz que la quinacrina o el metronidazol, pero como se presenta en forma líquida, puede administrarse a los niños. Las mujeres embarazadas pueden ser tratadas con paromomicina, pero sólo si los síntomas son graves.
Los individuos que viven con un enfermo afectado o que han mantenido contacto sexual con dicha persona deberían consultar a un médico para realizarse un análisis y, si es necesario, iniciar un tratamiento.
HERPES SIMPLE
La infección causada por herpes simple produce episodios recurrentes de vesículas pequeñas y dolorosas, llenas de líquido, sobre la piel o las membranas mucosas.
El herpes simple produce una erupción sobre la piel o las membranas mucosas. La misma erupción desaparece, pero el virus se mantiene en un estado inactivo (latente) dentro de los ganglios (una agrupación de células nerviosas) que proporcionan la sensibilidad de la zona infectada. Periódicamente el mismo herpes se reactiva y comienza a replicarse, causando erupciones cutáneas con vesículas, que se localizan en el mismo sitio que la aparición anterior. Sin embargo, éste puede estar presente en la piel sin causar ninguna vesícula evidente; el virus en ese estado puede ser una fuente de contagio para otras personas. Las erupciones pueden comenzar a raíz de una sobreexposición a la luz solar o bien por un estado febril, el estrés físico o emocional, la supresión del sistema inmunitario, o por la toma de ciertos alimentos o medicamentos, si bien, por lo general, se desconocen los factores que las desencadenan.
Los dos tipos de virus herpes simple que infectan la piel son VHS-1 y VHS-2. El VHS-1 es el que produce la formación de vesículas sobre los labios (herpes labial) y úlceras en la córnea del ojo (queratitis por herpes simple). Por lo general se transmite por contacto con secreciones de la boca o sus alrededores. El VHS-2 suele causar herpes genital y es transmitido principalmente por contacto directo con las vesículas, casi siempre durante una relación sexual.
SÍNTOMAS Y COMPLICACIONES
La recurrencia de herpes simple se presiente por la aparición de un hormigueo, malestar o picor, que precede a la formación de vesículas en varias horas o hasta 2 o 3 días. Sobre cualquier parte de la piel o las membranas mucosas pueden formarse vesículas rodeadas de un borde rojizo, si bien por lo general se forman en la boca o a su alrededor, en los labios y los genitales. Las vesículas (que pueden ser dolorosas) tienden a unirse, hasta el punto de conformar una única zona afectada. Tras unos días, las mismas comienzan a secarse y forman una delgada costra amarillenta y úlceras superficiales. La curación suele comenzar una o dos semanas después de su aparición y por lo general se completa en 21 días. Sin embargo, las vesículas formadas en zona húmedas del cuerpo pueden tardar más en curarse. Puede producirse cicatrización si las erupciones siguen desarrollándose en el mismo lugar o bien si aparece una infección bacteriana secundaria.
La primera infección causada por herpes en los niños puede provocar llagas dolorosas e inflamación en la boca y las encías (gingivoestomatitis) o bien una dolorosa inflamación de la vulva y la vagina (vulvovaginitis). Estos procesos también causan irritabilidad, pérdida del apetito y fiebre. En los niños pequeños y con menos frecuencia en los de mayor edad, la afección puede propagarse por la sangre y afectar a órganos internos, como el cerebro (una infección que puede ser mortal).
Una mujer que haya tenido una infección con VHS 2 puede trasmitirla a su feto, especialmente si lo ha contraído durante los tres últimos meses de embarazo. El herpes simple en un feto causa desde una leve inflamación de la membrana que rodea el cerebro (meningitis), hasta en ocasiones una inflamación intensa del tejido cerebral (encefalitis).
Si los niños o adultos afectados por una enfermedad cutánea llamada eccema atópico se infectan con el virus herpes simple, en ocasiones desarrollan una enfermedad potencialmente mortal llamada eccema herpético. Por consiguiente, los afectados de eccema atópico deberían evitar estar cerca de una persona con una infección herpética activa. En los enfermos de SIDA, las infecciones herpéticas de la piel pueden ser particularmente graves y persistentes. Estas personas también presentan con mayor frecuencia inflamación del esófago y del intestino, úlceras alrededor del ano, neumonía o anomalías nerviosas.
Cuando el herpes simple penetra a través de una lesión de la piel del dedo, se produce una inflamación dolorosa y rojiza de la punta del mismo que recibe el nombre de panadizo herpético. Suele aparecer frecuentemente en los trabajadores sanitarios que nunca han tenido herpes simple y entran en contacto con fluidos corporales que lo contienen.
DIAGNÓSTICO
El herpes simple suele ser difícil de reconocer. Puede ser confundido con una reacción alérgica, otras infecciones víricas o incluso una reacción cutánea medicamentosa. La localización de las vesículas en la superficie corporal puede ayudar a establecer el diagnóstico.
Si el médico sospecha que alguien está afectado de herpes simple puede examinar una muestra de sus vesículas al microscopio. En el caso de una infección por dicho virus, en las muestras aparecerán grandes células infectadas. Los cultivos del virus, los análisis de sangre que comprueban si ha aumentado el número de anticuerpos y las biopsias pueden confirmar el diagnóstico. De todos modos, rara vez se necesita acudir a estas pruebas. Es posible establecer un diagnóstico en un estadio muy precoz, usando nuevas técnicas tales como la reacción en cadena de la polimerasa, que puede ser utilizada para identificar el ADN del virus en un tejido o humor corporal.
TRATAMIENTO
Generalmente, el único tratamiento necesario para el herpes labial es mantener limpia la zona afectada lavándola suavemente con agua y jabón. A continuación es necesario secar el área por completo; si las vesículas quedan húmedas la inflamación puede empeorar, la curación se retrasa y posiblemente favorezca la sobreinfección bacteriana. Para evitarla o tratarla, puede aplicarse sobre la piel una pomada con un antibiótico como la neomicina-bacitracina. Si aumenta cada vez más la infección bacteriana o bien está provocando síntomas adicionales, se pueden administrar antibióticos por vía oral o mediante inyección intramuscular.
Las cremas antivíricas como la idoxuridina, la trifluridina y el aciclovir suelen ser eficaces si se aplican directamente sobre las vesículas. El aciclovir o la vidarabina, ingeridos por vía oral, pueden ser utilizados para las infecciones herpéticas graves que afectan a todo el organismo. En ocasiones se agrega aciclovir por vía oral a diario para evitar que se repitan las erupciones, particularmente cuando los genitales han resultado afectados. En los casos de queratitis herpética simple o herpes genital es posible que se necesiten medidas específicas de tratamiento.
MONONUCLEOSIS INFECCIOSA
La mononucleosis infecciosa es una enfermedad caracterizada por fiebre, dolor de garganta y agrandamiento de los ganglios linfáticos, causada por el virus de Epstein-Barr, un herpesvirus.
| Ganglios linfáticos cervicales |
|
|
Después de invadir las células que recubren la nariz y la garganta, el virus de Epstein-Barr alcanza los linfocitos B (glóbulos blancos responsables de la producción de anticuerpos). La infección causada por este virus es muy frecuente y afecta a niños, adolescentes y adultos por igual. Alrededor del 50 por ciento de los niños ha sufrido una infección por el virus de Epstein-Barr antes de los 5 años de edad. Sin embargo, no es muy contagioso. Los adolescentes y los adultos jóvenes suelen contraer mononucleosis infecciosa al besarse o tener otro contacto íntimo con alguien ya infectado.
El virus de Epstein-Barr se ha relacionado con el linfoma de Burkitt, un tipo de cáncer que aparece principalmente en el África tropical. También puede influir en el desarrollo de ciertos tumores de los linfocitos B que afectan a las personas inmunodeprimidas (como las sometidas a trasplantes de órganos o las que padecen SIDA) y en algunos cánceres de nariz y garganta. A pesar de que no se sabe cuál es el papel que desempeña el virus en estos cánceres, se cree que partes específicas del material genético del mismo alteran el ciclo de crecimiento de las células infectadas.
SÍNTOMAS Y COMPLICACIONES
En los niños menores de 5 años, la infección, habitualmente, no produce sintomatología. En adolescentes y adultos puede producirlos o no. Se cree que el tiempo transcurrido entre la infección y la aparición de los síntomas (periodo de incubación) es de 30 a 50 días.
Los cuatro síntomas más importantes son cansancio, fiebre, dolor de garganta e inflamación de los ganglios linfáticos. No todas los afectados presentan el cuadro completo. Por lo general, la infección comienza con una sensación de malestar que dura varios días o semanas. Luego, aparecen la fiebre, el dolor de garganta y el agrandamiento de los ganglios linfáticos. La temperatura suele subir aproximadamente hasta 39,5 °C por la tarde o al comenzar de la noche. La garganta puede doler mucho y en la parte posterior de la misma en ocasiones se forma un material similar al pus. Cualquier ganglio linfático aumenta de tamaño, pero los del cuello lo hacen mas frecuentemente. El cansancio suele ser más intenso en las 2 o 3 primeras semanas.
En más del 50 por ciento de los que padecen mononucleosis infecciosa el bazo aumenta de tamaño. El hígado puede hacerlo ligeramente. Con menor frecuencia, pueden producirse ictericia y edema alrededor de los ojos. Las erupciones cutáneas no son frecuentes, pero en un estudio, los infectados por el virus de Epstein-Barr que recibieron el antibiótico ampicilina, generalmente, las desarrollan. Otras complicaciones incluyen inflamación del tejido cerebral (encefalitis), convulsiones, alteraciones nerviosas, inflamación del revestimiento cerebral (meningitis) y anomalías del comportamiento.
El bazo es más susceptible a las lesiones y complicaciones, como la rotura del mismo. Si ésta se produce, es necesario extirparlo quirúrgicamente. El número de glóbulos blancos suele aumentar, pero también puede descender, igual que las plaquetas y los glóbulos rojos. Por lo general vuelven a la normalidad sin tratamiento. En raras ocasiones, los ganglios linfáticos agrandados del cuello presionan las vías respiratorias. Como consecuencia se desarrolla una cierta congestión pulmonar pero que no suele producir síntomas.
DIAGNÓSTICO
El diagnóstico se basa en la sintomatología. Sin embargo, los síntomas no son específicos y semejan a los de otras infecciones. Por ejemplo, la infección por citomegalovirus provoca un síndrome que resulta difícil de distinguir de la mononucleosis infecciosa. Otros virus y la toxoplasmosis también pueden generar síntomas similares, así como también determinados efectos secundarios de algunos fármacos y ciertas enfermedades no infecciosas.
Un análisis de sangre confirma, en ocasiones, el diagnóstico de mononucleosis infecciosa al detectar anticuerpos contra el virus de Epstein-Barr. El organismo produce nuevos linfocitos B para eliminar los que ya están infectados. Estos tienen un aspecto característico y aparecen en grandes cantidades en la sangre de las personas con la enfermedad. La infección estreptocócica de la faringe, que puede parecerse a la mononucleosis infecciosa, suele ser identificada mediante un cultivo de faringe y debe tratarse con antibióticos para evitar los abscesos y reducir la probabilidad de contraer fiebre reumática.
PRONÓSTICO Y TRATAMIENTO
Los afectados con mononucleosis infecciosa, generalmente, se recuperan por completo. La duración de la enfermedad varía. La fase aguda dura aproximadamente 2 semanas y, tras ella, la mayoría consigue reanudar sus actividades habituales. Sin embargo, el cansancio puede persistir durante varias semanas y en ocasiones algunos meses.
Rara vez (en menos del uno por ciento de las infecciones) una persona con mononucleosis infecciosa puede fallecer. La muerte se debe a complicaciones, como la inflamación del cerebro, la rotura del bazo o la obstrucción de las vías respiratorias; además, una mala evolución es particularmente posible en inmunodeprimidos.
Se recomienda que las personas afectadas de mononucleosis infecciosa guarden reposo hasta que desaparezcan la fiebre, el dolor de garganta y la sensación de malestar. Debido al riesgo de que el bazo se rompa, deben evitarse los deportes de contacto o los que supongan levantar grandes pesos durante un período de 6 a 8 semanas, aunque el mismo no haya aumentado de tamaño.
Para la fiebre y el dolor se administra paracetamol (acetaminofén) o aspirina. Sin embargo, ésta debe evitarse en los niños debido a la posibilidad de que contraigan síndrome de Reye, que puede resultar mortal. Algunas complicaciones, como la inflamación de las vías respiratorias, se pueden tratar con corticosteroides. A pesar de que el aciclovir reduce la producción de virus de Epstein-Barr, tiene poco efecto sobre los síntomas de mononucleosis infecciosa.
RABIA
La rabia es una infección vírica del tejido cerebral que causa irritación e inflamación de éste y de la médula espinal.
El virus de la rabia está presente en la saliva de los animales infectados. Un animal con rabia transmite la infección a otros animales o a los humanos al morderles o, en ocasiones, con el lamido. Desde el punto de inoculación inicial el virus se desplaza a través de los nervios hasta la médula espinal y el cerebro, donde se multiplica. A continuación desciende por los nervios hacia las glándulas salivales, donde se instala.
Diferentes animales pueden trasmitir la rabia a los humanos. Aun cuando la fuente habitual de infección de los humanos son los perros, también los gatos, los murciélagos, los mapaches, las mofetas, los zorros y otros animales pueden ser responsables del contagio. No es frecuente que los ratones, las ratas u otros mamíferos pequeños transmitan la rabia, en parte porque la mordedura de otro animal suele resultarles mortal. En los países desarrollados, la vacunación ha eliminado en gran medida la rabia en los perros. Sin embargo, sigue siendo bastante frecuente en la mayoría de los países de América Latina, África y Asia, donde las mascotas no siempre están vacunadas contra dicha enfermedad. Los animales infectados pueden tener rabia furiosa o muda. En la rabia furiosa, el animal está agitado y presenta conducta anormal; posteriormente queda paralizado y muere. En la rabia muda, la parálisis localizada o generalizada es lo que predomina desde el comienzo.
Actualmente, en los países desarrollados, la mayor parte de los casos de rabia humana suelen ser causadas por mordeduras de animales salvajes infectados. Dichos animales pueden tener un comportamiento furioso, pero es más probable que presenten cambios de comportamiento menos obvios. Los de hábito nocturno (murciélagos, mofetas, mapaches y zorros) infectados por la rabia pueden salir durante el día y no demostrar el miedo habitual ante los humanos.
A pesar de que resulta extremadamente raro, la rabia puede contraerse respirando aire infectado. Se ha descrito el desarrollo de dos casos entre unos exploradores que respiraron el aire de una cueva infestada de murciélagos.
SÍNTOMAS
La sintomatología suele comenzar entre 30 y 50 días después del contagio, pero el período de incubación varía de 10 días a más de un año. Dicho período suele ser más corto en las víctimas de mordiscos en la cabeza o el tronco o en quienes sufren muchas mordeduras.
En el 20 por ciento de los casos, la rabia se inicia con parálisis en las piernas, que se va extendiendo hacia el resto del cuerpo. Sin embargo, la enfermedad suele comenzar con un corto período de depresión mental, inquietud, sensación de malestar y fiebre. La inquietud se convierte en una agitación incontrolada y el enfermo produce gran cantidad de saliva. Los espasmos musculares de la garganta y del área vocal suelen ser terriblemente dolorosos. Estos espasmos son causados por la irritabilidad del área cerebral responsable de las acciones de tragar y respirar. Una brisa ligera o el simple intento de beber agua pueden inducir dichos espasmos. En consecuencia, una persona que padece rabia no puede beber y, por este motivo, la enfermedad suele recibir el nombre de hidrofobia (miedo al agua).
DIAGNÓSTICO
Cuando alguien es mordido por un animal enfermo o salvaje, la mayor preocupación debe ser la posibilidad de que tuviese rabia. Para determinar si se trata de un animal rabioso suele ser necesario realizar un examen de una muestra de tejido cerebral. Para ello, el animal debe ser capturado y observado. En realidad, debería ser sacrificado para examinarle el cerebro. Si al cabo de este tiempo un perro o un gato sin síntomas muerde a una persona, puede ser confinado y examinado por un veterinario durante 10 días. Si el animal sigue sano, se puede llegar a la conclusión de que no tenía rabia en el momento de la mordedura.
Si un individuo que ha sido mordido por un animal desarrolla síntomas de inflamación cerebral progresiva (encefalitis), es probable que la causa sea la rabia. No sirve de nada hacer una prueba para detectar el virus hasta que no aparecen síntomas. Una biopsia cutánea, mediante la cual se toma una muestra de piel (generalmente del cuello) para examinarla al microscopio, puede revelar la presencia del virus.
PREVENCIÓN Y TRATAMIENTO
Para prevenir la rabia se deben tomar ciertas medidas antes de la exposición al virus o bien inmediatamente después de la misma. Por ejemplo, se puede aplicar una vacuna a quienes tienen un alto riesgo de estar expuestos al virus. Entre estas personas se encuentran los veterinarios, los técnicos de laboratorio que manipulan animales potencialmente infectados, los que viven o permanecen más de 30 días en países en vías de desarrollo en los que la rabia canina es muy frecuente y los que se dedican a explorar cuevas de murciélagos. La vacunación brinda cierto grado de protección a casi toda la gente durante el resto de su vida. Sin embargo, los valores de anticuerpos descienden con el paso del tiempo y las personas con elevado riesgo de seguir expuestas deberían recibir una dosis de refuerzo cada 2 años.
Los individuos que hayan sido mordidos por un animal rabioso rara vez desarrollan la enfermedad si se toman medidas preventivas de inmediato. Los mordidos por conejos y roedores (incluyendo ardillas, ardillas rayadas, ratas y ratones) no necesitan tratamiento ulterior a menos que exista una fuerte sospecha de rabia; estos animales rara vez están infectados. Sin embargo, quienes hayan sido mordidos por animales salvajes como las mofetas, los mapaches, los zorros y los murciélagos necesitan tratamiento a menos que el animal pueda ser capturado y se demuestre que no tiene rabia.
La mejor medida de prevención es tratar de inmediato una herida producida por la mordedura de un animal. La zona contaminada se limpia completamente con jabón. Las heridas profundas se lavan con agua jabonosa. Una vez limpias las heridas, las personas que no han sido inmunizadas previamente con la vacuna contra la rabia reciben una inyección de inmunoglobulina contra ésta, aplicando la mitad de la dosis en el área del mordisco. También se les inyecta la vacuna contra la rabia el mismo día de la exposición al virus y los días 3, 7, 14 y 28. El dolor y la inflamación de la zona de la inyección suelen ser poco importantes. Es raro que se produzcan reacciones alérgicas graves durante la serie de cinco inyecciones; menos del uno por ciento de los vacunados desarrolla fiebre tras haberla recibido.
En alguien mordido que ya ha sido vacunado con anterioridad, el riesgo de contraer rabia es menor, pero aun así es fundamental limpiar la herida de inmediato y aplicar dos dosis de la vacuna (los días 0 y 2).
Antes de que se contara con la terapia que existe en la actualidad, la persona que padecía rabia fallecía al cabo de 3 a 10 días de haberla contraído. La mayoría moría a causa de una obstrucción en las vías respiratorias (asfixia), convulsiones, agotamiento o parálisis generalizada. A pesar de que en el pasado se consideraba que la muerte por rabia era inevitable, unos pocos sobrevivían. En esos casos la supervivencia se puede atribuir al cuidado intensivo para controlar los síntomas que afectaban a los pulmones, al corazón y al cerebro. Una vez que los síntomas han aparecido, ninguna vacuna ni inmunoglobulina contra la rabia parece tener efecto.
Descargar
| Enviado por: | Vicentita |
| Idioma: | castellano |
| País: | México |