Química
Obtención de éster y saponificación
LABORATORIO QUÍMICO
OBTENCIÓN DE ÉSTERES Y SAPONIFICACIÓN
Introducción:
A través del presente trabajo de laboratorio podremos ver en vivo y en directo la reacción de saponificación que es la reacción por medio del cual se genera el jabón, un elemento tan esencial en nuestras vidas, tendremos que comprobar que tiene la propiedad de limpiador y esto lo podremos verificar cuando le salga espuma al ser frotado con el agua.
A demás presenciaremos la evolución de un ácido carboxílico que reaccionará con diversos productos para formar un éster. Conoceremos las propiedades de los ésteres y su utilización.
I- Síntesis Experimental de un Éster
Materiales:
-
125 grs de mantequilla
-
Etanol
-
Hidróxido de sodio
-
Ácido sulfúrico
-
Hielo
La esterificación de Fisher consiste en la reacción entre un ácido carboxílico y un alcohol la cual transcurre en una reacción no muy favorecida a los productos y debido a la poca reactividad agregándole catalizadores ácidos se puede acelerar la velocidad de reacción. La reacción general sigue del siguiente esquema:
a) Reacción de Formación de Éster
1) CH3CH2CH2COOH + CH3CH2OH CH3CH2CH2COOCH2CH3 + H2O
El ácido butanoico reacciona con el etanol, generando un éster y agua, el agua se forma porque se sale el grupo OH del etanol y reacciona con un hidrógeno que sale del ácido butanoico generando el H2O.
2) CH3CH2CH2COOCH2CH3 + H2O + NaOH + H2SO4
El hidróxido de sodio sirve para neutralizar el acido sulfúrico que sirve como catalizador, porque se necesita de un medio ácido para que funcione la reacción.
b) El nombre del compuesto es “Butirato de Etilo”
c) Olor muy agradable, buen disolvente, puede formar puentes de hidrógenos, se puede ocupar como combustible biológico o biodiesel
d) Tiene olor a piña, son utilizados como saborizantes y aromático.
f) El ácido sulfúrico funciona como catalizador de la esterificación, ya que se necesita un ácido duro para poder romper los enlaces del hidrogeno y oxígeno.
II- PREPARACIÓN DE UN JABÓN

Materiales
-
aceite común (ojala de oliva)
-
hidróxido de sodio
-
vaso pp. 100 y 250 ml.
-
Varilla de vidrio
-
Probeta de 50 ml.
-
Cucharita de plástico
-
Mechero
-
Cloruro de sodio
-
Etanol
Procedimiento
Pusimos los 20 cm3 de aceite en un vaso pp. De 100 ml. Luego le agregamos 12 ml de etanol y cm3 de disolución de hidróxido de sodio. Pusimos el vaso de 100 ml. En el de 250 ml. Y lo calentamos a baño María, agitando fuertemente la mezcla. Lo calentamos durante bastante tiempo. A la vez hicimos una solución caliente y saturada de NaCl. Finalmente, mientras estaba caliente, vertimos las dos mezclas en un vaso pp., para así tener el jabón listo al día siguiente.
Análisis y aplicación
¿Con qué motivo se agrega etanol a la mezcla de aceite e hidróxido?
El etanol es agregado a la mezcla para así lograr que esta adquiera un aspecto compacto y homogéneo. De esta forma logramos obtener un sistema homogéneo, logrado cuando agregamos esta sustancia y agitamos fuertemente, durante bastante rato la mezcla. También podemos decir que gracias a esta sustancia hizo que la reacción se verifica más rápidamente gracias al etanol o también llamado alcohol etílico
¿Cuál es la función del NaCl una vez formado el jabón?, ¿Cuál es la función del “Salado”?
El salado consiste en el momento en que agregamos la solución concentrada de sal común (NaCl o cloruro de sodio) para separar el jabón de la glicerina formada y del exceso de hidróxido de sodio. Como el jabón es insoluble en el agua salada, se acumula en forma de grumos y sube a la superficie por su menor densidad, lo cual debió ocurrir mientras dejamos la mezcla en reposo durante la noche. En resumen Se agrega una solución de sal común (NaCl) para que el jabón se separe y quede flotando sobre la solución acuosa.
Escribir la reacción química (general) de la actividad realizada
Los jabones se preparan por medio de una de las reacciones químicas más conocidas: la llamada saponificación de aceites y grasas.
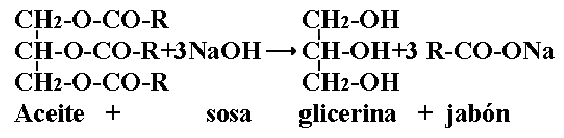
¿Qué otros ingredientes se pueden agregar al jabón?, ¿con que fin?
Para obtener diferentes cualidades en la obtención del jabón podemos agregarles diferentes ingredientes como perfumes, preservativos, pigmentos o colorantes. Como preservativos del jabón, pueden usarse antioxidantes. Los tintes o pigmentos que se utilizan en la fabricación del jabón para colorearlo. Dependiendo de si estás fabricando un jabón de proceso en frío o caliente o de si es un jabón moldeable de glicerina, el color se añadirá a mitad del proceso, en el primer caso, o al final del mismo en el caso del jabón moldeable. Algunos tipos de jabones según los ingredientes agregados son por ejemplo:
- Jabón de zarzamora suave: Ofrece el aspecto del ante azul blando y, si añades más polvos de azul de ultramar, obtienes una réplica del lapislázuli. Evita la tentación de añadir demasiado colorante a los jabones porque se acaban manchando las toallas o quedando cercos azules por todo el cuarto de baño.
- Jabón melocotón Melba: Cremoso jabón, tiene una embriagadora fragancia de melocotón y geranio y las cualidades suaves y sedosas de la glicerina y del aceite de semilla de albaricoque.
- Jabón de Eucalipto: Refrescante y antiséptico
- Jabón de lodo termal: ayuda a limpiar y nutrir la piel
El jabón todavía tiene restos de álcalis (base), como poder demostrarlo
En la mayor parte de los jabones se utiliza el NaOH como álcali saponificador o neutralizante. Los Álcalis son necesarios para saponificar aceites, grasas o ceras. La adición de los álcalis saponifica las grasas más saturadas y forma grumos de jabón fácilmente extraíbles por centrifugación, decantación o filtrado. Los álcalis son compuestos alcalinos o sea es un compuesto muy básico, o sea de un pH bajo. Podemos medir la presencia de álcalis midiendo el pH del jabón.
Nota: con nuestro jabón logramos lavarnos las manos y obtener espuma de este (aunque en poca cantidad), hubiésemos obtenido un mejor jabón separándolo totalmente de los restos que se generaron luego del tiempo de reposo. El jabón es muy suave al tacto, debido a que lleva glicerina que se obtiene como subproducto de la reacción.
Conclusión
Finalizado el experimento y comparando los resultados con los diferentes grupos, podemos deducir que:
*La calidad del aceite afectó el producto, como pudimos ver, al utilizar aceite de oliva ( como lo hizo otro grupo) se obtuvo un jabón mucho más duro en comparación al obtenido con aceite común y corriente, por lo que es recomendable, para experimentos como éste, utilizar de este aceite(oliva).
*Los colores de los experimentos, generalmente amarillos, podrían haber variado de tonalidad, ya sea, por el tiempo en que se mantuvo a baño maría, de la agitación (si fue la adecuada o no) y de lo saturada que estuvieron las disoluciones en el proceso de salado.(Esta conclusión es en comparación al producto del grupo que utilizó los mismo materiales que nosotros).
*El salado es un proceso fundamental en la elaboración de jabón, porque separa el jabón de la glicerina formada y del exceso de hidróxido de sodio. Como el jabón es insoluble en el agua salada, se acumula en forma de grumos y sube a la superficie por su menor densidad. Después de varias horas, se extrae por la parte inferior l y de lo saturada que estuvieron las disoluciones en el proceso de salado.
*El salado es un proceso fundamental en la elaboración de jabón, porque separa el jabón de la glicerina formada y del exceso de hidróxido de sodio. Como el jabón es insoluble en el agua salada, se acumula en forma de grumos y sube a la superficie por su menor densidad. Después de varias horas, se extrae por la parte inferior la mezcla de glicerol y agua salada.
Con respecto al experimento de la formación de ésteres pudimos concluir que:
*La reacción del ácido sulfúrico con el agua eran exotérmicas y se necesitaban de un catalizador (H2SO4) para producir ésteres.
*Estos ésteres generalmente tienen olores a frutas, en nuestro caso fue olor a piña.
*Derivan de los ácidos carboxílicos ( butanoico) y alcoholes (etanol)
*Podemos utilizarlos en variados productos aromáticos como perfumes entre otros, los cuales poseen olores muy agradables.
*Se podrá utilizar como disolvente de determinadas sustancias, gracias a su gran capacidad de disolver.
Descargar
| Enviado por: | Tamara Osses Lama |
| Idioma: | castellano |
| País: | Chile |
