Química
Obtención de cloro-sosa mediante una celda electrolítica con membrana
OBTENCIÓN DE CLORO-SOSA MEDIANTE UNA CELDA CON MEMBRANA.
OBJETIVO
El objetivo de este proyecto consiste en la obtención de cloro y sosa cáustica a partir de cloruro de sodio, en una celda electrolítica con membrana.
FUNDAMENTOS TEÓRICOS.
Se conoce como electroquímica a la parte de la química que trata de la relación entre las corrientes eléctricas y las reacciones químicas, ocupandose de la relación entre las reacciones de óxido-reducción, en las que tiene lugar la transferencia de electrones y la producción y uso de la corriente eléctrica y de la conversión de la energía química en eléctrica y viceversa. En un sentido más amplio, la electroquímica es el estudio de las reacciones químicas que producen efectos eléctricos y de los fenómenos químicos causados por la acción de las corrientes o voltajes.
División: electrólisis (celdas electrolíticas) y celdas electroquímicas (celdas galvánicas).
Electrolitos: soluciones acuosas que conducen la electricidad.
No electrolitos: soluciones que no son descompuestas por la electricidad, no conducen la corriente eléctrica.
Celdas voltaicas o galvánicas: son dispositivos utilizados para transformar la energía química en eléctrica, a la cual se le llama voltaica en honor de su descubridor.
Una pila voltaica consta de dos electrodos que se sumergen en las soluciones de sus iones, de tal modo que las soluciones estén en contacto y debido a la reacción sobre uno de los electrodos, se produce una diferencia de potencial entre las dos placas, es decir, se produce una corriente eléctrica. Ejemplo: de celda galvánica: entre hierro y cobre.
CORRIENTE ELÉCTRICA Y MOVIMIENTO DE IONES
La mayoría de los compuestos inorgánicos y algunos de los orgánicos se ionizan al fundirse o cuando se disuelven en agua u otros líquidos; es decir, sus moléculas se disocian en especies químicas cargadas positiva y negativamente que tienen la propiedad de conducir la corriente eléctrica. Si se coloca un par de electrodos en una disolución de un electrólito (compuesto ionizable) y se conecta una fuente de corriente continua entre ellos, los iones positivos de la disolución se mueven hacia el electrodo negativo y los iones negativos hacia el positivo. Al llegar a los electrodos, los iones pueden ganar o perder electrones y transformarse en átomos neutros o moléculas; la naturaleza de las reacciones del electrodo depende de la diferencia de potencial o voltaje aplicado.
La acción de una corriente sobre un electrólito puede entenderse con un ejemplo sencillo. Si el sulfato de cobre se disuelve en agua, se disocia en iones cobre positivos e iones sulfato negativos. Al aplicar una diferencia de potencial a los electrodos, los iones cobre se mueven hacia el electrodo negativo, se descargan, y se depositan en el electrodo como átomos de cobre. Los iones sulfato, al descargarse en el electrodo positivo, son inestables y se combinan con el agua de la disolución formando ácido sulfúrico y oxígeno. Esta reacción de descomposición producida por una corriente eléctrica se llama electrólisis.
En todos los casos, la cantidad de material que se deposita en cada electrodo al pasar la corriente por un electrólito sigue la ley enunciada por el químico físico británico Michael Faraday. Esta ley afirma que la cantidad de material depositada en cada electrodo es proporcional a la intensidad de la corriente que atraviesa el electrólito, y que las masas de distintos elementos depositados por la misma cantidad de electricidad son directamente proporcionales a las masas equivalentes de los elementos, es decir, a sus masas atómicas divididas por sus valencias.
LEYES DE FARADAY
La electrolisis consiste en la descomposición de una sustancia por el paso de la corriente eléctrica. En un proceso electrolítico ocurre una transformación de energía eléctrica en energía química. Los iones positivos o cationes se dirigen al electrodo negativo (cátodo), al que proporcionan electrones (reducción), y los iones negativos se dirigen al polo positivo (ánodo), al que ceden electrones (oxidación).
1ª. Ley: la cantidad de una sustancia liberada o depositada en un electrodo es proporcional a la cantidad de electricidad que pasa por un electrolito.
m = eQ ( masa = equivalente electroquímico x la cantidad de electricidad (coulombs).
2ª. Ley: las masas de distintos elementos liberados en los electrodos por una misma cantidad de electricidad son directamente proporcionales a sus equivalentes químicos. Esta ley se comprueba conectando en serie varias cubas electrolíticas. Su expresión matemática es :
m1/peso equivalente 1 = m2/peso equivalente 2.
Todos los cambios químicos implican una reagrupación o reajuste de los electrones en las sustancias que reaccionan; por eso puede decirse que dichos cambios son de carácter eléctrico. Para producir una corriente eléctrica a partir de una reacción química, es necesario tener un oxidante, es decir, una sustancia que gane electrones fácilmente, y un reductor, es decir, una sustancia que pierda electrones con facilidad. Las reacciones de este tipo se pueden entender bien con un ejemplo, el funcionamiento de un tipo sencillo de pila electroquímica. Al colocar una varilla de cinc en una disolución diluida de ácido sulfúrico, el cinc, que es un reductor, se oxida fácilmente, pierde electrones y los iones cinc positivos se liberan en la disolución, mientras que los electrones libres se quedan en la varilla de cinc. Si se conecta la varilla por medio de un conductor a un electrodo de metal inerte colocado en la disolución de ácido sulfúrico, los electrones que están en este circuito fluirán hacia la disolución, donde serán atrapados por los iones hidrógeno positivos del ácido diluido. La combinación de iones y electrones produce gas hidrógeno, que aparece como burbujas en la superficie del electrodo. La reacción de la varilla de cinc y el ácido sulfúrico produce así una corriente en el circuito externo. Una pila electroquímica de este tipo se conoce como pila primaria o pila voltaica.
En la batería de acumuladores, o acumulador (conocida comúnmente como pila secundaria), se proporciona energía eléctrica desde una fuente exterior, que se almacena en forma de energía química. La reacción química de una pila secundaria es reversible, es decir, se produce en un sentido cuando se carga la pila, y en sentido opuesto cuando se descarga. Por ello, una pila secundaria puede descargarse una y otra vez.
APLICACIONES INDUSTRIALES
La descomposición electrolítica es la base de un gran número de procesos de extracción y fabricación muy importantes en la industria moderna. El hidróxido de sodio o sosa cáustica (un producto químico importante para la fabricación de papel, rayón y película fotográfica) se produce por la electrólisis de una disolución de sal común en agua (véase Álcalis). La reacción produce cloro y sodio. El sodio reacciona a su vez con el agua de la pila electrolítica produciendo hidróxido de sodio. El cloro obtenido se utiliza en la fabricación de pasta de madera y papel.
Una aplicación industrial importante de la electrólisis es el horno eléctrico, que se utiliza para fabricar aluminio, magnesio y sodio. En este horno, se calienta una carga de sales metálicas hasta que se funde y se ioniza. A continuación, se obtiene el metal electrolíticamente.
Una pila voltaica aprovecha la electricidad de una reacción química espontánea para encender una bombilla (foco). Las tiras de cinc y cobre, dentro de disoluciones de ácido sulfúrico diluido y sulfato de cobre respectivamente, actúan como electrodos. El puente salino (en este caso cloruro de potasio) permite a los electrones fluir entre las cubetas sin que se mezclen las disoluciones. Cuando el circuito entre los dos sistemas se completa (como se muestra a la derecha), la reacción genera una corriente eléctrica. Obsérvese que el metal de la tira de cinc se consume (oxidación) y la tira desaparece. La tira de cobre crece al reaccionar los electrones con la disolución de sulfato de cobre para producir metal adicional (reducción). Si se sustituye la bombilla por una batería la reacción se invertirá, creando una célula electrolítica.
Álcali, sustancia que produce iones hidróxido, OH-, al disolverse en agua. El término procede del árabe al-qili, "cenizas de la planta de almajo", que hacía referencia a los hidróxidos y carbonatos de potasio y sodio, lixiviados de las cenizas de aquella planta. En la actualidad, este término también se aplica a los hidróxidos de amonio (NH4+) y otros metales alcalinos, y a los hidróxidos de calcio, estroncio y bario. Los carbonatos y el hidróxido de amonio sólo proporcionan concentraciones moderadas de iones hidróxido y se llaman álcalis débiles. En cambio, los hidróxidos de sodio y potasio producen iones hidróxido en concentración suficientemente alta para destruir la carne; por esta razón se llaman álcalis cáusticos. Las disoluciones de álcalis colorean de azul el tornasol rojo, neutralizan los ácidos, tienen un tacto jabonoso y son conductores eléctricos.
El hidróxido de sodio (sosa cáustica), NaOH, es un producto comercial importante que se usa para hacer jabón, rayón y celofán. También se emplea para procesar pasta de papel, en las refinerías de petróleo, y para obtener otros productos químicos. Se fabrica principalmente por medio de la electrólisis de una disolución de sal común, dando lugar a hidrógeno y cloro como subproductos importantes.
El carbonato de sodio, Na2CO3, cuyas disoluciones son álcalis débiles por hidrólisis, se obtiene de depósitos naturales o a partir de disoluciones de sal común por el proceso Solvay. Se usa para fabricar vidrio, como agente de limpieza y para ablandar el agua.
En la actualidad, el término álcali está siendo sustituido por el de base.
ELECTROLISIS DE UNA DISOLUCIÓN ACUOSA DE NaCl:
En ésta electrólisis las disoluciones acuosas de cloruro de sodio (salmuera) contienen varias especies susceptibles de ser oxidadas o reducidas, las reacciones de oxidación que pueden ocurrir en el ánodo son:
Las posibles reducciones que pueden ocurrir en el cátodo son:
Reacción global:
La concentración de los iones de cloro disminuye durante la electrolisis y la de los iones OH aumenta. Por lo tanto, además del H2 y del Cl2 el NaOH puede obtenerse como subproducto útil por evaporación de la disolución acuosa al final de la electrolisis.
Los productos principales obtenidos son el cloro y el hidroxido de sodio.
CLORO.
De símbolo Cl, el cloro es un elemento gaseoso amarillo verdoso. Pertenece al grupo 17 (o VIIA) del sistema periódico, y es uno de los halógenos. Su número atómico es 17.
El cloro elemental fue aislado por vez primera en 1774 por el químico sueco Carl Wilhelm Scheele, quien creía que el gas era un compuesto; no fue hasta 1810 cuando el químico británico sir Humphry Davy demostró que el cloro era un elemento y le dio su nombre actual.
A temperatura ordinaria, es un gas amarillo verdoso que puede licuarse fácilmente bajo una presión de 6,8 atmósferas a 20 ºC. El gas tiene un olor irritante, y muy concentrado es peligroso; fue la primera sustancia utilizada como gas venenoso en la I Guerra Mundial
Es extremadamente reactivo, por lo que en la naturaleza no lo encontramos en estado puro sino combinado, formando mayoritariamente sales metálicas, de las cuales la más abundante es el cloruro sódico. El 0, 045 % de la corteza terrestre está compuesta por combinaciones de cloro, que representa el 2,9 % de los océanos. Ocupa el lugar 20 en abundancia en la corteza terrestre. El cloro tiene un punto de fusión de -101 ºC, un punto de ebullición de -34,05 ºC a una atmósfera de presión, y una densidad relativa de 1,41 a -35 ºC; la masa atómica del elemento es 35,453.
El cloro es un elemento activo, que reacciona con agua, con compuestos orgánicos y con varios metales. Se han obtenido cuatro óxidos: Cl2O, ClO2, Cl2O6 y Cl2O7. El cloro no arde en el aire, pero refuerza la combustión de muchas sustancias; una vela ordinaria de parafina, por ejemplo, arde en cloro con una llama humeante. El cloro y el hidrógeno pueden mantenerse juntos en la oscuridad, pero reaccionan explosivamente en presencia de la luz. Las disoluciones de cloro en agua son comunes en los hogares como agentes blanqueadores.
Precisamente, dicha reactividad, juntamente con sus características particulares (elevado poder oxidante, abundante, económico), lo convierten en una sustancia de un interés técnico y económico extraordinario, que en numerosos casos es insustituible o bien de muy difícil sustitución. No olvidemos que todo proceso alternativo debería cumplir las condiciones siguientes:
- técnicamente realizable
- viable económicamente
- menor impacto medioambiental
Ello no es posible en muchos casos.
La mayor parte del cloro es producida por la electrólisis de una disolución ordinaria de sal, obteniéndose hidróxido de sodio como subproducto. Debido a que la demanda de cloro excede a la de hidróxido de sodio, industrialmente se produce algo de cloro tratando sal con óxidos de nitrógeno, u oxidando el cloruro de hidrógeno. El cloro se transporta como líquido en botellas de acero. Se usa para blanquear pulpa de papel y otros materiales orgánicos, para destruir los gérmenes del agua y para preparar bromo, tetraetil-plomo y otros productos importantes.
|
EL CLORO: ESENCIAL PARA LA VIDA Y EL BIENESTAR El cloro es el undécimo elemento más abundante en la litosfera, es incluso más abundante que el carbono. Junto con el sodio forma un compuesto esencial para la vida: la sal (cloruro sódico). La primera célula viva se desarrolló hace unos 3.000-4.000 millones de años en la fuente de toda materia orgánica: el mar. La sal es vital para nuestro organismo (sin sal no podemos vivir), por lo que ha sido desde la antigüedad una sustancia muy apreciada. El cloro interviene, directamente o como intermediario, en más del 50% de la producción química industrial mundial y es parte integrante de la vida misma de la industria (aeroespacial, mecánica, telecomunicaciones, transportes, informática, química, petroquímica, farmacia, cosmética, construcción, nuclear, tratamiento de aguas, metalurgia, confección, deportes, etc). La química del cloro crea bienestar y calidad de vida. En nuestras actividades cotidianas utilizamos constantemente productos químicos, cuya fabricación depende directa o indirectamente del cloro, por ejemplo, para lavarnos, vestirnos, alimentarnos, desplazarnos, trabajar, distraernos, hacer deporte, proteger nuestra salud.
IMPORTANCIA SOCIO-ECONÓMICA DEL CLORO. La química del cloro es uno de los pilares del desarrollo económico e industrial del siglo XX. El desarrollo del consumo de cloro en un país está directamente relacionado con la evolución de la progresión de su Producto Nacional Bruto (PNB). Cada año, en el mundo, se producen unas 40 millones de toneladas de cloro, utilizadas y transformadas en productos útiles para nuestra vida cotidiana. En Europa occidental , la producción anual se eleva a más de 9 millones de toneladas. La actividad "cloro" proporciona empleo a varios millones de personas en el mundo y cerca de dos millones únicamente en Europa Occidental. La cifra de negocios de la industria de Europa Occidental, imputable al cloro, se estima en unos 24 billones de pesetas. La producción de cloro en España fue de 560.000 t en el año 1994. La cifra de negocios imputable al cloro, directa o indirectamente, en España puede estimarse en una cantidad superior a los 4 billones de pesetas. Se estima que más de 186.000 personas dependen directa o indirectamente de la industria química del cloro en España. La utilización del cloro en Europa en el año 1994 fue la siguiente: - polímeros clorados (Policloruro de vinilo, policloropreno, policloruro de vinilideno...) 44 % - polímeros sin cloro (Poliuretano, policarbonato, siliconas, resinas epoxi, fibras de carbono, politetrafluoroetileno, polisulfuro de fenileno...) 12 % - otros productos clorados (farmacia, colorantes, plaguicidas, disolventes...) 20 % - intermedios (medicamentos, fitosanitarios, química fina, ...) 20 % - cloro elemental (tratamiento agua potable, química del bromo, metalurgia...) 4 % El cloro hace posible el "desarrollo sostenible" solicitado en la Cumbre de la Tierra de 1992. Gracias a su reactividad pueden utilizarse los recursos naturales de forma más efectiva, ahorrando energía, ya que al reaccionar a temperatura ambiente, generalmente no precisa de aporte energético suplementario. También los paneles aislantes de poliuretano contribuyen al ahorro de energía en edificios y viviendas. Este material ha hecho posible, junto con los agentes refrigerantes, la difusión de la refrigeración, contribuyendo a una distribución más racional de los productos alimenticios. Por otra parte, los productos fitosanitarios han aumentado de forma espectacular la producción de las cosechas, contribuyendo a reducir el hambre en los países del tercer mundo. En muchos de dichos países, el uso de determinados insecticidas (DDT), desinfectantes (cloro, lejía) y medicamentos ha logrado dominar, e incluso erradicar, algunas enfermedades endémicas (cólera, malaria, tifus). Hoy no sería posible utilizar la energía solar sin el cloro. Las células solares están compuestas de sílice ultrapuro (99,9999 %), cuya obtención precisa cloruro de hidrógeno. También se precisa sílice ultrapuro en la fabricación de "microchips" para las computadoras.
OBTENCIÓN DEL CLORO. Se obtiene en el proceso de electrólisis de la sal. Juntamente con el cloro se obtiene también sosa cáustica (NaOH), e hidrógeno. La sosa cáustica es un álcali extremadamente importante para la industria química, que se utiliza para la producción de papel, aluminio, fibras textiles (rayón, fibrana), jabones y detergentes, procesamiento de alimentos, tratamiento de aguas, etc. El hidrógeno se utiliza en la hidrogenación de grasas, fabricación de vidrio plano, suavizantes, etc, o como combustible. Por cada 1,7 t de cloruro sódico se obtiene 1 t de cloro, 1,13 t de sosa cáustica y 315 m3 de hidrógeno. Existen tres métodos de producción a partir de una disolución de sal en agua (salmuera):
1) Instalaciones con células de mercurio Estas células se fundamentan en la propiedad del sodio de formar con el mercurio (cátodo) una amalgama líquida, que se descompone con el agua en NaOH (disolución al 50%), H2 y Hg. El cloro se desprende en el ánodo. Desde el punto de vista ecológico, las electrólisis con cátodos de mercurio han estado acusadas de contribuir a la contaminación atmosférica y acuífera. Actualmente la técnica moderna ha puesto a punto ánodos dimensionalmente estables construidos de titanio, recubiertos de metales nobles, que proporcionan una economía en el consumo energético y permiten obtener un cloro más puro, sin contaminación de CO2 y otras materias orgánicas cloradas. Los efluentes (líquidos y gaseosos) son desmercurizados. Es muy importante mantener las emisiones de mercurio lo más bajas posibles, pues es un material tóxico a bajas concentraciones. 2) Instalaciones con células de diafragma En este tipo de célula, los compartimentos anódico y catódico están separados por una lámina porosa, denominada diafragma. El cloro se desprende en el ánodo, mientras que el hidrógeno y la solución alcalina de NaOH (10 al 12 %) se generan en el cátodo. Aunque dichas células consumen menos energía que las de mercurio, para obtener una solución de hidróxido sódico comercial (al 50 %) es necesario evaporar el agua y precipitar la sal residual, proceso muy costoso. Además, tienen el inconveniente ecológico-sanitario de utilizar amianto para la construcción de los diafragmas y de que la sosa cáustica obtenida no alcanza el grado de pureza necesaria para determinadas aplicaciones. 3) Instalaciones con célula de membrana La membrana está fabricada a base de polímeros perfluorosulfónicos y es permeable sólo a los cationes (Na+, H+), impidiendo el paso a los aniones (Cl-, OH-). Se pueden obtener disoluciones de hidróxido sódico de concentración superior al 30 %. Dichas disoluciones son de elevada pureza y requiere un consumo de energía para evaporar el agua al objeto de alcanzar la concentración de 50 % en NaOH (calidad comercial). Las células de membrana tienen la ventaja sobre las de mercurio y diafragma de que no utiliza ningún material contaminante para la separación de los productos electrolíticos, siendo su consumo energético similar al de las de diafragma. Sin embargo, el coste que supondría el reemplazamiento de las células existentes de mercurio por las de membrana, no justificaría el cambio de tecnología, habida cuenta que los enormes progresos conseguidos en las de mercurio, hacen que las ventajas medioambientales de dicho cambio sean mínimos. | ||||
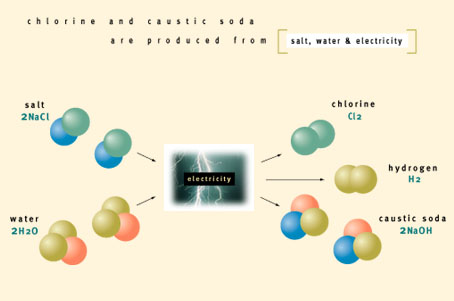
Para la obtención del cloro es necesario efectuar la electrolisis, la cual descompone a la sal y el agua en sus elementos básicos, incluyendo el cloro, se hace pasar una corriente electrica a traves de cloruro de sodio, de manera que en el cátodo (electrodo positivo) se lleve a cabo la reducción del sodio y en el ánodo (electrodo negativo) la oxidación del cloro. Los iones de cloro se depositan en electrodo positvo y se forma cloro molecular (gas); mientras que en el ánodo se tiene el ion de sodio, el cual se une con el hidroxilo (OH) formándose NaOH.
| Sal + Agua (electricity) | Cloro + sosa cáustica + hidrógeno. | ||||||
| 2NaCL + 2H20 | Cl2 + Na OH +2HH | C | |||||
Algunas de las celdas utilizadas para la producción de cloro-sosa deben contar con:
-
Diseño simple y económico.
-
Altas densidades de corriente que minimicen el capital invertido en la planta.
-
Los componentes en la celda deben ser viables, con larga vida y rápidas
-
Buena eficiencia de corriente y materiales producidos por las reacciones de los electrodos. Las reacciones parasitas no solo bajan la energía e incrementan el uso de material, sino que también contaminan el producto.
-
Bajo poder de consumo. El cual es determinado por la eficiencia de corriente y el voltaje de la celda.
El ion cloro es usualmente oxidado en una ligera solución ácida para prevenir la hidrólisis del cloro a hipoclorito. El pH del cátodo en las celdas de membrana y de diafragma es de aproximadamente 14, ya que la reacción en el eléctrodo genera hidroxido.
MATERIALES DE LOS ELECTRODOS.
Con excepción del cátodo en la celda de mercurio, es libre la selección de los materiales del cátodo y del ánodo, mientras cumplan con los siguientes requisitos.
El material del ánodo debe producir el cloro a un bajo potencial mientras no apoye la oxidación de agua a oxígeno
El material del cátodo debe producir el hidrógeno a un bajo potencial en solución alcalina.
El funcionamiento de los electrodos en las tres diferentes tecnologías genera diferentes reacciones.
En la celda de diafragma el ánodo opera en un medio más alcalino, que en las celdas de mercurio y de membrana, solo en las celdas de diafragma el cátodo presenta el ion cloro en solución lo cual puede incrementar los problemas de corrosión particularmente cuando la celda esta en un circuito abierto
El cátodo en las celdas de diafragma es normalmente suave, el cual es muy estable a la corrosión y con un sobrepotencial de 300 a 500 mV .
En las celdas de mebrana la catálisis se facilita debido a ausencia de cloro en solución y al uso del cátodo (el cual no esta forrado de metales que se tienen que reemplaar periódicamente).
El diseño debe permitir la liberación rápida de burbujas, lo cual contribuye a disminuir el iR.
Es esencial que el material de los electrodos en la celda de cloro-sosa, tenga un buen funcionamiento por meses o años sin que se tengan que reemplazar los componentes. Es esencial que el ánodo pueda ser reemplazado fácilmente
La forma y el tamaño de los electrodos resulta irrelevante, mientras cumplan con su función.
En la historia de la industria del cloro-sosa el material del ánodo ha sido de grafito o de alguna otra forma de carbono.
El sobrepotencial del Cl2 ésta por arriba de los 500mV y dentro de un rango de 2 a 3 kg del ánodo de carbon por tonelada de cloro,
El perfecto separador en una celda de cloro-sosa debe de contar con:
El paso de los iones de sodio, pero no de protones, sin la transportación de los iones cloro, el cual podría contaminar al NaOH
Tener una baja resistencia
Ser estable al cloro húmedo y 50% de NaOH durante un largo período de tiempo. Propiedades que pueden ser mantenidas cuando el catolito es 50% hidróxido de sodio.
A diferencia de la celda de membrana, la celda de diafragma es porosa y no puede discriminar entre las especies, por lo cual en ésta celda la sosa cáustica producida es contaminada frecuentemente por el ion cloro.
El catolito no puede abandonar la celda sin contener más del 10% de NaOH
El hidróxido producido en la celda de diafragma debe estar concentrado por la evaporación al 50% de la solución. Por otro lado las celdas de membrana generalmente son capaces de mantener este criterio por encima del otro.
La estabilidad química es obtenida por la fabricación de membranas de polímeros perfluorosulfónicos. Mientras que la conductividad iónica resulta del uso de monómeros con cadenas con terminaciones de grupos ácidos.
Se ha observado que la estructura de los polímeros junto con los hidrocarbonos y los grupos ácidos forman canales a través de los cuales pasan los cationes, ésta selectividad del catión debe surgir a partir de estos canales.
La primera membrana electrolítica fue construida en 1890, notándose en los últimos 25 años grandes avances en la tecnología, obteniéndose grandes innovaciones científicas económicas y sociales en la conservación de energía, control de contaminación y teniendo altos estándares de seguridad. En 1970 se introdujo la primer tecnología de celda de membrana la cual ha tenido numerosos avances hasta considerarse la mejor. En 1987 ésta tecnología fue la responsable del 10% de la producción total mundial, se espera que ésta sea la más dominante y tal vez la única tecnología en la industria del cloro-sosa.
Existen dos tipos básicos de membrana basados en ácido fuerte y ácido débil. La membrana de ácido fuerte tiene propiedades superiores, la desventaja es que tienen la incapacidad de permitir la producción de altas concentraciones de NaOH (menos del 15%). En contraste con esto la membrana de ácido débil permite la producción del 30% al 40% de sosa cáustica sin tener pérdidas significantes en la eficiencia de la corriente; estas membranas tienen una mayor resistencia particularmente si están en contacto con una solución ácida
El tipo de polímero utilizado en la membrana puede minimizar la resistencia eléctrica si son hechas con un espesor aproximado de 0.1 mm, estas son reforzadas con finas redes de plástico
Actualmente la membrana más sofisticada no tiene huecos.
Las membranas solo operan con condiciones altamente controladas. En particular la salmuera debe tener un alto grado de pureza.
CELDAS DE MERCURIO.
En la celda de mercurio las reacciones en el electrodo son:
y la amalgama de sodio es hidrolizada, mediante la siguiente reacción:
reacción la cual se lleva a cabo en presencia de un catalizador en un reactor de separación.
El potencial reversible de la celda es de menos 3.16 V . El ánodo es de DSA, El sobrepotencial asociado con las reacciones del electrodo son muy lentas, el voltaje normal de la celda es aproximadamente de -4.50 V y el voltaje adicional es necesario para conducir la corriente a través del hueco del Hg-DSA, los electrodos y las conexiones de la celda
Una celda típica de mercurio es normalmente larga con las siguientes dimensiones 15*2*.3m, su base es de acero en la cual el mercurio puede fluir a través por el fondo de la celda, forrada de titanio. A la entrada de la celda existe una sufase de mercurio con orificios de ánodo y cátodo de menos de 1 cm cada uno. Teniendo aproximadamente 250 ánodos, por lo que casi toda la celda está cubierta por ánodo. La salmuera debe tener una concentración del 25% a una temperatura de 60°C que fluye a través de la celda y el 17% de esta es reciclada a través de depósitos de sal o después de un tratamiento. El cloro gaseoso deja la celda por la parte superior de la celda, mientras que la amalgama de sodio (aproximadamente 0.5% Na) sale por la base, pasa a través de dos lavadas para remover toda la solución de cloruro de sodio y entrar al Denuder, El denuder es un tanque de reacción con bolitas de grafito impregnado con algún metal de transición como el Fierro o níquel, que catalizan la descomposición de la amalgama; la amalgama de sodio y el volumen de agua pura, que es inyectada al denuder, son controladas por el grafito y el reactor. La reacción ocurre rápidamente en el denuder y es altamente exotérmica, ya que el metal de transición provee una surface alternativa de mercurio para la evolución de la reacción de hidrógeno; las reacciones en el denuder ocurren bajo un tipo de mecanismo de corrosión.
El hidrógeno gaseoso sale por la parte superior del denuder y el mercurio es recirculado a la celda y el hidróxido de sodio sale por debajo.
Es posible producir 50% de NaOH directamente.
Un cuarto de celda típico consiste de un gran número de celdas en serie, que utilizan aproximadamente 480 V (teniendo cerca de 100 celdas juntas).
El proceso de purificación se hace generalmente por precipitación del grupo II de metales como hidróxidos o por incrementación del pH con NaOH .
La salmuera es entonces acidificada para provocar la hidrólisis del cloro a 60°C, pasa al denuder y posteriormente a la celda.
Después de la electrolisis y la descomposición de la amalgama en el denuder los tres productos (Cloro, hidrógeno e hidróxido de sodio) deben ser filtrados y transformados para la venta. El NaOH se obtiene con una pureza del 50%, el cloro es comprimido en una licuadora y transportado directamente a una planta química, el hidrógeno es utilizado si es posible como alimentador químico o vendido como gas comprimido. El efluente de salmuera debe ser tratado con aire que remueva el cloro residual, el cual es utilizado para la fabricación de hipoclorito
CELDA DE DIAFRAGMA.
La celda de diafragma tiene un separador constituido de asbesto con varios polímeros que mejoran el funcionamiento del separador.
La reacción en los electrodos genera cloro e hidróxido de sodio directamente.
Los asbestos son depositados directamente en una hoja de gasa que actúa como cátodo; el ánodo es un lugar cerrado del diafragma y el 30% de la salmuera pasa en el compartimiento del ánodo ; el cloro es formado en el ánodo; El H2 gas y el NaOH son formados en el separador puesto (cátodo)
Al utilizar los asbestos en los diafragmas se tienen algunos problemas como:
Es una barrera física por lo que todos los iones de las especies son capaces de pasar a través de él, lo cual produce un gradiente de concentración. El Na es transportado rápidamente a través del diafragma del ánodo al cátodo por difusión, convección y migración, pero casi igual cantidad del cloro acompaña a los iones sodio. La concentración del ión hidróxido formado en el cátodo debe estar restringida a menos del 12% lo cual significa que debemos introducir más pasos en el proceso para obtener una solución al 50% y aun así la sosa contiene 1% de Cl lo cual es inaceptable para muchas aplicaciones, ya que incrementa los problemas de corrosión en cualquier solución de NaOH que contenga metales, sin embargo las plantas de diafragma son muy atractivas si el NaOH puede ser utilizado aún con 10% de Cl.
La caída del IR es considerable en diafragma. El potencial reversible de la celda es de - 2.2 V; estas celdas operan en un rango de - 3.2V a -3.8 V, el voltaje adicional esta asociado a los separadores de asbesto. En estas celdas el IR disminuye conforme el tiempo porque el depósito de hidróxido de calcio e hidróxido de magnesio en los poros del diafragma minimizan dicho efecto, por lo que la salmuera que se utiliza debe estar perfectamente purificada. El proceso de purificación de la salmuera debe ser más riguroso que el de la celda de mercurio.
Los asbestos no son identificados y su tiempo de vida es un factor determinante en el diseño de la celda. El diafragma debe ser reemplazado a los pocos meses y el diseño de la celda debe permitir el lavado de viejos asbestos y debe permitir reemplazar esto por nuevos. Recientemente los diafragmas han sido mejorados con la adición de varios polimeros en el asbesto.
CELDAS DE MEMBRANA
Las reacciones en el electrodo en la celda de membrana son las misma que se llevan a cabo en la celda de diafragma, con la diferencia de que ahora el separador es una membrana permeable (catión) .
La primera tecnología de celda de membrana fue hasta 1970 cuando se estaban conociendo las propiedades esenciales de las membranas perfluorosulfónicas en las celdas de cloro-sosa.
Dada la habilidad de la membrana de discriminar entre aniones y cationes pueden ser separados los iones de sodio y protones, produciéndose directamente en la celda NaoH al 40% lográndose por evaporación obtener 50% de NaOH libre de Cloro. La membrana esta diseñada para no permitir el paso del Cl(-) y OH(-). La contaminación de la sosa por el cloro es baja. Esta celda puede ser operada a altas densidades de corriente, encontrándose el valor ótpimo entre 0.25 a.40 A/cm-2 .
La celda de membrana ha coincidido con el rápido incremento de los costos de energía, lo cual es de importancia en el consumo de energía Afortunadamente, una buena catálisis se lleva a cabo por medio de las reacciones en los electrodos. La resistencia de la membrana es también baja por lo que utiliza menos energía. Existe una celda llamada cero hueco en la cual los dos electrodos están en contacto cada una al lado opuesto de la membrana.
Los compartimientos del ánodo y el cátodo son alimentados con 25% de salmuera y agua respectivamente.
Existen diferentes tipos de celda:
Un cuarto de celdas normalmente contiene de 50 a 100 celdas las cuales son capaces de producir más de 10000 ton de cloro por año.
El voltaje puede ser menor a 2.7V ; la temperatura común es de 90°C y la salmuera debe estar perfectamente purificada para evitar problemas tanto en el ánodo como en la salmuera, es común incluir un ion extra para precipitar las impurezas. En condiciones óptimas el tiempo de vida de la membrana es de poco más de 3 años, los electrodos tienen una vida más larga.
INGENIERIA Y CONTROL DE EQUIPO.
En la ingeniería química la tendencia se dirige hacia la completa utilización de los crudos y la energía. Por ejemplo todo el calor de las reacciones exotérmicas es usado en otra parte de la planta además las plantas han tenido que cambiar debido a los requerimientos legales de monitoreo y control de contaminación, en la industria del cloro-sosa esto concierne al mercurio y al cloro, normalmente ambos la atmósfera y el efluente son monitoreados y ahora el cloro y el mercurio son menos riesgosos. En particular las densidades de corriente han sido incrementadas y los cuartos de celda son más largos.
Tal vez, el primer paso de la era moderna haga una introducción de rectificadores de silicón el cual incrementa la eficiencia de conversión del 86 al 99%. Estos pueden producir una corriente de 240V .
La revolución electrónica ha sido de gran importancia en la organización y control de las plantas de cloro.sosa. ahora es posible medir y registrar en una computadora los datos de cada celda y llevar el control del proceso.
COMPARACIÓN DE LOS DIFERENTES TIPOS DE CELDA.
En la siguiente tabla se muestra una comparación de los tres diferentes tipos de celda:
COSTO INICIAL DE LA PLANTA.
Sabemos que las celdas son construidas con materiales caros, estas contienen eléctrodos con materiales costosos ya que es común que sean de titanio para evitar la corrosión, minimizar el número de celdas y aumentar su tiempo de vida. En el proceso electroquímico la densidad de corriente se determina por el tamaño y el número de celdas necesarias para lograr la producción anual requerida.
Las celdas de mercurio trabajan a una densidad de corriente mucho mayor que las de menbrana y las de diafragma.
Solo las celdas de mercurio pueden producir el NaOH al 50% directamente, las celdas de diafragma al 12% por lo cual deben estar combinadas con una planta de evaporación. La celda de membrana requiere que la salmuera tenga alto grado de pureza. En las plantas donde se trabaja con celdas de mercurio, el efluente de be ser tratado y monitoreado aumentando el costo de la planta.
COSTOS DE OPERACIÓN.
Los costos de operación incluyen el laboratorio, el reemplazamiento de los componentes, la renta y el IVA.
Una comparación es muy infavorable para las celdas de diafragma, ya que se requiere de un espacio mayor debido a que se necesita una planta de evaporación. Las celdas de membrana y de mercurio tienen un tamaño similar.
Todos los procesos son alargados.
Es necesario reemplazar el diafragma y la membrana siendo más fácile este último.
VALORES AÑADIDOS DURANTE EL PROCESO.
Estos valores dependen de la materia prima y del valor de los productos. Para los tres procesosla materia prima que se requiere es similar por lo que noexiste gran diferencia en este aspecto, sin embargo difieren en la pureza de los productos lo cual afecta en el precio de los mismos. Por lo que la tecnología de celda de diafragma al tener los productos más impuros se ve afectada, esto puede ser favorable en el caso de que el NaOH pueda ser vendido paa un uso en que se permita un 10% de cloro en la solución; por ejemplo puede ser vendido para neutralizar el ácido durante síntesis orgánica.
COSTOS DE ENERGÍA.
En la siguiente gráfica se muestra una comparación del consumo de engría en los tres diferentes tipos de celda para la producción de cloro-sosa. Las líneas completas representan únicamente la electrolisis y las líneas punteadas representan el consumo de energía total incluyendo la evaporación.
PROCEDIMIENTO EXPERIMENTAL.
Como ya hemos mencionado anteriormente nuestro proyecto consiste en la obtención de cloro y sosa a partir de cloruro de sodio en una celda con membrana, para esto fue necesario hacer varias determinaciones para poder concluir cual era la corriente óptima que debe utilizarse para la producción del cloro y la sosa en la celda.
La celda utilizada consiste de dos electrodos: Uno de grafito el cual funciona como ánodo, y uno de fierro el cual funciona como cátodo
Entre estos dos electrodos se coloca una membrana la cual impide el paso de Cl- y OH-. La celda consiste de dos compartimentos unidos, obteniéndose del lado del grafito el cloro (parte superior ) y por el frente de la celda el NaOH (parte inferior). La solución de cloruro de sodio saturada se introduce por un pequeño orificio localizado en la parte superior de la celda (mismo por donde se obtendrá el cloro) mientras que el agua es introducida por la parte superior del frente de la celda. (en la parte inferior se obtiene la sosa). La figura de la celda utilizada se muestra al final de este tema, pero
Preparación e instalación de la celda.
Se coloca la membrana en la celda, se sella bien la celda y se monta en dos soportes universales; una vez montada se vierte el cloruro de sodio en la parte superior de la celda, lo cual puede hacerse con ayuda de una jeringa; se llena el compartimiento del frente con agua destilada por el orificio que se encuentra en la parte superior (puede usarse una pizeta)
Se conecta en serie. Para esto es necesario recordar que la entrada de electrones se realiza en el electrodo de fierro (cátodo) y la sálida es por el electrodo de grafito (ánodo). Esto se muestra en el diagrama al final de este tema.
Una vez conectado, se fija la corriente al valor deseado. En este caso se hicieron determinaciones con una intensidad de corriente de 0.5,0.75,1.0,1.25 y de 1.5 (el valor óptimo se obtuvo a 1.25) se espera a que el valor sea constante y se deja trabajar por aproximadamente una hora. (registrar el tiempo).
Transcurrido el tiempo, se apaga la fuente de poder, se desconecta la celda y se transfiere la sosa obtenida a un vaso de precipitado de 1 litro (para esto se abre la manguera de la parte inferior del frente de la celda) se enjuaga con agua destilada y se registra el volumen obtenido.
Titulación del NaOh obtenido.
Posteriormente se toma una muestra de 25ml con una pipeta volumétrica, se transfiere a un matraz erlenmeyer de 250 ml se le adicionan unas gotas de fenoftaleína y se titula con ácido clorhídrico 1M. Se registra el volumen y se hacen los cálculos correspondientes.
CALCULOS.
Numero de equivalentes (1) =
Se titula con HCl 1N = 1M
N1V1=N2V2
Porcentaje de eficiencia de la celda
RESULTADOS.
| I (A) | Vtot NaOH | Vmuestra | Vtit HCl | N NaOH | Eq (1) | Eq | % eficiencia |
| 0.5 | 75 | 25 | 4.6 | 0.184 | 0.01865285 | 0.0138 | 73.9833333 |
| 0.75 | 104 | 25 | 5.2 | 0.208 | 0.02797927 | 0.021632 | 77.3143704 |
| 1 | 105 | 25 | 7.3 | 0.2912 | 0.0373057 | 0.03066 | 82.1858333 |
| 1.25 | 86 | 25 | 6.5 | 0.26 | 0.02331606 | 0.02236 | 95.8995556 |
| 1.5 | 78 | 25 | 15.25 | 0.61 | 0.05595855 | 0.04758 | 85.0272222 |
| 1.75 | 132 | 25 | 7.1 | 0.284 | 0.06528497 | 0.037488 | 57.4220952 |
Concentración HCl: 1N
Tiempo: 3600seg. En la de 1.25ml el tiempo fue de 1800 seg.
Los volúmenes están dados en m; en el caso del Vtit se hicieron de 2 a 4 titulaciones con muestras de 25ml y se saco un promedio de los datos obtenidos.
ANÁLISIS DE RESULTADOS.
En base a los resultados obtenidos se observa que la corriente óptima es de 1.25 A al darnos un valor máximo de eficiencia de la celda con este valor. Debemos tomar en cuenta que por falta de tiempo, en está determinación el tiempo de funcionamiento fue menor con respecto a las otras determinaciones. Por otra parte se observa que al pasar este valor de la corriente la eficiencia de la celda disminuye considerablemente.
Se observa que el valor de la concentración de sosa va de un intervalo de 0.15 a 0.284 , teniéndose para la corriente de 1.5 un valor 0.6, lo cual parece indicar un posible error, o bien que a esa corriente la solución se concentra más sin embargo por la relación de volúmenes y los equivalentes la eficiencia es menor y la concentración de la sosa es mayor. Sería bueno realizar otra determinación para poder concluir con mayor certeza sobre este resultado.
Es importante mencionar algunos factores que pudieron afectar de alguna forma nuestras mediciones: En la celda se tenían algunas fugas, al retirar la sosa de la celda se quedaba un poco de está en la celda, en algunas mediciones la celda no pudo ser llenada bien dado a algunas fugas, el tiempo de operación fue medido con reloj de mano (se puede determinar mejor este dato con un cronometro). Estas fallas de la celda fueron minimizadas de manera que no afectaran considerablemente nuestras mediciones.
Respecto a la tecnología de celda de membrana en base a la investigación previa podemos decir que ésta es muy buena y cumple con las necesidades de producción de muchas industrias; actualmente comienza a tener preferencia sobre las de mercurio y de diafragma
Descargar
| Enviado por: | Juan Bribiesca |
| Idioma: | castellano |
| País: | México |
