Laboratorio
Modelos atómicos
Modelos Atómicos
Louis-Víctor de Broglie
El investigador Louis Víctor de Broglie fue uno de los investigadores en dar a conocer su modelo atómico empezando con la teoría quántica donde decía que los electrones eran ondas de donde se podría derivar básicamente lo que es la longitud de onda lo que decía que cualquier partícula de masa y velocidad tiene una onda en movimiento lo cual se calcula con:
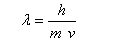
Lo que quiere decir que onda es igual a la altura de el objeto dividido en el producto de masa y velocidad lo que el trata de demostrar es que los electrones se pueden manifestar como ondas al igual que la luz.
Y después de unos años gracias a Davisson y Germen se demostró que esto era posible mediante métodos de reflexión.
Otro científico llamado thomson descubrió que con la difracción se podía obtener un mayor aumento en los microscopios iluminado objetos con los electrones.
Lo cual no ha sido totalmente confirmado ya que solo se le aplica a objetos a nivel subatómico.
Principios de Werner Heisenberg
Dice que no se puede hablar con exactitud de los modelos lineales en un objeto lo cual en este caso seria afirmar que los electrones pueden producir ondas o pueden formarlas y debido a esto no se puede conocer con exactitud el movimiento lineal de algo tan pequeño.
Se dice que aunque fuesen todos los electrones totalmente iguales cambiaria su movimiento lineal en cuanto a distribución de el mismo.
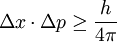
El grafico anterior habla de las posiciones de cada uno de los electrones en dicho caso.
Lo cual se puede simplificar en un método menos avanzado.
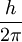
A lo cual se dice que viene otra formula la cual modifica los ángulos de las ondas.
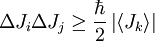
Por esa razón decía que las ondas pueden tener variables.
Las consecuencias de esta teoría es que no se puede tener claro la posición y movimiento de cada cuerpo por lo cual no podemos medir con total exactitud.
Max Planck
Todos en su tiempo creían que las radiaciones electromagnéticas eran por las ondas pero el descubrió que podía haber ciertas variables en cada onda.
El fue el primero en proponer que detrás de eso había una energía producida por el electromagnetismo y a dicha energía decidió llamarle cuántos.
Lo cual llego a cambiar los conceptos de luz y materia.
Lo que ha cambiado desde entonces lo único que ha cambiado es que a los cuantos de luz se les cambio el nombre a fotones.
También denomino a los cuerpos que pueden absorber la radiación sin emitir radiación propia como cuerpos negros.
Teoría quántica
Describe las moléculas subatómicas entre materia y radiación.
El que también aporto algo a esta teoría fue Einstein el cual logro explicar gracias a Planck la energía fotoeléctrica.
Bohr decía que las orbitas de electrón eran fijas y que cada orbita tenia el mismo valor que un cuánto cada orbita puede variar entre absorción y emisión de la radiación.
Por desgracia en los materiales mas completos con demasiadas orbitas no es muy exacto el calculo.
Broglie
Aporto lo de las ondas junto con thomson.
Lo que trataban de explicar era que los electrones no se dispersan como las partículas sino como las ondas reforzando siempre un punto medio y quitando intensidad en los lados.
Algebra Lineal
También se puede basar en la teoría de matrices o algebra lineal la cual habla de que los electrones son como las partículas y se dirigen en línea y no como las ondas las lineales no se intensifican en un punto medio sino solo en los lados en ciertos casos.
En el descubrimiento de una teoría se fundaron las bases para seguir con las investigaciones del átomo lo cual ayudo a los investigadores del siglo veinte.
Se descubrieron las líneas espectrales que simbolizan la absorción y emisión de fotones cuando el electrón esta en un cambio de nivel de energía paso a modificar la física para derivar ramas de la física las cuales son:
Física de la materia condensada.
Se encarga de investigar la materia solido y liquida así como sus derivados como el vidrio, los polímeros, materiales orgánicos y compuestos.
Se utilizaron los rayos X para estudiar los cristales gracias a esto se descubrió la superconductividad y semiconductores.
Se desarrollaron el láser, la fibra óptica y transistores.
La superconductividad
Se investiga la resistencia a la electricidad también se investiga la repulsión al campo magnético.
La superconductividad depende de la temperatura y los materiales.
De este estudio se derivo la ciencia criogénica un arte de congelar las cosas y conservarse de alguna manera quitando las bacterias.
Física nuclear
Estudia las reacciones de los átomos y electrones así como los efectos que producen.
Todo empezó por el descubrimiento de la radioactividad en las sales de uranio por el científico Henri Becquerel después Marie Curie descubrió el Polonio y el Radio.
Después Otto Hahn descubrió la fisión nuclear con el uranio al irradiarlo con neutrones.
Partículas elementales
Estudia hasta las partículas mas pequeñas las cuales son las subatómicas y estudian sus interacciones y reacciones a los estímulos.
Ernest Rutherford
Nació en 1913 en Nueva Zelanda comprobó el modelo atómico de thomson con partículas positivas y negativos distribuidas uniformemente.
Demostró que las partículas alfa se desviaban después de pasar por la materia el decía que el núcleo era de carga positiva y los electrones de carga negativa giraban alrededor de el núcleo después Bohr trato de complementar el trabajo diciendo que los electrones solo existen en algunas orbitas y no emiten ningún tipo de radiación electromagnética.
A estas orbitas se les llamaba estados estacionarios y podían variar según la posición de los ángulos usando la teoría de Plank se pudo determinar la energía de cada estado estacionario así como los radios después de esto la teoría fue confirmada por Gustav Hertz.
Bohr continuo con sus estudios en los cuales demostró que los electrones son capacees de producir luz de ahí saco la teoría del electrón “elevado” un estimulo a los electrones desde el menor al mayor en radio y energía después de un corto periodo vuelve a su estado original en este experimento descubrió que al volver a su estado original desarrolla un solo foton y de la energía de este foton se define si es de orbita mayor o menor y otro descubrimiento importante es que se dio cuenta que con cada foton se podía definir cada onda con esto Bohr pudo explicar el espectro atómico.
Descargar
| Enviado por: | Etan |
| Idioma: | castellano |
| País: | Argentina |
