Química
Metano, Propano, Etano y Heptano
Hidrocarburos
Metano.-
Fórmula Estructural
H
H C H
H
Fórmula Molecular
CH4
Propiedades físicas
Es menos denso que el agua y soluble en disolventes apolares.
Posee un átomo de carbono, su punto de fusión es -182.5 ° C y su punto de ebullición es de -161,6 ° C.
Propiedades químicas
Es bastante inerte debido a la elevada estabilidad de los enlaces C-H y a su baja polaridad. No se ve afectado por ácidos o bases fuertes ni por oxidantes como el permanganato. Sin embargo la combustión es muy exotérmica aunque tiene una elevada energía de activación.
Aplicaciones
También se le denomina gas de los pantanos y formeno. En las minas de carbón suele formar mezclas explosivas con el aire, y se le da el nombre de gas grisú. El peligro del gas grisú no sólo se debe a los efectos mecánicos y térmicos de la explosión, sino también al enrarecimiento del aire por escasez de oxígeno (asfixia), y además, por la formación del monóxido de carbono (CO) que es altamente tóxico.
Propano.-
Fórmula Estructural
H H H
H C C C H
H H H
Fórmula Molecular
CH3 - CH2 - CH3 C3H8
Propiedades físicas
Hidrocarburo gaseoso, incoloro y combustible que se halla en el petróleo americano. Tiene 4 átomos de Carbono, su punto de fusión es -138.3° y su punto de ebullición es de -0.5 ° C.
Propiedades químicas
Posee baja polaridad. No se ve afectado por ácidos o bases fuertes ni por oxidantes como el permanganato.
Aplicaciones
Por sus aplicaciones es un buen sustituto del gas obtenido por destilación seca de la hulla.
Se obtiene En yacimientos subterráneos de petróleo. Una vez extraído el crudo se procede a un tratamiento de refino para obtener los distintos productos que provienen de este aceite, entre ellos el gas propano.
Su principal aplicación es servir de combustible en hogares, comercios e industrias.
Etano.-
Fórmula Estructural
H H
H C C H
H H
Fórmula Molecular
CH3 - CH3 C2H6
Propiedades físicas
Se encuentra en estado gaseoso a temperatura ambiente.
Presenta un índice de octanage superior al de la gasolina y tiene una presión de vapor inferior, resultando en menores emisiones evaporativas. La combustión en el aire es inferior a la de la gasolina, lo que reduce el número y la importancia de los incendios en los vehículos. su punto de fusión es -183.3° y su punto de ebullición es de -88.6 ° C.
Propiedades químicas
Su estructura es única ya que existe una sola manera de unir los átomos de carbono en estas moléculas
No se ve afectado por ácidos o bases fuertes ni por oxidantes como el permanganato.
Aplicaciones
El etano se puede utilizar de dos maneras:
-
como mezcla con la gasolina con el objetivo de un aumento del octanage de la gasolina.
-
como etano puro, compuesto de etano hidratado, a 95,5 GL.
El etano es un excelente combustible automotriz El etano anhidro tiene un poder calorífero inferior y superior de 21,2 y 23,4 mega joules por litro, respectivamente, contra 30,1 y 34,9 mega joules por litro de gasolina.
En Brasil las propiedades del etano (como combustible) llevaron al desarrollo de motores a alcohol y motores para la mezcla alcohol/ gasolina. Hasta 1988, los avances se realizaron por la industria automovilística (GM, Ford, Volskwagen, Fiat) para sistemas carburados; actualmente, se encuentran disponibles para todos los motores con sistemas a inyección electrónica.
heptano.-
Fórmula Estructural
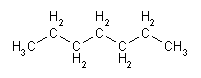
Fórmula Molecular
CH3 - (CH2)5 - CH3 C7H16
Propiedades físicas
Se encuentra en estado líquido. El n-heptano es muy detonante
su punto de fusión es -90.6° y su punto de ebullición es de 98.4 ° C.
Propiedades químicas
Se obtiene por la rectificación y destilación de la parafina.
Es bastante inerte gracias a su baja polaridad
Aplicaciones
-
Solvente para extracción de aceites
-
Solvente para pinturas y preparación de adelgazadores
-
Se emplea como desolvente y en síntesis orgánica
Descargar
| Enviado por: | Koch |
| Idioma: | castellano |
| País: | Ecuador |
