Industria y Materiales
Metales: características
Características de los metales
Los metales tienen una serie de características que los diferencian de los demás materiales, los no metales. Además de que todos, a excepción del mercurio, son sólidos, la más característica de las propiedades de los metales es su brillo especial, que curiosamente se llama brillo metálico. El brillo es la capacidad de un material para reflejar, absorber o reflectar la luz. Los metales, una vez pulidos, reflejan la mayor parte de la luz que les llega.
Adamantino Subadamantino
Vítreo Metálico
Submetálico Nacarado
Sedoso Resinoso
Graso Húmedo
Otra característica que cumplen la casi totalidad de los metales es ser buenos conductores eléctricos y mostrar carga eléctrica positiva en los procesos de electrólisis. La estructura electrónica de los átomos metálicos se caracteriza por la existencia de pocos electrones en su capa externa, por lo que se requiere escasa energía para que los pierdan y adopten la estructura estable en forma de cationes. Además, en una masa metálica, los electrones de valencia fluctúan de uno a otro átomo formando la denominada “nube electrónica”, de algún modo compartida por todos los átomos del metal. Así muchos son empleados para hacer cables, etc... Además también son buenos conductores del calor.
Los metales son materiales, en general, bastante densos, insolubles en agua y en muchos disolventes, y opacos con un espesor adecuado.
En cuanto a las propiedades metálicas podemos decir que los metales presentan resistencia a la tracción, es decir, que pueden soportar grandes cargas, que se calcula poniendo el material en una cubeta imprimiéndole una fuerza que se aumenta progresivamente y dividiendo la carga máxima de fuerza que se la ha aplicado a la probeta por la sección transversal de la misma.
Los metales son poco duros, así una de las funciones más importantes de las aleaciones es mejorar esta propiedad. La dureza se delimita dejando caer contra una superficie pulida de un metal una bola de acero especial y muy duro (método Brinell) o un diamante piramidal (método Vickers). Una vez hecho esto podemos medir la dureza del metal de dos maneras: por la relación entre la carga en kilogramos y la huella dejada en el metal en milímetros cuadrados, estaremos hablando de dureza de retroceso, o bien teniendo en cuenta la altura que adquiere la bola en el rebote, cuanto más blando sea el material, menor altura alcanzará ya que la energía del impacto ha sido absorbida en casi su entera totalidad por la deformación del metal, y se llamará dureza a la penetración.
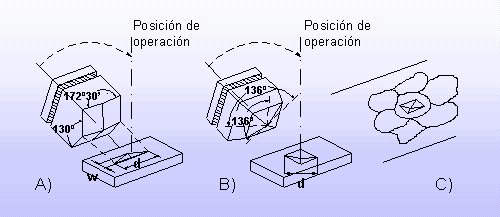
Los metales son muy dúctiles, es decir, que se pueden estirar en forma de hilos; y bastante maleables, podemos estirarlos en láminas sin romperlos. Una de las malas propiedades de los metales es su baja resistencia a la fatiga, o la situación en la que se encuentran algunos metales tras ser expuestos a ciclos de carga de una intensidad menor al crítico de rotura del material.
Entre las características en el carácter químico no se puede establecer una relación común a todos los metales ya que, por ejemplo, en el caso de la oxidación, nos encontramos con una diferencia ostensible tanto en tiempo como en la energía liberada. Existen metales inoxidables como el oro y los hay que tardan menos de un día en oxidar su capa exterior a un milímetro de profundidad como el hierro, el cobalto y el bario.
Tratamientos de mejora de los metales
Endurecimiento:
Endurecimiento en frío: Cuando sometemos un material a determinada tensión ( ), es decir, fuerza aplicada a la probeta por unidad de sección se produce en el metal un determinado alargamiento o deformación unitaria ( ) que sale tras la fórmula:
Si establecemos una tabla poniendo en el eje de abcisas la tensión y en el de ordenadas el alargamiento nos sale una tabla en la que podemos diferenciar tres fases:
La primera parte queda representada como una recta y se llama zona elástica. Si detuviéramos la tensión en esta zona el metal volvería a su longitud inicial. La zona elástica se termina cuando se alcanza el límite elástico.
A partir de ese límite elástico se inicia la zona plástica en la que las deformaciones son ya permanentes y si el ensayo se acaba en esta zona el metal sólo se recuperará un poco, marcándose un nuevo límite elástico, más amplio que el anterior, como sería en la tabla regresar del punto A al punto B. Con este proceso aumenta la propiedad elástica y la dureza del metal, eso sí, nunca deberemos llegar a la zona llamada de estricción, donde llegaría a romperse. Lo malo es que este endurecimiento lleva consigo una fragilidad. Para vencer esta fragilidad se suele someter a un tratamiento térmico denominado recocido y explicado más tarde.
Endurecimiento por afino de grano: Existe una relación experimental entre el límite elástico de un metal ( ) y el tamaño medio de sus granos (d) que siendo y K constantes dependientes del material y de la temperatura:
De esta expresión deducimos que cuanto menor sea el tamaño del grano, mayor será el límite elástico del metal. Entonces se le aplica al metal una temperatura mayor a la de su punto de transformación para obtener así un grano fino y destruir las partes defectuosas. En el transcurso del enfriamiento a velocidad relativamente lenta, el acero recobra una textura normal.
Endurecimiento por solución sólida: Las soluciones sólidas de las que ya hemos hablado, tanto de sustitución como de inserción, provocan un aumento en la dureza del metal por la deformación mecánica que se produce al no coincidir exactamente los tamaños de los átomos de disolvente y de soluto, o a causa del pequeño tamaño de los huecos intersticiales en las soluciones de inserción. (para explicar volver a usar gráficos de soluciones sólidas).
Térmicas:
Recocido: El recocido es un calentamiento que permite al metal recuperar sus mejores características de ductilidad y toda su plasticidad. Éste y otros muchos procesos serán explicados posteriormente ya que se aplican también al acero.
Temple. Consiste en el calentamiento de algunas aleaciones, principalmente férricas, seguido de un enfriamiento muy rápido; el objeto del calentamiento es lograr que la aleación adquiera una estructura cristalina propia de las elevadas temperaturas, y el fin del enfriamiento brusco es impedir que el metal vuelva a su estructura natural y conserve la estructura cristalina de altas temperaturas también a temperatura ambiente. Con el temple así se consigue un constituyente anormal de la aleación, con su estructura cristalina deformada de forma que se ha aumentado la dureza del metal.
Revenido: Consiste en un recalentamiento que se mantiene durante cierto tiempo a una temperatura suficiente, que en ningún caso debe alcanzar la zona de conversión. El efecto del revenido es neutralizar las tensiones internas y donarle una estructura físico-química a ciertas partes de la pieza.
Termoquímicas:
Cementación. Es el calentamiento de una pieza metálica en contacto con cemento, y que le proporciona propiedades especiales mediante difusión de uno o varios elementos del cemento en toda su masa (cementación profunda), o bien limitando dicha difusión a las capas externas para obtener un producto compuesto que posea en su superficie propiedades diferentes de las del resto de su masa.
Nitruración: La nitruración aumenta la dureza. Después de tratamientos de temple y revenido a 550.º C se le mantiene a esa temperatura en un molde de acero calentado por un horno eléctrico, por el que circula una corriente de gas amoníaco. Luego hay otros derivados como:
Calorización. En contacto con un cemento sólido formado de polvos de aluminio y cloruro de amonio.
Sherardización. Por medio del cinc.
Sulfinización. Mediante la inmersión del metal en un baño especial se consigue incorporarle una capa de carbono, nitrógeno y, sobre todo azufre.
Mecánicas:
Forja. La forja crea en el metal una estructura fibrosa que nunca es completamente destruida y mejora las propiedades de las piezas, aumentando su compacidad de su textura. Según los metales el trabajo de forja se efectúa en frío o caliente dado que a cada metal corresponden una o varias zonas de temperatura que resultan idóneas.
En la gran forja industrial se utiliza para el caldeo voluminoso hornos de carbón o de fuel-oil y se suelen emplear únicamente prensas.
(foto de forja enciclopedia)
En la forja se comienza por modificar profundamente su estructura interna mediante un caldeo suficiente. Seguidamente unos tratamientos térmicos adecuados permiten obtener características mecánicas en frío precisas para el trabajo a realizar posteriormente por la pieza. A continuación las piezas se someten a un tratamiento de estabilización para evitar posteriores alteraciones.
En los talleres de forja a mano se utilizan fraguas, que consisten en fogones provistos de una campana de humos, fija u oscilante, y de un fuelle que inyecta el aire necesario para la combustión a través de una tubería acoplada al aparato.
Trefilado. Permite obtener alambres de gran longitud con relación al diámetro, y de perfil constante. El material de partida es el alambre laminado. Se efectúa forzando el paso de este alambre a través de los agujeros de una hilera, de perfil determinado. El alambre laminado se recoge en rollos que, para estirarlos, se disponen en una devanadera, y el extremo del alambre se pasa por la hilera, montada sobre el banco, y se tira del mismo hasta engancharlo en el tambor tractor. Las hileras, según los metales a trefilar, son de distintos tipos de acero o de diamante. La elección del material de la hilera también depende de otros factores, tales como el diámetro de los orificios y la longitud del alambre. El diámetro definitivo se obtiene tras sucesivas pasadas a través de hileras de orificios decrecientes. Cada pasada por el material produce tensiones por lo que este debe de ser sometido posteriormente a un tratamiento de recocido.
(foto enciclopedia)
Tratamientos superficiales:
Cromado. Se utiliza como protección de numerosos objetos domésticos así como para objetos que han de mantener un aspecto brillante. Los baños clásicos de cromado están constituidos por soluciones de ácido crómico y de sulfato de cromo calentados a unos 50º C .
ENLACES QUÍMICOS
Todas los materiales y en conjunto todos los elementos están formados por un conjunto de átomos agrupados. En el caso de los metales estos átomos están situados formando estructuras cristalinas.
Lo primero que hay que saber es el porqué de la agrupación de los átomos. Podemos decir que los átomos se agrupan para conseguir la mayor estabilidad posible, es decir que contengan la menor cantidad posible de energía. Como los átomos que tienen una cantidad de energía casi nula son los gases nobles, los demás tienden a imitarlos. Los gases nobles tienen en su última capa de la corteza ocho electrones así que los demás intentarán conseguir ese número de electrones. Así por ejemplo el cloro, con siete electrones en su tercera capa, tiende a conseguir un electrón; y el magnesio, con dos electrones en su tercera capa, tiende a perderlos para que su última capa sea la segunda, que ya contiene ocho electrones.
Cl Mg
Para conseguir o desprenderse de los electrones se establecen uniones entre los átomos. Estos enlaces pueden ser de tres tipos diferentes:
Enlace iónico: Se producirá entre átomos no metálicos y metálicos, como puede ser entre dos átomos de cloro y uno de magnesio. En este ejemplo mencionado cada uno de los átomos de cloro adquieren uno de los electrones de la tercera capa del magnesio. Además el hecho de que uno sea un catión y los otros dos un anión, establece entre ellos también una atracción magnética.
Enlace covalente: Ocurre entre dos átomos de elementos no metálicos, como puede ser entre dos átomos de cloro. Cada uno de los dos átomos pone uno de sus electrones en común y así los dos átomos del enlace comparten una pareja de electrones y cada uno tiene ocho electrones en su tercera capa.
Enlace metálico: Este es el que más nos interesa ya que, como su propio nombre indica, es el que se produce entre elementos metálicos y la base de la estructura de los metales. En este enlace los elementos sueltan sus electrones sobrantes y estos se sitúan alrededor de todos los cationes. Estos electrones evitan la repulsión que debería producirse entre los cationes por tener la misma carga magnética.
Estudiando este tipo de enlace nos da una muestra de algunas de las propiedades de los elementos:
-Conductividad eléctrica. Los electrones tienen una gran movilidad ya que lo único que les puede impedir moverse es encontrarse en su camino con los cationes y eso le da una mayor conductividad eléctrica. También gracias a entender su estructura comprendemos el porqué de que la conductividad eléctrica disminuya con el aumento de temperatura, ya que cuanta más temperatura mayor es la vibración de los cationes y más espacio contra los que chocar los electrones.
- Conductividad térmica: La densidad de los metales es muy elevada, es decir, que los átomos están muy próximos los unos de los otros. Cuando aplicas calor a una zona del metal ya hemos dicho que los catines más próximos a esa zona comienzan a vibrar con mayor energía cinética transfiriéndole esta a sus átomos contiguos mediante una colisión. Así la energía se transfiere rápidamente por toda la pieza y en el exterior lo observamos por el paso del calor.
-Maleabilidad. Al deformar mecánicamente un sólido metálico, no cambia su disposición magnética ya que quedan de igual manera los cationes unidos con una nube de electrones a su alrededor. Sin embargo en los otros dos tipos de enlaces si desplazaras los átomos aparecería una oposición entre cationes en vez de coincidir cada catión con un anión y se acabaría la sujeción. .
CELDA UNIDAD
Un metal es un material que se caracteriza, en su composición, porque sus átomos se disponen de una manera totalmente ordenada, es decir, posee estructura cristalina. Existe en cada metal un patrón formado por pocos átomos que se trata de la mejor forma de simplificar su estructura. Este patrón se llama celda unidad, que se repetirá constantemente. Existen siete tipos de celdas unidad.
| SISTEMA CRISTALINO | LONGITUDES | ÁNGULOS | GEOMETRÍA CELDILLA UNIDAD |
| CÚBICO | a=b=c | ð=ð=γ=90º | |
| HEXAGONAL | a=bðc | ð=ð=90º; γ=120º | |
| MONOCLÍNICO | aðbðc | ð=γ=90ºðð | |
| ORTORRÓMBICO | aðbðc | ð=ð=γ=90º | |
| ROMBOÉDRICO | a=b=c | ð=ð=γð90º | |
| TETRAGONAL | a=bðc | ð=ð=γ=90º | |
| TRICLÍNICO | aðbðc | ððððγð90º |
REDES DE BRAVAIS
Una vez estructurados los sistemas cristalinos nos tenemos que acordar de que los metales están formados por átomos y debemos observar como se agrupan estos. Por ejemplo, las celdas de tipo cúbico se pueden agrupar simplemente poniéndose unas superpuestas a las otras (cúbica simple), procurando que uno de los átomos que actuarían de arista del cubo ocupe siempre el centro de otro de los cubos (cúbica centrada en el cuerpo), o bien que uno de estos átomos que actuarían como arista se sitúe en el medio de una de las caras (cúbica centrada en las caras). Hay catorce tipos de estructuras:
Monoclínica centrada en las bases:
Ortorrómbica centrada en las bases:
Ortorrómbica centrada en el cuerpo:
Ortorrómbica centrada en las caras:
Como curiosidad interesante diremos que el primero en darse cuenta de estas estructuras y de describirlas y darles nombre fue Frankenheim en 1835 pero se equívoco diciendo que había un total de quince. Ocho años más tarde Bravais se percató de esta equivocación y de que dos de las estructuras de Frankenheim eran la misma. Así que , a lo mejor injustamente, reciben el nombre de “Redes de Bravais”.
Las redes que tienen la gran mayoría de los metales útiles para la industria son la cúbica centrada en el cuerpo (sodio, potasio, cromo, molibdeno, volframio y hierro alfa), la cúbica centrada en las caras (aluminio, cobre, oro, plata y níquel) y la hexagonal (cinc, zirconio, cadmio, berilio y titanio).
En estas tres redes existen huecos en los que se pueden introducir átomos extraños a la red, estamos hablando de soluciones sólidas de inserción.
Hay otro tipo de soluciones sólidas en las que los átomos extraños apartan a los originales de sus posiciones.
Para que dos metales se puedan alear por sustitución es preciso que cumplan una serie de requisitos tales como que los tamaños de los átomos sean semejantes y que ambos cristalicen en la misma red.
DEFECTOS CRISTALINOS
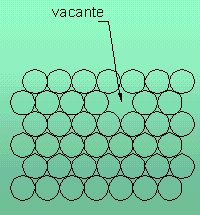
- Vacantes: Estas son un tipo de imperfecciones cristalinas en las que existe una ausencia de átomos aislados, en ciertas posiciones cristalinas. Se producen al solidificarse, cuando aparecen determinadas perturbaciones locales:
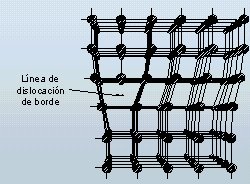
- Dislocación: Es la ausencia conjunta de un grupo de átomos que podríamos alinear en subplanos. En la imagen vemos que el hueco dejado por los átomos desaparecidos produce que los demás componentes de la estructura cambien su posición de igual manera que se alteran las uniones entre ellos. Con esta imperfección los metales poseen una plasticidad y fluencia enorme.
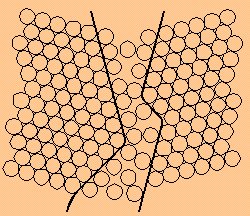
- Junta de grano: Si bien la estructura de un material cristalino es una red tridimensional homogéneamente ordenada, la de un metal o aleación está compuesta por múltiples zonas ordenadas, dispuestas de tal forma que sus ejes no coinciden entre sí. A estas zonas se les denomina cristales o granos, y a la zona límite entre dos de ellos se la conoce como junta de grano.
GLOSARIO
Límite elástico: Punto de estiramiento de un metal que indica que, una vez superado, el metal no vuelve a su situación inicial, sino que queda deformado.
Zona de conversión: Punto de temperatura en el que las estructuras cristalinas de los elementos varían.
BIBLIOGRAFÍA
Gran enciclopedia Larousse - Editorial Planeta
Enciclopedia virtual Planeta 99
Página web de la Cátedra de Ciencia de los Materiales e Ingeniería Metalúrgica de la Escuela Superior de Ingenieros de Sevilla.
Página web del Grupo de Materiales de la Universidad Politécnica de Valencia.
Zona elástica
Zona plástica
Zona de estricción
Descargar
| Enviado por: | Jorge González Domínguez |
| Idioma: | castellano |
| País: | España |
