Química
Industrial: Cobre
EL COBRE
DESCUBRIMIENTO
El cobre era conocido en la prehistoria y fue probablemente el primer metal utilizado para fabricar útiles y objetos decorativos.
Los objetos de cobre se han encontrado entre los restos de muchas civilizaciones antiguas, incluyendo las de Egipto, Asia Menor, China, sudeste de Europa, Chipre (palabra de la que se deriva su nombre), y Creta.
Los nativos americanos también utilizaban el cobre desde el tercer milenio A.C. El análisis de los objetos de cobre y sus aleaciones, y el estudio de los minerales existentes en las regiones donde fueron encontrados inducen a pensar que ya en el año 6.000 A.C. el hombre desarrollaba procesos metalúrgicos.
PREPARACION
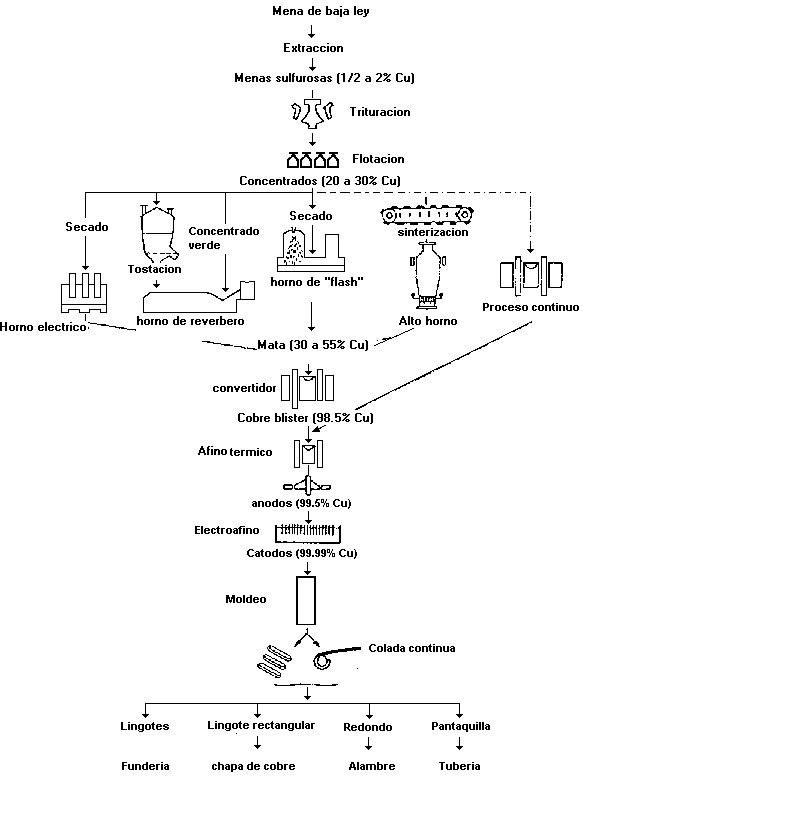
La metalurgia del cobre varía con la composición del mineral. Los minerales que contienen cobre nativo se trituran, se lavan y se separa el cobre para fundirlo y prepararlo en barras.
Si la mena consiste en óxido o carbonato de cobre, se tritura y se trata con ácido sulfúrico diluido para producir sulfato de cobre disuelto del que se obtiene el metal por electrólisis o, utilizando chatarra, por desplazamiento con el hierro:
Cu SO4 + Fe = Cu + FeSO4
Los óxidos y los carbonatos también se reducen con carbón cuando los minerales tienen bastante riqueza en cobre. Los minerales más importantes, los sulfuros, contienen entre el 1 y el 12% de cobre; estos se muelen y se concentran por flotación. Los concentrados se reducen en un horno, quedando cobre metálico crudo, llamado blister, aproximadamente del 98% de pureza.
El cobre crudo es posteriormente purificado por electrólisis, hasta una pureza superior al 99,9%.
MINERALES
Los minerales de cobre utilizados industrialmente pertenecen a tres grupos:
1. El cobre nativo: diseminado en la ganga, forma yacimientos raros, solo importantes en algunos de los estados de América del norte y en Rusia.
2. Los minerales oxidados (Chile). La cuprita, Cu2 O, es fácil de tratar; La azurita (Azul), 2cO3Cu . Cu(OH)2, Y la malaquita (verde), CO3CU. (OH)2, son minerales carbonatados que se lleva a óxidos por calcinación.
3. Los minerales sulfurados son los más abundantes: la calcosina (gris o negra), CU2S; la calcopirita o pirita de hierro, FeS2: al antimonio, al arsénico, al cinc y está asociada a la pirita de hierro, FeS2; al antimonio, al arsénico, al cinc e incluso a la plata y el oro.
MENAS
Raramente contienen grandes cantidades de cobre, pero se compensa con su gran abundancia, los minerales principales es la calcopirita, sulfuro de cobre y hierro, de la que se extrae, aproximadamente la mitad de la producción mundial.
Menas sulfuradas:
De grano superior para la fusión directa.
De grano medio, que exigen la concentración para hacerlas explotables.
De grano bajo, que requieren la concentración y extracción en gran escala del mineral, estas operaciones , en unión con la molienda, son económicas. Es aconsejable la biohidrometalurgia.
Pitiricas.
Menas oxidadas:
De grano superior y medio, que se puede convertir en cobre negro, con el hierro y otras impurezas o bien mezcladas con menas sulfuradas o concentrados la mata por fusión.
De grano bajo o inferior: que se tratan por lixiviación, a menudo con previo ataque biológico anaeróbico.
MÉTODOS GENERALES DE EXTRACCIÓN
Después de los tratamientos preliminares se aplica principalmente la concentración por flotación a los minerales sulfurados. Si el contenido de cobre es superior al 3 %, la extracción se hace por vía seca (piró metalurgia), y si está comprendido entre 0,3, y 3 %, se realiza por vía húmeda (hidrometalurgica).
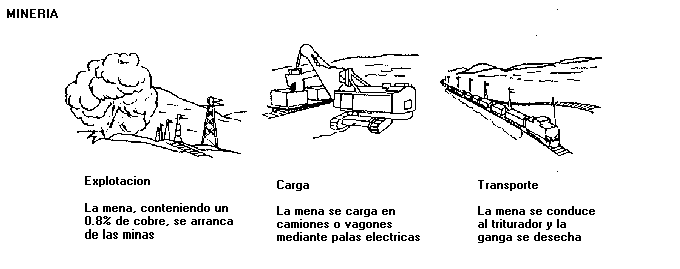
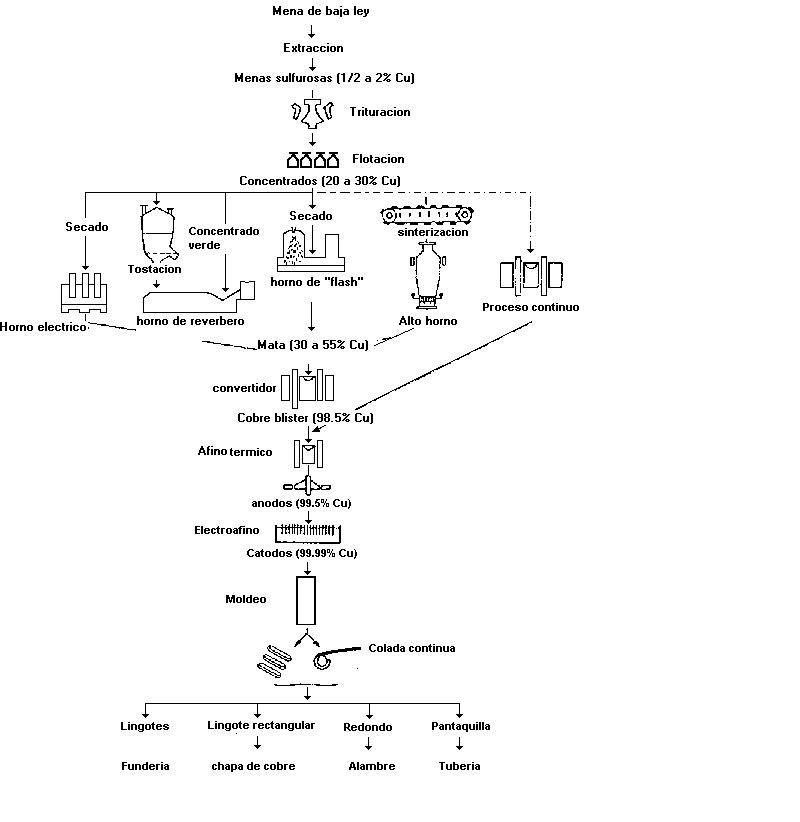
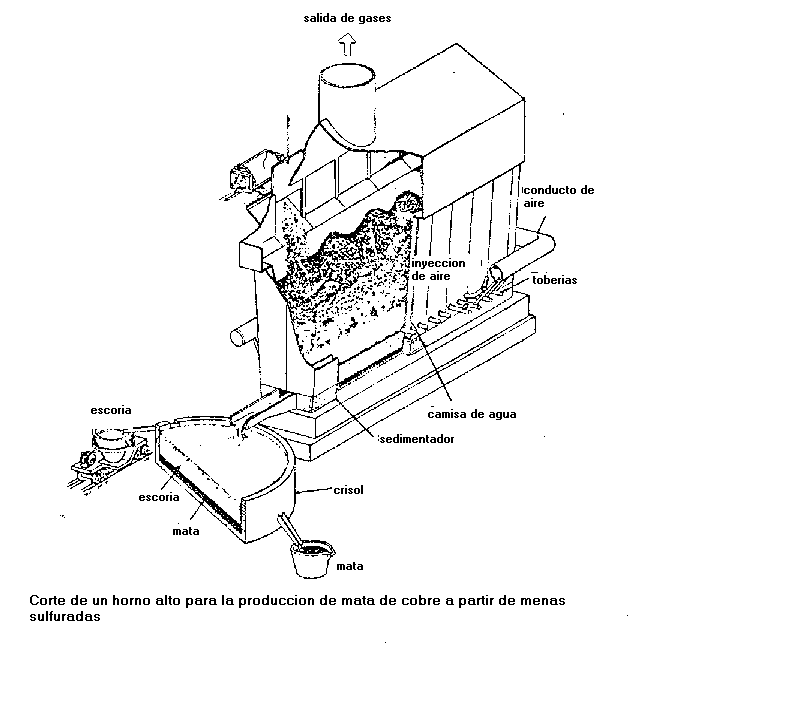
Extracción por vía seca o pirometalurgia: Es obtiene un cobre bruto, atravez de un concentrado denominado mata, El tratamiento de los sulfuros de cobre por vía seca comprende cuatro fases:
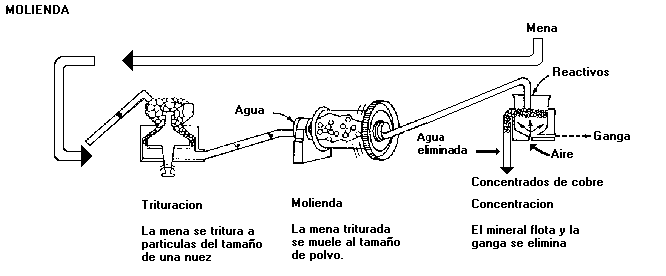
Concentración: el 90% de las menas de cobre sulfuradas, extraídas de las minas, se concentran por procedimiento de flotación. Mediante la adición de productos químicos como el isopropil, el cianuro sodico y el cal, que hacen flotar los sulfuros de cobre y deja los fulsuros de hierro en el fondo, debido a que el cal y el cianuro sodico forman la pirita.
Tostión previa del mineral: separación parcial del hierro, se elimina parte del azufre. Se hace en horno reverbero y se basa en los dos hechos siguientes:
El azufre tiene mayor afinidad para el cobre que separa el hierro.
El oxígeno tiene mayor afinidad para el hierro que separa el cobre.
Fusión: para obtener una mata, que hace pasar toda la masa metálica a estado liquido, produciendo reacciones químicas. De esta manera se separa la escoria procedente de la ganga y el oxido ferrico formado por la tostación. Para obtención de una mata con 35 % de Cu: El producto de la tostión precedente se funde en presencia de sílice, SiO2:
La sílice se combina con el óxido de hierro para dar silicato de hierro.
La ganga pasa al estado liquido.
La mata es un mineral de cobre enriquecido, con 35 % de Cu, y contiene también los metales preciosos.
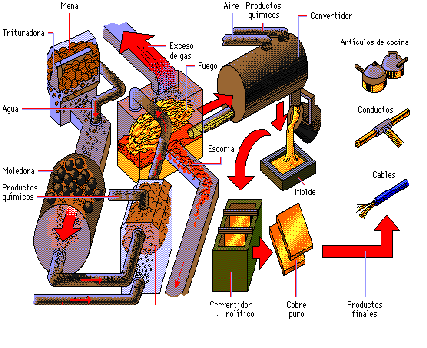
Conversión de la mata en cobre bruto. Conversión de la mata en cobre bruto. La operación tiene dos fases:
Fase: La mata fundida se introduce en un convertidor que no se envía el viento a través de la masa fundida y se oxida inmediatamente el hierro, transformándose el oxido ferroso en silicato por adición de sílice.
Fase: Se cuela la escoria y se vuelve a soplar. La temperatura se mantiene. El cobre oxidado reacciona sobre el sulfuro. Los metales preciosos pasan al cobre bruto o cobre negro. El cobre bruto se cuela en placas.
Afino: Se realiza en horno de cuba, en horno eléctrico o en horno de reverbero, para los concentrados finos, calentando a una temperatura de 1100ºC con el fin de obtener matas. El horno de cubas se utiliza preferiblemente para obtener cobre negro, que es apartir de de la fusión de chatarra. El afino del cobre bruto en el principio del ánodo soluble.
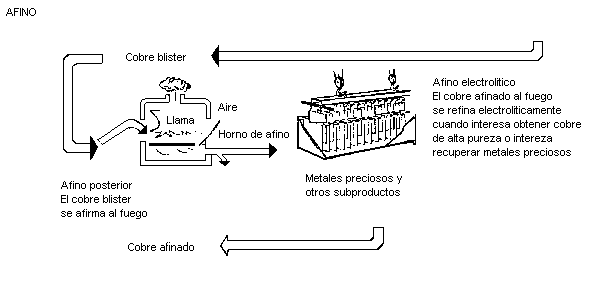
El cobre bruto que contiene 10 % de impurezas (compuestas de Fe, Zn, Bi, As, Sb, etc.) y los metales preciosos, se emplea como ánodo soluble. El electrolítico es una solución acuosa con 15 % de So4Cu, con un 5 % de ácido sulfúrico.
Extracción por vía húmeda. Este procedimiento, por disolución y precipitación, se aplica a los minerales muy pobres. La solución se trata bien por electrolisis o bien se desplaza el cobre por el hierro. Sobre la masa de hierro se cementa el cobre que se desprende periódicamente por golpeteo. Así se obtiene el cobre cáscara o cobre de cementación que se somete al afino.
PRODUCTOS COMERCIALES
En el mercado del cobre se distingue:
El cobre electrolítico, con 99,93%, de Cu, que se emplea en electricidad en forma de flejes, alambres, barras o cintas.
El cobre normal, de 99,25 %, muy empleado en la fabricación de latones.
Cobre de 96 a 97 %, empleado para la fabricación de aleaciones ordinarias o de SO Cu.
PROPIEDADES
Configuración electrónica: 1s22s2p63s2p6d104s1
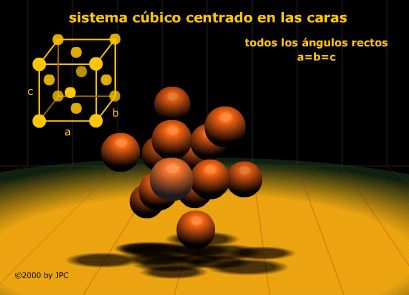
Es un metal de color rojizo característico que cristaliza en el sistema cúbico centrado en las caras.
A causa de muchas propiedades deseables como su conductividad eléctrica y calorífica, su resistencia a la corrosión, su maleabilidad y ductilidad y su belleza, el cobre se usa en una amplia variedad de aplicaciones.
Tiene poca actividad química y únicamente se oxida en el aire húmedo muy lentamente, recubriéndose de una capa de carbonato básico que lo protege de la corrosión posterior.
Su oxidación se favorece en medio ácido por lo que no es recomendable su uso en utensilios de cocina, ya que las sales que forma son eméticas (provocan vómitos).
Calentado al rojo se oxida y puede arder en el cloro y en el azufre.
Sólo es atacado por los ácidos oxidantes y puede formar complejos con algunas sustancias como por ejemplo el amoníaco.
El cobre forma dos series de compuestos químicos: cuprosos, en los que el cobre tiene valencia +1, y cúpricos, en los que tiene valencia +2. Los compuestos cuprosos se oxidan fácilmente a cúpricos, en muchos casos por la mera exposición al aire y son de poca importancia industrial; los compuestos cúpricos son estables.
Valores de las Propiedades
| 63,546 uma | |
| 1083,4 ºC | |
| 2567 ºC | |
| 8,9500 g/cm³ | |
| 2,8 | |
| + 0,34 V Cu2+ | Cu | |
| 401,00 J/m s ºC | |
| 595,8 (mOhm.cm)-1 | |
| 384,56 J/kg ºK | |
| 13,0 kJ/mol | |
| 305,0 kJ/mol | |
| 338,0 kJ/mol de átomos | |
| +1, +2, +3 , +4 | |
| 745,4 kJ/mol | |
| 1957,9 kJ/mol | |
| 3553,5 kJ/mol | |
| 118,5 kJ/mol | |
| 1,28 Å | |
| 1,17 Å | |
| Cu+1 = 0,96 Å | |
| 7,1 cm³/mol | |
| 6,7 ų | |
| 1,9 |
Resumen de Reactividad
| Con aire: | Suave; con calor —> CuO ; Cu2O |
| Con H2O: | No reacciona |
| Con HCl 6M: | No reacciona |
| Con HNO3 15M: | Suave; —> Cu(NO3)2 ; NOx |
ABUNDANCIA Y ESTADO NATURAL
El cobre ocupa el 25º lugar en abundancia en la corteza terrestre.
Se encuentra libre cerca del Lago Superior en Michigan, donde hay menas en cantidades económicamente importantes y, en menor proporción, en otras partes del mundo.
También se encuentra mezclado con otros metales como oro, plata, bismuto y plomo, y como sulfuros, sulfatos, carbonatos y óxidos minerales.
Los principales minerales son la calcopirita (mezcla de sulfuros de cobre y hierro), la azurita (carbonato básico de cobre) que se encuentra en Francia y Australia, la malaquita, también un carbonato básico de cobre, en los Urales y la cuprita, un óxido, que se encuentra en Cuba.
La producción mundial estimada es de 8,8 millones de toneladas anuales.
FORMA CRISTALIZADA
USOS DEL COBRE
Debido a que es muy dúctil, pueden hacerse cables de cualquier diámetro desde 0,025mm en adelante. La resistencia a la tensión del cable de cobre está en torno a los 4200 kg / cm²; se usa en líneas eléctricas de tensión y de telegrafía, así como también en la instalación eléctrica de interiores, cordones de lámpara y maquinaria eléctrica como generadores, motores, controladores, dispositivos de señalización, electroimanes y equipo de comunicaciones.
El cobre se ha usado para monedas a lo largo de la HISTORIA y también para utensilios de cocina, cubas y objetos decorativos. Durante mucho tiempo se usó para proteger el fondo de los buques de madera.
El cobre puede depositarse electrolíticamente con mucha facilidad, solo o sobre otros metales. Para este fin se usan grandes cantidades, particularmente para hacer planchas tipográficas para imprimir.
Ciertas soluciones de cobre tienen la facultad de disolver la celulosa y por ello se usan grandes cantidades de cobre en la fabricación del rayón.
El cobre se usa también en muchos pigmentos y en insecticidas y fungicidas, aunque normalmente ha sido reemplazado por productos químicos orgánicos sintéticos para este fin.
ALEACIONES DE COBRE
El cobre es muy tenaz y dúctil y se suelda bien, y muchas de sus aleaciones se caracterizan por una conveniente asociación de resistencia mecánica y ductilidad, si bien el trabajo mecánico continuado endurece el material con una disminución de la ductilidad, lo cual hace que la deformación continuada resulte progresivamente más difícil.
El cobre y sus aleaciones son muy útiles en la técnica y para los variados instrumentos industriales corrientes, y, así mismo, para las instalaciones químicas.
Las propiedades de cobre que inducen a su empleo en estas ultimas son:
Excelente resistencia a la corrosión para una amplia variedad de agentes.
Gran ductilidad, lo que permite ser hechurado en cualquier forma deseada.
Buena resistencia a tracción, que la mantienen a determinadas temperaturas.
Facilidad de soldadura según varios métodos.
El cobre es metal base de numerosas aleaciones:
Los latones, aleaciones de cobre y cinc;
Los bronces, aleaciones de cobre y estaño;
Las platas alemanas, aleaciones de cobre, níquel y un poco de cinc.
ALEACIONES DE COBRE
| Aleación composición | Condición | Resistencia A tracción Kg/mm2 | Limite elástico Kg/mm2 | Alargamiento % | Dureza | |
| Aleación hechurada monofásica | ||||||
| C 11000 ETP, 99.9 Cu | Recocida Agria | 22.5 35.1 | 7.0 28.1 | 45 6 | 40 RF 85 RF | |
| C 26800 65 Cu, 35 Zn | Recocida Agria | 32.3 52.1 | 9.8 42.2 | 65 8 | 88 RF 80 RB | |
| C 61400 91 Cu, 7 Al, 2 Fe | Agria | 57.6 | 28.1 | 35 | 90 RB | |
| C 71500 70 Cu, 30 Ni | Recocida Agria | 30.9 52.7 | 14.1 47.8 | 40 12 | 37 RB 85 RB | |
| Aleación hechurada polifásica | ||||||
| C 17200 98 Cu, 2 Be | Recocida Envejecida | 49.2 123 | 21.1 98.4 | 42 7 | 57 Rc 38 Rc | |
| Aleación moldeada | ||||||
| C 80100 91 Cu, 5 Sn, 5 Zn, 5 Pb | Moldeada | 17.6 | 6.3 | 40 | BHN 44 | |
| C 93700 80 Cu, 10 Sn, 10 Pb | Moldeada | 26 | 11.9 | 30 | BHN 60 | |
| C 96400 70 Cu, 30 Ni | Moldeada | 24.6 | 12.6 | 20 | BHN 60 | |
| C 82400 98 Cu, 2 Be | Moldeada | 47.8 | 26 | 28 | BHN 140 | |
| C 92600 88 Cu, 10 Sn, 2 Ni | Endurecida | 105.4 | 98.4 | 1 | 38 Rc | |
| C 95300 89 Cu, 10 Al, 1 Fe | Moldeada | 30.9 | 15.5 | 6 | BHN 85 | |
| Moldeada Tratada Térmicamente | 52.7 59.7 | 19 29.5 | 25 15 | BHN 140 BHN 174 | ||
LATONES
Aleación de cobre y cinc. El latón es más duro que el cobre, es dúctil y puede forjarse en planchas finas. Antiguamente se llamaba latón a cualquier aleación de cobre, en especial la realizada con estaño. Es posible que el latón de los tiempos antiguos estuviera hecho con cobre y estaño. La aleación actual comenzó a usarse hacia el siglo XVI.
Su maleabilidad varía según la composición y la temperatura, y es distinta si se mezcla con otros metales, incluso en cantidades mínimas. Algunos tipos de latón son maleables únicamente en frío, otros sólo en caliente, y algunos no lo son a ninguna temperatura.
Todos los tipos de esta aleación se vuelven quebradizos cuando se calientan a una temperatura próxima al punto de fusión. Véase Metalistería.
Para obtener latón, se mezcla el cinc con el cobre en crisoles o en un horno de reverbero o de cubilote. Los lingotes se laminan en frío. Las barras o planchas pueden laminarse en varillas o cortarse en tiras susceptibles de estirarse para fabricar alambre.
Los latones comprenden una amplia zona de aleaciones de cobre que contienen del 55 al 80% de cobre y el resto de cinc, con o sin la adición de cantidades relativamente pequeñas de otros elementos, principalmente estaño, plomo, hierro, manganeso, níquel, aluminio y silicio. Las propiedades de estas aleaciones varían desde las del cobre casi puro hasta las de los latones especiales, con una resistencia de tracción de unos 80 Kg/mm2 en estado de moldeo, lo cual se logra por adición de adecuadas combinaciones de los anteriores elementos. El metal de dorar es una aleación de 80 a 95% de cobre y de 20 a 5% de cinc.
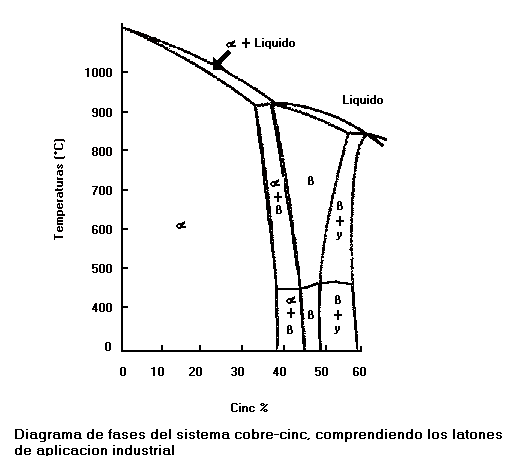
El diagrama de fases del sistema cobre-cinc es típico de las asociaciones complejas de disoluciones y fases intermedias que concurren en los sistemas Cu-Zn, Cu-Al, Cu-Be y Cu-Si. Afortunadamente, las aleaciones útiles de estos sistemas, generalmente, corresponden a regiones de la disolución sólida rica en cobre, y la fase alfa( ), en todas ellas, tienen la estructura del cobre, modificadas las dimensiones por la presencia del segundo elemento en disolución sólida.
En todos los sistemas metálicos existe una cierta relación entre las propiedades mecánicas y la microestructura. En el caso de las aleaciones cobre-cinc, en términos generales ocurre:
Propiedades mecánicas de latones colados en arena
| Cinc % | % Fase Alfa | Resistencia a tracción Kg/mm2 | Alargamiento % sobre 50 mm |
| 33.7 38.0 41.8 45.5 | 100 75 55 0 | 23.6 33.9 38.7 47.9 | 63 56 50 27 |
La resistencia a tracción y él limite elástico aumentan al crecer la proporción de cinc, se produce un salto al aparecer la fase ß, alcanza el máximo a la composición correspondiente a partes iguales de alfa( ) y ß, y en cuanto aparece la fase y desciende, rápidamente, la resistencia a la tracción.
El alargamiento asciende hasta un máximo y comienza a disminuir antes de alcanzar la composición limite de la disolución sólida alfa( ) a medida que aumenta la cantidad de ß disminuye considerablemente el alargamiento, y este es muy pequeño en presencia de ý.
La fase alfa( ) tiene la mayor resistencia al choque, pero disminuye en cuanto aparece ß, y la aleación es muy frágil cuando contiene Ý.
La dureza aumenta mucho con la presencia de ß y aun más con la de Ý.
Las aleaciones que solo contienen alfa( ) se trabajan muy bien y se pueden laminar en caliente y en frío; las que contienen alfa( ) y ß solo se pueden laminar en caliente, pues en frío se deforman muy poco sin que haya rotura.
Las aleaciones estrictamente de cobre-cinc, que forman la base de la serie completa de latones, se dividen en tres grupos principales:
-
Latones alfa: que contienen hasta un 39% de cinc.
-
Latones alfa-beta: que empiezan a formarse a un 37.5% de cinc aproximadamente y terminan en la proporción de un 45%.
-
Latones beta: que comprenden los de un 46 a un 50%, aproximadamente de cinc.
A un valor próximo al 50% de cinc comienza la aparición de la fase Ý, que hace que le material sea frágil.
Latones forjados comerciales y sus usos
| Nombre Corriente | % de cinc | Aplicaciones |
| 5 | Imitación de oro, joyería, emblemas. |
| 10 | Bisutería, embutición, forjados, pequeña ferretería, tales como tornillos y remaches |
| 15 | Embutición, entalla, estampado, radiadores de automóvil y tubos resistentes a la corrosión. |
| 20 | Artículos estirados y estampados, tubos flexibles; buena resistencia a la corrosión. |
| 30 | Mejor zona para la embutición; también se denomina “70-30” y “latón de embutición”. |
| 34 | Alfileres, roblones instrumentos musicales, clavijas eléctricas, vainas de cartuchos; excelente para la embutición, económico por su menor contenido de cobre. |
| 40 | Representativo de los latones alfa-beta, mejores propiedades para la tracción; las mejores propiedades para el trabajo en caliente. |
Latones: Se distinguen dos clases: los latones ordinarios, a partir de Cu y de Zn, y los latones especiales, que contiene uno o dos metales más aparte del cobre y el cinc.
Latones ordinarios. Son aleaciones de Cu y Zn con más de 55 % de cobre. Presenta sobre el cobre las ventajas siguientes: 1; precio mas bajo: 2; mayor facilidad para el moldeo; 3; gran maleabilidad; 4; gran resistencia mecánica y dureza más elevada; 5; mayor resistencia a los agentes atmosféricos.
Latones para bisutería, con 80 a 85 % de Cu. Ejemplo es el similor o tompac.
Latones mecánicos: embutición ( latones 70- 30, con 70 % de Cu): de fácil mecanización ( 55 a 50 % de cobre.
Latones de soldadura fuerte: soldaduras del hierro ( 70 a 90 % de Cu); del cobre ( 55 a 45 %)
Latones especiales: cuando se requiere un aumento de dureza o de resistencia a la tracción se añade a las aleaciones cobre/cinc 60/40, aluminio, hierro, manganeso, estaño, níquel y algunas veces silicio. Utilizado en tubos de condensación
Son aleaciones Cu- Zn a las que se añaden uno o varios elementos: Pb, Mn, Fe, etc.
Latones al plomo- 1 o 2 % de plomo facilitan la mecanización.
Latones al hierro o metales delta ( 55 % de Cu, 42 % de Zn, 1.5 % de Fe, 1 % de Mn): - son aleaciones muy maleables y resistentes a la corrosión para hélices, válvula y turbinas de vapor.
Latones al manganeso, - Se añade 2 a 4 5 de Mn a los latones con 60 % de Cu para aumentar la resistencia a la tracción y el limite elástico ( hélices de barcos, árboles de hélice). Un ejemplo es el metal Roma ( 58 % de Cu, 40 % de Zn, 2 % de Mn).
Latones al estaño.- con la composición 60% de Cu, 23 % de Zn y 2 % de Sn resisten muy bien a la corrosión por el agua del mar, empleándose para bombas y en construcción naval.
Los latones se emplean mucho cuando se necesita embutir, aunque por su tendencia a empañarse o deslustrarse al estar expuestos a la interperie conviene en muchos casos, protegerlos con un recubrimiento.
Latones rojos
Contienen menos de un 20% de cinc; se pueden trabajar en caliente entre 750° y 900°, a partir del lingote, pero es corriente terminarlos por laminado o estirado en frío.
La plasticidad de estos metales es mayor cuanto menos cinc contienen; se caracterizan por ser muy resistentes a la corrosión y no sufren descincificación ni la corrosión intergranular en ciertos ambientes. Son mas caros y dentro de este grupo se encuentran tres tipos que son:
-
Metal de dorar
-
Bronce comercial
-
Latón rojo
-
Latón bajo :Una cuarta aleación, se incluye, a veces, en este grupo, pero, en realidad, las propiedades son intermedias entre los latones rojos y los amarillos.
Latones amarillos: contienen 20 al 35% de cinc y sólo una pequeña proporción de estaño y plomo. Las aleaciones con mayor cinc son mas fácil de moldear que los de menor y la resistencia ala corrosión es mas pequeñas. Es usado para combatir la corrosión.
BRONCES
BRONCES: el termino bronce se aplica a las aleaciones de cobre distintas a de los latones, que mantienen el color del cobre y en las que predomina este elemento.
Cualquiera de las distintas aleaciones compuestas sobre todo de cobre y estaño. Ni los bronces modernos ni los antiguos contienen sólo estos dos metales. Los griegos y los romanos añadieron cinc, plomo y plata a las aleaciones de bronce para usarlas en herramientas, armas, monedas y objetos de arte.
El cinc, el plomo y otros metales se encuentran ocasionalmente en el bronce que se fabrica hoy. Los componentes del bronce varían; así, cuando contiene al menos un 10% de estaño, la aleación es dura y tiene un punto de fusión bajo. Los nombres de las variedades de bronce provienen de los componentes adicionales, como el bronce al aluminio, el bronce al manganeso y el bronce al fósforo.
El bronce es más resistente y duro que cualquiera otra aleación común, excepto el acero, que le supera en resistencia a la corrosión y facilidad de lubricación. El bronce moderno se utiliza en la fundición artística y en la fabricación de instrumentos sonoros.
Los bronces se utilizan según su aleación en forma de alambres, o bandas para muelles o resortes de todas clases, mallas y otro propósitos, y los bronces complejos en forma moldeada, tanto para antifricciones como para aplicaciones generales de ingeniería.
La ductilidad de los bronces es mayor que la de los latones, se pueden laminar, estirar en frió y darles la dureza por estos medios.
Cuando en un bronce se disminuye en mayor proporción el estaño que el cinc la conductibilidad térmica y eléctrica son mejores.
Bronces ordinarios: Son aleaciones Cu-Sn con mas de 70% de Cu; con contenidos menores se obtienen productos quebradizos. Se distinguen:
Bronces maleables para medalla, con 4 a 10% de Sn.
Bronces mecánicos para engranajes, con 9 a 12% de Sn.
Bronces mecánicos para cojinetes, con 15 a 20% de Sn.
Los bronces de campanas y artísticos, 20 a 30% de SN.
Bronces especiales: Son aleaciones ternarias o cuaternarias.
Bronces al cinc.- aumenta la maleabilidad y la facilidad de moldeo. ejemplos:
Bronce de monedas: 95 % de Cu, 4% de Sn, 1% de Zn.
Bronce artístico duro: 90% de Cu; 8% de Sn, 2% de Zn.
Bronce de orfebrería: 75% de Cu, 5% de Sn, 20 % de Zn.
El bronce con 5% de estaño en una aleación alfa se emplea para monedas y medallas.
Si se le añade 1% de cinc se puede utilizar para estatuas, placas, puertas, válvulas y otros elementos relacionados con las técnicas del vapor.
La mayoría de las campanas se hacen en bronce y el mejor sonido lo dan cuando contienen 20-22% de estaño y cantidades variables de cinc y plomo.
La aleación es dura, relativamente frágil y requiere una gran destreza para el molde y recocido, con el fin de evitar tensiones perjudiciales.
Bronces al plomo.- El plomo mejora la calidad frente al frotamiento y auto lubrica; para evitar la separación del plomo en el estado liquido se añade níquel o cinc.
Ejemplos: Bronces mecánicos. 885 de Cu, 9 % de Sn, 25 de Pb, 1% de Zn.
Bronces fósforos- Trazas de fósforos; sirven para eliminar los óxidos, particularmente el Cu: O, y para aumentar la dureza y disminuir las sopladuras. Ejemplo: 89 % de Cu, 8 % de Sn, 2 % de Zn, 0,1 % de P.
Las aleaciones de 9-13% de estaño y de 0.3-1.5% de fósforo se emplean para piezas de maquinarias que requieren una superficie antifricción capaz de soportar grandes pesos, asociada con bajo coeficiente de fricción, tales como engranajes y válvulas de corredera
PLATAS ALEMANAS ( MALECORTS)
Platas alemanas: Son aleaciones ternarias Cu- Zn- Ni, inalterables, de un aspecto blanco que justifica su empleo en bisutería.
Estas aleaciones para la joyería de imitación tienen 50 a 65 % de Cu, 7 a 30 % de Ni y 10 a 35 % de Zr. Reciben muy diversos nombres: plata alemana, plata nueva, argentán, alpaca, packfong, etc.
La aleación mas empleada para vajillas y cubiertos contienen 60% de Cu, 20% de Ni y 20% de Zn.
OTRAS ALEACIONES
Aleaciones con manganeso y silicio.
El cupromanganeso, con 4 a 5 % de Mn, se emplea en hogares de locomotoras.
Los cuprosilicios, la adición de silicio aumenta la resistencia a la tracción, los hilos telefónicos, con 0.1% de Si, son tan buenos conductores de la corriente como el cobre puro y en cambio la resistencia mecánicas es más grande.
Bronces de aluminio: Las aleaciones de cobre y aluminio, son de tres tipos:
Tipo I: 92 a 90 % de Cu y 8 a 10% de Al, color como el oro, un bello pulimiento y resistente a la corrosión, se lamina en caliente y toman temple.
Tipo II: Para monedas se han empleado aleaciones con 8% de Al, 0.5% de Mn y 91.5% de Cu.
Tipo III: La adición de hierro y níquel produce aleaciones con propiedades mecánicas muy parecidas a las del acero semiduro recocido; se utiliza en construcción naval. Composición 80% de Cu, 5% de Ni, 5% de Fe y 10% de Al. Templadas desde 800 grados.
Soldaduras fuertes: Las aleaciones para soldaduras fuertes son aleaciones que unen los materiales formando aleaciones con ellos. Su punto de fusión es inferior al de los metales que unen ( no hay fusión de estos como en la soldadura autógena). Se utiliza el bórax como fundente.
HECHICERO Página 11 10/05/01



Descargar
| Enviado por: | Hechicero |
| Idioma: | castellano |
| País: | Colombia |
