Química
Determinación del número de transporte
Repaso de Física-Química
Determinación del número de transporte
Definición de número de transporte
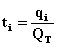
Se define el número de transporte o de transferencia ti de un ion ![]()
como la fracción de la corriente o carga total que atraviesa la solución, transportada por los iones de ese tipo, esto es:
donde qi y QT representan la carga transportada por los iones en cuestión y la carga total respectivamente mientras que Ii e IT representan la corriente transportada por los iones estudiados y la total respectivamente.
Determinar el numero retransporte de un iòn significa poder cuantificar la contribución del mismo a la corriente total que circula a través de una superficie de referencia, como consecuencia de la existencia de un gradiente de potencial eléctrico, pero en ausencia de un gradiente de potencial eléctrico, pero en ausencia de un gradiente de potencial químico. Entonces el problema radica en el diseño de un dispositivo en el cual se pueda verificar este fenómeno y que a su vez permita la determinación cuantitativa del numero de transporte.
Para generar un campo eléctrico dentro de un electrolito se colocarán dos electrodos y se aplicará entre ellos una diferencia de potencial. Si los electrodos son, como en este caso, de Cu y el electrolito es CuSO4, se producirán las siguientes reacciones de electrodo como consecuencia de la diferencia de potencial aplicada:
Cátodo: Cu++ + 2e- Cu0
Ánodo: Cu0 Cu++ + 2e-
Esto implicará el consumo (cátodo) y la producción (ánodo) de Cu++, con lo cual se dará origen a un gradiente de concentración en las proximidades de los electrodos que en principio sería un obstáculo para la determinación del número de transporte.
Diferentes métodos para la determinación de los números de transporte
Se han desarrollado numerosos métodos para la determinación de los números de transporte que pueden agruparse en tres grupos fundamentales:
-
Método de Hittorf : basado en la determinación del cambio de concentración de la solución en las proximidades de los electrodos al paso de la corriente.
-
Método de la interfase móvil: basado en la determinación de la velocidad de movimiento al paso de la corriente de la interfase formada por dos soluciones con un ion común en contacto.
-
Método basado en la determinación de fuerzas electromotrices de celdas de concentración adecuadas.
Sólo se explica el primer método por ser el de interés.
Determinación del número de transporte por el método de Hittorf
Existen numerosas variantes del método, pero en todos los casos se basa en el empleo de una celda, como la indicada esquemáticamente el la figura, dividida por tabiques porosos u otro medio en tres compartimientos:
-
Uno que contiene al cátodo y que llamaremos “compartimiento catódico”
-
Otro que contiene al ánodo y que llamaremos “compartimiento anódico” y
-
Un “compartimiento intermedio” que no contiene ningún electrodo.
A: Compartimiento anódico.
C: Compartimiento catódico.
I: Compartimiento intermedio.
V: Fuente de tensión directa.
Q: Coulómetro.
mA: Miliamperímetro
Mediante una fuente de corriente directa adecuada, se pasa por la celda una carga QT, cuya magnitud puede conocerse exactamente colocando, por ejemplo, un columbimetro en serie con la celda.
La hidrólisis del agua ocurre por la reacción:
2H2O 2H+ + 2OH-
2OH- H2O + ½O2 + 2 e -
En este compartimiento sólo se desprende oxígeno de manera que no ocurre nada con los iones sulfató, con los iones cobre ni con los iones hidronio.
El ión sulfato tendría la siguiente reacción:
SO4 -2(ac) SO4 + 2 e - (2)
Pero como el SO4 no es nada estable, esta reacción no sucede. Este compuesto prefiere quedarse en solución.
Al ión cobre no le pasa nada en el compartimiento anódico debido a que este no es estable oxidándose más, por lo que se queda como esta Cu +2 (ac).
Por la misma razón que el ión cobre con el hidronio no pasa nada.
Como en la oxidación del ánodo se desprenden electrones estos pasan a los electrodos del columbímetro a través del cable que los conecta cargando negativamente al electrodo que se convierte en el cátodo.
Para cualquiera de las 2 regiones; anódica o catódica; cuando haya circulado una cantidad de carga eléctrica igual a Q culombios, se cumplirá:
96.484 C ______ t- eq. SO4Cu
Q C______ Δ eq. SO4Cu
Por lo tanto, se deberá determinar la cantidad de carga eléctrica circulada durante la electrolisis y los equivalentes de SO4Cu involucrados, ganados o perdidos según se trate del compartimento anódico o catódico respectivamente.
Descargar
| Enviado por: | Raùl Rodriguez |
| Idioma: | castellano |
| País: | España |
