Biología, Botánica, Genética y Zoología
Conservación de Semillas
1. Introducción
Recursos fitogenéticos.
Desde la aparición de la vida en la Tierra, el proceso evolutivo ha originado una enorme diversidad de especies e individuos que mediante los procesos de selección permanente se han adaptado a las diferentes condiciones del globo. Esta variabilidad genética acumulada resulta esencial para el equilibrio del sistema.
Los recursos genéticos vegetales son la suma de todas las combinaciones de genes producidos durante el proceso de evolución de las plantas y se denominan recursos porque implican que el material tiene o puede tener valor económico o utilitario actual o futuro. Bajo esta definición se incluyen normalmente las categorías siguientes: variedades de especies cultivadas, tanto tradicionales como comerciales; especies silvestres o asilvestradas afines a las cultivadas o con un valor actual o potencial, y materiales obtenidos en trabajos de mejora genética (Esquinas- Alcázar 1993).
Los recursos fitogenéticos constituyen un patrimonio de la humanidad de valor incalculable y su pérdida es un proceso irreversible que supone una grave amenaza para la estabilidad de los ecosistemas, el desarrollo agrícola y la seguridad alimentaria del mundo:
“Los recursos genéticos vegetales de los que depende la seguridad de la alimentación están desapareciendo a un ritmo alarmante” (FAO, 1996)
Con la aparición de la agricultura, el hombre empieza a intervenir de forma decisiva en la evolución natural de las plantas que cultiva. Las poblaciones de plantas cultivadas empiezan a sufrir fuertes presiones selectivas debido a las prácticas agrícolas, siendo el resultado la aparición de características morfológicas y fisiológicas peculiares como pueden ser el gigantismo en los frutos, el aumento de la producción, la reducción de la dehiscencia de las semillas, la germinación rápida y uniforme o la pérdida de capacidad de competir con la vegetación natural.
Los cultivos primitivos se fueron extendiendo desde sus lugares de origen, transportados por migraciones primero y rutas comerciales después, encontrándose condiciones diversas de clima, suelo, vegetación y otros factores ambientales. De esta forma, las poblaciones de plantas cultivadas evolucionaron de forma diferente según las características de las nuevas zonas y las distintas prácticas agrícolas utilizadas y, en numerosos casos, se produjeron intercambios de genes o formación de híbridos con las especies silvestres de las nuevas localidades.
El resultado de la acción del hombre y la selección natural a lo largo de miles de años sobre las miles de especies utilizadas a lo largo de la historia de la humanidad, ha sido el establecimiento de una diversidad vegetal constituida por un enorme número de variedades y genotipos locales, caracterizados por su adaptación a las necesidades humanas y al medio ambiente.
Erosión genética.-
Desde hace 200 años, como consecuencia del desarrollo agrícola e industrial y la progresiva unificación de hábitos culturales y alimenticios, el número de cultivos y la heterogeneidad dentro de los mismos han ido descendiendo progresivamente y, en la actualidad, el 90% de la alimentación mundial está basada en sólo unas 30 especies vegetales y unas docenas de variedades.
La pérdida de diversidad se acentuó entre los años 1940-50 cuando el desarrollo de la mejora genética dio lugar a la introducción de variedades comerciales, uniformes y mucho más adaptadas a las técnicas modernas de cultivo y a los nuevos sistemas de comercialización, siendo incuestionable el beneficio obtenido de ello por una población mundial creciente y subalimentada.
Sin embargo, como contrapartida, las variedades modernas, con una base genética muy reducida, han ido desplazando a innumerables variedades tradicionales, heterogéneas y menos productivas, pero altamente adaptadas a su ambiente local y poseedoras de una gran diversidad genética.
La pérdida de variabilidad genética supone una limitación de la capacidad de responder a nuevas necesidades y un incremento de la vulnerabilidad de nuestros cultivos frente a cambios ambientales o aparición de nuevas plagas o enfermedades.
La hambruna que en el siglo XIX produjo la muerte y emigración de millones de irlandeses es probablemente el ejemplo más dramático constatado del peligro de la uniformidad genética. La estrecha base genética de las patatas cultivadas en ese momento en Europa hizo que un ataque de tizón (Phytophtora infestans) arrasase unas cosechas que constituían la base de la alimentación de Irlanda en esa época. Otro desastre agrícola causado por la uniformidad de los cultivos tuvo lugar en Estados Unidos en 1970, donde un ataque de taladro (Helminthosporium maydis) destruyó más del 50% de los maizales del Sur, siendo este hecho el detonante para que este país iniciase una política de conservación de recursos fitogenéticos. Muchos casos similares se han multiplicado recientemente, poniendo en peligro la estabilidad económica y social de algunos países.
El reconocimiento de la erosión genética como un problema grave tiene lugar en los años 50, cuando el desarrollo agrícola empieza a alcanzar a las regiones del planeta con mayor diversidad genética, siendo en este momento cuando se empiezan a poner en marcha medidas globales para preservar los recursos fitogenéticos.
Acciones que derivaron en la situación actual de los recursos naturales y las causantes de la erosión genética vegetal.-
Se podrían destacar las modificaciones producidas en el sector agrario: en un principio se produce el paso de una agricultura tradicional a otra moderna, para satisfacer la demanda alimentaria de la población urbana, se necesita un aumento de las producciones agrícolas. Se producen procesos de concentración de las explotaciones agrícolas dando lugar a una caída del número de estas y de la población activa dedicada a la agricultura; debido al éxodo rural y al abandono de las tierras marginales.
La agricultura comienza una relación más estrecha con el conjunto del sistema económico, apareciendo la imagen del empresario agrícola e industria agrícola. Esto está ligado a un proceso de modernización, derivado de un avance tecnológico importante que origina grandes modificaciones en las condiciones de producción agrícola; tanto en el material vegetal como en el cultivo.
Además el fenómeno de internacionalización y el marketing, provocan un cambio en los gustos y preferencias de la población, estandarizándolos criterios de calidad de los productos agrícolas en los países desarrollados. Se imponen los productos perfectos, no perecederos, con más apariencia que sabor, debido tanto a la producción fuera de estación como al propio material vegetal.
Luego, los cambios en la densidad de población, el aumento en el nivel de vida de la población desarrollada y el hecho evidente de que ese tipo de agricultura es insostenible y produce problemas severos inmediatos y futuros; hacen que se vuelva a plantear un nuevo cambio en el sector agrario y en las políticas agrarias. Un paso de esa agricultura moderna a otra de carácter sostenible, en la que se mantengan los niveles de producción para satisfacer las aspiraciones de la población mundial, siendo económicamente viable, pero sin degradar el medio ambiente y conservando los recursos naturales.
El consumidor de esta nueva etapa, empieza a buscar en los productos alimentarios algo más que apariencia, exige productos de mayor calidad y libres de contaminantes, así como también empieza a buscar soluciones a los grandes problemas medio ambientales con nuevos cultivos industriales que produzcan materias primas no alimentarias menos contaminantes. Pero para que esto sea posible, la biodiversidad de las plantas nativas o introducidas resulta fundamental.
Biodiversidad agrícola.-
Dentro del conjunto de la diversidad biológica es quizá la diversidad agrícola la que tiene un interés más claro e inmediato para el hombre. Se entiende por biodiversidad agrícola a la totalidad de especies animales, vegetales y de microorganismos y todas las variedades o razas de los mismos, producidas por la acción conjunta y recíproca del medio ambiente, los recursos genéticos y la gestión y prácticas humanas. Las acciones del hombre a lo largo de la historia de la agricultura son, quizá las que determinan en mayor medida la biodiversidad agrícola de la que disponemos.
Los primeros agricultores se limitaban a dispersar en las cercanías de sus viviendas las semillas de frutos que habían recolectado de plantas silvestres. Desde ese momento la variabilidad genética de las plantas que son sembradas comienza a disminuir, ya que se escogen unas y se rechazan otras. Este proceso transportado a un periodo de miles de años da como resultado una pérdida constante de genes en las poblaciones cultivadas.
Es por esta razón que al hablar de biodiversidad son igual de importantes todas las especies cultivadas, todas las variedades de un mismo cultivo, las especies acompañantes de los cultivos, las malas hierbas y las especies silvestres de las que provienen los cultivos. Esta importancia se centra en la existencia de caracteres, en definitiva genes, que pueden estar presentes en unas variedades y en otras no. Muy a menudo cuando se obtienen variedades productivas y apetecibles, ha aparecido otro tipo de problemas, como la sensibilidad a factores ambientales o a enfermedades y plagas, que han tenido que ser solucionados con la ayuda de variedades más rústicas o de especies silvestres relacionadas.
En España debido a la diversidad de climas y condiciones ambientales locales existentes, así como a la influencia de muchas y diferentes culturas a lo largo de siglos, se ha desarrollado una enorme diversidad de productos agrícolas que suponen la base de una alimentación sana, rica y equilibrada, y que además aportan productos o materiales de utilidad.
La conservación de los recursos vegetales supone el mantenimiento de las poblaciones, bien sea in situ (en el lugar de sonde provienen) o ex situ (en bancos de colecciones de germoplasma), al considerar que estos materiales son útiles o potencialmente útiles para su uso y manejo actual y futuro.
La importancia de la conservación radica en la potenciabilidad de uso de los recursos a conservar. Es decir, actualmente se utilizan una serie de especies determinadas y determinadas variedades dentro de cada especie. Esto es algo que cambia con el tiempo, en función de las demandas de los consumidores, de los problemas que pueden surgir en el cultivo, etc. Antiguamente cada agricultor tenía en su huerto unas variedades diferentes a las del vecino, que hoy día conocemos como variedades tradicionales. En la actualidad existe una tendencia muy acentuada hacia el monocultivo, existiendo grandes extensiones de terrenos en las que se cultiva una única variedad de una misma especie. Esto, que es muy beneficioso a nivel comercial por la homogeneidad de la producción, es enormemente peligroso a nivel genético, ya que se produce un importante empobrecimiento de la variabilidad. Esto quiere decir que cuando surge un problema como una enfermedad o una plaga, al igual que ocurrió en EEUU, esta afecta a esa gran superficie de cultivo por igual, cosa que no sucedía del mismo modo cuando el campo tenía varios cultivos y variedades.
Con el sistema de cultivos que existe actualmente en nuestros campos la conservación de la biodiversidad agrícola no es una tarea sencilla. En principio se necesita recolectar el material a conservar, cosa que cada vez es más difícil por la creciente desaparición de variedades tradicionales. También es necesario un conocimiento previo de lo que se quiere conservar y cómo debe realizarse el manejo de esos materiales. Hay que conocer cada cultivo y saber en que estado se encuentran sus recursos, qué es lo que más peligro de desaparición corre y tener un profundo conocimiento de sus ciclos y requerimientos para poder manejarlo adecuadamente, así como del tipo y condiciones de conservación más apropiados, ya que la conservación no es más que un paso previo para la posterior utilización de los materiales vegetales conservados.
Utilidad de la conservación de los recursos vegetales.-
La utilización y aprovechamiento del material vegetal conservado depende del conocimiento que se tenga de sus características y utilidad de mantenerlo viable y disponible.
El material vegetal conservado se puede utilizar de manera directa o indirecta. La utilización directa consiste en introducir los recursos en determinadas zonas en función de sus características. Esto implica la utilización con fines productivos, o bien la reintroducción de especies o variedades en zonas en que se han perdido o dejado de cultivar, o bien la restauración de hábitats o paisajes, así como aplicaciones industriales directas.
La utilización indirecta consiste en mejorar las variedades disponibles mediante la introducción en las mismas de genes de interés provenientes de especies silvestres o variedades tradicionales. Este tipo de utilización es lo que conocemos como mejora genética vegetal y su objetivo es incrementar la producción o mejorar la calidad o introducir resistencias en los cultivos. Para obtener variedades mejor adaptadas y con rendimientos más elevados, los mejoradores deben contar con recursos genéticos adecuados y suficientes. Los recursos genéticos en general, incluyendo cultivares primitivos, malas hierbas y especies silvestres relacionadas son la base para el desarrollo de nuevas variedades.
2. Semillas ortodoxas y recalcitrantes
Tiene un gran interés, en cuanto a lo que la conservación se refiere, la distinción de semillas ortodoxas y recalcitrantes.
Las semillas ortodoxas son aquellas que pueden conservarse en condiciones de baja humedad y baja temperatura. Son de este tipo las semillas de leguminosas y cereales de climas templados (trigo, cebada, garbanzo, habas, etc.).
Las recalcitrantes son las que no pueden desecarse sin pérdida de viabilidad ni mantenidas a baja temperatura sin sufrir daños graves. En este grupo se encuentran entre otras, las de caña de azúcar, cocotero, té, caucho, castaño y cítricos.
Sólo se pueden conservar en bancos de semillas las ortodoxas; las especies con semillas recalcitrantes han de conservarse por cualquier otro procedimiento, en particular mediante colecciones de plantas vivas y, en función de que sea posible, de cultivo de tejidos in vitro. Se estima que se han colectado y conservan en aproximadamente 1300 bancos de germoplasma unos seis millones de muestras. Pero no todos los bancos ni todas las muestras se encuentran en condiciones óptimas.
Una tercera categoría de comportamiento de las semillas en almacenamiento ha sido demostrada recientemente con semillas de café, palma aceitera, papaya y neem; son las denominadas semillas intermedias. La principal característica de este comportamiento es cierta sensibilidad a la desecación hasta un nivel de humedad relativamente bajo de 7 a 10% (en equilibrio con una humedad relativa ambiental de 30-50%). Sin embargo, la longevidad de las semillas secas de origen tropical se reduce en temperaturas bajas (por debajo de 5°C) y temperaturas bajo cero. Por esto, las condiciones ideales para el almacenamiento a largo plazo de semillas ortodoxas (5% de contenido de humedad, -18°C) son potencialmente dañinas para las semillas intermedias y no deben usarse ya que les provoca la muerte en pocos meses. A pesar de esto, es posible almacenar las semillas "intermedias" por periodos de alrededor de 10 años, desecándolas hasta un 7-10% de contenido de humedad, y manteniéndolas a la temperatura de un laboratorio.
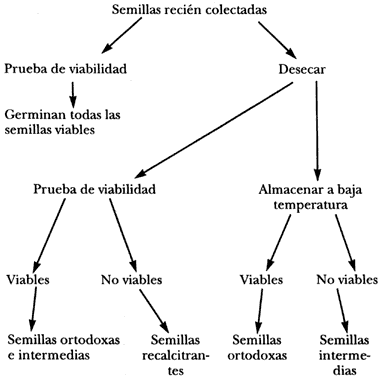
Pruebas sencillas para definir si una semilla es ortodoxa o recalcitrante:
A pesar de que es posible hacer presunciones acerca del comportamiento de una especie de semilla en almacenamiento basándose en su tamaño, apariencia, historia de vida y filogenia, es necesario hacer pruebas para saber con precisión el comportamiento de cada especie en particular. La prueba se inicia dividiendo una porción de semillas en dos partes iguales. Se prueba la viabilidad de una de las fracciones de semillas frescas y la otra mitad se somete a una desecación gradual y cuidadosa antes de probar su viabilidad. Para completar, una prueba adicional que se realiza antes y después de someter las semillas a congelación, indicará si las semillas que toleran la desecación son ortodoxas verdaderas o intermedias.
Número de individuos de los cuales deben recolectarse las semillas:
Las semillas deben recolectarse a partir del mayor número posible de plantas individuales. El mínimo de individuos aceptable para conservar algo de la variabilidad que se encuentra en la población de una localidad es de 30 o más, siempre y cuando dichos individuos sean producto de reproducción sexual y no clonal, lo cual no siempre es fácil de percibir. Un número mayor de individuos y áreas de recolección más amplias permiten una mejor representación de tal variabilidad. Las semillas de cada genotipo materno deben mantenerse separadas si se desea mejorar la variación genética durante la multiplicación.
Cuando se recogen semillas de plantas anuales o perennes de corta vida no debe recolectarse más de 20% de la cosecha local total, ya que de otra manera podría resultar afectada su posibilidad futura de sobrevivencia. Esto es particularmente importante para las especies de plantas raras, con potencial reproductivo reducido o en plantas en vías de extinción.
3. Análisis de la semilla
La semilla de buena calidad tiene las características siguientes: reproduce con fidelidad las características genéticas de la especie o cultivar, tiene capacidad para una germinación elevada, está libre de enfermedades e insectos y está exenta de mezclas con otras semillas de cultivos, semillas de malezas y de material extraño e inerte. La capacidad de germinación y la pureza de las semillas pueden determinarse haciendo un análisis de una pequeña muestra representativa del lote en cuestión.
Dicho análisis proporciona información para cumplir las normal legales, determina la calidad de la misma y permite establecer la densidad de siembra necesaria para tener cierta población de plántulas. Cuando la semilla se ha almacenado por un tiempo largo, es conveniente volver a analizarla.
Muestreo
El primer paso para llevar a cabo un análisis de semillas es conseguir una muestra uniforme que represente el lote que se está considerando. Para ello se toman porciones iguales de semillas en partes del lote uniformemente distribuídas. Las muestras así tomadas se mezclan y luego se dividen en lotes más pequeños para tener la muestra de trabajo. La cantidad de semilla requerida para la muestra de trabajo varía según las clases de semillas.
Análisis de pureza
Se entiende por pureza el porcentaje en peso de “semilla pura” presente en la muestra. Por “semilla pura” se entiende a la especie, variedad o tipo, que define en forma principal la semilla presente en el lote. Después de haber pesado la muestra de trabajo, se divide visualmente en:
La semilla pura de la clase que se está considerando.
Semillas de otras plantas de cultivo.
Semillas de maleza.
Materia inerte.
Al hacer el análisis de pureza se puede calcular el número de semillas puras por kilogramo. Este dato es necesario como guía para ajustar la densidad de siembra.
Prueba de viabilidad
El porcentaje de germinación es el número relativo de plántulas normales producidas por la semilla pura. Existen distintas pruebas de viabilidad:
Prueba de germinación: se coloca a las semillas en sus condiciones ambientales óptimas de luz y temperatura.
Prueba con embriones separados: se separa el embrión de la semilla y se hace germinar él solo, el embrión viable germinará. Esta prueba se usa para determinar la germinación de semillas de arbustos y árboles cuyos embriones exigen largos períodos de postmaduración para germinar.
Prueba con tetrazolio: es un método bioquímico en el cual se demuestra la viabilidad no por la germinación, sino por el color rojo que aparece cuando se remojan las semillas en una solución de TTC (cloruro de 2,3,5 trifeniltetrazolio). El tejido no viviente queda sin teñirse. Esta prueba distingue entre los tejidos vivos y no vivos, de una semilla individual, y puede indicar debilidad antes de que la germinación sea afectada.
Análisis con Rayos X: es posible emplear radiografías de las semillas para detectar en ellas disturbios mecánicos, infestación de insectos, semillas vanas, número de embriones por semilla, el desarrollo del embrión y del endospermo, así como grietas y fisuras debido a daños por condiciones del tiempo. Para lograrlas se pueden emplear agentes de contraste, tales como soluciones de sales o metales pesados. Estos entran en las semillas dañadas y penetran en las células muertas, pero no en las vivas, debido a su semipermeabilidad. Los rayos X penetran con más facilidad a través de las células vivas y producen una exposición en la película.
Tratamientos de semillas
Los tratamientos de semillas para controlar enfermedades son de tres tipos: desinfestación, desinfección y protección.
Los desinfestantes eliminan al organismo presente en la superficie de la semilla. Dentro de este grupo podemos destacar el hipoclorito de calcio, el agua de bromo y el bicloruro de mercurio.
Los desinfectantes eliminan los organismos que están dentro de la semilla. Entre los tratamientos de este tipo se encuentran el agua caliente, el formaldehído y el vapor aireado.
Los protectores son materiales que se aplican a la semilla y que la protegen de los hongos del suelo. Entre los materiales más antiguos se encuentran ciertos fungicidas de zinc y de cobre.
4. Métodos de conservación de recursos fitogenéticos
En teoría, la conservación puede aplicarse a tres niveles de organización:
-
Génica
-
De organismo
-
Ecológica
Los métodos de recursos fitogenéticos pueden clasificarse en dos grandes categorías:
-
Métodos de conservación “in situ”: Consisten en preservar las variedades o poblaciones vegetales en sus hábitats originales.
-
Métodos de conservación “ex situ”: Consisten en la conservación en los llamados bancos de germoplasma.
4.1 Conservación “ex situ”
El objetivo de los bancos de germoplasma es el de conservar al máximo posible la biodiversidad existente para garantizar la posibilidad de usarla en el presente o futuro. Esto surge como respuesta de emergencia ante el grave problema de pérdida de biodiversidad (erosión genética) detectado en la última mitad del siglo XX, debido al abandono del cultivo de las variedades locales, sustituidas por variedades comerciales mejoradas mucho más uniformes. Esta pérdida de biodiversidad es un verdadero riesgo para la humanidad, dado que nuestra alimentación se basa en el aprovechamiento de los recursos genéticos vegetales.
Para conseguir conservar esta diversidad genética, se emplean diversos métodos que permiten distinguir distintos tipos de Bancos de Germoplasma. El más empleado (por su facilidad) es la conservación de semillas en condiciones de baja humedad y temperatura. La gran ventaja es que permiten preservar una gran diversidad genética en un espacio relativamente pequeño, con un coste modesto y durante grandes períodos de tiempo (hasta cientos de años). El mayor inconveniente, aparte del riesgo de pérdidas catastróficas del material conservado, es que las variedades conservadas se separan de su medio natural, lo que supone una necesidad de multiplicarlas y regenerarlas en un ambiente que no es el suyo (alto riesgo de erosión genética).
Otros grandes problemas encontrados al recurrir al material conservado en los bancos de germoplasma, y que son inherentes a los mismos, son:
-
El material proporcionado puede no corresponder exactamente con la variedad que se pretendía obtener debido a la gran variabilidad de nombres locales, posibles mezclas en los procesos de multiplicación, errores de documentación,...
-
El material conservado en los bancos no siempre está disponible.
-
Dadas las limitaciones de los bancos de germoplasma, las muestras que se pueden proporcionar de cada entrada son pequeñas (del orden de 100 o 200 semillas)
-
La información (datos de pasaporte y caracterización) que los bancos de germoplasma pueden proporcionar del material que conservan, muchas veces es insuficiente para llegar a conocer como eran las variedades tradicionales de una comarca, ya que con frecuencia no se dispone de datos agronómicos.
Por tanto, este tipo de conservación no debe entenderse como una alternativa de la conservación “in situ” (o en finca), sino un complemento de esta.
NOTA: A modo de ejemplo del funcionamiento de un banco de germoplasma (en este caso un banco de semillas), ilustramos un protocolo de conservación empleado en el Centro de Recursos Filogenéticos (CRF).
4.2 Conservación de semillas ortodoxas
El proceso a seguir para la conservación a largo plazo de este tipo de semillas es el que se ilustra a continuación:
4.2.1. Técnicas de desecación
El primer paso para asegurar la correcta conservación de las semillas ortodoxas, una vez recolectadas (en el momento de madurez fisiológica) y limpias (procurando eliminar al máximo en la limpieza los parásitos que puedan presentar) es su desecación. Este proceso es de suma importancia para maximizar la longevidad posterior de las semillas, ya que una desecación incompleta tendría unos resultados catastróficos cuando sometamos a las semillas a bajas temperaturas, en tanto que una desecación demasiado rápida podría llegar a dañar a los embriones.
El objetivo del proceso de desecación es reducir el contenido de humedad de la semilla hasta un valor que permita reducir al máximo su actividad metabólica, y evitar daños por congelación cuando se someta a esta a bajas temperaturas. El valor óptimo depende de las especies, pero señalamos como referencia las Normas Internacionales para Bancos de Germoplasma (FAO/IPGRI 1994), las cuales establecen un contenido de humedad óptimo entre el 3% y el 7%, dependiendo de las especies.
Lo primero que se debe hacer es intentar medir el grado de humedad de cada semilla antes de proceder al secado de las mismas. El contenido de humedad de las semillas se puede determinar cuantificando directa o indirectamente el agua que contienen. Las determinaciones directas se pueden hacer mediante métodos gravimétricos, de cromatografía y de espectrofotometría, y las indirectas mediante métodos higrométricos, de espectroscopia infrarroja, resonancia magnética nuclear y reacciones químicas de las semillas. En la actualidad existen en el mercado analizadores electrónicos (humidímetros) que permiten cuantificar con rapidez y exactitud el contenido de humedad de la semilla. Si no se dispone de esa tecnología, se puede recurrir a los métodos mencionados en el párrafo anterior, descritos en el manual sobre tecnología de semillas para bancos de germoplasma y en el protocolo para determinar el comportamiento de las semillas en almacenamiento.
Para conseguirla desecación de las semillas se pueden aplicar distintos métodos agrupables en:
a) Desecación por medios físicos: manteniendo las semillas en condiciones de baja humedad ambiental y Tª controlada. A modo de ejemplo, en el CRF se mantienen las semillas a 20ºC y 20% de HR durante aproximadamente 1-2 meses. Para una conservación a corto plazo, se pueden desecar las semillas al sol (siempre y cuando la tª de exposición no sea excesiva).
b) Añadiendo un desecante (el más usado es el Gel de Sílice o Silica Gel) a las muestras de semillas, manteniendo el conjunto de semillas-desecante en un recipiente hermético. Cuando el gel haya absorbido toda la humedad que pueden retener (se detecta por su cambio de color, de azul intenso a rosa pálido) se reemplaza por nuevo gel seco, hasta que ya no vira de color. en ese momento, el contenido de humedad de la muestra será próximo al 3%.
Decir que la desecación por medios físicos es mucho más lenta que la llevada a cabo por el gel, y normalmente no se alcanzan valores tan bajos de humedad. Por este motivo, la desecación por medios físicos puede ser más adecuada para semillas que no admitan una desecación excesiva o demasiado rápida, tal como parece ser el caso de algunas leguminosas de semilla grande (p.e. judías, habas,...)
Desde el punto de vista práctico, la desecación por medios físicos se adapta mejor para el manejo de semillas grandes, o grandes cantidades de semillas, en tanto que la desecación en gel de sílice es el método más cómodo cuando manejamos semillas pequeñas, como pueden ser la mayoría de las hortícolas. El gel de sílice, además tiene la ventaja de que se puede añadir a los recipientes en los que se conserva la semilla, sirviendo como indicador para detectar si en alguno de ellos ha entrado humedad durante el almacenamiento.
En ocasiones puede resultar interesante combinar ambos procedimientos de secado de las semillas, desecándolas primero hasta un 5-7% de humedad mediante medios físicos y luego completando el secado hasta un 3% mediante el gel de sílice.
4.2.2. Envasado de semillas
Una vez que hemos desecado las semillas, y antes de pasarlas a la cámara donde se vayan a conservar, es necesario envasarlas. Existe una amplia gama de recipientes para empacar semillas, de variadas formas y materiales, desde sobres de papel y de aluminio hasta frascos de vidrio y latas de diferentes metales. Más que la forma o el material, lo que importa del envase es la hermeticidad, es decir, que aísle el germoplasma para evitar que absorba humedad y/o se contamine. La elección el envase dependerá de las características de las semillas y del término al cual se espera conservarlas. En la práctica también está determinada por los recursos del banco, puesto que así como los envases varían en forma y materiales, también varían en costos. Los envases herméticos, por ejemplo, son óptimos pero costosos. La inversión dependerá de lo que se desee hacer con el material.
En resumen, los tipos de envases, juntos con sus ventajas e inconvenientes, son:
-
Envases de vidrio: Son los mejores recipientes para la conservación a corto-medio plazo, sobre todo con un buen cierre, tipo “tarro de mermelada (mejor si van provisto de una junta de goma)”. Estos tienen como ventaja que se pueden acceder a las semillas de su interior sin necesidad de desecharlos, teniendo que cuidar que siempre queden bien cerrados y manipular en un ambiente bien seco. además, al ser transparentes, permiten añadir en su interior una pequeña cantidad de gel de sílice que nos servirá de testigo para comprobar si en algún bote ha entrado humedad.
-
Envases de plástico: Estos no son recomendables para conservar las semillas a medio o largo plazo, puestos que los plásticos no son totalmente herméticos al vapor de agua
-
Envases metálicos con cierre hermético (tipo lata de conserva, no con rosca): son muy adecuados para la conserva de semillas a largo plazo, por su resistencia y hermeticidad, pero tienen el inconveniente de que cada vez que se accede al material hay que desechar la lata, por lo que resultan poco apropiados para la conservación a corto y medio plazo.
-
Sobres de aluminio trifoliado: Pueden no ser totalmente herméticos (depende del material y del sistema empelado para sellarlos), por lo que convendría comprobarlos antes de utilizarlos. En cualquier caso, por su facilidad de manejo son muy útiles para conservación a corto o medio plazo, y también para distribuir las semillas.
4.2.3. Condiciones de almacenamiento
Las condiciones en que se mantienen las semillas, una vez desecadas y envasadas, depende del plazo de tiempo para el que se pretendan conservar, así como los medios disponibles. Si la conservación se realiza a medio-largo plazo (más de 10 años), puede ser conveniente sacar periódicamente muestras de semillas para hacerles un ensayo de germinación que nos permita determinar si las condiciones de conservación están siendo las correctas.
Según el plazo que queramos tener almacenadas las semillas, se les aplicará un tratamiento u otro:
-
A corto o medio plazo (p.e. durante 15 años): No es necesario mantenerlas a temperaturas muy bajas, siempre y cuando hayan sido correctamente envasadas y desecadas. Una temperaturas de unos 4ºC, que es la que puede proporcionar una nevera doméstica, puede ser suficiente para conservar la mayoría de las semillas durante muchos años, siempre que las mantengamos secas durante todo ese tiempo. Es necesario que la temperatura se mantenga lo más estable posible durante todo el periodo de conservación.
-
A largo plazo: Para este tipo de almacenaje si es conveniente mantener las semillas a una temperatura más baja. Así, por ejemplo, en las cámaras de conservación en las cámaras de conservación del CRF , la colección activa (disponible para los usuarios) se mantiene a -4ºC, envasada en botes de vidrio, en tanto que la colección base (destinada a la conservación a largo plazo) se mantienen en latas metálicas y a -18ºC. En desecación a 20ºC y 20% de HR para semillas grandes (cereales, leguminosas, calabazas,...) y mediante gel de sílice cuando se trata de semillas pequeñas (la mayoría de las hortícolas, forrajeras y arómaticas-medicinales).
Otros factores ambientales distintos de la temperatura y la humedad parecen tener poca influencia en la conservación de las semillas. Así, por ejemplo, las pruebas realizadas por diversos autores sobre la influencia de la composición de la atmósfera en contacto con las semillas no han llegado a nada concluyente. Aunque sí parece que a muy largo plazo los gases producidos por el metabolismo embrionario acabarían envenenando a las propias semillas, en esas condiciones de baja humedad y temperatura este metabolismo es tan lento que no debería afectar incluso durante largos periodos de conservación. Lo que sí resulta conveniente es que las cámaras de conservación se mantengan a oscuras (si se utilizan recipientes transparentes para las semillas), excepto, claro está, cuando se tenga que acceder a su interior.
4.2.4. Otros tipos de conservación
En este apartado, queremos detallar brevemente otros dos tipos de conservación de semillas no tan extendidos como los ya comentados antes:
4.2.4.1. Crioconservación
La crioconservación consiste en colocar los explantes en nitrógeno líquido (-196°C) para detener su crecimiento pero conservando la viabilidad y la estabilidad genética y fisiológica. Es una técnica reciente y con buenas perspectivas, pues permite almacenar por períodos indefinidos cualquier especie que tolere y sobreviva al congelamiento. Por esta razón, resulta particularmente útil para conservar especies de semilla no ortodoxa o de reproducción vegetativa, difíciles de conservar en cámaras o en campo (Ashmore 1997; Benson 1999; Engelmann 2000).
La crioconservación consiste en a) cultivar el explante in vitro (precrecimiento), b) desecarlo al mínimo permisible según la especie, c) tratarlo con crioprotectores (glicerol, sacarosa, manitol, prolina, polietilenglicol) para evitar la cristalización de líquidos intracelulares, d) congelarlo en nitrógeno líquido, e) almacenarlo, f) descongelarlo y g) tratarlo para recuperar plantas viables (Wang et al. 1993; Rao y Riley 1994; Pérez-Ruíz 1997).
El éxito de la crioconservación depende de la reacción de la especie al congelamiento por lo que requiere protocolos específicos. Existen diversas técnicas como la deshidratación-encapsulación, la vitrificación, la encapsulación-vitrificación, la desecación, el precrecimiento, el precrecimiento-desecación y el goteo-congelamiento (Ashmore 1997) pero las investigaciones en este campo, como las que realiza el CIP (Perú) con papas tolerantes al congelamiento y el CIAT con yuca, todavía se basan en el ensayo y el error (Rao y Riley 1994). La metodología tiene limitantes siendo las principales la dificultad y el tiempo requeridos para regenerar plantas completas a partir de las estructuras conservadas.
4.2.4.2. Conservación “in vitro”
El cultivo in vitro cobra cada vez mayor importancia como herramienta de conservación e intercambio de germoplasma porque permite mantener un amplio rango de especies, en diversidad de muestras sanas y en poco espacio, e intercambiarlas fácilmente. Sin embargo, requiere tecnología y conocimientos aún en desarrollo, protocolos para cada especie y recursos considerables por lo que conviene evaluar la alternativa de conservar germoplasma in vitro frente a otras opciones de conservación, y aplicarla principalmente en aquellas especies difíciles de conservar como semilla o en campo.
4.2.4.3. Ozonoterapia
A título anecdótico, pudimos encontrar en internet una empresa que se dedica a aplicar un tratamiento con ozono, no sólo para la conservación de las semillas y granos almacenados (sobre todo los cereales), sino para la prevención de plagas que se alimentan de estos cuando se encuentran almacenados. Además, aporta otras ventajas:
-
Eliminación de fuentes generadoras de calor para el secado, no produce contaminación por el "no" uso de combustibles.
-
Reducción del consumo energético a valores mínimos. La energía eléctrica que utiliza se reduce a 50 Kw/h total para el secado de 100 tns.
-
Su sistema integral de tratamiento del aire / oxigeno utilizado no permite el ingreso de polvo -gases externos microbios - hongos contenidos en la humedad ambiente virus y bacterias.
-
La principal materia prima utilizada para el tratamiento es el aire de costo cero.
-
En el mismo procedimiento de secado se realiza el tratamiento fitosanitario-descontaminación, otorgándole al cereal máxima calidad y pureza, y conservar así todas sus propiedades.
-
No genera ningún tipo de riesgos a la salud para el operador y personal en general de la planta.
Conservación “ in situ”
Idealmente, la forma más apropiada de conservar una entidad biológica es dentro del ecosistema del que naturalmente forma parte. En la conservación in situ no sólo se preservan cada uno de los componentes del ecosistema sino también todas sus relaciones recíprocas y se permite la continuación de los procesos evolutivos de las plantas.
La conservación in situ resulta especialmente adecuada en las especies silvestres y presenta menos problemas que en las plantas cultivadas debido a que sus hábitats son ecosistemas naturales en los que no interviene la acción humana.
La conservación in situ de las especies silvestres implica la adecuada protección y gestión de los ecosistemas en los que habitan y, para ello, existen un gran número de figuras de salvaguardia de espacios naturales (parque natural, parque nacional, reservas, etc.). Los costes de este tipo de conservación disminuyen cuando en la zona protegida están concentradas diferentes especies. Contrariamente, cuando las áreas de distribución de las plantas son demasiado extensas el establecimiento de medidas de protección se dificulta por su coste y su interferencia con otras actividades humanas.
En España, el número de áreas protegidas ha crecido espectacularmente en los últimos años, existiendo actualmente más de 500. Según el estudio hecho por Gómez-Campo (1997) estas zonas incluyen un alto porcentaje de especies endémicas o amenazadas, aproximadamente el 95% en Canarias, el 80% en Andalucía y el 100% en Baleares.
La conservación in situ de variedades locales, denominada actualmente conservación “en finca” implicaría en un sentido estricto el cultivo de estos materiales en sus zonas de origen y con las técnicas tradicionales.
En general, este tipo de conservación ha sido considerada problemática por su complejidad y coste ya que, en principio, precisaría de constante supervisión y de incentivos a los agricultores para compensar los menores rendimientos de las variedades tradicionales. Sin embargo, en los últimos años, ha creado gran expectación en el ámbito internacional, ha visto incrementado el número de proyectos e iniciativas para respaldar y fomentar la ordenación, conservación y mejora de los recursos fitogenéticos en explotaciones agrícolas.
Desde una perspectiva real, la conservación “en finca” de variedades locales parece poco viable si no se realiza con un enfoque de utilización. En este sentido, el desarrollo de sistemas agrícolas sin grandes insumos (mano de obra, materia prima, energía, parte del equipo, capital amortizado, etc.), más respetuosos con el medio ambiente y más diversificados; en resumen, más sostenibles ofrece buenas expectativas para revalorizar y preservar la diversidad genética contenida en los cultivares tradicionales, especialmente adaptados a este tipo de agricultura.
Además, las variedades locales pueden ofrecer unas características de calidad organoléptica en cuanto a diversidad de sabores, aromas, aspecto, etc., que son valoradas cada vez más positivamente, al menos en un sector de la población dentro del mundo desarrollado, como ya se comentó anteriormente en la introducción de este trabajo.
En la recuperación del cultivo de variedades tradicionales es de destacar la labor reciente que desde hace unos años realizan muchos grupos de agricultores “biológicos” y organizaciones de tipo no gubernamental o similares, muchas de las cuales poseen la ventaja de aportar una fuerte concienciación y un espíritu altruista en mayor o menor grado.
PRINCIPALES PROBLEMAS
En la mayoría de los países existe la infraestructura mínima adecuada para la conservación ex situ de los recursos filogenéticos, es decir, bancos de germoplasma de semilla, y en algunos la infraestructura para el mantenimiento de colecciones in vitro. Sin embargo, el problema común es la falta de recursos para desarrollar actividades propias de mantenimiento de las colecciones, situación que conduce a que muchas veces los bancos de germoplasma sean solamente depósitos de semillas.
& Las facilidades disponibles de conservación ex situ de cada país no son utilizadas de forma coordinada por las distintas instituciones, incrementándose innecesariamente los costos de infraestructura y mantenimiento.
& Se carece de listas de especies o grupos de especies prioritarias para la conservación ex situ, conservándose especies no prioritarias, dejando en muchos casos de lado las más importantes para el mejoramiento o por su susceptibilidad a sufrir erosión genética.
& Las muestras genéticas (diversidad entre y dentro de poblaciones) y los tamaños de las entradas no son en muchos casos los más recomendados, dándose en muchas especies un efecto fundacional importante, debido a que la variabilidad ingresada a los bancos de germoplasma no es representativa de las frecuencias de genotipos originales.
& Se constata una alta proporción de entradas conservadas en bancos de germoplasma de la región que no cuentan con datos suficientes, faltando inclusive los datos de pasaporte.
&Se detectan importantes problemas de erosión genética, muchas veces porque las muestras no son suficientemente grandes, o porque existen problemas metodológicos en la multiplicación y/o regeneración.
&Para muchas especies no existen los conocimientos biológicos necesarios para la conservación ex situ, particularmente en especies silvestres de las que no se dispone de protocolos previamente desarrollados.
&El monitoreo de las colecciones no es realizado con la frecuencia y métodos adecuados. No existen o son insuficientes las facilidades para la regeneración de las especies conservadas, siendo particularmente grave en las especies alógamas.
& El número y capacitación del personal técnico es en general , escaso, situación que afecta al conjunto de actividades en torno a la conservación ex situ.
En definitiva, la carencia de infraestructura y/o la falta de recursos para el mantenimiento, así como el número limitado de técnicos especializados, han llevado a que ciertos países no cuenten con posibilidades de conservar el patrimonio fitogenético de sus países, los cuales, en muchos casos, están siendo colectados y conservados en bancos de germoplasma de países desarrollados, quienes ven en muchos de éstos, un producto estratégico potencial.
ESTRATEGIAS PROPUESTAS
A continuación se señalan los principales puntos para la resolución de los problemas planteados para la conservación ex situ de los recursos fitogenéticos:
• Realizar un mejor aprovechamiento de las facilidades disponibles de conservación ex situ en los países, las cuales podrán canalizarse a través de un Sistema Nacional de Recursos Genéticos en el que participen todas las instituciones involucradas en la conservación ex situ e in situ.
•Establecer listas en cada país con las especies o grupos de especies prioritarias que requieran conservación ex situ.
• Apoyar la consolidación de la infraestructura de conservación ex situ en los países menos desarrollados, incluyendo facilidades para la regeneración o multiplicación de las entradas conservadas, contemplando en particular el caso de las alógamas.
• Incluir actividades rutinarias de monitoreo, multiplicación y regeneración antes de que los niveles de viabilidad lleguen a límites que causen erosión genética irreversible.
% Promover la investigación científica en nuevos métodos y técnicas de conservación ex situ, así como en aquellas especies en que no existe protocolos mínimos. Se deben generar líneas de investigación que aseguren los conocimientos necesarios para que las especies conservadas sean adecuadamente multiplicadas o regeneradas, manteniendo la representatividad de la variabilidad existente en las poblaciones naturales.
% Apoyar actividades y proyectos de investigación que fomenten la complementariedad entre métodos in situ y ex situ de conservación.
% Facilitar el uso de germoplasma vegetal a través de la documentación adecuada de la información disponible en las colecciones nacionales, haciendo espectacular énfasis en la información inicial que acompaña la entrada. Integrar dicha información a una base de datos nacional disponible en internet; analizar efectivamente la información con el propósito de proponer colecciones nucleares; y finalmente, estandarizar la información a nivel de la región ( por ejemplo, información de pasaportes y firmas de colectas unificadas).
% Procurar los mecanismos necesarios para el intercambio de conocimientos ligados a la conservación ex situ de recursos fitogenéticos en los países menos desarrollados. Esta iniciativa debería propiciar la coordinación y complementación en el uso de tecnologías, espacios de formación y capacitación, ejecución de talleres internacionales, cursos y pasantías.
% Capacitar personal responsable de las diferentes etapas en el manejo de los bancos de germoplasma, especialmente a nivel semitécnico.
% Promover un protocolo común entre los países menos desarrollados de acceso al germoplasma conservado en los bancos activos, así como un código de conducta que regule al recolección y/o intercambio de muestras de especies y recursos genéticos por parte de los investigadores.
% Concienciar a los niveles técnico-políticos sobre el papel de la conservación ex situ para la efectiva utilización de los recursos fitogenéticos, desterrando el concepto de servicio o depósito de entrada.
5. Manipulación genética de semillas
LA TECNOLOGÍA TERMINATOR:
La tecnología Terminator es la aplicación de una patente genérica para el control dela expresión de los genes de las plantas. Básicamente, es un mecanismo suicida que puede ser activado por un estímulo exterior específico ( choque térmico, osmótico, composición química específica) y como resultado las semillas de la siguiente generación se auto-envenenan y se destruyen.
El estímulo específico desencadenante es el antibiótico tetraciclina que se aplica a las semillas antes de su venta.
¿Cómo funciona la tecnología Terminator?
La versión principal de Terminator es un conjunto de 3 genes que se insertan en una planta G1, G2 y G3. ( otras versiones reparten estos genes entre dos plantas que se cruzan por polinización)
El resultado final es siempre el mismo: la siguiente generación de planats produce semillas muertas.
G1:
-
Promotor: promotor LEA abundante en la embriogénesis tardía
-
Espaciador: fragmento de DNA con ambas secuencias de reconocimiento LOX. El espaciador actúa como un elemento de seguridad ya que no deja que el gen de la toxina se active.
-
Gen de la toxina: gen RIP ( proteína inhibidora del ribosoma)
G2:
-
Gen promotor: un promotor que se puede suprimir.
-
Gen de la recombinasa: CRE/LOX: sistema de un virus bacteriófago.
G3:
Sistema reprimible con tetraciclina.
-
Promotor
-
Gen del represor.
Cuando el estímulo escogido en este caso la tetraciclina se aplica a las semillas antes de venderse se consigue bloquear el represor producido por G3 y en consecuencia el gen de la recombinasa G2 se transcribe. El enzima fabricado actúa entonces como unas tijeras moleculares que corta el gen espaciador G1 por sus extremos. La eliminación de estos fragmentos hace posible la síntesis de la toxina. Puesto que esto sucede en las últimas etapas de la maduración de la semillas provoca la muerte de ésta.
El mercado de semillas transgénicas esta dominado por Monsanto, empresa multinacional que posee casi exclusivamente el monopolio de bancos de semillas transgénicas.
6. Visita al centro de Conservación de la Biodiversidad Agrícola de Tenerife.
Este centro lleva abierto aproximadamente 1 año y medio. Se encuentra ubicado en el municipio de Tacoronte y al él llegan numerosas variedades distintas de semillas con el fin de conservar la biodiversidad agrícola de nuestra isla.
Una vez que llegan a este centro dichas semillas se las somete a una serie de procesos para su almacenamiento y posteriormente devueltas al agricultor cuando las condiciones sean las adecuadas para su cultivo y finalmente su germinación.
Ahora pasaremos a detallar los pasos desde que llegan las semillas al centro:
Recepción
En este primer paso, las semillas llegan y son depositadas en bolsas de embalar debidamente etiquetadas con el nombre de la especie al que corresponda o con unas siglas de identificación.
2. Limpieza
Este paso es muy importante. Tras la llegada de las semillas, de un determinado tipo, hay que separarlas. Hay que tener cuidado ya que aunque tengamos una bolsa etiquetada que indica que su contenido es de un determinado tipo de semillas, tenemos que comprobarlo y para esto existe este paso de limpieza el cual se realizará a mano. Se irán seleccionando las semillas y verificando el tipo de una a una. Si vemos que alguna no coincide con el tipo de semillas que nos dieron se retirará del resto para no mezclarlas. Las semillas a medida que vamos observando una a una, las vamos introduciendo en un bote de cristal etiquetado.
Aquellas semillas enfermas se sacarán del resto de semillas para estudiar su patología : hongos, virus,....
También la limpieza y separación de semillas se podría realizar mediante tamizado con varias mallas de poro variado.
3. Secado
Para correcta conservación, las semillas deben ser desecadas y eliminar la humedad que puedan tener. Esto se consigue gracias a que se introducen en los botes de cristal unas pocas piedritas de gel de sílice. El gel de sílice absorberá la humedad de las semillas. El color inicial de estas bolitas de gel de sílice es anaranjado que indicará que las bolas están secas y por lo tanto captarán bien la humedad de las semillas. En cambio, estas bolitas se tornarán a color más oscuro cuando estén húmedas por lo que ya no servirían y habría que reciclarlas. Cuando bolitas estén oscuras se las mete en estufa para que pierdan la humedad y así puedan ser de nuevo utilizadas.
4. Refrigeración
Ahora el último paso en la una correcta conservación de semillas es introducirlas en una nevera. La temperatura de la misma dependerá de si estamos trabajando con semillas de corto medio o largo plazo.
Por ejemplo: para semillas de corto plazo se conservarían a 5ºC y las de largo plazo a unos -20ºC.
Dependiendo ya del tipo de semilla, podrá ser conservada más o menos tiempo hasta que lleguen las condiciones adecuadas de germinación para ser entregados, dichas colecciones de semillas, a los agricultores para su posterior siembra.
Aquí trabajan con semillas de avena, trigo, cebada, judías, millo,...
A parte de este tema de conservación de semillas, actualmente este centro está estudiando distintas variedades de castañas que se encuentran en Tenerife. Hasta el momento ya han sido descritas 15 variedades distintas.
8. Conclusiones
La conservación in situ y ex situ, en sus diversas modalidades, deben considerarse como métodos complementarios y no excluyentes para lograr el objetivo común de preservar los recursos fitogenéticos, siendo necesaria la colaboración y coordinación entre los distintos sectores implicados -instituciones, bancos de germoplasma, agricultores, grupos sociales, etc- para conseguir una integración armónica y equilibrada de ambas estrategias.
9. Bibliografía
Artículos:
Mayor, P. , Escudero, M. C., Catalá, M. S. Y Costa, J. Conservación de Recursos Fitogenéticos Agrícolas (I). En Agrícola Vergel, mayo 2002
Centros de Recursos Fitogenéticos en España. Desireé Afonso Morales. Cabildo Insular de Tenerife. Centro de Conservación de la Biodiversidad Agrícola de la isla de Tenerife. Curso de: “La conservación de los recursos fitogenéticos agrícolas: Teoría y Práctica.” 15/01/04 al 26/01/04. Facultad de Farmacia
Páginas webs:
FAO - Servicio de Recursos Fitogenéticos y Semillas: http://www.fao.org/ag/agp/agps
FAO-Sistema de Información Mundial en Recursos Fitogenéticos: http://apps2.fao.org/wiews
IPGRI (International Plant Genetic resources Institute): http://www.cgiar.org/ipgri
Programa Cooperativo Europeo para Recursos Genéticos:
http://www.cgiar.org/ecpgr
Convenio sobre Diversidad Biológica: http://www.biodiv.org
INIA (Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria):
http://www.formarse.com.ar/ozonoterapia/tratamiento%20semillas%20cereales.htm
http://www.fao.org/montes/foda/wforcong/publi/v2/t8s/1-5.HTM
http://www.uaaan.mx/DirInv/texthtml/ccdts.htm
http://www.aldearural.com/subcategorias/documentacion/reunionreddesemillas.htm
http://www.iespana.es/naturaeduca/agro_reprod_semillas.htm
http://www.iespana.es/sabores/Conservando_nuestras_semillas.htm
http://www.infoagro.com/semillas_viveros/semillas/control_semillas.asp
http://www.ecologistasenaccion.org/article.php3?id_article=26
http://www.unesco.org/courier/1999_06/sp/ethique/txt1.htm
http://canales.laverdad.es/cienciaysalud/4_3_17.html
Conservación en el ámbito mundial:
The Convention on Biological Diversity (CBD) http://www.biodiv.org/
The global Plan of Action for the Conservation and Sustainable Use of Plant Genetic Resources for Food and Agriculture http://www.fao.org/inicio.htm
The World Heritage Convention http://www.unesco.org/
The Convention on International Trade in Endangered Species of Wild Flora and Fauna (CITES) http://www.cites.org/
The Convention on Wetlands of International Importance http://www.ramsar.org/
UNESCO Man and the Biosphere programme (MAB) http://www.unesco.org//mab/
Conservación en el ámbito europeo:
The convention on the conservation of European Wildlife and Natural Habitats (Bern Convention) http://www.ecnc.nl/doc/europe/legislat/bernconv.html
Directiva de habitats y especies 92/43/CEE http://europa.eu.int/comm/environment/nature/habdires.htm
The Pan-European Biodiversity and Landscape Diversity Strategy http://www.strategyguide.org/
The European Community Biodiversity Strategy ">http://biodiversity-chm.eea.eu.int/>
Conservación en el ámbito nacional:
Ministerio de Medio Ambiente http://www.mma.es/conserv_nat/biodiv/especies/index.htm
Real Decreto 1997/1995 http://www.mediterranea.org/cae/real_decreto_1997-1995_biodiversidad.htm
Conservación en el ámbito de la comunidad autónoma:
Conselleria de Medi Ambient http://www.cma.gva.es/
Conservación de hábitats prioritarios en la Comunidad Valenciana http://www.microhabitats.org/Life/
Conservació i gestió d'espais forestals a les muntanyes valencianes http://www.uv.es/~ramos/gan/marzo.html
Otros
Micro-reserves capture Valencia's special flora http://www.plant-talk.org/Pages/14micros.html
Boletín de la Comisión de Flora del Comité Español de la UICN http://www.uam.es/otros/consveg/
OBTENCIÓN DE MUESTRA
EXPEDICIONES
DONACIONES
DUPLICADOS BANCOS
RECEPCIÓN Y LIMPIEZA
DESECACIÓN (<7% de humedad)
CONTROL DE VIABILIDAD
CONSERVACIÓN EN CÁMARAS FRÍAS
COLECCIÓN BASE
COLECCIÓN ACTIVA
-18º C
-4º C
CARACTERIZACIÓN Y EVALUACIÓN
INTERCAMBIO
DATOS DE PASAPORTE
DATOS DE GESTIÓN
DATOS DE CARACTERIZACIÓN
PROTOCOLO DE CONSERVACIÓN DE SEMILLAS DEL CENTRO DE RECURSOS FITOGENÉTICOS
MULTIPLICACIÓN
RECOLECCIÓN
LIMPIEZA
DESECACIÓN
ENVASADO HERMÉTICO
CONSERVACIÓN EN FRÍO
Descargar
| Enviado por: | Choque Osmótico |
| Idioma: | castellano |
| País: | España |
