Nutrición Humana y Dietética
Bromatología aplicada
PRÁCTICA 1
ELEMENTOS DE TRABAJO EN UN LABORATORIO
1. - LA ESTRUCTURA DE UN LABORATORIO
A - Estructura organizativa:
-
Jefe: Titular superior que emitirá los informes relacionados con la práctica en el laboratorio.
-
Supervisor: se encarga de los laboratorios de análisis bromatológico.
-
Jefe de equipo: coordinador y realizador de las actividades en el laboratorio.
-
Personal de análisis: profesionales de la experimentación con los alimentos. Deberá conocer los alimentos con los que va a trabajar.
-
Personal de soporte: personas que sin trabajar en labores analíticas serán esenciales en el lavado del material, reactivos, etc.
B - Diseño de un laboratorio:
Área de administración: formada por despachos, zona de recepción y preparación de muestras que será el lugar donde vamos a recoger las muestras y las vamos a analizar fisico-química y bioquímicamente y el laboratorio.
Dispositivo de seguridad: que se va a corresponder con las duchas para lavado de ojos, extintor, etc.
Ventilación adecuada y aire acondicionado: van a ser importantes para el mantenimiento de los equipos de trabajo, sobre todo si son sofisticados porque los cambios bruscos le afectarán.
Espacio utilizado: diez metros cuadrados por persona de laboratorio
Suministros: agua potable y destilada, electricidad, etc.
2. - RECOGIDA DE MUESTRAS:
Será un proceso muy controlado, en el que se realizará codificación y habrá un sistema de registro. Las muestras se almacenarán en condiciones adecuadas, como las muestras congeladas que se almacenarán a temperatura de congelación.
3. - MATERIALES:
Equipos e instrumentos: deberemos conocer las diferencias entre unos y otros. Distinguimos un baño termostático, una centrífuga, etc.
Gestión de suministros: el laboratorio debe contar son registros del material solicitado.
Equipo de mantenimiento: es muy importante porque los instrumentos deben sufrir un proceso de mantenimiento.
4. - OPERACIONES DE LABORATORIO:
Nos permite estimar los recursos necesarios. Las prioridades de análisis nos mostrarán la importancia de unas muestras frente a las otras, distinguiendo: prioridad 1, 2,... La 1 será importante para el consumo de las personas y la 2 importante para la calidad del producto.
La realización de análisis deberá contar con un control, debe existir un interés activo.
Deberemos realizar un informe con los volumenes de productos utilizados y donde recogamos todos los datos numéricos del análisis.
5. - NORMAS DE SEGURIDAD:
Se debe intentar almacenar reactivos inflamables, en almacenes separados. Los riesgos químicos son peligrosos, los biológicos se relacionan con sustancias de naturaleza cancerígena y los físicos se relacionan con el vidrio, etc.
Se deberá contar por lo tanto con sistemas y equipos de seguridad y emergencia y además se requerirá de equipos de primeros auxilios.
No todos los laboratorios cumplen estas normas pero si aquellos que kieren obtener un certificado ISO.
6. - MÉTODOS DE ANÁLISIS:
- Gravimétrico
- Tritimétrico
- Prop. Físicas
- Potenciométricos
- Separativos
- Enzimáticos
- Microbiológicos
- Sensoriales
Entre los distintos materiales de volumetría de precisión, encontramos: probetas, buretas y otros medidores. Podrán variar con la temperatura
También podremos encontrar: pipetas, matraces, vasos volumétricos, tubos de ensayo, vidrio de reloj, placas de petri, sistemas de condensación, condensadores, etc.
PRÁCTICA 2
CONTROL DE CALIDAD DE LECHE Y PRODUCTOS LACTEOS
1. - LECHE
DETERMINACIÓN DE LA ACIDEZ
Procedimiento: Añadimos a un vaso de precipitados 10 ml. de leche y 4-5 gotas de fenolftaleina, para posteriormente neutralizar con NaOH 0.1 N.
Resultados: Como la sosa utilizada es NaOH 0.1 N, mediremos la acidez mediante los grados Dornic.
El volumen de NaOH utilizado para neutralizar la muestra fue de 2.5 ml.
Los grados Dornic que se obtiene según el volumen de NaOH obtenidos fue de:
ºDornic = 9x2.5= 22.5 º
Expresamos la acidez como gr de ácido láctico por cada 100ml. de leche y obtenemos:
ºD= 22.5x0.01=22.5x10-2
Luego la acidez de la leche expresada en porcentaje de ácido láctico será:
R.: 0.225 % de ácido láctico.
Una acidez superior a 19 ºD (22.5 ºD en nuestro caso) se le achaca a leches de más de 10 horas (ordeño de la noche).
DETERMINACIÓN DE PROTEÍNAS
Fundamento teórico: Para este caso utilizamos la técnica del formol. Por cada molécula de formol añadida las proteínas liberan un protón al medio. Luego si añadimos formol en exceso al medio nos aseguraremos que todos los protones de las proteínas sean liberados.
Procedimiento: Tomamos 10 ml. y le añadimos 20 ml de agua destilada junto con unas gotas de fenolftaleina para posteriormente neutralizar con NaOH (procedimiento ya realizado para la determinación de la acidez de la leche). Ahora añadimos formol (2-3 ml.) y neutralizamos por el mismo método para dejar libres los grupos carboxilo de las aa. Valorando posteriormente la acidez con NaOH.
Resultados: Los ml de NaOH utilizados para la primera valoración, son los mismos que los de la determinación de la acidez.
VNaOH= 2.5 ml. de NaOH 0.1 N
Para la segunda valoración los ml de NaOH utilizados para neutralizar los ácidos libres de la leche fueron:
VNaOH=1.5 ml.
Los ml gastados en la segunda valoración se multiplican por 2.24 para expresar el resultado como porcentaje de proteínas:
1.5 ml. x 2.24 = 3.32%
Luego aplicamos una regla de tres y obtenemos que:
100% 78.5% caseínas
3.32% x
R.: 2.6 % de caseínas
DENSIDAD DE LA LECHE:
Procedimiento: Medimos la leche a una temperatura de unos 22ºC. Como el lactodensímetro está calibrado a 20ºC, deberemos multiplicar por un factor de correción que será de 0.2 por cada ºC de diferencia.
Resultado: El valor obtenido con el lactodensímetro más el factor de correción nos un resultado de:
R.: 1.031+0.004= 1.0314
Nota: El factor de corrección deberemos sacárselo al último dígito del valor obtenido por el lactodensímetro.
Interpretación: El valor que da el lactodensímetro parece indicar una leche de vaca, puesto que el valor corresponde con el valor medio de la leche de vaca. Además parece ser una leche entera puesto que si el valor fuese mayor o menor se trataría de una desnatada o adulterada, aunque aquí no es el caso.
CLORURO SÓDICO:
Procedimiento: Tomamos 10 ml de leche y le añadimos dos gotas de dicromato potásico, para posteriormente valorar con nitrato de plata hasta alcanzar un valor anaranjado.
Resultados: Los ml de nitrato de plata utilizados para neutralizar la muestra fueron:
V=5.1 ml. de AgNO3
Con ese valor procederemos a calcular el porcentaje de cloruros, cuyo valor será:
% cloruros= 0.0585x5.1 ml. de AgNO3= 0.298 %
Interpretación: Los valores de cloruro sódico obtenidos muestran una alteración de la leche puesto que su valor está un tanto por encima del 0.2% que se considera el límite de la leche normal, luego será una leche con anomalias(mamitis, adición de soluciones preparadas, etc.)
ESTRACTO SECO:
Procedimiento: En esta determinación procedemos a cuantificar el contenido de extracto seco en leche tras desecar las muestras según los procedimientos oficiales.
Resultados:
1 A
P. placa desecada = 94.115 g.
Pmuestra leche = 11.393 g P placa + Peso leche= 105.408 g
Pfinal. = 96.266 g.
Extracto seco (%) = [96.266/(94.115 + 11.393)] *100 = 91.24%
1 B
P. placa desecada = 97.136 g.
Pmuestra leche = 11.465 P placa + Peso leche = 108.601 g
Pfinal. = 100.961 g.
Extracto seco (%) = [100.961/(97.136 +11.465)] *100 = 92.96 %
1 C
P. placa desecada = 97.136 g
Pmuestra leche= 12.764 g. P placa + Peso leche = 109.9 g
Pfinal. = 98.661g.
Extracto seco (%) = [98.661/(97.136 +12.764)] *100 = 89.773 %
Si realizamos una media aritmética de los tres valores obtenidos, vemos que el contenido en estracto seco de la leche va a ser de:
R.: 91.32% de estracto seco
2. - YOGURT:
DETERMINACIÓN DE LA ACIDEZ:
Procedimiento: El procedimiento utilizado es el mismo que para la determinación de leche.
Resultados: El volumen de NaOH obtenido en la neutralización de los ácidos del yogurt, fue de:
VNaOH 0.1 N= 11.8 ml.
Los ºDornic correspondientes calculados según los ml de NaOH gastados en la neutralización son:
ºDornic= 9x11.8= 106.2
Con lo cual el porcentaje de acidez expresado como porcentaje de ácido láctico será:
106.2x0.01= 1.062 % de ácido láctico
DETERMINACIÓN DE PROTEÍNAS:
Procedimiento: El procedimiento es el mismo que para la leche pero en el yogurt.
Resultados: Los ml de NaOH gastados fue de 1.5 ml que multiplicado por 2.24 dará las proteinas.
1.5x2.24= 3.36% de proteinas
Si ahora lo que queremos es expresar el resultado como porcentaje de caseínas, aplicaremos una regla de tres:
(3.36x78.5)/100= 2.63% de caseínas
ESTRACTO SECO:
Procedimiento: Tomamos 3gr de muestra de yogur y lo colocamos sobre una placa de la que conocemos su peso, para someter a desecación y determinar más tarde el porcentaje de materia seca con respecto a la muestra tomada.
Resultados: Los resultados vienen recogidos en la siguiente tabla:
Peso cápsula=92.246
Peso yogurt=3g
Peso final=92.5619g (desecado)
Si aplicamos la fórmula del protocolo de prácticas para obtener el porcentaje de materia seca obtenemos un valor de:
Estracto seco(%) = [(92.5619-92.2460)/100]/3 = 10.53%
3. - QUESO:
ESTRACTO SECO:
Procedimiento: El extracto seco del queso y los quesos fundidos es la masa, expresada en porcentaje ponderal, que queda después de someter la muestra a desecación.
Resultados:
Peso de la placa: 57.4970 g
Peso placa + queso = 57.7970 g
Peso final = 57.6628 g
Peso muestra = 0.3 g
Ahora aplicamos la fórmula:
Extracto seco (%) = (57.6628 - 57.4970) / 0.3 x 100 = 55.2667 %
Luego el resultado final será de:
R.: 55.2667 %
CONCLUSIONES:
Leche:
Las leches estudiadas o analizadas en el laboratorio han sido de dos muestras diferentes, leche UHT envasada en treta-brik y una leche problema supuestamente de cabra. A ambas se le realizaron un análisis para el control de calidad en dichas leches. También como productos lácteos se analizaron una muestra representativa de estos como fueron yogur y queso, realizándose únicamente composición bromatológica.
A las leches se le realizaron las siguientes determinaciones:
-
Contenido en extracto seco (norma FIL-21:1962)
-
Contenido en proteínas (método Sorensen - Walker).
-
Determinación de Grasa en leche (Método Gerber)
-
Determinación de Densidad (Métodos para la determinación de Densidad: Lactodensimetría)
-
Determinación de Acidez (Métodos Oficiales y Recomdendados por el Centro de Investigación y control de la Calidad. Ministerio de Sanidad y Consumo)
-
Determinación de Cloruro Sódico (Idem anterior)**
-
Actividad Peroxidasa (Prueba de Storchs)*
-
Prueba de la Fosfatasa Alcalina.*
-
Prueba de la Reducatasimetría en leche (Prueba de la Resazurina o Azul de Metileno).*
-
Prueba del Alcohol.*
-Las tres primeras determinaciones son para la caracterización del tipo de leche según su contenido en extracto seco, en proteínas y en grasa, pudiendo obtener por diferencia el contenido en carbohidratos.
Obtuvimos un valor de extracto seco del 91, 32 % de peso fresco, valor que nos ayudará a expresar los demás valores, como el contenido en grasa, referido a dicho extracto seco. Debido a que las mediciones que se realizaron se observaron entre las 3 repeticiones realizadas una desviación mayor de del 0.005%, nos indicaría que los valores no son los más exactos, aunque los tomaremos como válidos.
El contenido total de proteínas, expresado en porcentaje de caseínas fue el de 3.94 %, así como el contenido total de grasa fue1.55%, por lo que podemos más o menos asegurar que la leche que se nos dio de tetra-brik verifica que se trata de una leche desnatada, si además tenemos en cuenta el valor obtenido en la destitometría. El valor obtenido en dicha determinación fue de 1.039, entrando en los valores normales de leche de vaca, aunque, los valores medios para una leche entera sean entorno a los 1.031. Así, podemos afirmar, que obteniendo una mayor densidad al valor medio, estaremos frente a una leche desnatada.
El contenido en graos Dornic de 18º, nos indicaría que se trata de una leche fresca.
El valor obtenido de cloruro sódico analizada a la leche problema 0.281% (valor superior al 0.2%, nos indica que se trata de una leche con anomalías, como puede ser mamitis o adición de soluciones preparadas.
Las determinaciones posteriores, son indicadores de calidad o determinantes de algún tipo de adulteración el dichas muestras de leches. Así obtenemos las siguientes conclusiones:
Debido a un resultado positivo en la prueba de Actividad Peroxidasa, Prueba de la Fosfatasa Alcalina, Prueba de la Reductasimetría, Prueba del Alcohol en la muestra de leche problema de “cabra” indica que estamos frente a una leche que no ha sufrido ningún tratamiento térmico en general y en particular de pasterización, que si ha sufrido pasteurización, con la prueba de la Fosfatasa Alcalina confirma que no ha sido correcta en dicho caso, que contiene un número un poco más elevado de microorganismos que la otra leche (aunque el contenido siga siendo bajo) y por último la prueba del alcohol nos indica que es una leche inestable al alcohol, precipitando de forma visible las proteínas, indicando que pueda existir algún desequilibrio salino en la composición de la leche, indicando que no sea una leche que soporte ningún tipo tratamiento térmico.
Así de forma análoga, pero en sentido contrario, el resultado negativo también de dichas pruebas, indican que la leche envasada indica que se trata de una leche que ha sufrido tratamiento térmico, e incluso una correcta pasteurización, existiendo un número muy bajo de microorganismos y así como también siendo estables al alcohol.
El queso, como producto lácteo, analizado fue un queso llamado “Baby-bell” al que se le realizaron las siguientes determinaciones características para la determinación bromatológica:
-
Contenido en extracto seco (norma IDL 4:1958)
-
Determinación de Grasa en queso (Método Gerber)
Tras la determinación de dichos parámetros obtuvimos los valores correspondientes como fueron, un contenido en extracto seco del 88,86 % de extracto seco en la materia fresca, valor necesario para la obtención del contenido en grasa. Obteniendo un valor de grasa expresado en materia seca de queso, deduciendo con dicho valor que estamos frente a un queso de composición más bien grasa.
Por último, en cuanto al control de calidad de productos lácteos, se le realizó tres determinaciones a un tipo de yogur como son:
-
Contenido en extracto seco (Método recomendado por el Centro Nacional de Alimentación y nutrición)
-
Contenido en proteínas (método Sorensen - Walker)
-
Determinación de Grasa en yogur (Método Gerber)
-
Determinación de Acidez (Métodos Oficiales y Recomdendados por el Centro de Investigación y control de la Calidad. Ministerio de Sanidad y Consumo)
En cuanto al contenido en extracto seco obtenido fue un total de 10.53%. El contenido en proteínas obtenido fue de 5.02 % de proteínas, expresadas en porcentaje de caseínas.
Así mismo, se obtuvo el contenido total de grasa, siendo de un 5.6 %.
Por último el valor obtenido de grados Dornic 106.2º, pone en evidencia que se trata de un producto lácteo que ha sufrido un proceso de fermentación.
Así, podemos concluir afirmando, que lo más posible es que según los parámetros descriptivos bromatológicos obtenidos con dichas técnicas se trata de un yogur natural.
PRÁCTICA 2B: CONTROL DE CALIDAD DE LECHE Y PRODUCTOS LACTEOS
DETERMINACIÓN DE LA ACTIVIDAD PEROXIDASA:
Procedimiento: Para esta determinación utilizamos una leche problema(leche de cabra recién ordeñada sin tratar) y una leche entera UHT comprada en un supermercado y supuestamente pasteurizada. Tomamos 1 ml de leche y le añadimos otro de 1,4 fenilendiamina con dos gotas de peróxido de hidrógeno y dejamos pasar unos segundo para observar el color.
Resultados: Tras realizar la prueba pudimos comprobar como en la leche UHT no experimentó ningún cambio de color con lo que la prueba fue negativa, mientras que la leche problema resultó dar una prueba positiva a consecuencia de haber experimentado un cambio de color.
Interpretación: La leche UHT había sufrido el proceso de pasteurización mientras que la leche problema no.
DETERMINACIÓN DE FOSFATASA EN LECHE PASTERIZADA:
Procedimiento: Tomamos dos muestras de leche (de cabra y UHT). Ambas las añadimos sobre una disolución de agua y pastillas de lastognost I y II. Hervimos ambos durante 1 hora y se añade lastognost III.
Resultados: Al añadir la pastilla de Lactognost III aparece un color azul en el tubo B (leche de cabra) lo que indica la presencia de actividad fosfatasa en la leche no hervida mientras que en la otra leche (UHT) no aparece color que indique presencia de actividad fosfatasa.
Interpretación: La leche UHT (tubo A) muestra una correcta pasterización mientras que la de cabra (tubo B) muestra presencia fosfatasa.
PRUEBA DE LA REDUCTASIMETRÍA:
Procedimiento: A 10 ml de leche le añadimos 0.5 ml de azul de metileno. Los ponemos al baño maría y leemos los resultados al cabo de 10 minutos y una hora.
Resultados: Al cabo de 10 minutos, en la prueba de la reductasa no ocurre ningún cambio aparente. Al cabo de 60 minutos tampoco se observa ningún cambio.
Interpretación: Podemos decir que existe un bajo contenido en microorganismos en la muestra a estudiar. Cabe reseñar que la muestra A (leche UHT) presenta un color azul un poco más claro que la muestra B (leche de cabra).
PRUEBA DEL ALCOHOL:
Procedimiento: Tomamos cuatro muestras, dos A y dos B. A dos de ellas les añadimos alcohol 68 º y a las otras dos alcohol de 72º y procedemos a mezclar
Resultados: La leche UHT no precipita en presencia de alcohol de 72º ni tampoco precipita en presencia de alcohol de 68º. Por su parte la leche de cabra precipita en presencia de ambos alcoholes (68º y 72º).
Interpretación: La leche de cabra no ha sido tratada térmicamente y por eso ante la presencia de alcohol precipitan sis proteínas mientras que la leche UHT no precipita lo que indica o verifica su tratamiento.
PRÁCTICA 2C: CONTROL DE CALIDAD DE LECHE Y PRODUCTOS LACTEOS
DETERMINACIÓN DE GRASA EN LECHE POR EL MÉTODO DE GERBER:
Procedimiento: Véase protocolo de prácticas.
Resultados: El valor de grasa en leche leído en el butirómetro es de 1.5gr, luego como la lectura se realizó con una pipeta de 11ml, tenemos que el contenido de gramos de grasa es:
Gramos de grasa = 1.5 +0.06/ 1.041= 1.557gr. de grasa en leche
DERTERMINACIÓN DE GRASA EN YOGUR POR EL MÉTODO DE GERBER:
Procedimiento: Véase protocolo de prácticas.
Resultados: La lectura es de 1.5g, es decir 1.5 es la diferencia entre el valor superior y el inferior obtenido en el butirómetro.
Como habíamos tomado 25g de muestra, el valor que obtendremos será de:
%grasa = (1.4/25)*100 = 5.6% grasa
DETERMINACIÓN DE GRASA EN QUESO:
Procedimiento: Véase protocolo de prácticas.
Resultados: El estracto graso será del 24% según la lectura tomada. Ahora deberemos tener el resultado de la practica 2ª para obtener el porcentaje. Luego mediante una regla de tres obtendremos:
24% 55.56%
x 100%
x = 43.2% de materia grasa en el queso
PRÁCTICA 3: CONTROL DE CALIDAD DE HUEVOS
OVOSCOPIA:
Procedimiento: Colocaremos el huevo sobre el ovoscopio y procederemos a observar los parámetros que nos interesen.
Cáscara y cutícula: Al ovoscopio se puede ver descalcificacion a modo de manchas y grietas de dificil visión. También observaremos bajo la luz U.V..
Ante una coloración más intensa el huevo será más nuevo. Si el huevo es viejo aparecerán pintas a consecuencia de la descalcificación
Observación: En nuestro huevo no se apreciaron manchas de consideración, ni suciedad ni grietas demasiado grandes. Parecía estar bastante bien.
Cámara de aire: Se puede observar mediante el ovoscopio la cámara de aire con un tono un tanto más oscuro en la base del huevo.
Procedimiento: Procedemos a señalarlo con un lápiz y luego medimos la altura con un pie de rey.
Resultados: La cámara de aire tenia una altura de 0.19 cm. Esto nos indica que el huevo muy fresco puesto que consideramos fresco hasta los 3 mm y por lo tanto es un huevo de muy poco tiempo.
Yema y clara: La observación al microscopio nos permitirá descubrir manchas oscuras que indicarán presencia de carne o sangre en el caso de la clara. Para la yema, podrá observarse una mancha de color más oscuro pero en ningún caso negro. Podremos además observar el movimiento de ésta, no moviéndose apenas en los huevos frescos.
Observación: El movimiento era casi nulo, apenas se movía. Además el huevo no bailaba, lo que concuerda con la definición de huevo fresco, ya que si el huevo es viejo bailará por la acumulación de aire.
LUZ U.V.:
Cutícula: Su observación bajo luz U.V. nos va a permitir determinar la categoría del huevo.
Observación: El huevo observado era blanco y su coloración azul clara.
Interpretación: Un huevo blanco con coloración azul clara bajo luz U.V. nos viene a decir que existe una ligera pérdida de la cutícula.
UNIDADES HAUGH:
Fundamento teórico: Estas unidades son consecuencia de una expresión matemática, que nos permite medir la calidad en función del interior del huevo abierto. Para determinar estas unidades, precisamos de una serie de parámetros.
Resultados:
Peso del huevo = 75.6 gr.
Altura de la clara densa = 5 mm.
U.H. = 100xlog (5+7.57 - 1.7x76.50.37) = 61.37
U.H. = 61.37
Interpretación: Un valor de unidades de 61.37 nos indica un huevo de muy buena calidad en cuanto a su yema.
DETERMINACIÓN DEL pH:
Procedimiento: Para obtener el pH del huevo tomaremos un papel indicador que nos dará el valor correspondiente.
Resultados: El pH de la clara fue de 9, mientras que el pH de la yema fue de 7.
Interpretación: Un pH tan básico es indicativo de un huevo conservado en cámara además de que nos indica que dicho huevo tiene varias semanas.
COLOR DE LA YEMA DEL HUEVO:
Procedimiento: Para su determinación utilizamos un patrón denominado abanico de Roche. Romperemos el huevo sobre papel aluminio y compararemos con el abanico el cual nos dará un valor.
Resultados: El valor obtenido en el abanico según el color de la yema fue de 8.
ESPESOR DE LA CÁSCARA:
Procedimiento y resultados: Para su medida utilizábamos el Pie de rey y la lectura obtenida fue de 0.07 mm.
CARACTERÍSTICAS ORGANOLÉPTICAS:
La yema poseía una forma esferoidal y perfectamente diferenciada de la clara. Se podían observar las chalazas como estructuras blancas y enrolladas sobre sí mismas. Su olor era agradable lo que parecía indicar que el huevo no estaba en mal estado.
CONCLUSIÓN FINAL:
Huevos:
La calificación global del huevo fue muy buena. Clasifiqué el huevo en la categoría A, pues era la categoría en la que más recaían los factores determinados.
El huevo además era joven como indicada el análisis de su cáscara y cutícula ante la ausencia de manchas de consideración y suciedad, además del pequeño tamaño de su cámara de aire.
Tampoco se observó en el análisis al ovoscopio anormalidades en clara y yema, ni “baile”, con lo que se concluye un huevo joven y fresco.
La cutícula presentaba una ligera pérdida, la yema poseía una forma esferoidal y perfectamente diferenciada de la yema y un valor de unidades Haugh referentes a una categoría A que es en la que se clasifica el huevo.
Luego el huevo era joven, fresco y conservado en refrigeración (según el pH), además de clasificarse en la categoría A, que indica una buena calidad de huevo.
PRÁCTICA 4: CONTROL DE CALIDAD EN ALIMENTOS DE ORIGEN VEGETAL
ACTIVIDAD PEROXIDASA: EN LECHUGA
Procedimiento: Se toman 10 gr. de lechuga y se mezclan con 50 ml. de agua para ser homogeneizados en un triturador. Se preparan dos muestras:
Muestra 1: macerado + guayacol + peróxido de hidrógeno. Tras agitar presentará un color rojo parduzco.
Muestra 2: macerado + guayacol + peróxido de hidrógeno + 5 minutos sometido a calor. La muestra tras el tratamiento aparecía con un color verdoso claro.
Resultados e interpretación: Se obtuvieron dos muestras con idéntico contenido de elementos pero una fue sometida a calor y la otra no. La que fue sometida a calor presentó una coloración verdosa clara mientras que la otra una coloración roja pardusca. Ello nos indica que la que fue sometida había perdido la totalidad de su peroxidasa mientras que la otra no.
pH y ACIDEZ TITULABLE:
Procedimiento: Se añadieron dos gotas de NaOH 0.1 N para alcanzar un pH = 8.1, siendo el volumen de sosa usado de 0.2ml, en un macerado que contenía un total de 10 gr. de vegetal fresco (lechuga para este caso).
Resultados: Son calculados en función de los ml de NaOH 0.1 N utilizados multiplicados por un factor de conversión.
| Acético | 0.2 ml. NaOH | factor de conversión = 0.06 | 0.2x0.06 = 0.012% |
| Cítrico | 0.2 ml. NaOH | factor de conversión = 0.07 | 0.2x0.07 = 0.014% |
| Láctico | 0.2 ml. NaOH | factor de conversión = 0.09 | 0.2x0.09 = 0.018 % |
| Málico | 0.2 ml. NaOH | factor de conversión = 0.067 | 0.2x0.067 = 0.0134% |
| Tartárico | 0.2 ml. NaOH | factor de conversión = 0.075 | 0.2x0.075 = 0.0144% |
ÍNDICE DE REFRACCIÓN DE LA GRASA:
Procedimiento: Utilizamos un refractómetro para medir el índice de refracción que nos dará la relación entre refracción de la luz y la matería grasa. Cada aceite presentará un índice de refracción característico.
Para esta prueba tomamos dos tipos de aceite, medimos su grado de refracción y determinamos el tipo de aceite del que se trata.
Resultados:
TIPO DE ACEITE ÍNDICE DE REFRACCIÓN
Aceite de oliva 1.469
Aceite de girasol 1.473
Interpretación: Con los índices de refracción determinamos el tipo de aceite de oliva que estabamos analizando y según las tablas del protocolo obtuvimos que los aceites analizados fueron de oliva y de girasol.
DETERMINACIÓN DEL VACIO:
Procedimiento: Para la lectura de la presión en el interior de una lata de conserva, se utiliza un vacuómetro, que se coloca sobre la tapa y manualmente se presiona con la finalidad de agujerear la tapa y medir la presión interior.
Resultados: La presión obtenida tras realizar la perforación fue de -0.6 bares en el caso de la lata de macedonia.
Posteriormente procedimos a medir el espacio de cabeza y la medida obtenida fue de 0.9mm, obtenida con el pie de rey.
DETERMINACIÓN DE SÓLIDOS SOLUBLES Y pH DEL LÍQUIDO DE GOBIERNO:
Procedimiento: Se determinan gracias a la medida en un refractómetro que nos dará los grados Brix que serán equivalentes a una determinada concentración.
Resultados: Los grados Brix obtenidos en el refractómetro fue de:
ºBrix=15.1º
Para la determinación del pH del líquido de gobierno utilizaremos un peachímetro.
pH=3.71
Interpretación: Como los almíbares se clasifican en función de sus grados brix, tenemos que para el caso estudiado de la lata de macedonia tendremos un almíbar ligero, mientras que el pH es correcto debido a que no supera un valor establecido de 4.6.
PESO NETO Y PESO ESCURRIDO:
Procedimiento: Pesaremos los distintos componentes de la lata a estudiar.
Resultados:
| Peso total | 485.7gr. |
| Peso placa + sólido | 325.8gr. |
| Peso líquido | 159.9gr. |
| Peso placa | 59.2gr. |
| Peso escurrido | 266.6gr. |
ESPESOR DE LA LATA:
Procedimiento: En la práctica se midió el espesor de la hojalata mediante una medida indirecta.
Resultados:
Espesor de la tapa = 0.16 mm
P = 1.8 gr.
S = 14.52 cm2
Superficie = 4.4x3.3 = 14.52 cm2
Espesor de la hojalata = (1.8x100)/(14.52x7.85) = 180 / 113.98 = 1.579 cm
Nota: El valor que nos sale no es correcto, pero el profesor nos dijo que pusiéramos lo que nos había salido porque el procedimiento aplicado era el correcto.
CÁLCULO DE LA COMPACIDAD:
Procedimiento: Vease protocolo de prácticas
Resultados:
Grosor real del cierre = 1.34 mm
Espesor del cuerpo = 0.38 mm
DETERMINACIÓN DE LA LÍNEA DE BARNIZ:
Procedimiento: Cortamos una muestra de hojalata de dimensiones conocidas, la lavamos y la introducimos en una disolución de sulfato de cobre. Posteriormente lavar con alcohol, agua y dejar secar.
Resultados e interpretación: La línea de Barniz nos sale roja por lo tanto indica que la tapa carece de éste. Puede deberse a algún fallo o puede deberse a que la lata analizada sea muy vieja.
PRÁCTICA 5: CONTROL DE CALIDAD DE LA MIEL
DETERMINACIÓN GRAVIMÉTRICA DEL CONTENIDO DE SÓLIDOS SOLUBLES EN AGUA:
Procedimiento: Pesamos 20gr de miel de romero (en nuestro caso) y diluimos en 50ml de agua. Una vez disueltos, procederemos a medir el pH con un peachímetro.
Posteriormente añado NaOH hasta que el pH tenga un valor entre 8-9, para, más tarde, filtrarlo(en este caso el profesor de prácticas nos dijo que no lo hiciésemos con un criso poroso porque se obturaba y tardaba mucho en filtrarse. Lo que hicimos fue utilizar un filtro hecho manualmente y colocado sobre un embudo).
Resultados: El pH inicial que se había obtenido fue de 3.58 y tras añadir un volumen de 4.5 ml. de NaOH obtuvimos un pH final de 8.47.
El peso del papel de filtro antes de filtrar fue de 0.587gr(en ausencia de miel).
Después de filtrar el peso fue de 0.949gr(con miel y tras haber calentado).
Todos los valores vienen recogido en la siguiente tabla:
| Pesos/ volúmenes/ valores | |
| pH inicial | 3.58 |
| pH final | 8.47 |
| NaOH 0.1 N | 4.5ml |
| papel de filtro no usado | 0.587gr |
| papel de filtro usado | 0.949gr |
Luego el contenido de sólidos insolubles será de 0.362gr de sólidos insolubles en 20gr de miel. Si lo que quiero es expresarlo en 100gr de miel, lo que tendremos será:
1.81gr/100gr de miel
DETERMINACIÓN DE LA ACIDEZ:
Procedimiento: Peso 10 gr. de miel y disuelvo en 75 ml. de agua para posteriormente valorar con NaOH 0.1 N y tras homogeneizar añado unas gotas de fenolftaleina para obtener una valoración visual. También utilizaré el peachímetro para obtener dos medidas y así poder valorar con una mayor seguridad.
Resultados: El volumen de NaOH gastado en la valoración fue de 2.2 ml., pues fue aquel que llevaba el pH de la disolución de miel hasta un pH = 8.3 aproximadamente.
Para obtener la acidez, aplicamos la fórmula del protocolo y obtuvimos que:
Acidez = 10x2.2 = 22 miliequivalentes de ácido
22 meq. 10gr.
x 1000gr
x = 2200 meq / Kgr. de miel
DETERMINACIÓN DE LAS CENIZAS:
Procedimiento: Peso en un crisol vacío 5gr de miel, tomando previamente el peso del crisol vacío. Una vez pesado el crisol y añadido a él los 5gr de miel procederemos a calentar para generar un proceso de caramelización. Tras un rato calentándose lo introduciremos en la mufla y lo dejaremos durante 4-5 horas para posteriormente medir el peso del crisol con las cenizas.
Resultados: Los resultados obtenidos se recogen en la siguiente tabla:
| Pesos | |
| Crisol | 51.704gr |
| Miel | 5gr |
| Crisol + Miel | 56.704gr |
| Crisol + Cenizas | 51.707gr |
Para expresar los resultados como porcentaje con respecto al total de muestra utilizada tendremos que el valor total de cenizas es de 0.003gr/5gr de miel. En porcentaje será:
0.06% de cenizas
DETERMINACIÓN DE LA HUMEDAD:
Procedimiento: Utilizaremos un refractómetro, sobre el que colocaremos una gota de miel, previo lavado de la lente con un poco de alcohol para evitar la presencia de posibles restos de muestra medidos anteriormente a nuestra medida.
Resultados: El índice de refracción obtenido fue de 1.4910 y su contenido en humedad es del 18.2 %. El resultado lo obtenemos de las tablas establecidas para la determinación del contenido en humedad del protocolo de prácticas.
R.: 18.2 % de humedad
ANÁLISIS POLÍNICO:
Procedimiento: Pesamos 10 gr. en un vaso de precipitados de 50 ml., añadiendo posteriormente 20 ml. de agua acidulada. Homogeneizamos la muestra y centrifugamos más tarde, decantamos y resuspendemos más tarde para volver a centri fugar durante 5 min. Seguimos el protocolo para finalmente colocar una gota sobre el porta, colocamos sobre sobre la gota un cubre y miramos al microscopio.
Resultados: Los granos de polen observados en la muestra de miel analizada fueron:
| Grano de polen de Azahar | Presenta una corona que rodea a un nucleo amarillo |
| Grano de polen de romero | Son los más abundantes |
DETERMINACIÓN FOTOMÉTRICA DEL CONTENIDO DE HIDROXIMETILFURFURAL:
Procedimiento: Disolvemos 5 gr. en 25 ml. de agua, homogeneizamos y añadimos Carrez I y II (0.5 ml.) para llevar posteriormente hasta 50 ml. Mezclamos, filtramos y desechamos los primeros 10 ml. de filtrado. Continuamos con el protocolo y añadimos al tubo de referencia agua y al de referencia bisulfito.
Tras obtener la muestra mediremos en el espectrofotómetro a 284nm y a 336nm, habiendo previamente establecido el 0 con agua destilada.
Resultados: Los resultados de absorbancia obtenidos en el espectrofotómetro están recogidos en la siguiente tabla:
| Longitud de onda | Bisulfito (referencia) | Agua (muestra) |
| 284 nm | 0.482 | 0.640 |
| 336 nm | 0.062 | 0.074 |
El contenido final lo obtenemos de la fórmula:
mg HMF/100gr. de miel = [(0.640-0.074)x14.97x5]/5= 8.47 mg HMF/100gr. de miel
R.: 8.47 mg HMF/100gr. de miel
PRÁCTICA 6: CONTROL DE CALIDAD EN PESCADOS Y PRODUCTOS DE LA PESCA
DETERMINACIÓN DE LA ESPECIE DE PESCADO ANALIZADA:
Procedimiento: Para su determinación utilizaremos un manual que nos servirá de guía para determinar la especie de pescado analizada.
Resultados: El pescado que analizamos durante la práctica fue el besugo (Pagellus sp.)
DETERMINACIÓN DE LA FRESCURA DEL PESCADO:
Fundamento teórico: Para la determinación de la frescura utilizaremos una serie de parámetros característicos del pescado como ojos, mucus, musculatura, etc. En función del aspecto que presenten ante la vista dichos parámetros los clasificaremos en las distintas categorias en función de su calidad (extra, A, B o C).
Procedimiento: Abriremos el pescado y estudiaremos sus distintas regiones anatómicas valorando desde el 3 (como extra) hasta el 0(como no admitido) los distintos parámetros. Una vez medidos todos los parámetros procederemos a realizar una media aritmética con la finalidad de determinar la frescura del pescado.
Resultados: Los valores adjudicados a los distintos parámetros estudiados vienen recogidos en la siguiente tabla:
| PARÁMETROS | VALORES |
| Piel | 2 |
| Mucosidad | 3 |
| Ojo | 0 |
| Branquias (aspecto) | 1 |
| Branquias (olor) | 2 |
| Carne | 1 |
| MEDIA ARITMÉTICA | 1.5 |
Interpretación: El valor obtenido clasifica el pescado estudiado con la denominación B la cual no es de muy buena calidad pero no necesariamente se precisará una retirada del consumo humano.
DETERMINACIÓN DE LA TRIMETILAMINA POR EL MÉTODO DEL ÁCIDO PÍCRICO:
Procedimiento: Véase el de protocolo de prácticas.
Resultados: La absorbancia obtenida en el espectrofotómetro a 410nm fue:
A= 0.158
Para determinar a partir de esa absorbancia los mg de TMA (trimetilamina) utilizaremos la fórmula del protocolo en la cual se multiplica el valor de la absorbancia por 3.75 obteniendo el valor deseado que nos permitirá determinar el grado de alteración del pescado. El valor obtenido fue:
3.75x0.158= 0.5925 mg TMA/100gr de pescado
Interpretación: Según la tabla del protocolo el valor obtenido para mi pescado viene a indicar una incipiente alteración, pero el pescado será apto para el consumo. Sabido es que cada tipo de pescado se altera de manera distinta, es decir, a distinta velocidad. Nuestro pescado era fresco de por la mañana y fue analizado por la tarde desde las 15:00 h. hasta las 18:00 h. y presentaba un cierto grado de alteración, pero ello a pesar de todo el pescado era apto para el consumo humano.
REACCIÓN DE LA PARA-QUINONA:
Procedimiento: Homogeneizamos 3gr de pescado con 20ml de agua destilada y homogeneizamos para posteriormente centrifugar y añadir 0.2ml de para-quinona a 8ml de sobrenadante.
Resultados: Apareció un color turbio pero muy claro (no lo identifiqué como amarillo canario), el cual no era anaranjado ni tampoco rojo.
Interpretación: Puesto que a mayor intensidad de color, mayor alteración, interprete el color obtenido (que no fue amarillo canario) como pescado fresco que no ha sufrido alteración. Con lo cual según esta prueba el pescado era fresco.
PRUEBA COLORIMÉTRICA DE NESSLER:
Procedimiento: Es el mismo que el del protocolo de prácticas.
Resultados: Al mezclar los 10ml de filtrado con el reactivo, obtenemos un color amarillo azufrado.
Interpretación: Este color será indicativo de buena calidad del pescado.
PRÁCTICA 7: CONTROL DE CALIDAD EN CARNE Y PRODUCTOS CÁRNICOS
DETERMINACIÓN DE NITRITOS EN PRODUCTOS CÁRNICOS:
Procedimiento: Ponemos 10ml en un tubo de ensayo de extracto de jamon york y le añadimos una disolución colorimétrica. Posteriormente aislaremos de la luz durante un período de tiempo para después medir la absorbancia a 520nm habiendo establecido previamente una recta patrón.
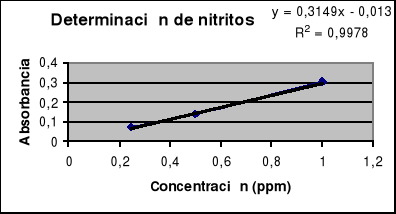
Resultados: Los valores de absorbancia obtenidos a 520nm para la realización de la recta patrón fueron, según las concentraciones dadas en ppm, fueron:
| Concentración | Absorbancia |
| 0.25ppm | 0.070 |
| 0.5ppm | 0.138 |
| 1ppm | 0.304 |
Tras obtener estos valores que nos dan la recta patrón, introdujimos la muestra problema, la cual la hicimos por duplicado obteniendo dos valores de absorbancia para ser más precisos en nuestras medidas. Los valores de absorbancia obtenidos fueron:
1ª Lectura = 0.239
2ª Lectura = 0.266
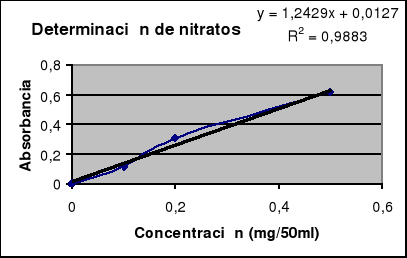
La recta patrón determinada se representa en la siguiente gráfica, junto con la ecuación de la recta. Tomamos y como el parámetro que representa la absorbancia y x como el parámetro que representa la concentración.
Para esta ecuación de la recta, podemos observar que ante los valores de absorbancia obtenidos la concentración de nitritos en la muestra va a ser para cada uno de ellos:
Absorbancia 1ª = 0.239 Concentración = 0.80ppm
Absorbancia 2ª = 0.266 Concentración = 1.25ppm
Como la muestra fue realizada por duplicado, para ser más exactos en nuestras medidas, lo que hacemos es una media aritmética de los valores finales obtenidos. Para expresar correctamente la concentración utilizaremos la fórmula dada en el protocolo de prácticas para posteriormente realizar la media aritmética ya nombrada, de manera que:
Ppm nitritos = (0.80*2500)/(10*10) = 20ppm
Ppm nitritos = (1.25*2500)/(10*10) = 31.25ppm
Si realizamos una media aritmética de esos valores obtenidos, tendremos un valor final de concentración de:
25.62ppm será la concentración final obtenida en el extracto de carne.
Interpretación: Un valor tan bajo de nitritos libres puede indicar que se ha utilizado nitratos para la conservación de la carne. De una forma o de otra el nivel de nitritos libres hace que la carne sea óptima para el consumo.
DETERMINACIÓN DE NITRATOS EN PRODUCTOS CÁRNICOS:
Procedimiento: Añadimos 10ml de extracto a un matraz con 1ml de brucina-ácido sulfanílico y más tarde ácido sulfúrico lentamente. Aislamos de la luz durante un tiempo para después añadir agua destilada hasta completar 40ml y volver a aislar de la luz. Luego dejamos enfriar en hielo hasta alcanzar Tª ambiente y luego enrasamos a 50ml para medir en el espectrofotómetro.
Resultados: Los valores de absorbancia obtenidos a 410nm para la realización de la recta patrón fueron, según las concentraciones dadas en mg/50ml, fueron:
| Concentración | Absorbancia |
| 0.1 mg/50ml | 0.120 |
| 0.2 mg/50ml | 0.305 |
| 0.5 mg/50ml | 0.620 |
Tras obtener estos valores que nos dan la recta patrón, introdujimos la muestra problema, la cual la hicimos por duplicado obteniendo dos valores de absorbancia para ser más precisos en nuestras medidas. Los valores de absorbancia obtenidos fueron:
1ª Lectura = 0.021
2ª Lectura = 0.014
La recta patrón determinada se representa en la siguiente gráfica, junto con la ecuación de la recta. El coeficiente de correlación obtenido fue de 0.99 con lo cual la recta patrón parece ser bastante fiable pues la correlación es buena. Tomamos y como el parámetro que representa la absorbancia y x como el parámetro que representa la concentración.
Para esta ecuación de la recta, podemos observar que ante los valores de absorbancia obtenidos la concentración de nitratos en la muestra va a ser para cada uno de ellos:
Absorbancia 1ª = 0.021 Concentración = 6.67x10 -3mg/50ml
Absorbancia 2ª = 0.014 Concentración = 1.04x10 -3mg/50ml
Como la muestra fue realizada por duplicado, para ser más exactos en nuestras medidas, lo que hacemos es una media aritmética de los valores finales obtenidos. La media aritmética nos da un valor definitivo de:
3.85x10 -3mg/50ml
Esa concentración se encontraba en los 50ml de disolución, en el cual había 10ml de estracto. Si lo extrapolamos a los 200ml de la disolución de la que proviene tendremos que:
3.85x10-3 10ml
x 200ml
x = 7.7x10-2 mg/200ml
Como en los 200ml de disolución inicial había 10gr de estracto, si lo calculamos para un kg, podremos ver que la concentración final va a ser:
7.7 mg/kg será la concentración de nitratos en el jamón york
Interpretación: El bajo contenido de nitratos indica que el alimento analizado es apto para el consumo. El valor es más bajo incluso que el de los nitritos. Parece indicar que se utilizaron nitratos para la conservación y por el proceso de transformación de nitratos en nitritos, la concentración de los últimos libres será mayor que la de los últimos.
DERTERMINACIÓN CUALITATIVA DE ALMIDÓN EN PRODUCTOS CÁRNICOS:
Procedimiento: Pesamos 19gr de Jamon York triturado y calentamos 5min a partir de haber empezado a hervir tras haber añadido 40ml de agua destilada. Lo sacamos y dejamos enfriar. Centrifugamos y tomamos unicamente porción sólida de la muestra. Más tarde añadiremos solución yodo-yodurada y observamos el color adquirido.
Resultados: La coloración obtenida fue un color muy oscuro, entre azul y negro.
Interpretación: La aparición de éste color nos indica la presencia de almidón, lo que además coincide con la etiqueta del producto analizado que indicaba la presencia de fécula.
DETERMINACIÓN DEL pH:
Procedimiento: Pesamos 5gr de magra de cerdo y lo trituramos con agua destilada de forma que obtengamos una disolución de magra de cerdo. Posteriormente dejamos reposar y mediremos el pH.
Resultados: El pH lo medimos con el pH-metro, y con tiras de pH específicas para medir el pH de la carne. Los resultados obtenidos fueron:
| Disolución de carne medida con el pH-metro | 5.78 |
| Disolución de carne medida con las tiras | 5.2 |
| Pedazo de carne medido con la tira | 5.7 |
Interpretación: Los valores obtenidos nos permiten determinar si la carne analizada es de tipo DFD o PSE. Las diferencias en los valores obtenidos tras medir con las tiras radica en que las tiras están destinadas a medir pH en la muestra de carne y no en disoluciones.
El valor de pH tras el sacrificio de los animales, suele disminuir pasado un tiempo a consecuencia de los procesos propios de autolisis de las células de la carne. El valor obtenido en la práctica (más bajo de lo que indica el protocolo) parece ser normal, y por ello la carne es apta para el consumo.
- * : Determinaciones realizadas a ambas muestras de leches para su posterior comparación.
** : Únicamente realizada a la leche problema de “cabra”.
Descargar
| Enviado por: | Silvica |
| Idioma: | castellano |
| País: | España |
