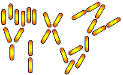Biología
Bacterias
“LABORATORIO DE MICROBIOLOGIA”.
UNIDAD 1
“ BACTERIAS “.
INTRODUCCIÓN:
Los microorganismos pueden ser eliminados, inhibidos o muertos por agentes físicos o químicos. Se dispone actualmente de una gran variedad de técnicas y agentes que actúan de manera diferente y cada uno tiene sus propios limites de aplicación de practica.
Entre los agentes físicos más utilizados están el calor, la presión, la radiación, los filtros y el ultrasonido. Entre los agentes químicos se encuentran los compuestos de cloro, yodo, fluor y bromo; metales pesados como el mercurio; así mismo alcoholes, fenoles, aldehídos y cetonas entre otros.
La elección del método de esterilización depende de la naturaleza del material que va a ser tratado.
Esterilización por autoclave. El autoclave es un instrumento para hervir el agua bajo presión. Es un cilindro de metal, horizontal o vertical con una tapa también de metal que puede ser cerrada mediante pestillos o cerrojos sobre una arandela de goma. Está provista de una llave de vapor, un manómetro y una válvula de seguridad. El agua hierve en el cilindro ya sea mediante quemadores exteriores de gas o por calentador eléctrico de inmersión. La tapa se atornilla y la llave de vapor se deja abierta, cerrándose cuando ya haya sido desplazado todo el aire, puesto que en caso contrario la presión leída sobre el manómetro indicaría la presión del aire, más presión de vapor y la temperatura obtenida seria la que corresponde únicamente al vapor.
Cuando se cierra la válvula de vapor se eleva la presión y es usual fijar la válvula de seguridad para que se abra a 15 libras , que corresponde a una temperatura de 121 ºC.
Esterilización por aire caliente. Las estufas de aire caliente esterilizan por calor seco, por deshidratación de las células. El aire no es buen conductor del calor y este tipo de esterilización supone problemas de penetración. El calentamiento puede ser por gas o por electricidad, pero en todos los casos la estufa debe tener un ventilador fijado en su parte superior, ya que si no, la temperatura puede variar considerablemente en puntos distintos del interior.
Se precisan temperaturas de 160 - 180 ºC que pueden ser mantenidas con un termostato de gas sencillo, que darán unas diferencias de unos 5 ºC. El horno no eléctrico es mucho mas limpio que el de gas.
FORMAS BÁSICAS DE LAS BACTERIAS.
Cocos
Micrococos, aparecen aislados y dispersos tras la división celular. Diplococos, aparecen por pares. Estreptococos, tienden a unirse formando cadenas. Estafilococos, aparecen en grupos irregulares, a veces de gran tamaño
|
|
|
|
|
|
|
| forma esférica: se llama Coco | División a lo largo del mismo plano, formando cadenas cortas | División a lo largo de 2 planos diferentes: Tétradas | División a lo largo de 3 planos | ||
| 2 cocos juntos: Diplococos | 4 - 20 en cadenas: Estreptococos | regularmente: Sarcinas | irregularmente: Estafilococos | ||
Bacilos
grandes variaciones morfológicas: fusiformes, estreptobacilos, cocobacilos
|
|
|
|
|
| Forma de vara: se llaman Bacilos | Dos bacilos juntos: Diplobacilos | Cadenas de bacilos: Estreptobacilos | Empalizadas, Bacilos lado con lado o en figuras en X, V o Y |
Espirales (Treponemas, Borrelias ...)
|
|
|
| Forma espiral rígida se llama: Espirilo | Si la espiral es flexible y ondulada se llama: Espiroqueta |
Utilizamos el término Pleomorfismo para referirnos a la adopción de diferentes formas en una misma especie.
Técnicas de tinción. Fundamentos.
El tamaño de la mayoría de las células bacterianas es tal que resultan difíciles de ver con el microscopio óptico. La principal dificultad es la falta de contraste entre la célula y el medio que la rodea, y el medio más simple de aumentar el contraste es la utilización de colorantes. Estos pueden emplearse para distinguir entre tipos diferentes de células o para revelar la presencia de determinados constituyentes celulares, tales como flagelos, esporas, cápsulas, paredes celulares, centros de actividad respiratoria, etc.
Las células generalmente son tratadas para coagular el protoplasma antes de teñirlas, proceso llamado fijación. Para bacterias, la fijación por el calor es lo más corriente, aunque también puede fijarse con sustancias químicas como formaldehído, ácidos y alcoholes. Después de la fijación, si se añade el colorante, no se producen ulteriores cambios estructurales en el protoplasma. La fijación se realiza habitualmente en células que han sido fijadas sobre un portaobjetos, tratando después éste con el agente fijador, y siguiendo inmediatamente el proceso de tinción. La fijación produce habitualmente el encogimiento de las células; la tinción, por el contrario, hace que las células aparezcan mayores que lo que son realmente, de manera que las medidas de las células que han sido fijadas o teñidas no pueden realizarse con mucha precisión.
La mayoría de los colorantes son compuestos orgánicos que tienen alguna afinidad específica por los materiales celulares. Muchos colorantes utilizados con frecuencia son moléculas cargadas positivamente (cationes) y se combinan con intensidad con los constituyentes celulares cargados negativamente, tales como los ácidos nucleicos y los polisacáridos ácidos. Ejemplos de colorantes catiónicos son el azul de metileno, el cristal violeta y la safranina. Otros colorantes son moléculas cargadas negativamente (aniones) y se combinan con los constituyentes celulares cargados positivamente, tales como muchas proteínas. Esos colorantes incluyen la eosina, la fucsina ácida y el rojo Congo. Otro grupo de colorantes son sustancias liposolubles; los colorantes de este grupo se combinan con los materiales lipídicos de la célula, usándose a menudo para revelar la localización de las gotículas o depósitos de grasa. Un ejemplo de colorante liposoluble es el negro Sudán.
Algunos colorantes teñirán mejor sólo después de que la célula haya sido tratada con otra sustancia química, que no es un colorante por sí mismo. Esta sustancia se denomina mordiente; un mordiente habitual es el ácido tánìco. El mordiente se combina con un constituyente celular y lo altera de tal modo que ahora sí podrá atacar el colorante.
Si se desea simplemente incrementar el contraste de las células para la microscopía, son suficientes los procedimientos simples de tinción. El azul de metileno es un buen colorante simple que actúa sobre todas las células bacterianas rápidamente y que no produce un color tan intenso que oscurezca los detalles celulares. Es especialmente útil para detectar la presencia de bacterias en muestras naturales, puesto que la mayor parte del material no celular no se tiñe.
La tinción negativa es el reverso del procedimiento de tinción usual: las células se dejan sin teñir, pero se colorea en cambio el medio que las rodea. Lo que se ve, por tanto, es el perfil de las células. La sustancia utilizada para la tinción negativa es un material opaco que no tiene afinidad por los constituyentes celulares y que simplemente rodea las células, tal como la tinta china (que es una suspensión de partículas de carbono coloidal) o la nigrosina (un colorante negro insoluble en agua). La tinción negativa es un modo satisfactorio de aumentar el contraste de las células en la microscopia óptica, pero su máxima utilidad está en revelar la presencia de cápsulas alrededor de las células bacterianas.
Los métodos de tinción son de gran utilidad, pero deben usarse siempre con precaución, ya que pueden conducir a errores. Las moléculas de colorante forman en ocasiones precipitados o agregados que parecen estructuras celulares auténticas, pero que son formaciones completamente artificiales inducidas por el mismo colorante. Tales estructuras se denominan artefactos, y deben tomarse muchas precauciones para tener la seguridad de que no nos estamos equivocando al creer que un artefacto es una estructura realmente existente.
Bacteria Gram Positiva Bacteria Gram Negativa

PRACTICA # 1
“PREPARACIÓN Y ESTERILIZACIÓN DEL MATERIAL PARA EL LABORATORIO DE MICROBIOLOGÍA.”
OBJETIVO:
El alumno aprenda la técnica para la preparación y esterilización del material de laboratorio usado en microbiología.
MATERIALES Y REACTIVOS:
11 Pipetas de 1 ml o 2 ml.
10 Tubos de ensayo sin tapón ( que cubra 1/3 del tubo de 10 ml ).
1 Pipeta de 10 ml.
1 Clip.
1 Gradilla.
1 Vaso de p.p. de 100ml o 250 ml.
1 Matraz erlenmeyer de 500 ml.
1 Probeta de 100 ml.
1 Mechero fisher.
Agar.
Algodón
Alcohol
Cinta adhesiva de papel.
Papel dextrasa.
Gasa.
MÉTODOS:
Preparación para la elaboración de los gorros.
Para tener una base para el calculo del gorro, tenemos que aproximadamente con un pliego de papel dextrasa de tamaño carta, se obtiene un gorro adecuado para tapar un matraz de 500 ml. Los pasos principales para la elaboración de ellos ( figura no. 1.1 ) es la siguiente:
Se corta el papel dextrasa en forma de rectángulo, del tamaño según se necesita.
Se dobla el papel a la mitad con respecto a la parte larga del mismo.
Se doblan las puntas superiores, según indica la figura uniéndolas por el centro.
De la parte inferior se dobla hacia arriba al borde de la hoja que queda encima, hasta la altura de las puntas unidas y se le da media vuelta al papel.
Se doblan las puntas de los lados, hasta la altura donde sobre sale el doblez del inciso no. 4, según indica la figura.
de la parte inferior se dobla hacia arriba , el borde sobresaliente de la hoja hasta el doblez interior.
se le da media vuelta al papel obteniéndose de esta manera el gorro.
Elaboración de tapones de algodón.
Los tapones son utilizados en los diferentes tamaños de tubos y matraces, por lo que el procedimiento presentado en la figura no. 1.2 es una forma generalizada del proceso.
Como base para la elaboración: con una tira de algodón de ( 15 - 20 cm de largo, 3 cm de ancho y un grosor de 0.5 cm ) aproximadamente , y con una gasa de 10 x 10 cm, se obtiene un tapón adecuado para un matraz de 500 ml.
Los principales pasos para la elaboración de tapones de algodón ( figura no. 12 ) se describen a continuación:
Se corta una tira de algodón, de largo adecuado a las necesidades ( ya sea para los tubos de ensayo o para el matraz de 500 ml )
Con una pinza de disección se prensa uno de los extremos.
Se enrolla el algodón en la pinza, de una manera que quede firme el enrollado.
Por otro lado, se corta el cuadro de gasa adecuado al tamaño requerido y se coloca en la boca ( en el del matraz o de los tubos de ensayo ), procurando centrarlo.
Con la pinza y el algodón enrollado en ella, la gasa se presiona hacia adentro del matraz, de manera que entre uniformemente por todos lados a la boca de este, dejando a flote la punta superior del algodón. La pinza es sacada del algodón dando una vuelta en sentido contrario al enrollado para que afloje, y jalando hacia arriba presionando el algodón para que no salga de la boca del matraz o de los tubos de ensayo.
Hasta este paso, deben quedar cuatro puntas de la gasa colgado a los lados de la boca del matraz: dos de las puntas que se encuentran opuestamente, se amarran entre si formando un lazo.
Luego se amarran las otras dos puntas restantes, obteniéndose de esta manera el tapón de algodón.
Preparación y envolturas de pipetas.
La preparación de las pipetas para su esterilización es sencilla; se lavan perfectamente con agua y jabón y se secan por 10 minutos en la estufa a 100 °C. Con un clip se le introduce en la boquilla de succión un filtro de algodón , de forma de que el algodón entre suavemente y sin romperse con la presión del clip. Este tapón tiene una doble función, una es para evitar que en un descuido de succión forzada, por obstrucción de la pipeta, ingiera el alumno el producto succionado al destaparse bruscamente, y la segunda razón es para evitar que por la boquilla de succión entren microorganismos que alteren el trabajo realizado.
Se corta una tira de papel dextrasa de aproximadamente 5 cm de ancho y 30 cm de largo.
Se dobla el extremo inferior aproximadamente 2 cm.
Se coloca la pipeta con la punta a la mitad del doblez anterior y con un ángulo de aproximadamente 25 - 30 grados de inclinación con respecto a la posición del papel dextrasa.
Se le hace un segundo doblez , tapando la punta de la pipeta con la porción de papel que sobresale a la punta de la pipeta.
Se le hace un tercer doblez a la punta de la pipeta que queda en el ángulo de inclinación, tal como se representa en la figura no. 1.3 de manera que cubra completamente la punta de la pipeta.
Se dá vuelta a la pipeta procurando que el papel vaya envolviéndola en forma de espiral.
Verificar que el enrollado no quede flojo, en caso de estarlo, reafirmar el papel con respecto a la forma de la pipeta.
En la parte superior, doblar hacia abajo el papel sobresaliente.
Cubrir con cinta adhesiva dicho doblez.
Procedimiento para la envoltura de cajas de Petri.
Al utilizar cajas de Petri en los cultivos microbianos, tienen que ser esterilizadas para poder vaciar dichos medios de cultivo que servirán de nutriente a los microorganismos tratados. Estas cajas se pueden esterilizar por calor húmedo o calor seco, siendo más recomendable el calor seco, por ser más confiable su efectividad.
Es necesario envolver las cajas Petri antes de esterilizarlas para evitar que al término de la esterilización estén expuestas al medio ambiente y se contaminen de nuevo. Para esterilizarlas se puede utilizar un recipiente cilíndrico de metal o envolviéndolas en papel dextrasa.
La manera de envolver las cajas se representa en la figura 1.4 y se describe a continuación:
Se corta papel dextrasa, de tamaño adecuado para el número de cajas que se deseen envolver y se colocan las cajas en el centro del papel.
los bordes de los costados se unen al centro cubriendo las cajas que se envuelven.
en la parte superior se unen los bordes de ambos lados y esta unión se dobla a la mitad, tal como se indica en la figura 1.4.
Se hace un segundo doblez, quedando recargado éste sobre las cajas.
Al papel se le presiona a los costados quedando al relieve el volumen de las cajas envueltas en el papel.
se doblan las puntas del papel de cada una de las esquinas al centro, según como se indica la figura.
Se le dá vuelta al material, quedando el doblez hacia abajo.
Las puntas salientes del papel en los lados de las cajas se doblan hacia arriba y al centro de las cajas y se les asegura con cinta adhesiva.
Preparación del agar nutritivo para las bacterias.
El frasco de agar dice 23 g/l. Y nosotros queremos preparar aproximadamente 200 ml, ya que cada caja se le va a vaciar aproximadamente 15 a 20 ml.
Se va a pesar 4.6 gr de agar nutritivo en la balanza granataria.
Se agregan inicialmente 50 ml de agua al matraz de 500 ml y se le agrega el agar, luego se le vacía el agua que es otros 50 ml sobre el papel ya que se puede quedar pegado el agar en el papel, después se agregan los 100 ml de agua restantes.
Entonces con un mechero se pone a calentar el agar que hay en el matraz, dándole vueltas sobre la llama del mechero, hasta que quede transparente a eso se le llama clarificar el agar.
Se deja enfriar y se pone en una olla de presión, para que se esterilice el agar y poder vaciarlo en las cajas, una vez que haya llegado a 121 ºC y 15 lbf / in2 se comienza a contar 15 minutos y dejar enfriar.
Luego se agarra el matraz y no este muy caliente, pero tampoco frió ya que puede gelificarse, se prende el mechero y hay un área aproximadamente de 30 cm alrededor del mechero estéril, se ponen las cajas boca abajo y se agarra una , se destapa el matraz se flamea la boca del mismo y se vacía en la caja aproximadamente 15 ml, se cierra la caja y se asienta hasta que gelifique.
Una vez que se hayan vaciado todas las cajas el agar, se espera a que gelifique, se ponen boca abajo y se envuelven con papel dextrasa o vitafilm y se guardan en el cuarto frío.
Preparación de la solución salina al 0.85% para los tubos de ensayo.
El peso del sodio es de 23 gr y el peso molecular del cloro es de 35.5 gr.,
Entonces el peso total de la muestra para preparar 1 litro de solución es de 58. 5 gr., pero se necesita que la solución este a 0.85% y se le va agregar a cada tubo 9 ml , como son 10 tubos son 90 ml, pero se necesita que este al 0.85%, entonces se hacen los siguientes cálculos:
Se pesan 0.04475 gr de NaCl y se diluye en 90 ml de agua, luego se vacía en cada tubo 9 ml de la solución salina y se pone en la olla de presión para que se esterilice la solución.
PRACTICA # 2
“AISLAMIENTO DE BACTERIAS”.
OBJETIVO:
Que el alumno aprenda la técnica para separar a las bacterias de los demás microorganismos que se encuentran en la muestra que haya traído.
MATERIAL:
10 tubos de ensayo con la solución salina previamente esterilizada.
11 pipetas estériles de 1 ml.
1 varilla de vidrio.
6 cajas de Petri con agar nutritivo.
MÉTODO:
Lo primero que se tiene que hacer es limpiar muy bien el área de trabajo, se le pasa un trapo seco y limpio para poder quitar todo el polvo de las mesas, luego se rocía con alcohol al 70% y se para el trapo, se lavan bien las manos antes y después de trabajar con las bacterias ya que pueden ser patógenas.
Lo que se debe hacer para poder aislar las bacterias es; (si es un liquido se agarra 1 ml de la muestra directamente y si es un sólido, se pesa 1 gr y se diluye en agua), con una pipeta estéril se toma 1 ml de la solución y se vacía en el primer tubo con solución salina previamente flameada la boca del tubo y en área estéril, entonces ya se tienen 10 ml, luego con otra pipeta estéril, se toma 1 ml del tubo donde se agregó la muestra ( pura) y se pone en el otro tubo, luego se agarra otra pipeta estéril, se destapa el tubo se flamea la boca del tubo anterior, se agarra 1 ml de la muestra, se tapa, tomas el siguiente tubo le quitas el tapón lo flameas y le agregas la muestra, lo vuelves a flamear y lo tapas de nuevo, y así sucesivamente hasta terminar lo 10 tubos.
Una vez que se haya puesto la muestra en los 10 tubos, el se agarran 3 tubos el más diluido, el menos diluido y uno de en medio de los dos. Entonces lo que se va hacer es poner las bacterias en las cajas de petri con agar para que crezcan, esto se hace por separado. Esto se hace por duplicado.
Primero se agarra el mas diluido, se toma 0.1 ml de la muestra el tubo y se pone en la caja de petri, la varilla de vidrio se remoja en alcohol y se pasa en la flama, luego se deja que se enfrié por 10 segundos y se esparce la muestra por toda la caja, luego se agarra el tubo de en medio y se toma 0.1 ml de la muestra, se pone en la caja de petri y se hace el mismo procedimiento con la varilla de vidrio y después se esparce por toda la caja. Por ultimo se toma el tubo que tiene mas muestra de los tres, se agarra 0.1 ml de la muestra y se pone en la caja de petri, se agarra la varilla de vidrio y se esparce por toda la caja.
Una vez terminado el trabajo, se flamea muy bien la varilla de vidrio, se envuelven las cajas ya sea con papel dextrasa o vitafilm y se guarda en la gaveta para esperar que crezcan las bacterias.
Se supone que en la primera caja que es la menos diluida debe haber más colonias de bacterias que en las otras dos cajas.
Por ejemplo:
30 colonias, 10 diluciones y se agarro el tubo mas diluido 1010.
30 x 10 x 1010 = esto nos da el no. De células viables por mililitro de solución.
PRACTICA # 3
“ PURIFICACIÓN DE LA CEPA BACTERIANA”
OBJETIVOS:
Escoger una cepa bacteriana y purificarla hasta que no tenga una contaminación alguna u otra bacteria en la caja.
MATERIALES:
6 cajas de petri con la muestra antes sembrada.
Asa de siembra.
2 cajas de petri nuevas con agar.
METODOLOGÍA:
El asa de platino se expone a la flama del mechero hasta quedar al rojo vivo.
Se coloca el asa de 10-15cm de la flama del mechero, es decir dentro del área estéril esperando aproximadamente de 10 a 20 segundos para que se enfrié
Se toma una caja con la cepa madre, toco la colonia la cual ya se debió haber marcado.
Alzar a la altura de la llama del mechero una caja Petri de agar nutritivo, utilizando la mano contraria con la que se tiene levantada el asa de platino y elegir un punto en el cultivo, el cual le pondremos punto 1 y comenzamos a hacer una serie de estrías.
Se flamea el asa en la llama del mechero hasta el rojo vivo.
Se le da un pequeño giro a la caja de Petri de tal forma que la punta de la última estría de la serie anterior, quede a modo para hacerse la siguiente serie de estrías (punto 2). Tocando el punto 1 solo dos veces al comenzar a estriar.
Se aplica el inciso 5 y se da de nuevo el pequeño giro, para comenzar a estriar en la última estría del punto 2, igual solo se toca solo9 dos veces al comenzar a estrías, el punto3.
Se repite el inciso 5 y 6 solo que ahora es del punto 3 al punto 4 el cual tan solo es un pequeño zigzag, que se realiza teniendo cuidado de no tocar las estrías anteriores para no cargar de nuevo carga microbiana, pues el objetivo es lograr colonias separadas.
PRACTICA # 4
“MORFOLOGÍA COLONIAL Y MICROSCÓPICA DE BACTERIAS.”
OBJETIVO:
El alumno observará las características microscópicas y microscópicas de la bacteria que se ha aislado.
MATERIALES Y REACTIVOS:
Microscopio
Asa de siembra.
Portaobjetos y cubreobjetos.
Cultivo a analizar
Aceite de inmersión.
Cristal violeta.
Mechero Fisher.
Espátula.
Alcohol desnaturalizado.
Agua destilada.
METODOLOGÍA:
Se realiza una resiembra del cultivo puro para analizar y se inocula durante 24 a 48 horas, es decir el tiempo en el que aproximadamente la bacteria ya a crecido y formado colonias separadas.
Después de las cuales de escoge una colonia aislada; para realizar las observaciones.
Para la observación de las características macroscópicas se estudia el tipo de colonia formada por la cepa.
Para las observaciones microscópicas se procede de la siguiente manera:
Se hace un frotis fresco; en un portaobjetos se pone una gota de cristal violeta con ayuda del asa previamente esterilizada; posteriormente se toma una azada de la colonia separada y se extiende sobre el colorante, no demasiado cerca del mechero para evitar que se seque la muestra. Se cubre con el cubreobjetos cuidando que la muestra no se salga por los bordes.
Se observa en un microscopio a 10x, 45x, y a 100x utilizando el acebote de inmersión.
OBSERVACIÓN MACROSCOPICA:
Edad: 24 horas
Tamaño de la colonia: aproximadamente de 0.1 a 3 mm
Color: pearly gates 47 A - 2P
Consistencia: Suave.
Luz transmitida: translucidas
Borde: Entero
Estructura interna: Homogénea
Elevación: Elevada
Superficie: Lisa
OBSERVACIÓN MICROSCÓPICA.
PRACTICA # 5
“ TINCION GRAM”

OBJETIVO:
El alumno aplicará la técnica de preparación de frotis
y la metodología para la tinción Gram.
MATERIALES Y REACTIVOS:
Pipeta Pasteur.
Porta y cubre objetos.
Cristal violeta.
Lugol.
Alcohol-cetonico
Safranina.
Microscopio.
Aceite de inmersión.
Mechero Fisher.
Alcohol desnaturalizado
Agua destilada.
METODOLOGÍA:
PREPARACIÓN DE UN FROTIS.
Sobre un portaobjetos de vidrio, limpio y seco, se coloca una gota del material que se va a teñir (si es líquido) o se hace rodar el hisopo con que se tomó la muestra. Una vez que el hisopo ha tocado la superficie del portaobjetos, que no está estéril, ya no puede ser empleado para inocular los medios de cultivo. Puede usarse una aguja estéril para transferir una pequeña cantidad de un cultivo bacteriano a la superficie del portaobjetos. Este material es suspendido en una gota de agua o solución salina previamente colocada sobre el portaobjetos. Cuando se trata de colonias muy pequeñas que pueden perderse en una gota de líquido se emplea una varilla delgada de madera estéril con la cual se toca la colonia obteniéndose así una fracción apreciable del desarrollo. El material se frota directamente sobre el portaobjetos, donde puede visualizarse con facilidad. El material colocado en el portaobjetos se deja secar al aire o bien se pasa varias veces por la zona azul de la llama de un mechero de Bunsen hasta que el vidrio esté tan caliente que moleste al tacto pero no queme.
Se prepara un frotis, y se coloca el portaobjetos sobre un vaso de precipitados.
A continuación se tiñe la muestra:
Se le adiciona cristal violeta por un minuto,
Se le agrega lugol por un minuto, después se lava suavemente con un chorro de agua
Se le agrega alcohol-cetonico durante 10 o 15 segundos,
Se le agrega safranina por un minuto, después se lava suavemente con un chorro de agua hasta que el agua salga sin colorante.
Una vez que la preparación esta totalmente seca, observar en los objetivos de 10, 45, y 100x, poniendo en este último el aceite de inmersión.
PRACTICA # 6
“TINCION ACIDO - RESISTENCIA”
OBJETIVO:
El alumno aplicará la técnica de tinción de Ziehl - Neelsen para determinar la ácido resistencia de la bacteria aislada.
MATERIALES Y REACTIVOS:
Pipeta Pasteur.
Porta y cubre objetos.
Vaso de precipitados de 200ml.
Soporte universal con arillo.
Tela de asbesto.
Matraz aforado de 500ml.
Asa de platino.
Cubre y porta objetos.
Fucsina fenicada.
Alcohol ácido.
Azul de metileno.
Microscopio.
Aceite de inmersión.
Mechero Fisher.
Alcohol desnaturalizado
Agua destilada.
METODOLOGÍA.
Preparación de reactivos.
Fucsina fenicada.
Formula.
Fucsina básica 5g.
Fenol 25g.
Etanol al 95% 50ml.
Agua destilada.
Forma de prepararlo:
Colocar el fenol en 100ml de agua y calentar a año Maria.
Cuando el fenol esta en solución añadir la fucsina básica poco a poco para que no forme grumos.
Esperar a que enfrié y agregar el etanol, mezclar.
Aforar a 500ml con agua destilada.
Alcohol-ácido
Formula.
Ácido clorhídrico 3ml.
Etanol al 95%
Forma de prepararlo:
Adicionar lentamente el ácido al alcohol y se agita, aforar a 100ml.
Azul de metileno.
Formula.
Azul de metileno 5g.
Agua destilada 100ml.
Forma de prepararlo:
Mezclar el azul y metileno con el agua hasta disolver completamente.
Preparación del frotis fijo y coloración.
En un porta objetos limpio se coloca una gota de agua destilada a la que con el asa de siembra, previamente esterilizada en la llama, se lleva una pequeña cantidad de suspensión de las bacterias o en su caso de una colonia.
Con el asa se extiende una gota y las bacterias sobre el portaobjetos se espera que seque y se fija la extensión por el calor, pasando dos o tres veces suavemente sobre la llama pero sin calentar demasiado, que lo soporte el dorso de la mano.
Coloración.
Cubrir la preparación con la fucsina, calentar la preparación en un baño Maria durante 5 min. No debe hervir. Si se evapora colocar mas colorante para evitar que se seque.
Lavar con agua el resto del colorante.
Decolorar con la mezcla de alcohol-ácido hasta que no caiga mas colorante.
Lavar con agua el resto del colorante.
Secar la preparación.
Examinar en el microscopio en objetivos de 10, 45, y 100x.
Tiene una capa gruesa de peptidoglicano (mureina) y dos clases de ácidos teicoicos. Ácido Lipoteicoico que está en la superficie, empotrado en la capa de peptidoglicano y unido a la membrana citoplásmica. Y ácido teicoico de la Pared que está en la superficie y se une sólo a la capa de peptidoglicano. El ácido Teicoico es el responsable del determinante antigénico del organismo.
Tiene una capa delgada de peptidoglicano (mureina) unida a una membrana exterior por lipoproteínas. La membrana exterior está hecha de proteína, fosfolípido y lipopolisacárido. En el lipopolisacárido, la porción de lípido está embebida en el fosfolípido y el antígeno O polisacárido está en la superficie. El lípido se llama Lípido A y es tóxico, pero el lipopolisacárido entero se llama Endotoxina. La pared de la célula tiene poros llamado Porines para el transporte de substancias de peso molecular bajo. Entre la membrana citoplásmica y la pared celular hay un espacio periplásmico con enzimas hidrolíticas, enzimas inactivadoras de antibióticos y proteínas de transporte.
Descargar
| Enviado por: | Adriana Aké Tamayo |
| Idioma: | castellano |
| País: | México |