Química
L'àtom
L'àtom
L'àtom = Tipus de partícula
Àtoms taula periòdica
Element
Molècula unió d'àtoms iguals
Substàncies pures
Compost Molècula unió d'àtoms diferents
Matèria
Mescles
Àtoms
Molècula Combinació d'àtoms
e- = electró
p+ = protó
Partícula n = neutró
catió = càrrega +
Ions
anió = càrrega -
escorça electrònica
Àtom neutrons ( sense càrrega )
Nucli
protons +
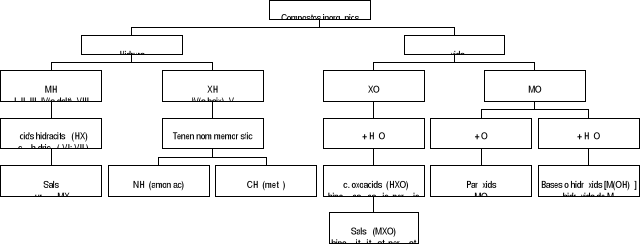
TIPUS DE COMPOSTOS
Compost = combinació de 2 o més elements diferents
Compostos binaris.
1- Hidrurs. Un dels elements és l'H i s'escriu a la dreta ( -ur ). Si porten metall MH, sinó XH
2-Óxids. Un element és l'O i sempre a la dreta. Si porten metall MO (bàsic), sinó XO (òxid àcid)
A la taula periòdica hi ha elements metàl·lics i no metàl·lics (columnes I, II, III, VIII són metalls, tenen caràcter electropositiu), (columna IV són semimetalls), (columnes V, VI, VII no són metalls, tenen caràcter electronegatiu)
Hidràcids (binaris, -hídric) HX (H a la dreta)
Àcids
Oxoàcids (ternaris, hipo- -ós, -ós, -ic, per- -ic)HXO + H2O
Bases o hidròxids M(OH)x MO + H2O M(OH)x
Derivats
Paròxids MO + O1 MO2
MX ( -ur )
Sals (venen dels àcids)
MXO ( hipo- -it, -it, -at, per- -at )
Hidrurs i derivats L'H sempre valència 1
Valències
Òxids i derivats L'O sempre valència 2
HIDRURS I DERIBATS
| I | II | III | IV | V | VI | VII | VIII |
| 1 i especials | 2 i especials | 3 | 4 | 3 | 2 | 1 | espacials |
ÒXIDS I DERIVATS
| I | II | III | IV | V | VI | VII | VIII |
| 1 i especials | 2 i especials | 3 | 2 i 4 | 1, 3, 5 | 2, 4, 6 | 1, 3, 5, 7 | especials |
Construcció dels elements. Estructura atòmica. Nombre atòmic i nombre màssic. Isòtops.
Protons p+
nucli
Neutrons n
Àtom
Capa electrònica electrons e-
Nombre atòmic (Z)
Z = nº p+ sempre un àtom neutre o ió
Neutre Z = nº p+= nº e-
Perd electrons (catió) Z = nº p+ " nº e-
Àtom
Guanya electrons (anió) Z = nº p+ " nº e-
Nombre màssic (A)
A=Z+N (partícules que es troben en el nucli)
N=A-Z
Isòtops
Mateix Z(nº atòmic)
Mateix element
Diferent A (nº màssic)
zX zX
isòtop
Massa atòmica o pes atòmic (A)
Substància pura " element " àtom
P " m P = pes / m= massa
N Kg P = m
Física Química
A es troba a la taula periòdica Xg (A " PA)
1 mol
Pes atòmic relatiu no té unitat i s'expressa, només, amb un nombre pur. El seu símbol es Ar .
El pes atòmic si té unitat i és g/1mol, ens indica els grams que té un mol. És troba a la taula periòdica.
Massa molecular o pes molecular
(M " Pm ) té unitat : g/1mol
element ( 2 àtoms iguals )
molècula
compost ( unió d'àtoms diferents )
S'ha de calcular a partir de pesos atòmics
M = " (A) (nº d'àtoms) tants cops com àtoms diferents té la molècula
Exemple:
MH2O = 1 · 2 + 16 · 1 = 18g/1mol 1mol H2O =18g
MNH3 = 14 · 1 + 1 · 3 =17g/1mol 1mol NH3 = 17g
MCa(OH)2 = 40 · 1 + 16 · 2 + 1 · 2 =74g/1mol 1mol Ca(OH)2 = 74g
MNaNO3 · 3(H2O) = 23 · 1 + 14 · 1 + 16 · 3 + 1 · 6 + 16 · 3 = 139g/1mol
La unitat per comptar l'àtom i molècules: el mol
litre
Vm = Volum molar (1mol de gas en cn) = 1mol gas en cn = 22,4l
g mol nº de partícules
A, M NA = 1mol de partícula = 6'02 · 1023
P (pressió) = 1atm (atmosfera)
Cn = condició normal
T (temperatura) = 0ºC =273K (Kelvin)
Na = Nº d'Avogadro
Factor de conversió: Operació matemàtica que permet fer canvis d'unitats, generalment d'una mateixa magnitud física.
Exemples:
t = 3min. sg. h.
3min. · 60sg. = 180sg, 180sg, · 1h = 0'05 h
1min. 3600sg.
V = 3cm3 l. m3
3cm3 · 1l. = 0'003l. 3cm3 · 1 m3 =3 · 10-6 m3
103 cm3 106 cm3
1- Problemes de g mol
2- Problemes de nº de partícules mol
3- Problemes de l mol
(nº de partícules mol)
a)Quantes molècules de metà, CH4, hi ha en 10 mols d'aquest compost?
molècules CH4 = ?
10 mols de CH4
10 mols de molècula · 6'02 · 1023 àtoms = 6'02 · 1024 molècules
1 mol de molècula
b)Calculeu els àtoms de ferro que hi ha en 0'01 mols d'aquest metall.
àtom de ferro = ?
0'01 mols de ferro
0'01 mols d'àtoms · 6'02 · 1023 molècula = 6'02 · 1021 àtoms
1 mols d'àtoms
2- (g mol)
Quina és la massa de 10 mols d'amoníac?
g = ?
10 mols NH3
M NH3 = 14 · 1 + 1 · 3 = 17g / 1mol
10 mols d' NH3 · 17g =170g d' NH3
1mol
3- ( g mol nº de partícules àtoms)
Calculeu els àtoms que hi ha en 1 gram de propà, C3H8.
àtoms = ?
1g C3H8 lectura fórmula M C3H8 = 21 · 3 + 1 · 8 = 44g
1 g de molècula · 1 mol · 6'02 · 1023 molècula · 11àtoms = 1'505 ·1023
44 g. 1 mol 1 molècula
Descargar
| Enviado por: | Marta |
| Idioma: | catalán |
| País: | España |
