Biología, Botánica, Genética y Zoología
Apoptosis
INTRODUCCIÓN
Existe una continua renovación molecular y de los átomos de las células, ello hace que pareciendo la misma persona, nuestras células sean diferentes, y que parecemos los mismos a pesar que nuestros átomos son otros. esto es parte del recambio vida-muerte y nueva vida celular. En los organismos, en general, las células mueren y dan lugar a otras que son iguales y cumplen la misma función, son clones por clave genética.
En la actualidad se conocen de manera general dos formas de muerte celular, la patológica que lleva a la necrosis y la Apoptosis.
La necrosis, tal vez la más conocida, fue descrita en 1858 por Virchow y puede ser definida como un fenómeno degenerativo producido por daño repentino y severo. Dentro de los factores desencadenantes pueden citarse la isquemia, la hipertermia o la hipotermia severas, el trauma físico o químico, así como altas concentraciones de agentes tóxicos, es el resultado de daño tisular grave y afecta a grupos celulares, las células que mueren por necrosis presentan características morfológicas y bioquímicas distintivas: los cambios tempranos incluyen aumento del volumen celular, ruptura de la membrana plasmática y liberación del contenido celular al microambiente, lo que desencadena un proceso inflamatorio que daña a las células sanas adyacentes. La liberación de hidrolasas ácidas de los lisosomas acelera la desintegración celular en la fase tardía de la necrosis. La cromatina se condensa de manera irregular en el núcleo y se degrada en sitios al azar.
El mecanismo de la necrosis se gatilla sin intervención activa de las células.
Por otra parte, la apostosis o apoptosis, proceso en que la célula programa su propia muerte, también llamada "suicidio celular", afecta sólo a células individuales o aisladas y no se asocia a inflamación. Se define como una forma de deceso celular caracterizada por la ejecución de un programa de muerte que tienen todas las células y que esta codificado genéticamente. Las primeras descripciones para este fenómeno las realizo William Councilman en 1890, quien señala la presencia de cuerpos acidófilos vacuolados en hígado de pacientes con fiebre amarilla. Mas tarde Robert Schröder en 1914 describe la presencia de partículas con cromatina picnótica en las glándulas endometriales dos o tres días antes del inicio de la menstruación. Es hasta 1965 que se hace la descripción detallada de esta forma de muerte celular y se sientan las bases para el estudio formal de este fenómeno. En el trabajo original estos investigadores describen los cambios histológicos que presentan las células de hígado de roedores después de ligar la vena porta. El área cercana a este vaso mostró células necroticas, mientras que en la periferia las células presentaban otra morfología: las células estaban encogidas, la cromatina estaba fuertemente condensada y sus membranas y organelos permanecían intactos. Son estos mismos investigadores los que en 1972 acuñan el termino apoptosis que sustituyo al de “necrosis por encogimiento”, hasta entonces utilizado. La palabra apoptosis deriva del griego apo que significa separación o derivación y ptosis, caída. Este termino se utilizaba en la antigua Grecia para describir la caída de los pétalos de las flores y la caída otoñal de las hojas de los árboles. Este término resalta el carácter fisiológico de la apoptosis, ya que implica que para que un organismo funcione adecuadamente, no solo debe tener la capacidad de producir nuevas células, sino también la habilidad de eliminar aquellas que ya no son capaces de cumplir con la función que tienen asignada. La apoptosis juega un rol determinante en la eliminación de células dañadas o peligrosas para el organismo (células infectadas con virus, células del sistema inmune, células con daño en el ADN, células cancerígenas) y también ocurre de manera fisiológica durante la morfogénesis y la renovación tisular, es necesaria para un adecuado proceso de división celular (mitosis) en estructuras en desarrollo, ya que al remover células no deseadas permite un adecuado balance para la mantención de un número celular óptimo. Determinados hechos celulares pueden ser explicados por trastornos en la regulación de los genes responsables de la apoptosis, como es el caso de la transformación y la progresión tumorales.
En este trabajo revisamos las características fundamentales de este mecanismo de muerte celular, sus variaciones morfológicas, bioquímicas, los genes involucrados y su papel en el desarrollo de malignidades, entre otros aspectos de interés.
FASES DE LA APOPTOSIS
El proceso apoptotico puede ser dividido en tres etapas: la primera fase es la de iniciación, en la cual la célula recibe el estimulo que la conduce a la muerte; en la segunda o fase de ejecución, se dan la mayor parte de los cambios morfológicos y bioquimicos característicos de la apoptosis; y por ultimo en la etapa de eliminación, los restos celulares son degradados por los macrófagos y células adyacentes.
Fase de iniciación o efectora;
La muerte apoptotica puede ser desencadenada por diferentes señales intra o extracelulares. Las primeras son, en muchos casos, originadas por estrés biológico, el cual provoca la liberación de citocromo C de la mitocondria (vía intrínseca), mientras que algunas de las señales extracelulares desencadenan el proceso apoptotico al unirse a su ligando presente en la membrana plasmática de la célula blanco (vía extrínseca). La naturaleza de los inductores puede ser fisiológica ( hormonas, citosina), biológica (bacterias, virus, parásitos), química (fármacos) o física (radiaciones), pudiendo un mismo estimulo generar efectos diferentes y gasta opuestos en distintos tipos celulares, e incluso en células del mismo tipo pero que se encuentren en diferente etapa de desarrollo.
Es por lo tanto la adopción sin retorno del compromiso hacia la muerte. Se caracteriza por el aumento en el contenido de Ca++ intracelular, que origina la activación de ciertos grupos enzimáticos (endonucleasas y proteasas -caspasas), junto con cambios en el citoesqueleto celular produciendo cambios en el tamaño y forma celular.
Fase de ejecución o degradativa:
La célula que ha recibido una señal que le induce apoptosis, pierde contacto con las células vecinas y el citoplasma se contrae provocando una disminución en el tamaño celular. Los organelos citoplasmáticos permanecen intactos, sin embargo en la mitocondria se dan cambios como la reducción del potencial transmembranal, el desacoplamiento de la cadena de transporte de electrones para la síntesis de ATP y el incremento en la generación de especies reactivas del oxigeno. En etapas posteriores la cromatina se condensa y se fragmenta. Finalmente la célula genera un numero variable de vesículas de diferentes tamaños (cuerpos apoptóticos) rodeados de membrana plasmática íntegra, que contienen parte de la cromatina y de los organelos celulares.
A nivel bioquímico, cuando un inductor llega a su célula blanco, avanza a través de ella gracias a intermediarios que dirigen dicha señal hacia la maquinaria enzimatica responsable de los cambios . esta maquinaria la constituyen principalmente las caspasas, tanto la apoptosis vía intrínseca como la vía extrínseca, provoca la activación de estas enzimas. Las caspasas activadas dependen del estimulo. Las caspasas constituyen una familia de proteasas de cisteína que muestran entre si similitud en la secuencia de aminoácidos, en estructura y en especificidad; sus sustratos deben contener una molécula de ácido aspartico y requieren del reconocimiento de almenos otros cuatro aminoácidos en el sitio de ruptura. Además de específica la ruptura es muy eficiente. De hecho algunas caspasas pueden ser sustrato de otras así como de si mismas vía auto procesamiento. Las caspasas son sintetizadas como zimógenos, por lo que requieren de un procesamiento proteo lítico para volverse activas. Los precursores de las caspasas están constitutivamente expresadas en las células vivas y su actitud esta regulada por una combinación de proteasas regulatorias, cofactores, umbrales y mecanismos de retroalimentación.
Dentro de las funciones de las caspasas destacan la inactivación de proteínas que normalmente protegen a la célula de la muerte apoptotica, de aquellas involucradas en la reparación de DNA y de las encargadas de la organización del cito esqueleto; participan en la destrucción de la lamina nuclear, en la activación de CAD, e inducen a la célula a expresar señales que la marcan para ser fagocitadas. Uno de los eventos característicos es la fragmentación del DNA por la nucleasa CAD.
La vía extrínseca puede ejemplificarse con la señal pro apoptptica que se desencadena por la unión de Fas con su ligando. FasL (CD95L) es un trímero que al unirse con Fas (CD95 o APO-1) induce la trimerizacion de este. Esta unión provoca el reclutamiento del complejo DISC al dominio citoplasmático de Fas. DISC contiene proteínas adaptadoras que permiten la unión de la pro- caspasa 8 favoreciendo su auto activación, la caspasa 8 puede entonces activar a las caspasas efectoras 3, 6 y 7, además puede activar a Bid y esta inducir la liberación del citocromo C y Apaf-1 de la mitocondria para formar el apoptosoma y activar también la vía intrínseca.
La vía intrínseca o mitocondrial se activa por estrés, y otras señales que provocan la translocacion a la mitocondria de miembros por apoptóticos. Lo anterior provoca la liberación de citocromo C al citosol, lo cual se acompaña de perdida del potencial de membrana mitocondrial y desestabilización de la membrana externa de la mitocondria. En el citosol el citocromo C se une a Apaf-1 en presencia de ATP y forma el complejo conocido como apoptosoma, el cual activa a la pro-caspasa 9, la cual puede activar a las caspasas 3, 6 y 7, estas son las principales responsables de los cambios morfológicos y bioquimicos que ocurren el la célula apoptotica ya que entre sus sustratos se encuentran proteínas del cito esqueleto, de la membrana nuclear y las encargadas de la reparación del DNA entre otras.
En otras palabras se degradan los ácidos nucleicos y hay más cambios en la membrana celular. Los cuerpos apoptóticos son fagocitados por macrófagos impidiendo la salida del contenido celular al exterior y evitando inflamación. En esta fase se activan las endonucleasas que se encargan de fragmentar el DNA; además se producen cambios marcados en el citoesqueleto, y se condensa la cromatina
Fase de eliminación:
Aunque la muerte celular ocurre de manera constante en un organismo, las células que están muriendo por apoptosis son rara vez vistas in situ debido a que son rápida y eficientemente removidas por células fagocíticas. Los responsables de esto son los fagotitos profesionales, pero existen evidencias de que fagotitos no profesionales, como las células dendríticas, epiteliales y fibroblastos también participan en la remoción.
Son varios los mecanismos de reconocimiento de las células apoptoticas, lo cual parece ser un evento conjunto que involucra varios receptores, que pueden funcionar aislada, simultánea o secuencial mente. La existencia de más de un mecanismo de reconocimiento asegura la remoción eficiente, disminuyendo la posibilidad de que estas células liberen su contenido citoplasmático y causen daño. Es posible que sea el estimulo que causo la muerte de la célula, el tipo de célula apoptotica y la naturaleza del fagocito involucrado, lo que pueda regular el o los mecanismos utilizados para remover la célula. In requerimiento esencial para que las células sean reconocidas y fagocitadas es la expresión de un ligando adecuado en la superficie celular y de su contraparte en el fagocito. Se ha observado que varias moléculas de superficie en las células fagocíticas median el reconocimiento y la internalizacion de las células apoptoticas. Entre ellas se puede citar algunas lectinas, integrinas, receptores “scavenger”, ABC transportadores, CD14 y receptores del complemento. En algunos casos la presencia o ausencia de estas moléculas dependen del origen del fagocito, de su distribución anatómica y de su estado de activación. Uno de los mecanismos mas estudiados y que al parecer es una señal que siempre esta presente en los linfocitos apoptóticos, es la perdida de la asimetría de la membrana celular, la cual tiene como consecuencia la exposición en la membrana externa de moléculas de fosfatidilserina (FS), que de manera normal están restringidas a la parte interna. Se ha expuesto que la exposición de la FS es una señal suficiente para inducir la fagocitosis de las células que la expresan.
Foto 1
CARACTERÍSTICAS MORFOLÓGICAS DE LA APOPTOSIS
La apoptosis es un proceso activo que implica síntesis proteica, en el cual la célula sufre una condensación nuclear y citoplasmática. Sus características morfológicas revelan condensación de la cromatina nuclear, desintegración nucleolar, disminución del tamaño nuclear, compactación del citoplasma y de organelo (excepto mitocondrias y ribosomas), alteraciones del citoesqueleto y aspecto de burbuja de la membrana, aunque no se rompa. Durante el proceso final ocurre fragmentación del DNA debido a una ruptura internucleosomal del DNA y se forman fragmentos nucleares recubiertos de membrana (cuerpos apoptóticos), que son fagocitados sin evidencia de reacción inflamatoria.
Cambios celulares durante la apoptosis
Uno de los aspectos más estudiados y conocidos respecto de la apoptosis, se refiere a los cambios morfológicos y bioquímicos que ocurren en la célula (Figura 1). Los primeros signos consisten en la separación de las células preapoptósicas de sus vecinas, con lo cual adquieren una forma más redondeada. En el núcleo, inicialmente la cromatina (ADN + proteínas) se agrupa o condensa en grandes masas, y luego el ADN se fragmenta debido a la acción de enzimas (endonucleasas).
|
|
| Figura 1. Diagrama de los cambios morfológicos y bioquímicos que ocurren durante la apoptosis. |
A nivel citoplasmático se forman vacuolas y el citoplasma se fragmenta, manteniéndose la membrana plasmática intacta. Los fragmentos citoplasmáticos se denominan cuerpos apoptósicos y juegan un papel importante en la estimulación de la fagocitosis de estas células por parte de células vecinas y/o macrófagos. En estos casos no existe respuesta inflamatoria ya que la eliminación de los fragmentos celulares se realiza sin que haya liberación del contenido celular hacia la matriz extracelular además la célula apoptotica induce en el fagocito la síntesis y secreción de moléculas antinflamatorias.
RECEPTORES DE MEMBRANA CELULAR QUE MEDIAN APOPTOSIS
Un avance importante para la investigación de la apoptosis se logró cuando se identificó un antígeno (Ag) de membrana celular capaz de inducir señales de apoptosis. Este receptor se denominó Fas o Apo-1, cluster de diferenciación (CD) 95, y es una proteína transmembrana tipo II glicosilada que se expresa constitutivamente en gran variedad de tejidos normales y líneas tumorales.
El interés en este receptor aumentó cuando se demostró, en modelos murinos, que las mutaciones en el gen que codifica a este receptor, se relacionan con trastornos linfoproliferativos por la incapacidad de producir apoptosis.
El Fas/Apo-1 es miembro de la superfamilia de los Factores de Necrosis Tumoral (TNF), entre los que se encuentran los Receptores TNF tipo I y II, el receptor del factor de crecimiento neuronal (NGF), CD40 y CD27.
El ligando del Fas/Apo-1 es una proteína de membrana tipo II miembro de la familia del TNF que está altamente expresado en linfocitos activados. La unión del Ag de membrana Fas/Apo-1 con su ligando y con anticuerpos antagonistas, es una de las vías de inicio de señales para la apoptosis. Existe una relación estrecha entre la participación del ligando Fas y la cito toxicidad mediada por los linfocitos T CD8+, mecanismo efector de gran importancia en la respuesta inmune antitumoral.
El papel de la interacción Fas/Apo-1 y su ligando en cáncer no está bien establecido; sin embargo, su papel en la apoptosis sugiere su participación como supresores del tumor. Por ejemplo, la inactivación de las señales vía Fas debido a la baja expresión de este Ag en la membrana, puede llevar a la célula a una supervivencia anormal y contribuir al desarrollo y progresión de malignidades.
MECANISMOS BIOQUÍMICOS DE LA APOPTOSIS
Las vías bioquímicas involucradas en la apoptosis se encuentran actualmente en investigación. Se conoce que los linfocitos y la mayoría de las células nucleadas experimentan ruptura internucleosomal del DNA mediante endonucleasas Ca2+ Mg2+ dependiente, entre las que se encuentran la NUC-18, la DNAsa I y la DNAsa II.
Sin embargo, existen múltiples evidencias de apoptosis en células enucleadas, por tanto el mecanismo apoptótico puede no interesar al núcleo. Ciertos experimentos realizados en células enucleadas de nematodos que sufren apoptosis, han evidenciado la existencia de más de una vía de apoptosis, donde los cambios citoplasmáticos pueden ser decisivos. En esta especie se han definido varios genes que codifican proteínas citoplasmáticas relacionadas con la apoptosis, como la Ced-3 (ICE-enzima convertidora de IL1 b), Ced-4 y la Ced-9. En los mamíferos existe la proteasa "ICE like" que forma una familia de proteasas suicidas y es homóloga a la proteína Ced-3 de nematodos, también se observa homología entre los genes Ced-9 nematodos y bcl-2 de mamíferos, ambos inhibidores de la apoptosis.
GENES INVOLUCRADOS EN LA APOPTOSIS FAMILIA DE GENES bcl-2
El bcl-2 (B cell leukemia/lymphoma 2 genes) fue el primer proto-oncogen detectado y fue asociado con procesos malignos de las células B. Durante la maduración de las células B puede ocurrir una traslocación cromosomal en el gen bcl-2; ello provoca un aumento en la expresión de la proteína citoplasmática Bcl-2, que origina inhibición de la apoptosis en células B y da por resultado la supervivencia de la célula transformada. Está demostrado que la sobre expresión del gen bcl-2 en linformas inducidos experimentalmente, se asocia con la proliferación neoplásica por los efectos inhibitorios de Bcl-2 sobre las vías de apoptosis. Este gen facilita el aumento de la supervivencia de la célula transformada y de este modo aumenta la posibilidad de futuras aberraciones genéticas que pueden conducir a la progresión maligna. La expresión de este gen en algunos tipos de cáncer es un marcador de mal pronóstico.
El gen bcl-2 forma parte de una familia de genes que intervienen en la regulación de la supervivencia de la célula. Los miembros de la familia Bcl-2 están integrados por: Bcl-2, Bax, Bad, Bcl-X1, Bcl-Xs, Mcl-1. El destino de una célula de morir o sobrevivir está determinado por las diferencias en la expresión de estas proteínas, actuando algunas como promotoras y otras como inhibidoras de las señales de apoptosis.
La figura 2 nos muestra la regulación de la apoptosis por la familia Bcl-2. Debe observarse como el heterodímero Bcl-2Bax y la variante Bcl-X1 tienen efecto inhibitorio de la muerte celular, al impedir la acción de las proteasas cisteínas que median señales de apoptosis. Sin embargo, la formación de homodímeros Bax-Bax, así como elevados niveles de Bax o Bcl-Xs, pueden favorecer la muerte programada de la célula.
FIGURA 2 . Regulación de la apoptosis por la familia Bol-2.
Es importante destacar que Bcl-2 no confiere protección a la célula contra la apoptosis, ni en la selección negativa de células autorreactivas del timo, ni en los mecanismos citotóxicos de los linfocitos T citotóxicos (CTL). Tampoco se aprecia su efecto protector sobre las células B inmaduras que sufren apoptosis por entrecruzamiento IgM ni en la activación de la célula vía receptor Fas/TNF.
El bcl-2 se expresa de manera importante durante estadios muy tempranos de la diferenciación de células B y T, y también está altamente expresado en la etapa de diferenciación final de los linfocitos; es por ello que las células en estadios intermedios de desarrollo son más susceptibles a la muerte celular.
OTROS GENES
Es conocido que ciertos oncogenes y genes supresores de tumor influyen en el mecanismo de muerte celular programada; tal es el caso de los genes c-myc y nur-77,26,30 que a pesar de estar asociados con la progresión del ciclo celular participan en la inducción de apoptosis en algunas células, también se encuentra el gen bcl-2 que como ya ha sido descrito, bloquea la apoptosis cuando es sobre expresado 23 y el gen p53, cuyo requerimiento se produce en casos de daño geonómico. La expresión de estos genes puede inducir a algunos tipos de cáncer a la apoptosis. Esto sugiere que la muerte celular programada es un mecanismo de defensa contra la transformación maligna.
El gen p53 ha sido llamado guardián del genoma por ser el encargado de bloquear la división celular cuando las células han sufrido daño en su material genético. Este bloqueo lo lleva a cabo deteniendo las células en la fase G1 del ciclo celular, con el objetivo de que se produzca la reparación del DNA antes de que se replique. Este gen mantiene la integridad del genoma ya que estimula la apoptosis en las células en las que el daño en el DNA ha sido sustancial. En diversos tipos celulares incluyendo los linfocitos, la sobre expresión de p53 conduce directamente a la apoptosis.
La pérdida de la función normal del gen p53 puede conducir al desarrollo de neoplasias malignas; de hecho son muy frecuentes las alteraciones en este gen en una variedad de cánceres humanos (más del 50 % de los tumores humanos están asociados a mutaciones en p53). Hay evidencias que hacen pensar que el alto riesgo de la transformación maligna en ausencia de p53 funcional, probablemente origina una oportunidad reducida de reparar el DNA y una incapacidad de eliminar por apoptosis la célula dañada no reparada. Aunque es desconocida la base real de la apoptosis inducida por este gen.
Los timocitos de ratón que pierden copias funcionales del p53 son incapaces de desarrollar apoptosis luego de ser irradiados; estas células responden normalmente a glucocorticoides y a señales a través del receptor.
Se ha evidenciado que los genes involucrados en una vía de apoptosis no necesariamente juegan una importante función en otra vía. Así por ejemplo nur77 se requiere para la apoptosis mediada por el receptor de células T (TCR), no siendo importante en la muerte celular por glucocorticoides o radiación ionizante. A pesar de esto, se ha observado en ratones deficientes de nur77, muerte celular mediada por el receptor, sugiriéndose que, o bien este gen no es requerido in vivo para la apoptosis, o existe un gen estrechamente relacionado con él que puede compensar su deficiencia.
Estudios anteriores sugieren la influencia de la expresión de nur77 en la proliferación o la diferenciación celular.
El producto de nur77 es una proteína que pertenece a la familia del receptor nuclear de hormonas esteroides y su efecto en la apoptosis está dado porque actúa como un factor de trascripción que regula la expresión de genes involucrados en la muerte celular.
Otro regulador fisiológico del ciclo celular que participa en la apoptosis es la proteína Myc, que es producto del proto-oncogen c-myc. La sobre expresión del gen c-myc pudiera resultar en mitosis o apoptosis en dependencia de la disponibilidad de otros factores que estimulan el crecimiento celular. De esta forma la expresión incrementada de Bcl-2 en presencia de un aumento de c-myc prococa una inhibición de la apoptosis mediada por c-myc, lo que explica la cooperación que se produce entre ambos genes en el origen de las neoplasias.
Además del papel que juega la apoptosis en el origen del cáncer, su modulación también pudiera influir en el tratamiento de esta enfermedad.
PAPEL DE LA APOPTOSIS EN EL SISTEMA INMUNITARIO
La muerte celular programada es muy importante para el desarrollo y funcionamiento del sistema inmunitario, debido a que interviene en los eventos de formación del repertorio de células T y B, en los mecanismos de tolerancia central y periférica, en la eliminación de células autorreactivas, en el establecimiento de la memoria inmunológica y en los mecanismos citolíticos de células asesinas naturales y linfocitos T citotóxicos.
Es conocido que el 95 % de los timocitos son eliminados en el timo por mecanismos de apoptosis, proceso denominado selección negativa (deleción clonal), el cual elimina la existencia de clones T autorreactivos.
También en la médula ósea existe un proceso similar de deleción de clones B, autorreactivos en el estadio B inmaduro por entrecruzamiento de la inmunoglobulina de superficie en ausencia de señales coestimulatorias.
No obstante, la apoptosis no se restringe a las células inmaduras.
FIGURA 3. Factores que regulan la ruta de las células T activadas, después del reencuentro con el Aq.
También los linfocitos T maduros, bajo ciertas condiciones, pueden sufrir apoptosis, lo que corrobora su papel inmunorregulador. Entre los factores que pueden inducir apoptosis en células maduras están: los glucocorticoides y las radiaciones gamma, la estimulación del complejo TCR/CD3 por anticuerpos monoclonales, Ags nominales y superantígenos y la estimulación de los receptores CD2, Fas/Apo-1 y TNF.
Se ha demostrado que la sensibilidad para lograr la apoptosis es más lenta en células maduras y requiere previa activación. La ruta que siguen los linfocitos T al ser estimulados depende de una serie de elementos que determinan si la célula prolifera, o si muere por apoptosis. La figura 2 muestra los diversos factores que influyen en dicha decisión.
IMPORTANCIA DE LA MITOCONDRIA EN LA APOPTOSIS
La mitocondria de la célula es fundamental en el proceso, Una gran variedad de eventos claves en apoptosis están focalizados en las mitocondrias. Estos incluyen: la liberación de activadores de caspasas (por ej., Citocromo C), cambios en el transporte de electrones, pérdida del potencial mitocondrial de transmembrana, alteraciones en el proceso de óxido - reducción celular, participación de la familia de las proteínas pro- y antiapoptóticas Bcl-2,etc. Las diferentes señales que convergen sobre las mitocondrias para disparar o inhibir estos eventos y sus efectos downstream delinean varios patrones principales en la muerte celular fisiológica.
-
Mitocondrias y disposición a la muerte celular
Los efectores de la apoptosis están representados por una familia de enzimas intracelulares (cisteína - proteasas) denominadas caspasas. Sin embargo, la inhibición de las caspasas no siempre inhibe la muerte celular inducida por estímulos pro-apoptóticos. Aunque los inhibidores de caspasas bloquean algunas, de todas las morfologías apoptóticas inducidas por la privación de factores de crecimiento, etoposide, actinomicina D, radiación ultravioleta (UV), staurosporina, expresión forzada de c-Myc o glucocorticoides, no se mantiene el potencial replicativo o clonogénico; las células finalmente mueren por inactivación de la actividad de caspasas, por una muerte no apoptótica. En contraste, las proteínas antiapoptóticas tales como la Bcl-2, Bcl-xL y la oncogénica Abl pueden mantener la supervivencia y la clonogenicidad en la fase de estos tratamientos. Inversamente, algunas proteínas proapoptóticas tales como Bax, una proteína de muerte celular de mamíferos que tiene como blanco la membrana mitocondrial, puede inducir su daño y las células mueren aún cuando las caspasas sean desactivadas. Tales observaciones experimentales, sostienen la existencia de un mecanismo independiente de las caspasas que dispone a las células a morir.
Al menos se han propuesto tres mecanismos cuyos efectos pueden estar correlacionados
-
Interrupción del mecanismo de transporte de electrones y el metabolismo energético.
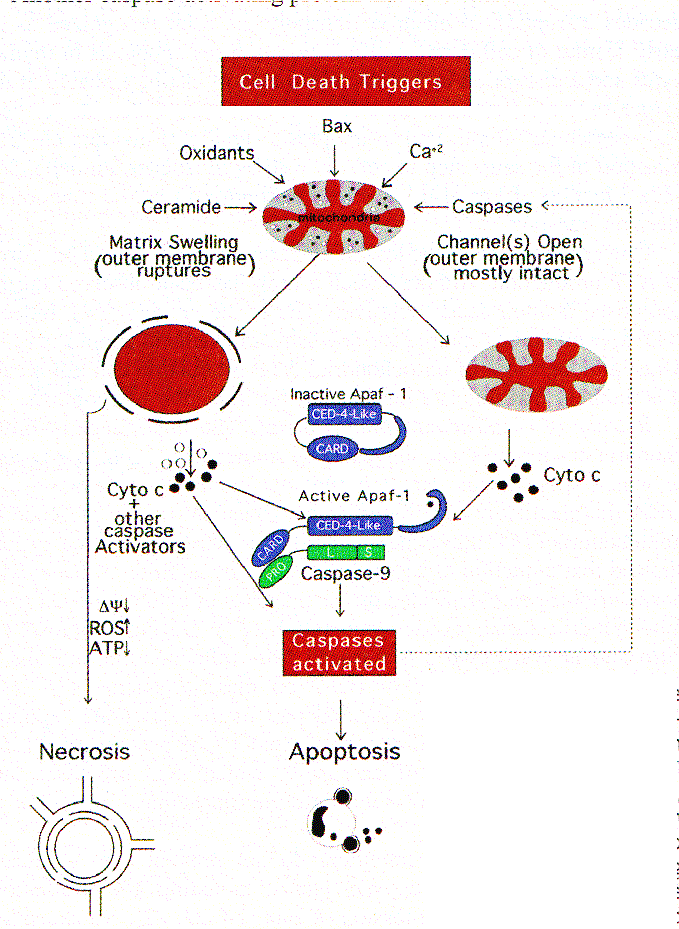
Por décadas la interrupción del transporte de electrones ha sido reconocido como una característica temprana de la muerte celular. La irradiación -g induce apoptosis en timocitos y una interrupción de la cadena de electrones, probablemente en el paso de citocromo b-c1 / citocromo c (cito c). La ceramida, (un segundo mensajero, implicado en el señalamiento apoptótico) interrumpe el transporte electrónico en el mismo paso tanto en células como en mitocondrias aisladas. La unión a Fas también conduce a la interrupción de la función de cito c en el transporte de electrones. Una consecuencia de la perdida del transporte electrónico debería conducir a una caída en la de producción de ATP. Aunque una caída de ese tipo puede observarse durante la apoptosis, esta ocurre en una fase relativamente tardía del proceso. Además el ATP parece ser requerido por eventos downstream en apoptosis. Así, aunque la carencia de ATP mitocondrial puede matar una célula, es poco probable que este sea un mecanismo de inducción de apoptosis. Liberación de proteínas activadoras de caspasas. La importancia de las mitocondrias en apoptosis fue sugerida por estudios con sistemas de células libres en los que se encontró que la condensación nuclear y la fragmentación del DNA, inhibible por Blc-2, son dependientes de la presencia de mitocondrias. Subsecuentemente, otros sistemas de células libres, mostraron que la inducción de activación de caspasas por adición de desoxi-adenosina trifosfato depende de la presencia de citocromo c, liberado de las mitocondrias durante la preparación del extracto. Durante la apoptosis (in vivo e in vitro) el cito c es liberado por las mitocondrias y es inhibido por la presencia de Bcl-2 en estas organelas. El cito c citosólico, forma una parte esencial del apoptosoma de vertebrados, el cual está formado por cito c, Apaf-1 y procaspasa-9. El resultado es la activación de caspasa-9, la que es luego procesada y activa otras caspasas para orquestar la ejecución bioquímica de las células.
Un hecho significativo es que los inhibidores de caspasas no previenen la liberación de cito c inducida por varios agentes apoptogénicos incluyendo la radiación UV, la staurosporina y la sobreexpresión de Bax. Una excepción es la liberación del cito c por parte de las mitocondrias, inducida por los miembros de la familia de los receptores del TNF: Fas, en el que la liberación del cito c se previene por la inhibición de caspasas (primariamente caspasa-8) reclutada por el dominio citosólico de Fas ligado. No obstante, la liberación del cito c puede algunas veces contribuir a la apoptosis mediada por Fas, amplificando el efecto de la activación de caspasa-8 en la activación de caspasas downstream. La visión emergente es que, una vez que el cito c es liberado, éste predispone a la célula a morir tanto por un mecanismo apoptótico rápido, que involucra la activación de caspasas por el Apaf-1, o un proceso necrótico más lento debido al colapso del transporte de electrones, que ocurre cuando el cito c es depletado de las mitocondrias, resultando en una variedad de secuelas deletéreas incluidas la generación De radicales de oxígeno libres y una disminución de la producción de ATP
Otros mediadores de apoptosis son también liberados desde las mitocondrias. Las mitocondrias de algunas células contienen procaspasa-3 que es liberada en el citosol durante la apoptosis, a pesar que aún no está claro si se activa antes de ser liberado. La posibilidad de que un pool intramitocondrial de procaspasa-3 participe en apoptosis de algunas células primarias es un intríngulis y su prevalencia en neuronas podría proveer la explicación del profundo impacto específico de la interrupción del gene de la caspasa-3 sobre la apoptosis neuronal pero no en otras formas celulares. Otra proteína activadora de caspasas que es liberada por las mitocondrias es el Factor Inductor de Apoptosis (AIF), que aparentemente procesa la procaspasa-3 in vitro. El que su actividad sea bloqueada por zVAD-fmk, un inhibidor general de caspasas, aumenta la posibilidad que el AIF sea en realidad otra caspasa.
-
Especies de oxígeno reactivo (ROSs) y redox celular.
Las mitocondrias son la mayor fuente de producción del anión superóxido. Se ha estimado que durante la transferencia de electrones al oxígeno molecular en la cadena respiratoria, entre 1 y 5% se pierden, la mayoría de estos electrones participan en la formación de O-2 . Todo factor que disminuya la eficiencia en el acoplamiento de la cadena de transporte de electrones, incrementa la producción de superóxidos. Tanto los superóxidos como la peroxidación de lípidos se ven notablemente incrementados durante la apoptosis inducida por una miríada de estímulos. Sin embargo, la generación de ROSs constituiría un evento relativamente tardío, que ocurre cuando las células se han embarcado en un proceso de activación de caspasas. En este sentido, los intentos por estudiar la apoptosis bajo condiciones de anoxia han demostrado que al menos algunos estímulos proapoptóticos, funcionan en ausencia de oxígeno. Esto demuestra que los ROSs no son condición sine qua non de la apoptosis. Sin embargo, los ROSs pueden ser generados bajo condiciones de virtual anaerobiosis, por lo que su rol en apoptosis no puede ser excluida.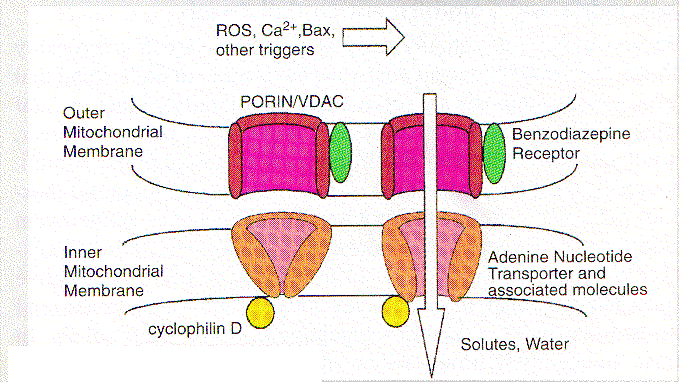
PORO PT:
En la mayoría de los escenarios de apoptosis, el potencial de la membrana mitocondrial interna (D y m) colapsa, indicando la apertura de un canal de conductividad conocido como el poro PT . La estructura y composición de este poro han sido parcialmente definidos pero los constituyentes incluyen tanto proteínas de la membrana interna tales como la translocadora del nucleótido adenina, como proteínas de la membrana externa, como la porina (canal aniónico dependiente de voltaje, VDAC), las que presumiblemente operan concertadamente en puntos de contacto, creando un canal a través del cual pasan moléculas # a 1.5 kD. La apertura de este canal no selectivo, permitido por el equilibrio de iones de la matriz y el espacio intermembrana de las mitocondrias, disipa el gradiente H+ a través de la membrana interna desacoplando la cadena respiratoria. Quizás más importante sea el hecho que, la apertura del poro resulta en una desrregulación del volumen de las mitocondrias debida a la hiperosmolaridad de la matriz, lo que causa la expansión del espacio de la matriz. Debido a que la membrana interna con sus pliegues posee mayor área que la membrana externa, esta expansión del volumen de la matriz puede ocasionar la ruptura de la membrana externa, liberando las proteínas activadoras de las caspasas localizadas en el espacio intermembrana hacia el citosol
Los inhibidores de la apertura de los poros como las ciclosporinas, [que se unen a la ciclofilina D, asociada con la adenine nucleotide trasnslocator (ANT)] y el ácido bongkrekico (que inhibe la ANT), parecen bloquear la apoptosis en algunos sistemas, proveyendo soporte a la idea que el PT es central en el proceso apoptótico. La Bcl-2 puede prevenir el PT mientras el activador de ANT: antractilosido y la Bax inducen tanto apoptosis como PT. Otros estímulos que afectan el poro PT directamente, tales como los oxidantes y la elevación patológica del Ca2+, pueden inducir la ruptura de la membrana mitocondrial externa y liberar las proteínas activadoras de caspasas. Así en muchos casos el PT parece ser el cerebro que orquesta la apoptosis.
Los inhibidores farmacológicos del poro PT previenen la inducción de apoptosis por varios estímulos directos, implicando un rol general. Sin embargo, algunos estudios han provisto evidencias que la liberación de cito c y la activación de caspasas pueden ocurrir antes de producirse ninguna pérdida detectable del D y m, implicando que la apertura del poro PT puede ocurrir downstream de la activación de caspasas mediada por apoptosomas. La capacidad de las caspasas para inducir la apertura de poro PT, que puede conllevar a la inducción de la activación de las caspasas (por liberación de cito c y AIF), generando un loop de amplificación de retroalimentación (Fig. 1) y complica los intentos por disecar la secuencia de eventos de muerte celular normales.
La liberación de cito c antes, o en ausencia de una caída del D y m en algunas células, sugiere la intervención de diferentes eventos regulatorios que controlan la permeabilidad de las membranas mitocondriales interna y externa. La apertura y cierre rápidos de las membranas mitocondriales, restableciendo su estado de baja conductividad reversible, puede permitir un restablecimiento del D y m conducido por la respiración, de tal manera que la interrupción o la perturbación de la membrana externa y la liberación del cito c, podrían ocurrir antes del colapso de la D y m.
Otro mecanismo de perturbación de la membrana externa es la hiperpolarización de la membrana mitocondrial interna (en nítido contraste con la hiperpolarización asociada con la apertura del poro PT). Esta ha sido observada en varios tipos celulares bajo una variedad de condiciones y es suprimida por el Bcl-xL. El porqué de la ocurrencia de esta polarización es oscura, sin embargo, el incremento de la exportación de los protones hacia el espacio intermembrana podría resultar en la protonización de los ácidos débiles. Estos pueden luego difundir libremente a través de la membrana interna y son atrapados cuando los protones se pierden. Al acumularse estos metabolitos, se incrementa la osmolaridad y el agua tiende a entrar, resultando en la expansión del espacio de la matriz y eventualmente provocando la ruptura de la membrana externa, liberándose el contenido del espacio intermembrana.
Aunque la ruptura de la membrana externa cause la liberación del cito c, caspasas, AIF y algunas veces formación de ROSs, solo un subconjunto de mitocondrias parecen estar afectadas. En contraste, los estudios han sugerido que la mayoría (si no todo) el cito c es liberado durante la apoptosis, lo que sugiere tanto que, o los métodos para detectar la ruptura de la membrana externa son poco sensibles o la liberación de cito c involucra otros mecanismos.
Una alternativa es que, la perturbación grosera de la membrana externa teóricamente podría inducir la apertura de un gran canal en la misma, capaz de liberar el cito c u otras proteínas desde el espacio intermembrana.
Aunque especulativa, la idea del canal proteico es atractiva debido a que de esta forma se evita postular el hinchamiento mitocondrial, lo que resulta más acorde al hecho que in vivo la morfología mitocondrial permanece intacta durante la apoptosis.
CONTROL DE LA APOPTOSIS
Los mecanismos que regulan la muerte celular son esenciales para el normal desarrollo y mantenimiento de la homeostasia. Las células crecen controladamente gracias a la expresión de genes que inducen señales de muerte en estadios definidos de diferenciación y en respuesta a estímulos fisiológicos determinados.
La apoptosis se desencadena por diversas señales, las cuales pueden ser fisiológicas, o por estimulaciones exógenos ambientales. Estas señales pueden actuar sobre receptores de superficie y causar la activación en cascada de proteínas citoplasmáticas; ello trae como resultado la activación de un programa genético que conduce, generalmente, a la nucleolisis por la acción de las endonucleasas.
Actualmente se admite que existen una serie de elementos que pueden ser comunes en la apoptosis y se han señalado como: inductóres, reguladores y efectores.
Los inductores son aquellas señales que inducen a la célula a entrar en apoptosis y pueden provenir desde dentro de la célula o desde el exterior. Algunos inductores poseen la capacidad de unirse a receptores en la membrana celular (proteínas o péptidos) y otros se unen a receptores en el citoplasma (esteroides). Factores externos como radiación ultravioleta o sustancias químicas pueden actuar como potentes inductores de apoptosis.
Dentro de los reguladores existen genes que codifican para proteínas que pueden inhibir o promover la muerte celular. Los genes de la familia Bcl-2 son los que están mejor estudiados. Estos genes codifican para proteínas que pueden inhibir o permitir la apoptosis. La proporción en que se expresan unas proteínas respecto de otras puede determinar que la célula muera o no.
Los efectores son los responsables, en última instancia, de los cambios estructurales que conducen a la muerte celular programada. Estos cambios son bastante parecidos en los distintos tipos de células. Los efectores son principalmente enzimas (endonucleasas y proteasas). Se cree que la activación de endonucleasas dependientes de calcio y magnesio, son las responsables de la fragmentación del ADN y de los cambios que ocurren en el núcleo de la célula. Entre las proteasas más estudiadas se encuentran las caspasas, que son consideradas como las moléculas efectores más importantes de la apoptosis. Cabe destacar que las caspasas están inactivas en las células sanas. En muchos casos la activación de un tipo de caspasa produce la activación de otras, generando una "cascada irreversible de caspasas" que amplifican notablemente la señal.
Los trastornos en la regulación de la apoptosis por diferentes vías, están presentes en la etiopatogenia de diversas enfermedades autoinmunes, neurodegenerativas, y también se sugiere que participen en el Síndrome de Inmunodeficiencia Adquirida (SIDA).
Debido a que la apoptosis puede considerarse como un proceso de eliminación de células defectuosas, la desregulación de los genes que codifican las proteínas relacionadas con la apoptosis, puede ser la causa del desarrollo de diversos tumores.
COMENTARIO
La muerte celular programada o apoptosis es una parte clave del desarrollo y es una medida de seguridad en la edad adulta, resulta ser un fenómeno fisiológico fundamental durante el desarrollo embrionario, ya que permite un adecuado balance del número celular del organismo en crecimiento, así como la regresión de estructuras que han perdido función o que no son necesarias.
Las muertes celulares por apoptosis son útiles, ayudan a esculpir el cuerpo y a mantener el correcto funcionamiento de las otras células.
Por ejemplo, los dedos de las manos y pies de los fetos humanos están unidos por una membrana, como en los patos; la apoptosis hace que esta membrana se disuelva antes del nacimiento. Sólo alrededor de la mitad de las células nerviosas del cerebro del recién nacido puede establecer conexiones útiles con otras células cerebrales; en lugar de llenar desordenadamente el cerebro en desarrollo, las restantes células nerviosas se autodestruyen. Millones de células del sistema inmune que podrían atacar incorrectamente al tejido del propio cuerpo comenten suicidio todos los días. Todo esto es para el bien del cuerpo —a menos que la apoptosis se descarrile—.
Este mecanismo de muerte celular interviene en importantes fenómenos fisiológicos como: embriogénesis, mantenimiento de la homeostasis, renovación tisular y desarrollo y funcionamiento del sistema inmunitario.
BIBLIOGRAFÍA
http://bvs.sld.cu/revistas/onc/vol13_2_97/onc11297.htm
http://www.cnice.mecd.es/eos/MaterialesEducativos/mem2001/biologia/ciclo/apoptosis.htm
http://www.tdx.cesca.es/TESIS_UAB/AVAILABLE/TDX-0923102-115450/fjtfv1de6.pdf
http://www.tecnicapecuaria.org/trabajos/200303280573.pdf
Descargar
| Enviado por: | Akasha |
| Idioma: | castellano |
| País: | Chile |

