Química
Amoníaco. Ácido sulfúrico, nítrico y clorhídrico. Cloro
AMONIACO
El amoniaco está constituido por moléculas de composición NH3. Los átomos del hidrógeno son equivalentes. La molécula tiene, por tanto, forma piramidal es decir presenta una hibridación sp3, donde tres de los orbitales se solapan con los hidrógenos y el que resta se queda con los electrones no compartidos. Los ángulos de enlace son algo menores que los de un tetraedro debido a la nube electrónica del par solitario que los reduce a un ángulo de 107º 20´. El nitrógeno ocupa el vértice de una pirámide, cuya base es un triángulo equilátero formado por los tres átomos de hidrógeno.
En el amoniaco tenemos átomos de hidrógeno unidos al nitrógeno , que es un átomo pequeño y electronegativo, por lo que el amoniaco presentará enlaces intermoleculares de puntes de hidrógeno al igual que la molécula de agua.
El hecho de que el amoniaco presente este tipo de enlace entre sus moléculas hace que sus puntos de fusión y ebullición, el calor de vaporización, la constante dieléctrica, etc... sean anormalmente altos.
PROPIEDADES DEL AMONIACO
A temperatura ambiente es un gas difícilmente licuable. Los altos puntos de fusión y ebullición con consecuencia de la fuerte asociación de moléculas , debido a su carácter polar y al posibilidad del N de formar enlaces con H.
Es un gas incoloro y tiene un olor picante característico, que irrita los ojos y de sabor cáustico. Es muy soluble en agua.
El amoniaco en estado liquido es muy poco conductor de la electricidad, bastante menos que el agua. Y por las características de la molécula es un disolvente ionizante. En éste estado el amoniaco se emplea como refrigerante y como disolvente. Arde en presencia del oxígeno puro con una llama poco luminosa, desprendiendo vapor de agua y de nitrógeno. Si se eleva la presión de la mezcla de oxigeno puro y amoniaco el resultado puede ser una explosión.
Es estable a temperatura ambiente pero se descompone por la acción del calor.
La reacción del amoniaco con metales, especialmente con alcalino y alcalinotérreos, puede dar lugar a amidas, imidas o nitruros.
Es mas ligero que el aire, posee una densidad de 0.6
Carácter Ácido-Base: en las reacciones químicas el amoniaco pueda actuar como base. Este comportamiento se explica inmediatamente recordando se estructura electrónica. El par solitario del nitrógeno puede compartirlo con otra molécula o ión que tenga un orbital vacío, formando un enlace covalente coordinado. Así puede aceptar un protón:
H2O + NH3 NH4+ + OH-
Es decir, se comporta como una base débil de Brönsted-Lowry, por lo que se utiliza en muchas reacciones como fuente moderada de iones OH-
Carácter Redox: puesto que en él el nº de oxidación del N es -3, que es el menor posible, en NH3 sólo puede actuar como reductor en las reacciones redox. Así, por ejemplo, a temperatura elevada se oxida con oxígeno molecular:
4 NH3 + 5O2 6H2O + 4NO
OBTENCIÓN DEL AMONIACO
1º Forma: En el laboratorio , el método mas corriente de obtener amoniaco es mediante una reacción ácido-base de desplazamiento, esto es, desplazando la base débil de una sal amónica por una base fuerte. Corrientemente se emplea hidróxido de cálcico:
2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2 NH3
2º Forma: A nivel industrial se utiliza el proceso de Haber-Bosch, que cosiste en la síntesis a partir de sus elementos:
N2 (g) + 3H2 (g) 2NH3 H= -92.4 KJ
Esta ecuación es un ejemplo de equilibrio. Por lo que utilizaremos el principio de Le Chatelier para calcular las condiciones optimas. Según éste principio tendríamos que conseguir una temperatura baja y una presión elevada. Pero a una baja temperatura la velocidad de reacción es extremadamente lenta. Por estas causas el proceso de formación del amoniaco se realiza entre los 400-500º C a través de un catalizador de óxido de hierro, y a unas 1000 atm de presión consiguiendo rendimientos de un 50 a un 70%.
APLICACIONES DEL AMONIACO
Se emplea para la obtención de sales amónicas, utilizadas como abono. Otra gran parte de se destina a la obtención de NO, de ácido nítrico y de nitratos. También se utiliza como ya hemos dicho antes, de refrigerante.
ÁCIDO SULFÚRICO
PROPIEDADES
El acudo sulfúrico es un líquido vicioso, incoloro y miscible con el agua. En el ácido sulfúrico líquido puro existen moléculas H2SO4 en equilibrio con SO2 y H2O. Es mal conductor de la corriente eléctrica. En el agua es un electrolito fuerte, debido a una intensa ionización. Lo mismo ocurre en e disolventes como el amoniaco o el HF líquido.
El ácido sulfúrico tiene una fuerte acción deshidratante y no sólo extrae el agua de las sustancias químicas y de los tejidos animales y vegetales, sino que por contacto directo causa la destrucción de éstos; además de sustancias como azúcares, papel y fibras textiles vegetales. Es por esto por lo que se utiliza para desecar sustancias
El ácido sulfúrico es un ácido fuerte, diprótico. En disoluciones diluidas, la primera disociación es prácticamente completa pero después la disociación del hidrogenosulfato es relativamente pequeña
El ácido concentrado y caleñita actúa como un agente oxidante, reduciéndose a dióxido de azufre. De este modo puede disolver metales sin embargo no ataca a metales nobles como el oro o el platino
OBTENCIÓN DEL ÁCIDO SULFÚRICO
En su fabricación industrial se utilizan dos métodos: el de las cámaras de plomo y el de contacto.
En su fabricación se pueden distinguir tres etapas:
Obtención del SO2
Oxidación de SO2 a SO3
Reacción de SO3 con agua para formar el ácido sulfúrico.
La obtención del SO2 se realiza por la combustión de S o tostando sulfuros sobre todo pirita
S + O2 SO2
4FeS2 + 11O2 2Fe2O3 + 8SO2
La segunda etapa de la fabricación es la más importante:
2SO2 (g) + O2 (g) 2SO3 (g) H=-197 KJ
A temperatura ordinaria la reacción es muy lenta, aumentando la temperatura aumenta la velocidad de reacción, pero al ser exotérmica el equilibrio se desplaza hacia la izquierda, por lo que el incremento de temperatura no puede ser excesivo.
También puede aumentar el rendimiento de la reacción, aumentando la presión, ya que la reacción transcurre con disminución del numero de moles. Empleando un catalizador adecuado a presión normal con una temperatura de unos 400 ºC se alcanzan rendimientos del 98%.
La diferencia entre los dos procedimientos industriales de producción del ácido sulfúrico estriba en el tipo de catalizador: En el método de las cámaras de plomo utiliza como catalizador óxidos de nitrógeno. En el método de contacto se utiliza como catalizador el platino finamente dividido en pentaóxido de divanadio. En este método es necesaria una cuidadosa purificación previa del SO2, pues, de lo contrario, se produciría un envenenamiento del catalizador que n lo inutilizaría.
La tercera etapa sería la formación del ácido sulfúrico. Una vez formado el SO3 no se hace reaccionar directamente con el agua debido a que la reacción es muy lenta. Por ello se recoge sobre H2SO4 concentrado, formándose ácido sulfúrico fumante u oleum, constituido principalmente por H2S2O7 (ácido pirosulfúrico) que al diluirlo con agua proporciona ácido sulfúrico de gran pureza. El ácido sulfúrico obtenido por el método de las cámaras de plomo es de una riqueza inferior al 70%, por lo que se utiliza para la fabricación de abonos, es un método mas barato que el de contacto con el que se obtiene una riqueza del 98%.
APLICACIONES DEL ÁCIDO SULFÚRICO
El ácido sulfúrico tiene multitud de variedad de aplicaciones técnicas como la fabricación de abonos, refinación del petróleo, fabricación de explosivos, fabricación de productos químicos, de colorantes de plásticos, de fibras textiles, pinturas, para limpiar de herrumbre el acero, en la fabricación de pilas y acumuladores
Debido a todas estas aplicaciones en ocasiones se utiliza para medir el grado de desarrollo de un país.
ÁCIDO NÍTRICO
PROPIEDADES
El ácido nítrico puro es líquido a la temperatura ordinaria e incoloro. En estado sólido también es incoloro. Es inestable, en el líquido está desasociado en pentaóxido de dinitrógeno y agua. El ácido nítrico es soluble en agua con gran desprendimiento de calor.
Las disoluciones acuosas de ácido nítrico se comportan frente a metales y a compuestos como óxidos, hidróxidos, carbonatos , etc..., como corresponde a disoluciones acuosas de ácidos fuertes.
El ácido nítrico concentrado es un poderoso agente oxidante y de los metales sólo en Au, Pt, Rh, e IR no son atacados por él. Sin embargo , algunos metales como el Al, Fe y Cr, se pasivan por la acción del ácido concentrado. Las razones de este hecho no son conocidas aunque parece probable la formación de una película impermeable de óxido. El único metal que libera H2, y sólo en la etapa inicial de la reacción, es el Mg ; los otros metales reducen generalmente al nitrógeno. El Au y los metales del grupo del platino se disuelven a agua regia (3 partes de HCL concentrado y 1 parte de HNO3 concentrado)el poder oxidante del HNO3 depende marcadamente de su concentración. A concentraciones menores de 2M, su poder oxidante es virtuosamente nulo.
Es un ácido muy fuerte, presenta la propiedad de los ácidos de neutralizar las bases y de desplazara otros ácidos más débiles.
Es un ácido muy oxidante. El nº de oxidación del nitrógeno es +5, el máximo que puede tener el nitrógeno, por tanto la tendencia de este es a reducirse. Los productos de la reducción dependen de la concentración del ácido nítrico y de la naturaleza del agente al que se le enfrente.
OBTENCIÓN DEL ÁCIDO NITRICO
Para la obtención del ácido nítrico de forma industrial se utiliza el denominado proceso de Ostwald. Consiste en la oxidación catalítica del amoniaco procedente de la síntesis de Haber, a óxidos de nitrógeno que por acción del agua pasan a ácido nítrico. Podemos dividir el proceso en tres fases:
Oxidación del amoniaco a óxido nítrico: La mezcla gaseosa de amoniaco y aire enriquecido en oxígeno se calienta a unos 800 ºC a través de un catalizador de platino, la reacción es:
4NH3 + 502 4NO + 6 H2O
Oxidación de NO a NO2: El monóxido de nitrógeno pasa a la torre de oxidación donde se añade más aire, oxidándose a dióxido de nitrógeno:
2NO + O2 2NO2
Paso de NO2 a HNO3: El dióxido de nitrógeno formado se conduce a la torre de hidratación donde, siempre en presencia de un exceso de aire, reacciona con el agua.
3NO2 + H2O 2HNO3 + NO
El ácido así obtenido se concentra por destilación, hasta que se obtiene una disolución de punto de ebullición constante, que es el ácido nítrico comercial (68% en peso y densidad 1,4 g/cm3)
APLICACIONES DEL ACIDO NITRICO
Se utiliza como base de fabricación de abonos y fertilizantes, explosivo y pinturas especialmente. También se emplea para la preparación de nitratos. Para la formación de agua regia
ÁCIDO CLORHÍDRICO
PROPIEDADES
También denominado como cloruro de hidrógeno es un compuesto polar covalente. A temperatura ambiente es un gas con un punto de fusión de -115 ºC y un punto de ebullición de -85 ºC, es incoloro y de olor acre, ácido e irritante, que forma nieblas con el aire húmedo, por ser muy soluble en el agua. En la disolución acuosa se comporta como un ácido muy fuerte. Por ello reacciona con óxidos e hidróxidos metálicos, carbonatos sulfitos etc... así como con metales activos, formando el cloruro correspondiente.
CaCO3 + 2 HCL CaCl2 + H2O + CO2
Zn + 2HCl ZnCl2 + H2
OBTENCIÓN DEL ÁCIDO CLORHÍDRICO
El HCl puede obtenerse por el desplazamiento de sus sales mediante ácido sulfúrico concentrado
NaCl + H2SO4 NaHSO4 + HCl
NaHSO4 + NaCl Na2SO4 + HCl
La reacción tiene lugar en dos fases. En la primera, a temperatura ordinaria, el equilibrio está desplazado hacia la derecha, por desprenderse en HCl ; en la segunda hay que calentar para que se verifique.
En la industria el HCl suele obtenerse por la unión directa de hidrógeno y cloro moleculares que tiene lugar de una forma explosiva por lo que hay que realizarlo bajo unas medidas de seguridad.
APLICACIONES DEL ÁCIDO CLORHÍDRICO
Tiene gran importancia industrial utilizándose para la limpieza del acero antes de galvinación o para obtener productos como cloruros metálicos tintes, jabones o como reactivo en análisis químicos, también se utiliza para la producción de productos textiles y como subproducto de la combustión del carburante usado en las centrales eléctricas que queman carbón.
CLORO
PROPIEDADES
De complejo molecular diatómico, su número atómico es 17 y de masa atómica 35.5 , es gaseoso a tempera ambiente, de color amarillo verdoso, de olor sofocante y tóxico. Fue descubierto por Scheele en 1774. Tiene una densidad de 2,5, se licua a -35º C y se almacena en forma líquida. Es bastante soluble en agua.
Está dotado de una gran actividad química, es decir, es muy reactivo. Se encuentra en la naturaleza formando compuestos debido a su alta actividad química.
OBTENCIÓN DEL CLORO
La forma más adecuada para preparar Cloro en el laboratorio consiste en oxidar el ácido clorhídrico. En un aparato como el que se indica en la figura,
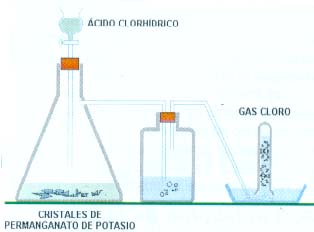
Se hace gotear lentamente ácido clorhídrico concentrado sobre unos cristales de permanganato de Potasio. La reacción se produce en temperatura ambiente.
El gas se recoge sobre salmuera saturada, puesto que el Cloro es moderadamente soluble en el agua. Si en posteriores experimentos interesa disponer de agua en Cloro, colóquese un frasco lavador entre el generador y el colector
A nivel industrial se obtiene como la electrolisis de la sal común obteniendo también sosa cáustica e hidrógeno
APLICACIONES DEL CLORO
El cloro tiene aplicaciones muy variadas en la industria química, como en la fabricación de productos orgánicos clorados (material plástico o sintético, solventes, insecticidas, herbicidas), en la industria de la celulosa y del papel y en las lavanderías como agente de blanqueo. También se adiciona como desinfectante al agua potable y al agua de las piscinas de natación.
10
Descargar
| Enviado por: | Couso |
| Idioma: | castellano |
| País: | España |
