Química
Ácidos y bases
Introducción
La acidez y la basicidad constituyen el conjunto de propiedades características de dos importantes grupos de sustancias químicas: los ácidos y las bases. Las ideas actuales sobre tales conceptos químicos consideran los ácidos como dadores de protones y las bases como aceptadoras. Los procesos en los que interviene un ácido interviene también su base conjugada, que es la sustancia que recibe el protón cedido por el ácido. Tales procesos se denominan reacciones ácido-base.
Historia del concepto de Ácido-Base.
Desde los primeros tiempos de la ciencia, los químicos, en su afán de ordenar sus conocimientos acerca de la materia y poner de relieve las semejanzas y contrastes en el comportamiento de las diferentes sustancias que manejaban, clasificaron a los compuestos inorgánicos (únicos conocidos por entonces) en tres grandes grupos: ácidos, bases y sales.
En un principio, la clasificación de las sustancias como ácidos o bases se basó en la observación de una serie de propiedades comunes que presentaban las disoluciones acuosas.
Ya en el año 1663, el científico inglés Robert Boyle estableció una serie de propiedades comunes a todos los ácidos, que fueron extendiéndose con el transcurso del tiempo.
En los comienzos del siglo XIX, las principales propiedades características de los ácidos eran:
-
Son compuestos que tienen un sabor agrio típico, llamado sabor ácido.
-
Producen una sensación punzante en contacto con la piel.
-
Sus disoluciones acuosas cambian el color de muchos colorantes vegetales; por ejemplo, producen un color rojo con el tornasol (azul).
-
Contiene hidrógeno que puede liberarse, en forma gaseosa, cuando a sus disoluciones acuosas se añade un metal activo, como, por ejemplo, cinc.
-
Disuelven muchas sustancias.
-
Cuando reaccionan con hidróxidos metálicos, pierden todas sus propiedades características.
Y las de las bases:
-
Tienen sabor amargo característico.
-
Sus disoluciones acuosas producen una sensación suave (jabonosa) al tacto.
-
Sus disoluciones acuosas cambian el color de muchos colorantes vegetales; por ejemplo, devuelven el color azul al tornasol enrojecido por los ácidos.
-
Precipitan muchas sustancias, que son solubles en los ácidos.
-
Pierden todas sus propiedades características cuando reaccionan con un ácido.
Esta última cualidad de las bases, análoga a la de los ácidos, de neutralizar sus propiedades características cuando reaccionaban entre sí, se llamó, por ello, neutralización.
El conjunto de las propiedades anteriores constituye lo que se llama una definición operacional o fenomenológica, basada en hechos experimentales, pero sin tratar de darles una interpretación.
Como es lógico, los químicos no se encontraban satisfechos con esta definición e intentaron poder explicar el comportamiento semejante de los ácidos o de las bases. Así a finales del siglo XIX empiezan a aparecer las primeras teorías de tipo conceptual, que tratan de enseñar el principio o la causa del comportamiento de los ácidos o de las bases.
Teoría clásica o de Arrhenius.
Svante Arrhenius, en 1887, llegó a la conclusión de que las propiedades características de las disoluciones acuosas de los ácidos se debían a los iones hidrógeno, H+, mientras que las propiedades típicas de las bases se debían a iones hidróxido, OH- .
Los iones hidrógeno o protones, debido a su pequeñísimo radio(Ⴛ10 -13 cm), no existen como tales en disolución acuosa , sino que están fuertemente hidratados . Resultados experimentales confirman que el ion hidronio o ión oxonio ,H30+, es particularmente estable, aunque también éste se encuentra hidratado. Para simplificar , se representan por H+ (aq) o H3O+(aq).
El ión OH- se llama frecuentemente ion hidroxilo y también, a veces, ion oxhidrilo. En disolución acuosa se encuentra, asímismo, hidratado.
Por ello propuso la siguiente definición:
En disolución acuosa:
-
Ácido es una sustancia que se disocia produciendo H+.
-
Bases es una sustancia que se disocia produciendo iones hidróxido, OH-.
Ejemplos típicos de ácidos, según la definición de Arrhenius , son todos los ácidos clásicos, HCl ,H2SO4,HNO3,etc, que al disolverse en agua se disocian o ionizan en la forma:
HCl 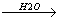
Cl- (aq) + H+ (aq)
Ejemplos de bases son todos los hidróxidos de metales (en particular los de los metales alcalinos y alcalinotérreos), que al disolverse en agua se disocian en la forma:
NaOH 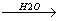
Na+(aq) + OH- (aq)
Con la teoría de Arrhenius se comprende fácilmente la capacidad de ácidos y bases de neutralizar sus propiedades características entre sí, lo que se llama por esto reacción de neutralización. Ello debe suponer la desaparición de los iones característicos, H+ y OH-,que se combinan para formar moléculas de agua. Así, por ejemplo, cuando se mezcla una disolución acuosa de ácido clorhídrico con otra de hidróxido sódico, la reacción de neutralización puede escribirse de la forma:
Cl- (aq) + H+ (aq) + Na+ (aq) + OH- (aq) 
H2O + Cl- (aq) + Na+ (aq)
Los iones Cl-(aq) y Na+(aq) prácticamente no han sufrido ninguna modificación, se llaman iones espectadores, por lo que la reacción de neutralización se reduce en esencia a:
H+ (aq) + OH- (aq) 
H2O
que , en general, está muy desplazada hacia la derecha. Así se justifica que la neutralización sea una reacción análoga para cualquier pareja ácido-base.
Teoría de Brönsted y Lowry.
El ión hidrógeno, H+, no puede existir como tal en disolución acuosa, sino que se encuentra en forma de ión hidronio, H3O+.Cuando un ácido se disuelve en agua, es lógico suponer que el ion hidronio se forma por la transferencia de un protón desde la molécula de ácido a una molécula de agua, con lo que la disociación del HCl, por ejemplo, puede escribirse de la forma:
(Para simplificar, se suprimirá en lo que sigue la indicación (aq) para los iones , entendiendo , no obstante , que se encuentran hidratados.)
HCl + H20 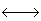
H3O+ + Cl-
Esta ecuación tiene la ventaja de hacer intervenir explícitamente al disolvente, que juega un importante papel en las reacciones ácido-base.
Teniendo esto en cuenta, se pueden explicar las propiedades de bases como el amoniaco, iones carbonato, etc., suponiendo que, en estos casos, la transferencia del protón se realiza desde una molécula de agua a una molécula de base, esto es, en la forma:
H2O + NH3 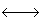
NH4+ + OH+
H2O + CO3 2- 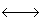
HCO 3- + OH+
Estas consideraciones condujeron a los químicos J. N. Brönsted y T. M. Lowry a proponer (en 1923) una nueva definición conceptual de ácidos y bases, más general que la de Arrhenius y que puede aplicarse a disolventes no acuosos:
-
Ácido es una sustancia capaz de ceder un protón (a una base).
-
Base es una sustancia capaz de aceptar un protón (de un ácido).
Las reacciones ácido-base según esta definición son reacciones de transferencia de protones.
En esta teoría, dada la reversibilidad de la transferencia de protones es muy importante tener en cuenta que, cuando una molécula de ácido que se representa de forma general por AH cede un protón, el resto de la molécula, A-, puede naturalmente aceptar un protón; es decir , que puede actuar como una base , que se llama base conjugada del ácido.
De forma análoga, cuando una base que se representará por B acepta un protón , se convierte en un ácido , BH+, puesto que puede volver a ceder el protón, y que se llama ácido conjugado de la base.
Una reacción ácido-base se puede escribir en la forma general:
AH + B 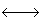
BH+ + A-
ácido 1 base 2 ácido 2 base 1
Las especies de cada pareja, AH/A- y BH+/B, que toman parte en toda reacción ácido-base, reciben el nombre de pares ácido-base conjugados.
Conviene tener en cuenta que la reacción anterior es reversible, y estará más o menos desplazada en uno u otro sentido según los pares ácido-base que se enfrenten. Es decir, que el concepto de ácido o de base es relativo. Así, por ejemplo, frente al HCl, el agua actúa como base aceptando un protón; en cambio, actúa como ácido cediendo un protón, frente al NH3 y CO3 2- , según se acaba de ver .
Las sustancias que pueden comportarse , en muchos casos , como ácidos o como bases se llaman anfipróticas (anfóteras, en la teoría de Arrhenius).
Para terminar, conviene darse cuenta que la teoría de Brönsted-Lowry es más general que la de Arrhenius, pero comprende a ésta como un caso particular.
Respecto al concepto de ácido, en disolución acuosa, ambas teorías son muy parecidas. Únicamente la teoría protónica extiende el concepto de ácido a ciertos iones no considerados explícitamente como ácidos en la teoría de Arrhenius.
En cuanto al concepto de base, las dos teorías presentan notables diferencias. En primer lugar, los hidróxidos de metales activos, se comportan como bases de Brönsted-Lowry, debido a su disociación produciendo iones OH -, que son los que realmente actúan como base, aceptando un protón.
Por otro lado, la teoría protónica amplía mucho el concepto de base, incluyendo como tales a moléculas neutras o iones, como NH3, CO3 2-, S 2-,etc., cuyo comportamiento como bases era difícil de explicar en la teoría de Arrhenius.
En resumen, las dos diferencias básicas respecto a la teoría de Arrhenius son que, no es necesario el agua aunque pueda estar presente, y las bases no tienen que ser compuestos de hidróxido. No obstante, una restricción que todavía permanece es la necesidad de un ácido prótico.
Teoría de Lewis
Para Lewis son bases las sustancias que tienen un par de electrones no compartidos que pueden ceder con mayor o menor facilidad. Por ejemplo:
H3N: C5H5N:
Son ácidos aquellas sustancias que tienen en su configuración electrónica orbitales libres capaces de aceptar el doblete electrónico. Por ejemplo:
Cl3Al, SO3, Ag +
La reacción de neutralización consiste en que el doblete electrónico de la partícula básica es aceptado por la partícula ácida, formándose un enlace covalente, y da lugar a compuestos de tipo salino. Lógicamente esta teoría engloba a las anteriores y amplia el concepto de ácido-base. Tiene interés teórico y se usa poco en Química Analítica.
Fuerza relativa de ácidos y bases
Los electrólitos son sustancias que se disocian más o menos completamente en iones cuando se disuelven en agua. De acuerdo con las teorías electroquímicas modernas debe hacerse una distinción entre electrólitos fuertes y débiles. Cuando se disuelven en agua, los electrólitos fuertes se disocian en iones virtualmente por completo mientras que en soluciones de electrólitos débiles coexisten iones y moléculas no disociadas del electrolito. Como los electrólitos fuertes están completamente disociados en solución acuosa, las concentraciones iónicas se encuentran directamente a partir de la concentración molecular de la solución. Los electrólitos débiles están incompletamente disociados y no es posible calcular las concentraciones iónicas individuales únicamente a partir de la sustancia.
De forma cualitativa , según Arrhenius , un ácido o una base es fuerte cuando en una disolución acuosa se encuentra totalmente disociado , mientras que es débil si el grado de disociación es pequeño.
De manera análoga , en la teoría de Brönsted-Lowry , un ácido será fuerte cuando muestre una gran tendencia a ceder un protón , mientras que una base fuerte presentará una gran tendencia a aceptar un protón. Esta tendencia a ceder o a aceptar es relativa , y depende de la sustancia con quien se enfrente .Por ello , hay que tomar una sustancia de referencia , que es normalmente el agua.
Es evidente que si un ácido es fuerte (gran tendencia a ceder un protón) su base conjugada mostrará muy poca tendencia a aceptar de nuevo el protón , esto es , será débil . En cambio , si un ácido es débil , su base conjugada será fuerte . En general , cuanto más fuerte sea un ácido tanto más débil será su base conjugada , y viceversa.
De una manera cuantitativa , la fuerza de un ácido (o de una base) puede expresarse mediante el valor de la constante de equilibrio , que resulta de aplicar la Ley de Acción de Masas a la reacción de dicho ácido (o base) con agua. Así , para el caso general de un ácido AH ,tendremos :
AH + H2O ![]()
H3O+ + A-
La constante de equilibrio será :
K= [H3O+][A-]
[AH][H2O]
En disoluciones acuosas diluidas , que son las que se manejan corrientemente , la concentración del agua permanece prácticamente constante (igual a la del agua pura) , por lo que puede incluirse en la constante de equilibrio , con lo que resulta :
Ka = K[H2O] = [H30+][A-]
[AH]
Esta constante Ka, llamada constante de disociación , de ionización y también constante de acidez , mide cuantitativamente la fuerza del ácido AH.
Cuanto mayor sea el valor de Ka , más fuerte será el ácido (y más débil su base conjugada A-).
De forma completamente análoga , la fuerza de una base B se mide cuantitativamente , por la constante de equilibrio de su reacción con agua:
B + H2O ![]()
BH+ + OH-
Kb = K[H2O ] = [ BH+][ OH-]
[B]
Esta constante Kb , llamada constante de disociación o de ionización de la base (constante de basicidad) , mide la fuerza de la base.
Puesto que siempre se elige el agua como sustancia de referencia , los valores de Ka (o de Kb) permiten ordenar los ácidos ( o las bases) según su fuerza relativa.
En resumen , en la teoría clásica , la fuerza de los ácidos depende exclusivamente de su disociación en agua, es decir ,de que sean electrólitos fuertes o débiles y la medida de esa fuerza vendrá dada por su constante de disociación. La constante ácida Ka, y la constante básica , Kb , serán la medida de la fuerza del ácido o de la base , cuanto mayor sea su valor , la sustancia estará más disociada, y por lo tanto el ácido (o la base) será más fuerte.Los ácidos y bases fuertes no tienen constantes de disociación al estar completamente disociados.
A continuación se explican más detalladamente estos conceptos :
Por definición un ácido o una base fuerte se disocia completamente en solución acuosa (siempre y cuando la concentración no sea excesivamente grande) . Así para calcular el PH de tales soluciones es necesario considerar un solo equilibrio, la disociación del agua Kw = [H+][OH-].
Un ácido débil , HA , es un ácido que se disocia menos del 100 % en una solución de concentración moderada . Para tales ácidos, la reacción
HA → H+ + A -
tiene una constante de equilibrio medible , Ka , la cual en el caso de una solución ideal está dada por
Ka = [H+][A-]
[HA]
Bases débiles:
Muy pocas bases débiles se describen por una ecuación análoga a la del ácido débil,
ROH → R+ + OH - .
En su lugar , la mayoría de las bases débiles son compuestos orgánicos, B, para las cuales la reacción
B + H2O Ⴎ BH+ + OH -
ocurre menos del 100 % en soluciones de moderada concentración. Su constante de equilibrio , Kb ,para una solución ideal es
Kb = [BH+][OH-]
[B]
(Como siempre la actividad del agua es igual a 1).
Bases conjugadas
El producto A- de la disociación de un ácido débil se llama base conjugada , ya que ella puede sufrir una hidrólisis de acuerdo con la siguiente reacción:
A-+ H2O → HA + OH-
(Esta reacción explica por qué las sales de los ácidos débiles son sustancias básicas)
La constante de equilibrio para esta ecuación se denota por Kcb, o algunas veces , Kh (la constante de hidrólisis), que para una solución ideal se expresa como
Kcb= Kh= [ HA][OH-] = Kw
[A-] Ka
Ácidos conjugados
De la misma manera , el producto de la reacción , BH+, de una base débil , es un ácido conjugado , puesto que puede ocurrir la reacción
BH+ Ⴎ B + A +
Para una solución ideal, la constante de equilibrio se expresa así:
Kca= [ B][H+] = Kw
[BH+] Kb
Ácidos polipróticos
Es importante no confundir la fuerza de un ácido , o de una base , con el número total de protones que pueden ceder , o aceptar, cada una de sus moléculas .
Los ácidos que sólo pueden ceder un protón (HCl , HNO3 ,etc.) se llaman monopróticos ( o también monobásicos ); si pueden ceder más de un protón se llaman polipróticos ( o polibásicos) , llamándose dipróticos cuando pueden ceder dos protones (H2SO4,H2CO3,etc.), tripróticos cuando pueden ceder tres protones (H3PO4) , etcétera.
Los ácidos polipróticos no ceden de una vez y con la misma facilidad todos los protones , sino que hacen de forma escalonada , y cada vez con mayor dificultad . Las correspondientes constantes de disociación , que pueden representarse por K1, K2, K3, ..., disminuyen mucho (aproximadamente por un factor de 10-5 ) para cada una de las sucesivas ionizaciones . Así , por ejemplo , para el ácido fosfórico .
H3PO4 + H2O 
H3O+ + H2PO4 - ; K1= 7,5 თ 10 -3
H2PO4 + H2O 
H3O+ + HPO4 2 - ; K2= 6,2 თ 10 -8
HPO4 + H2O 
H3O+ + PO4 3- ; K3= 2,2 თ 10 -13
ácido 1 base2 ácido2 base1
En una disolución acuosa de ácido fosfórico podemos considerar tres equilibrios simultáneos , cada uno caracterizado por su respectiva constante , siendo K1>> K2 >> K3 . En dicha disolución , además de H2O y H3O+, estarán presentes las siguientes especies químicas : H3PO4 , esto es , moléculas sin disociar , en la mayor proporción (puesto que incluso K1 es pequeña), y los iones H2PO4- , HPO4 2- y PO4 3- , en cantidades muy decrecientes ; la proporción del último, PO4 3 - , es pequeñísima.
Ionización del agua (El equilibrio del agua)
El agua pura se dice que es una sustancia no conductora de la electricidad , pero , en realidad, tiene una conductividad muy pequeña que puede medirse con aparatos muy sensibles . Esta conductividad indica que en agua pura deben existir iones , aunque en concentraciones extremadamente pequeñas. Esto significa que , si bien en pequeñísima proporción , el agua debe estar disociada (este proceso se llama , a veces, autoionización (Arrhenius) o autoprotólisis del agua (Brönsted-Lowry) ) en la forma:
H2O + H2O 
H3O+ + OH-
ácido1 base2 ácido2 base1
,la constante de equilibrio sería:
K = [H3O+][OH-]
[H2O] [H2O]
Teniendo en cuenta que la concentración del agua es prácticamente constante (55,5 mol/l), se puede incluir en la constante de equilibrio , que se expresa entonces en la forma :
Kw = K [H2O] [H2O] =[H3O+][OH-] = 1,0 თ 10 -14 (a 25 ºC) (2,ver efectos de la temperatura)
Esta constante ,Kw, se llama producto iónico del agua.
La concentración del agua se puede considerar constante cuando la concentración de soluto está por debajo de alrededor de 1 M y la presión es menor de 10 atm . Hay dos razones para esto : el coeficiente de actividad del agua es aproximadamente 1.00 para presiones menores de alrededor de 10 atm y la concentración del agua no varía con la adición de una cantidad limitada de soluto.
También debemos tener en cuenta los efectos de la temperatura:
Se requiere energía para disociar el agua en H+ y OH- . Por lo tanto , a medida que la temperatura del agua aumenta ,ocurre lo siguiente: la reacción procede hacia los productos H+ y OH- ,aumentando su concentración ; Los efectos de la temperatura , estudiados por H. S. Harned y W. J. Hamer se ilustran en la tabla siguiente. Se considerará Kw= 1,0 x 10 -14 y pKw=14.0 a 25 º C.
| Temperatura ºC |
Kw |
pKw | pH=pOH agua pura | [H+]=[OH-] agua pura |
| 0 10 20 25 35 50 60 | 1.14 x 10 -15 2.92 x 10 -15 6.81 x 10 -15 1.01 x 10 -15 2.09 x 10 -15 5.47 x 10 -15 9.61 x 10 -15 | 14.94 14.53 14.17 14.00 13.68 13.26 13.02 | 7.47 7.27 7.08 7.00 6.84 6.63 6.51 | 3.4 x 10-8 5.4 x 10-8 8.2 x 10-8 1.0 x 10-7 1.4 x 10-7 2.3 x 10-7 3.1 x 10-7 |
En agua pura , por cada ion H3O+ que se forme , debe formarse a la vez un ion OH-, es decir, que [H3O+] = [OH-] .Cualquier disolución acuosa en la que se cumpla esta condición se dice que es neutra , a dicha temperatura ,es:
[H3O+] = [OH-] = 1,0 თ 10 -7 mol/litro (a 25ºC)
Al disolver en agua pura un ácido , disolución ácida, ya no es cierto que [H3O+] = [OH-] , pues , como el ácido aporta iones H3O+ a la disolución , aumentará [H3O+] , con lo cual el equilibrio de disociación del agua se desplazará hacia la izquierda (principio de Le Chatelier), con lo que disminuirá [OH-] , de tal forma que el producto de ambas concentraciones , Kw ,permanece constante.
De forma análoga , si en agua pura se disuelve una base (disolución básica), aumentará la concentración de iones OH- y disminuirá, en la misma proporción , la concentración de iones H3O+, de forma que Kw permanezca constante.
En resumen , las disoluciones acuosas son neutras , ácida o básicas, cuando:
|
| A cualquier temperatura | A 25º C, en mol/litro |
|
Neutra
|
[H3O+] = [OH-] |
[H3O+] = [OH-] = 10-7 |
|
Ácida
|
[H3O+] > [OH-] |
[H3O+] > 10-7 [OH-] < 10-7 |
|
Básica
|
[H3O+] < [OH-] |
[H3O+] < 10-7 [OH-] > 10-7 |
Conviene también advertir que ni [H3O+] ni [OH-] pueden ser cero (puesto que entonces sería Kw=0 ) .Esto significa que en disoluciones ácidas siempre hay presentes iones OH- , aunque en pequeñísima concentración , y lo mismo ocurre con los iones [H3O+] en disoluciones básicas.
La relación existente entre [H3O+] y [OH-] en disolución acuosa liga también las constantes de acidez , Ka, y de basicidad , Kb, de cualquier par ácido base conjugados . En efecto , escribiendo las reacciones con agua de un ácido , AH , y de su conjugada , A- :
Ácido AH + H2O Ⴋ H3O+ + A- ; Ka
Base conjugada A- + H2O Ⴋ AH + OH- ; Kb
H2O + H2O Ⴋ H3O+ + OH- ;Kw
De las expresiones de Ka y Kb:
Ka = [A-][ H3O+ ] Kb = [ AH][OH-]
[AH] [A]
se deduce inmediatamente que
Ka · Kb=Kw
Lo que es obvio , teniendo en cuenta que la ionización del agua es la suma de las otras dos.
Esta relación permite calcular Kb a partir de Ka , o viceversa. Por ello , en las tablas de fuerza relativa de los pares ácido-base suele darse sólo el valor de Ka.
El concepto de pH
En disoluciones acuosas , como acabamos de ver , las concentraciones de los iones H3O+ y OH - están ligadas a través del producto iónico del agua , por lo que basta expresar sólo una de ellas para que la otra quede automáticamente determinada . Normalmente , se suele utilizar la concentración de iones H3O+ .
Corrientemente , la concentración de iones H3O+ en mol/litro suele variar entre los +límites:
[H3O+ ] =10-14 (para una disolución 1 N de una base fuerte)
[H3O+ ] =1 (para una disolución 1 N de un ácido fuerte)
Para poder expresar estas concentraciones mediante números sencillos , Sörensen , en 1909 , introdujo el concepto de pH , que se define como el logaritmo decimal , cambiado de signo , de la concentración de iones H3O+ (o iones H+ en la notación simplificada ), esto es:
pH = - log [H3O+]
Conviene tener muy en cuenta que , debido al cambio de signo en el logaritmo , la escala de pH va en sentido contrario al de la concentración de iones H3O+ , es decir, que el pH de una disolución aumenta a medida que disminuye [H3O+] , o sea la acidez. Esto puede verse claramente en la figura siguiente :

De la definición de disolución neutra , ácida o básica , que se ha visto anteriormente , es evidente que (a 25º C):
disolución neutra : pH = 7
disolución ácida : pH < 7
disolución básica : pH > 7
De la misma forma que el pH , se define también el pOH como:
pOH = -log [OH-]
Teniendo en cuenta la expresión del producto iónico del agua, se deduce inmediatamente que, a 25º , se cumple:
pH + pOH= 14
Descargar
| Enviado por: | Ferloro |
| Idioma: | castellano |
| País: | México |
