Química
Velocidad y equilibrio de reacciones
INTRO.VELOCIDAD Y EQUILIBRIO ...
Junto con los aspectos materiales y energéticos de las reacciones, la química se interesa por los detalles del proceso en sí. La rapidez de la reacción, los factores que influyen en ella, el mecanismo de la reacción o conjunto de pasos intermedios y la situación de equilibrio en las reacciones reversibles, constituyen algunos de estos detalles que completan la descripción fundamental de los procesos químicos.
Para que un proceso químico sea observable es preciso que se lleve a efecto con cierta rapidez. Así, por ejemplo, a pesar de los elevados porcentajes de oxígeno y nitrógeno existentes en la composición del aire, la reacción:
N2 + O2 → 2NO
tiene lugar con tal lentitud, que es prácticamente inobservable. En ocasiones, por el contrario, una reacción puede verificarse con tal rapidez que se convierta en explosiva. La combustión del hidrógeno constituye un ejemplo típico de este tipo de reacciones.
Una reacción química cuyo ritmo de transformación sea lento, no suele tener ningún interés en la industria química, ya que, por lo general, lo que se busca con la reacción es la obtención de un determinado producto en cantidades apreciables. Lo anterior pone de manifiesto la necesidad de conocer la rapidez con la que los reactivos se transforman en productos en una reacción química, es decir, su velocidad. La parte de la química que se preocupa del estudio de la evolución de las reacciones químicas, de su velocidad y de la influencia de los diferentes factores que pueden afectarla recibe el nombre de cinética química.
LA VELOCIDAD DE LOS PROCESOS ...
El concepto de velocidad de reacción
Se define la velocidad v de una reacción, como la cantidad de reactivo que se consume, o la de producto que se forma, por unidad de volumen en la unidad de tiempo.
Dado que la cantidad de sustancia por unidad de volumen en una disolución, se denomina concentración, y teniendo en cuenta que, por lo general, tanto los reactivos como los productos se hallan en disolución, ya sea líquida, sólida o gaseosa, la velocidad de reacción representa la variación de concentración de una cualquiera de las sustancias que intervienen en la reacción por unidad de tiempo.
Para una reacción del tipo:
A + B → C + D
donde A y B representan los reactivos y C y D los productos, la velocidad se puede expresar, recurriendo a la notación de incrementos, en la forma:
![]()
y se mide en mol/l · s.
![]()
que varía algo, la anterior expresión indica que v es, en efecto, la rapidez con la que varía (aumenta) la concentración ([ ]) del producto C con el tiempo. Junto con la anterior, son expresiones equivalentes de la velocidad:
![]()
dado que, si la masa se mantiene constante, la velocidad con la que aparecen los productos tiene que ser igual a la velocidad con la que desaparecen los reactivos. El signo negativo se introduce para compensar el que corresponde a la disminución de la concentración de los reactivos; de este modo, el valor de la velocidad resulta igual y positivo cualquiera que sea la sustancia A, B, C o D elegida.
Para una reacción como la de síntesis del yoduro de hidrógeno:
H2 + I2 → 2Hl
por cada mol de hidrógeno molecular H2 que se consume, se producen dos moles de yoduro de hidrógeno Hl; como ambos procesos se dan al mismo tiempo, la velocidad de aparición del producto es, en este caso, el doble de la de desaparición de uno cualquiera de los reactivos. La velocidad de reacción ha de ser única y viene dada por cualquiera de las ecuaciones siguientes:
![]()
Para una reacción más general, del tipo:
aA + bB → cC + dD
el resultado anterior puede expresarse en la forma:
![]()
La determinación de la velocidad de reacción
En general, la velocidad de una reacción varía con el tiempo, pues al principio la concentración de los reactivos es elevada, pero a medida que la reacción progresa, dicha concentración disminuye y con ella la velocidad del proceso.
La determinación experimental de la velocidad de reacción en un momento dado, puede hacerse a partir de la gráfica que representa la variación con el tiempo de la concentración de una cualquiera de las sustancias que intervienen. El cálculo de la pendiente permite estimar la velocidad. La tabla adjunta muestra los resultados obtenidos para la reacción de descomposición: 2HI → I2 + H2 al medir la concentración de Hl a intervalos sucesivos de tiempo de 10 minutos cada uno, mediante la toma de muestras de la mezcla gaseosa y su posterior análisis químico.
La representación gráfica de los pares de valores tiempo-concentración indica que la curva es decreciente, lo que significa que la concentración de reactivo disminuye con el tiempo. La velocidad de reacción en el último intervalo de tiempo, por ejemplo, vendrá dada por:
![]()
es decir,
v = 0,83 · 10-5 mol/l · min
El tomar con signo negativo la variación de la concentración de los reactivos equivale a considerar siempre la velocidad de reacción positiva.
FACTORES QUE MODIFICAN LA ...
Un modo de explicar el mecanismo mediante el cual las reacciones químicas se llevan a efecto es admitiendo que tales procesos son el resultado del choque entre las moléculas de las sustancias reaccionantes. Sólo cuando dicho choque es suficientemente violento se romperán las moléculas y se producirá la reordenación entre los átomos resultantes. El desarrollo riguroso de estas ideas básicas constituye la llamada teoría de colisiones. Nos apoyaremos, en lo que sigue, en esta interpretación de las reacciones químicas para describir cómo intervienen diferentes factores en la modificación de la velocidad de reacción.
Efecto de la concentración
Por la misma razón que son más frecuentes los accidentes de tráfico en las, «horas punta», cuanto mayor sea el número de moléculas de los reactivos presentes en un mismo volumen más fácilmente podrán colisionar. Asimismo, cuanto mayor sea el número de colisiones que se producen en la unidad de tiempo, tanto más probable será la realización de un choque eficaz, esto es, de un choque que dé lugar a la transformación de las moléculas. De esta forma se explica el hecho experimentalmente observado, de que al aumentar la concentración de los reactivos aumente la velocidad de la reacción química.
Efecto de la temperatura
De acuerdo con la teoría cinético-molecular de la materia, las moléculas constituyentes de cualquier tipo de sustancia se hallan en continua agitación vibrando o desplazándose con una energía cinética que es directamente proporcional a la temperatura absoluta T a la que se encuentre dicha sustancia. Experimentalmente se observa que la velocidad de una reacción aumenta bastante rápidamente con la temperatura.
Considerando conjuntamente la teoría cinética y la teoría de colisiones es posible explicar tal comportamiento. Al aumentar la temperatura, la energía cinética de las moléculas de los reactivos aumenta, con lo que los choques son más violentos poniéndose en juego en un mayor número de ellos la energía suficiente como para superar esa barrera que constituye la energía de activación. El efecto conjunto de estos procesos individuales se traduce en que una mayor cantidad de reactivos se transforma en la unidad de tiempo, es decir, la velocidad de reacción aumenta notablemente.
Efecto del catalizador
Se entiende en química por catalizador toda sustancia que incrementa la velocidad de una reacción sin verse ella misma alterada al final del proceso. El efecto del catalizador es, en cierto sentido, inverso al efecto de temperatura; en vez de aumentar la energía cinética de las partículas para poder salvar la cresta de la energía de activación, rebaja la altura de ésta, con lo cual hace más sencillo el proceso de transformación, pudiéndose en ocasiones llevar a cabo incluso a temperatura ambiente. El catalizador se combina con alguno de los réactivos, dando lugar a un producto intermedio de vida transitoria que reacciona con el resto con mayor facilidad. Una vez concluida la reacción se recupera, pudiendo ser nuevamente empleado.
Efecto del grado de división
Cuando el sistema está constituido por reactivos en distinto estado físico, como sólido y líquido por ejemplo, el grado de división del reactivo sólido influye notablemente en la velocidad de la reacción. Ello es debido a que, por verificarse la reacción a nivel de la superficie del sólido, cuanto más finamente dividido se encuentre éste, tanto mayor será el número de moléculas expuestas al choque y, por consiguiente, el número de choques eficaces aumentará.
LEY DE VELOCIDAD Y ORDEN DE REACCIÓN
La velocidad de una reacción química depende de la cantidad disponible de reactivos, o más exactamente, de su concentración. Así, para una reacción del tipo:
R1 + R2 → productos
la ecuación que relaciona la velocidad del proceso con la concentración de los reactivos se puede obtener experimentalmente, y se escribe en forma genérica como:
v = k [R1]n1 [R2]n2
donde k es una constante y n1 y n2 sendos coeficientes numéricos. Esta ecuación constituye la llamada ley de velocidad.
La constante de proporcionalidad k se denomina constante de velocidad y su dependencia con la temperatura fue establecida por Arrhenius en su ya famosa ley. El exponente n1 recibe el nombre de orden de la reacción respecto del reactivo R1 y el exponente n2 respecto del reactivo R2. El orden total viene dado por la suma de ambos (n1 + n2).
Los órdenes n1 y n2 no coinciden necesariamente con los coeficientes estequiométricos de la reacción ajustada y su determinación se efectua de forma experimental. Para ello se estudia cómo varía la velocidad de la reacción con la concentración del reactivo considerada, y a partir de los datos obtenidos se construye la gráfica correspondiente, y se determina su ecuación empírica; esta ecuación será del tipo v = k[R]n, siendo el n resultante el orden parcial de la reacción respecto del reactivo R.
EQUILIBRIO QUÍMICO
El concepto de equilibrio químico
La idea de reacción química lleva a veces a suponer que el proceso progresa de los reactivos hacia los productos, y que se detiene cuando se agota el reactivo que se encuentra en menor proporción. Este tipo de reacciones se denominan irreversibles. Sin embargo, con mayor frecuencia sucede que, a medida que los productos van haciendo su aparición en la reacción, tanto mayor es su capacidad para reaccionar entre sí regenerando de nuevo los reactivos. Cuando esto es posible en una reacción química, se dice que es reversible y se representa mediante una doble flecha, indicando así que la reacción puede llevarse a efecto tanto en un sentido como en el inverso:
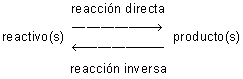
Cada proceso posee una velocidad propia que va variando con el tiempo. Así, en los comienzos, la velocidad de la reacción directa es mucho mayor que la de la reacción inversa, debido a la diferencia de concentraciones entre reactivos y productos; pero a medida que estos últimos se van formando los reactivos van desapareciendo, con lo cual ambas velocidades se aproximan hasta hacerse iguales. A partir de tal instante sucede como si la reacción estuviera detenida, pues las proporciones de reactivos y productos se mantienen constantes. Se dice entonces que se ha alcanzado el equilibrio químico.
El equilibrio químico tiene un carácter dinámico, pues no implica que la reacción se paralice en ambos sentidos como podría pensarse, sino que, en cada unidad de tiempo, se forman y desaparecen el mismo número de moléculas de cualquiera de las sustancias que intervienen en el proceso. Si algunos de los productos pueden desprenderse y abandonar el sistema, se rompe el equilibrio y la reacción se verifica sólo en un sentido, hasta que los reactivos se hayan transformado totalmente.
Por ejemplo, la reacción de oxidación del hierro por vapor de agua a alta temperatura, es reversible cuando se lleva a cabo en un recipiente cerrado:
3Fe + 4H2O ð Fe3O4 + 4H2
Pero debido a que el hidrógeno es un gas más ligero que el aire, si se abre el recipiente, lo abandonará, con lo cual ya no será posible el proceso inverso y el equilibrio quedará definitivamente roto.
La reacción de formación o síntesis de yoduro de hidrógeno (HI) a partir de sus elementos:
H2 + I2 ð 2HI
constituye otro ejemplo de reacción reversible. Para estudiarla en el laboratorio se emplean recipientes cerrados de modo que la cantidad total de materia no varíe. Cuidadosas medidas experimentales han permitido calcular las velocidades de las reacciones directa e inversa y su variación con el tiempo. La figura adjunta representa los resultados obtenidos. La velocidad del proceso directo:
H2 + I2 → 2HI es importante al principio (pendiente pronunciada), mientras que la del proceso inverso: 2Hl → H2 + I2 es casi nula. Conforme el tiempo avanza, la primera va disminuyendo y la segunda aumentando. A partir de un cierto instante ambas coinciden, lo que indica que entonces se ha alcanzado el equilibrio químico.
El principio de Le Chatelier
Existe un principio muy general que determina las posibilidades de variación de los equilibrios químicos. Fue propuesto a finales del siglo pasado por el químico francés Henri-Louis Le Chatelier (1850-1936), por lo que se conoce como principio de Le Chatelier. Se puede enunciar en los siguientes términos:
«Cuando sobre un sistema químico en equilibrio se ejerce una acción exterior que modifica las condiciones del sistema, el equilibrio se desplaza en el sentido que tienda a contrarrestar la perturbación introducida.»
He aquí algunos casos concretos de aplicación. Si en un sistema en equilibrio químico se aumenta la concentración de los reactivos, el equilibrio se desplazará hacia la derecha a fin de provocar la transformación de aquéllos en productos y recuperar así la situación inicial.
La ruptura del equilibrio de la reacción:
3Fe + 4H2O ð Fe3O4 + 4H2
provocada por la pérdida de H2, puede explicarse en términos análogos, ya que al disminuir la concentración de H2 la reacción se desplaza hacia la derecha para producir más hidrógeno, oponiéndose, de este modo, a dicha perturbación.
Una modificación de la temperatura del sistema en equilibrio puede producir igualmente un desplazamiento del mismo en un sentido o en otro. Así, por ejemplo, la reacción:
N2O4 + calor ð 2NO2
es endotérmica, por lo que un aumento de la temperatura desplazará el equilibrio en el sentido de la reacción directa, pues es en el que absorbe calor. La reacción inversa se verá favorecida por un enfriamiento, pues en este sentido se produce calor.
También los efectos de variaciones de presión, cuando el sistema posee componentes gaseosos, repercuten por análogas razones sobre el equilibrio. Así, por ejemplo, en la síntesis del amoníaco:
N2(g) + 3H2(g) ð 2NH3(g)
un aumento de presión desplazará el equilibrio hacia la derecha, ya que el número de moléculas en el segundo miembro es inferior y, por tanto, ejercerán una presión menor sobre el recipiente.
La ley del equilibrio químico
El principio de Le Chatelier permite predecir en qué manera se desplazará el equilibrio químico de una reacción reversible, pero no en qué medida. Una descripción cuantitativa del equilibrio fue efectuada por primera vez en 1870 por los químicos noruegos Guldberg (1836-1902) y Waage (1833-1918), que la expresaron en forma de ley. Así, para una reacción genérica del tipo:
aA + bB ð cC + dD
la ley de Guldberg y Waage se expresa matemáticamente en la forma:

en la cual los coeficientes estequiométricos a, b, c y d que se obtienen tras ajustar la reacción, aparecen como exponentes de las concentraciones de reactivos y productos; K toma, para cada reacción, un valor constante y característico que sólo depende de la temperatura y que se denomina constante de equilibrio.
La ley de Guldberg y Waage se conoce también como Ley de acción de masas (L.A.M.) debido a que, en el enunciado original, sus autores aludieron a conceptos tales como «fuerzas de acción» y «masas activas». Aunque el descubrimiento de esta ley fue el resultado de análisis de datos experimentales, algunos años más tarde pudo ser explicada teóricamente a partir de las leyes de la termodinámica.
La Ley de acción de masas permite hacer cálculos y predicciones sobre el equilibrio. Así, el efecto de la concentración puede explicarse como sigue: si en un sistema en equilibrio se aumenta la concentración de un reactivo, [A] por ejemplo, la reacción ha de desplazarse hacia la derecha en el sentido de formación de los productos para que el cociente representado por K se mantenga constante.
APLICACIÓN DE LA LEY DE ACCIÓN DE MASAS (I)
La reacción:
2NO(g) + O2(g) ð 2NO2(g)
presenta una constante de equilibrio K = 6,45 · 105 (a 500 K de temperatura). Determinar cuál ha de ser la concentración de oxígeno para que se mantenga el equilibrio en un sistema en el que las concentraciones de NO y NO2 son iguales.
De acuerdo con la ley de acción de masas:
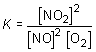
y dado que en el sistema considerado [NO2] = [NO], resulta:
![]()
es decir:
![]()
APLICACIÓN DE LA LEY DE ACCIÓN DE MASAS (II)
La constante de equilibrio, a 600 K, de la reacción de descomposición del amoníaco:
![]()
vale K = 0,395. Si en un recipiente de 1,00 l de capacidad y a 600 K se introducen 2,65 g de NH3 a igual temperatura, calcular cuáles serán las concentraciones en el equilibrio.
La cantidad de NH3 inicial expresada en moles será:
![]()
pues la masa molecular del amoníaco es:
M(NH3) = 14,0 + 3 · 1,0 = 17,0
y, puesto que el volumen del sistema es de un litro, la concentración inicial de NH3 será:
[NH3] = 0,156 mol/l
Pero conforme la reacción avance, la concentración irá disminuyendo hasta reducirse al valor de equilibrio. Si suponemos que se han descompuesto x moles/l de NH3, de acuerdo con la ecuación química de partida, se habrán formado
![]()
![]()
![]()
![]()
Según la ley de acción de masas, se cumplirá la relación:

y sustituyendo los valores de las concentraciones resulta:

Operando y sustituyendo el valor de K, se tiene:
![]()
que, reordenada, equivale a la ecuación de segundo grado:
1,30 x2 + 0,395 x - 0,0616 = 0
cuya solución aceptable es:
x = 0,114
Por tanto, las concentraciones de reactivos y productos en el equilibrio serán las siguientes:
[NH3] = 0,156 - x = 0,156 - 0,114 = 0,042 mol/l
![]()
![]()
Descargar
| Enviado por: | Luis Miguel Munguía |
| Idioma: | castellano |
| País: | España |
