Química
Teoría Atómica
CONTENIDO
-
HISTORIA DE LA TEORIA ATOMICA 4
-
TEORIA ATOMICA 5
-
TEORIA ATOMICA DE DALTON 6
-
MODELOS ATOMICOS 8
El Modelo de Thomson 8
El Modelo de Rutherford 8
Modelo Atómico de Niels Bohr 13
Modelo Cuántico (Actual) 15
-
BIBLIOGRAFIA 20
HISTORIA DE LA TEORIA ATOMICA
Cinco siglos antes de Cristo, los filósofos griegos se preguntaban si la materia podía ser dividida indefinidamente o si llegaría a un punto, que tales partículas, fueran indivisibles. Es así, como Demócrito formula la teoría de que la materia se compone de partículas indivisibles, a las que llamó átomos (del griego átomos, indivisible).
En 1803 el químico inglés John Dalton propone una nueva teoría sobre la constitución de la materia. Según Dalton toda la materia se podía dividir en dos grandes grupos: los elementos y los compuestos. Los elementos estarían constituidos por unidades fundamentales, que en honor a Demócrito, Dalton denominó átomos. Los compuestos se constituirían de moléculas, cuya estructura viene dada por la unión de átomos en proporciones definidas y constantes. La teoría de Dalton seguía considerando el hecho de que los átomos eran partículas indivisibles.
Hacia finales del siglo XIX, se descubrió que los átomos no son indivisibles, pues se componen de varios tipos de partículas elementales. La primera en ser descubierta fue el electrón en el año 1897 por el investigador Sir Joseph Thomson, quién recibió el Premio Nobel de Física en 1906. Posteriormente, Hantaro Nagaoka (1865-1950) durante sus trabajos realizados en Tokio, propone su teoría según la cual los electrones girarían en órbitas alrededor de un cuerpo central cargado positivamente, al igual que los planetas alrededor del Sol. Hoy día sabemos que la carga positiva del átomo se concentra en un denso núcleo muy pequeño, en cuyo alrededor giran los electrones.
El núcleo del átomo se descubre gracias a los trabajos realizados en la Universidad de Manchester, bajo la dirección de Ernest Rutherford entre los años 1909 a 1911. El experimento utilizado consistía en dirigir un haz de partículas de cierta energía contra una plancha metálica delgada, de las probabilidades que tal barrera desviara la trayectoria de las partículas, se dedujo la distribución de la carga eléctrica al interior de los átomos.
TEORIA ATOMICA
La descripción básica de la constitución atómica, reconoce la existencia de partículas con carga eléctrica negativa, llamados electrones, los cuales giran en diversas órbitas (niveles de energía) alrededor de un núcleo central con carga eléctrica positiva. El átomo en su conjunto y sin la presencia de perturbaciones externas es eléctricamente neutro.
El núcleo lo componen los protones con carga eléctrica positiva, y los neutrones que no poseen carga eléctrica.
El tamaño de los núcleos atómicos para los diversos elementos están comprendidos entre una cien milésima y una diez milésima del tamaño del átomo.
La cantidad de protones y de electrones presentes en cada átomo es la misma. Esta cantidad recibe el nombre de número atómico, y se designa por la letra "Z". A la cantidad total de protones más neutrones presentes en un núcleo atómico se le llama número másico y se designa por la letra "A".
Si designamos por "X" a un elemento químico cualquiera, su número atómico y másico se representa por la siguiente simbología:
ZXA
Por ejemplo, para el Hidrogeno tenemos: 1H1.
Si bien, todas las características anteriores de la constitución atómica, hoy en día son bastante conocidas y aceptadas, a través de la historia han surgido diversos módelos que han intentado dar respuesta sobre la estructura del átomo.
TEORÍA ATÓMICA DE DALTON 
Aproximadamente por el año 1808, define a los átomos como la unidad constitutiva de los elementos (retomando las ideas de los atomistas griegos). Las ideas básicas de su teoría, publicadas en 1808 y 1810 pueden resumirse en los siguientes puntos:
-
La materia está formada por partículas muy pequeñas para ser vistas, llamadas átomos.
-
Los átomos de un elemento son idénticos en todas sus propiedades, incluyendo el peso.
-
Diferentes elementos están formados por diferentes átomos.
-
Los compuestos químicos se forman de la combinación de átomos de dos o más elementos, en un átomo compuesto; o lo que es lo mismo, un compuesto químico es el resultado de la combinación de átomos de dos o más elementos en una proporción numérica simple.
-
Los átomos son indivisibles y conservan sus características durante las reacciones químicas.
-
En cualquier reacción química, los átomos se combinan en proporciones numéricas simples.
-
La separación de átomos y la unión se realiza en las reacciones químicas. En estas reacciones, ningún átomo se crea o destruye y ningún átomo de un elemento se convierte en un átomo de otro elemento.
A pesar de que la teoría de Dalton era errónea en varios aspectos, significó un avance cualitativo importante en el camino de la comprensión de la estructura de la materia. Por supuesto que la aceptación del modelo de Dalton no fue inmediata, muchos científicos se resistieron durante muchos años a reconocer la existencia de dichas partículas.
Además de sus postulados Dalton empleó diferentes símbolos para representar los átomos y los átomos compuestos, las moléculas.
Sin embargo, Dalton no elabora ninguna hipótesis acerca de la estructura de los átomos y habría que esperar casi un siglo para que alguien expusiera una teoría acerca de la misma.
Otras Leyes que concordaban con la teoría de Dalton:
-
Ley de la Conservación de la Masa: La Materia no se crea ni se destruye, sólo se transforma.
-
Ley de las Proporciones Definidas: Un Compuesto Puro siempre contiene los mismos elementos combinados en las mismas proporciones en masa.
-
Ley de las Proporciones Múltiples: Cuando dos elementos A y B forman más de un compuesto, las cantidades de A que se combinan en estos compuestos, con una cantidad fija de B, están en relación de números pequeños enteros.
MODELOS ATOMICOS
El Modelo de Thomson.
Thomson sugiere un modelo atómico que tomaba en cuenta la existencia del electrón, descubierto por él en 1897. Su modelo era estático, pues suponía que los electrones estaban en reposo dentro del átomo y que el conjunto era eléctricamente neutro. Con este modelo se podían explicar una gran cantidad de fenómenos atómicos conocidos hasta la fecha. Posteriormente, el descubrimiento de nuevas partículas y los experimentos llevado a cabo por Rutherford demostraron la inexactitud de tales ideas.
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas (Figura N° 01).
Figura N° 01
Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva.
En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
El Modelo de Ernest Rutherford.
Basado en los resultados de su trabajo, que demostró la existencia del núcleo atómico, Rutherford sostiene que casi la totalidad de la masa del átomo se concentra en un núcleo central muy diminuto de carga eléctrica positiva. Los electrones giran alrededor del núcleo describiendo órbitas circulares. Estos poseen una masa muy ínfima y tienen carga eléctrica negativa. La carga eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando que el átomo sea eléctricamente neutro.
El modelo de Rutherford tuvo que ser abandonado, pues el movimiento de los electrones suponía una pérdida continua de energía, por lo tanto, el electrón terminaría describiendo órbitas en espiral, precipitándose finalmente hacia el núcleo. Sin embargo, este modelo sirvió de base para el modelo propuesto por su discípulo Neils Bohr, marcando el inicio del estudio del núcleo atómico, por lo que a Rutherford se le conoce como el padre de la era nuclear.
Ernest Rutherford estudió los componentes de la radiación que ocurre espontáneamente en la Naturaleza. A continuación se presenta una tabla resumiendo las características de estos componentes:
| Rayo | Composición | Carga |
| alfa | 2 protones y 2 neutrones (llamados también núcleos de Helio) | 2+ |
| beta | Electrones de alta energía | 1- |
| gamma | Radiación Electromagnética de Longitud de onda muy corta (Alta Energía) | 0 |
En 1900 Rutherford, con la colaboración de Geiger Marsden, soporta y verifica su teoría con el experimento, hoy muy famoso, de la lámina de oro. El experimento era simple, bombardearon una placa de oro muy delgada con partículas (ALFA) procedentes de una fuente radioactiva. Colocaron una pantalla de Sulfuro de Zinc fluorescente por detrás de la capa de oro para observar la dispersión de las partículas alfa en ellas. Según se muestra en la siguiente figura:
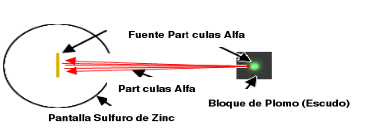
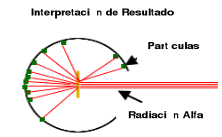
Figura N° 02
Lo anterior demostró, que la dispersión de partículas alfa con carga positiva, era ocasionada por repulsión de centros con carga positiva en la placa de oro, igualmente se cumplía con placas de metales distintos, pudiéndose concluir que cada átomo contenía un centro de masa diminuto con carga positiva que denomino núcleo atómico. La mayoría de las partículas alfa atraviesan las placas metálicas sin desviarse, porque los átomos están constituidos, en su mayoría, por espacios vacíos colonizado tan sólo por electrones muy ligeros. Las pocas partículas que se desvían son las que llegan a las cercanías de núcleos metálicos pesados con cargas altas (Figura N° 03).
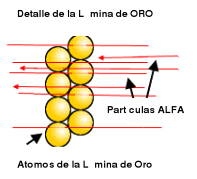
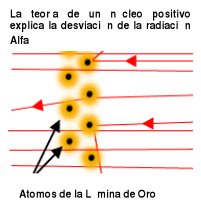
Figura N° 03
Gracias a estos desarrollos experimentales de Rutherford, éste pudo determinar las magnitudes de las cargas positivas de los núcleos atómicos. Los cálculos que se basan en los resultados del experimento indican que el diámetro de la "porción desocupada" del átomo es de 10.000 a 100.000 veces mayor que el diámetro del núcleo.
Aspectos más importantes del Modelo atómico de Ernest Rutherford:
-
El átomo posee un núcleo central en el que su masa y su carga positiva.
-
El resto del átomo debe estar prácticamente vacío, con los electrones formando una corona alrededor del núcleo.
-
La neutralidad del átomo se debe a que la carga positiva total presente en el núcleo, es igualada por el número de electrones de la corona.
-
Cuando los electrones son obligados a salir, dejan a la estructura con carga positiva (explica los diferentes rayos).
-
El átomo es estable, debido a que los electrones mantienen un giro alrededor del núcleo, que genera una fuerza centrifuga que es igualada por la fuerza eléctrica de atracción ejercida por el núcleo, y que permite que se mantenga en su orbita.
-
El valor de la cantidad de energía contenida en un fotón depende del tipo de radiación (de la longitud de onda). En la medida que la longitud de onda se hace menor, la cantidad de energía que llevan es mayor.
-
En la región 7.5x1014 hasta 4.3x10-14 , se encuentra el espectro visible, con los colores violeta, azul, verde, amarillo y rojo.
-
Las regiones donde las frecuencias es mayor (longitud de onda es menor), el contenido energético de los fotones, es grande en comparación con otras zonas.
-
En el caso de la luz ultravioleta (U.V.) sus radiaciones no se perciben a simple vista, pero conocemos su alto contenido energético al actuar como catalizador en numerosos procesos químicos.
|
|
| U | U= Frecuencia |
| cm | A° |
| |
| A°= Angstron (10-8) | |||
| 10-12 | 10-4 | 1022 | |
| 10-10 | 10-2 | 1020 | Rayos Lambda |
| 10-8 | 1 | 1018 | |
| Rayos X | |||
| 10-6 | 102 | 1016 | |
| Ultravioleta | |||
| 10-4 | 104 | 1014 | Visible |
| Infrarojo | |||
| 10-2 | 106 | 1012 |
|
| | Microondas Radar | ||
| 1 | 108 | 1010 | |
| 102 | 1010 | 108 | Ondas de Radio |
| 104 | 1012 | 106 |
![]()
= Longitud de onda: Distancia entre dos crestas en una onda (Longitud de un ciclo)
C = Velocidad de la luz (2.998 x 108 cm/seg)
![]()
= Frecuencia: Número de ondas que pasan por un punto en un segundo
La relación entre estas tres variables es:
![]()
(Radiación Electromagnética)
Serie de Balmer (1885). Espectro visible del H.
Serie de Lyman. Ultravioleta.
Series en el Infrarrojo.
Series Espectrales (Fómulas Empíricas)
El Modelo Atómico de Niels Bohr.
El físico danés Niels Bohr ( Premio Nobel de Física 1922), postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida ( por ejemplo en forma de radiación). Este modelo, si bien se ha perfeccionado con el tiempo, ha servido de base a la moderna física nuclear. Este propuso una Teoría para describir la estructura atómica del Hidrógeno, que explicaba el espectro de líneas de este elemento. A continuación se presentan los postulados del Modelo Atómico de Bohr:
El Atomo de Hidrógeno contiene un electrón y un núcleo que consiste de un sólo protón. · El electrón del átomo de Hidrógeno puede existir solamente en ciertas órbitas esféricas las cuales se llaman niveles o capas de energía. Estos niveles de energía se hallan dispuestos concéntricamente alrededor del núcleo. Cada nivel se designa con una letra (K, L, M, N,...) o un valor de n (1, 2, 3, 4,...).
-
El electrón posee una energía definida y característica de la órbita en la cual se mueve. Un electrón de la capa K (más cercana al núcleo) posee la energía más baja posible. Con el aumento de la distancia del núcleo, el radio del nivel y la energía del electrón en el nivel aumentan. El electrón no puede tener una energía que lo coloque entre los niveles permitidos.
-
Un electrón en la capa más cercana al núcleo (Capa K) tiene la energía más baja o se encuentra en estado basal. Cuando los átomos se calientan, absorben energía y pasan a niveles exteriores, los cuales son estados energéticos superiores. Se dice entonces que los átomos están excitados.
-
Cuando un electrón regresa a un Nivel inferior emite una cantidad definida de energía a la forma de un cuanto de luz. El cuanto de luz tiene una longitud de onda y una frecuencia características y produce una línea espectral característica.
-
La longitud de onda y la frecuencia de un fotón producido por el paso de un electrón de un nivel de energía mayor a uno menor en el átomo de Hidrógeno esta dada por:

-
Para Bohr el átomo sólo puede existir en un cierto número de estados estacionarios, cada uno con una energía determinada.
-
La energía sólo puede variar por saltos sucesivos, correspondiendo cada salto a una transición de un estado a otro. En cada salto el átomo emite luz de frecuencia bien definida dada por:
hv = | Ei - Ei |
De esta manera se explican los espectros atómicos, que en el caso del Hidrógeno los niveles de energía posibles están dados por la fórmula:
E = - (h/R)/n2 , ( n = 1, 2, 3, . . . infinito)
h = 60625 x 10-34 Joule - seg, Const. de Plank
R = 1.10 x 107 m-1 , Const. de Rydberg
El modelo de Niels Bohr, coincide con el propuesto por Rutherford, admite la presencia de un núcleo positivo que contiene, prácticamente, toda la masa del átomo, donde se encuentran presentes los protones y los neutrones.
Los electrones con carga negativa, se mueven alrededor del núcleo en determinados niveles de energía, a los que determinó estados estacionarios, y les asignó un número entero positivo. El nivel más cercano tiene el número 1, le sigue el 2, como se citó en párrafo de éste mismo enunciado (Modelo atómico de Bohr).
Siempre que el electrón se mantenga en la órbita que le corresponde, ni gana ni pierde energía.
Si un electrón salta de una órbita a otra capta o libera energía en forma de fotones. La cantidad viene dada por la diferencia de energía entre los dos (02) niveles.
La energía de cada nivel es mayor en la medida que se aleja del núcleo; sin embargo, las diferencias entre los niveles va disminuyendo, lo que permite que las transiciones electrónicas se produzcan con facilidad.
El número de electrones de cada elemento en su estado natural es característico, puesto que depende de su número atómico. Estos electrones estarán distribuidos en diferentes niveles energéticos que pueden funcionar como estaciones de paso para aquellos que reciben suficiente energía para saltar de un nivel a otro. Al devolverse, la luz que, difractada, produce el espectro característico.

Atomo de Niels Bohr
Modelo Mecano - Cuántico.
Se inicia con los estudios del físico francés Luis De Broglie, quién recibió el Premio Nobel de Física en 1929. Según De Broglie, una partícula con cierta cantidad de movimiento se comporta como una onda. En tal sentido, el electrón tiene un comportamiento dual de onda y corpúsculo, pues tiene masa y se mueve a velocidades elevadas. Al comportarse el electrón como una onda, es difícil conocer en forma simultánea su posición exacta y su velocidad, por lo tanto, sólo existe la probabilidad de encontrar un electrón en cierto momento y en una región dada en el átomo, denominando a tales regiones como niveles de energía o niveles energéticos. La idea principal del postulado se conoce con el nombre de Principio de Incertidumbre de Heisenberg; que no es más, que le hecho de que cada partícula lleva asociada consigo una onda, lo que impone restricciones en la capacidad para determinar al mismo tiempo su posición y su velocidad.
Los estudios realizados sobre el movimiento circular, en el campo de la física, demuestran que cualquier partícula cargada que se encuentra girando alrededor de un punto irradia energía continuamente. Este descubrimiento afecta la explicación dada por Bohr, en cuanto a la estabilidad de un átomo y la ubicación de sus electrones.
Modelo atómico actual.
Entre los conocimientos actuales o no sobre el átomo, que han mantenido su veracidad, se consideran los siguientes:
| ASPECTOS BASICOS | |
| 1 | La presencia de un núcleo atómico con las partículas conocidas, la casi totalidad de la masa atómica en un volumen muy pequeño. |
| 2 | Los estados estacionarios o niveles de energía fundamentales en los cuales se distribuyen los electrones de acuerdo a su contenido energético. |
| 3 | La dualidad de la materia (carácter onda-partícula), aunque no tenga consecuencias prácticas al tratarse de objetos de gran masa. En el caso de partículas pequeñas (electrones) la longitud de onda tiene un valor comparable con las dimensiones del átomo. |
| 4 | La probabilidad en un lugar de certeza, en cuanto a la posición, energía y movimiento de un electrón, debido a la imprecisión de los estudios por el uso de la luz de baja frecuencia. |
Fue Erwin Schodinger, quien ideó el modelo atómico actual, llamado "Ecuación de Onda", una fórmula matemática que considera los aspectos anteriores. La solución de esta ecuación, es la función de onda (PSI), y es una medida de la probabilidad de encontrar al electrón en el espacio. En este modelo, el área donde hay mayor probabilidad de encontrar al electrón se denomina orbital.
El valor de la función de onda ![]()
asociada con una partícula en movimiento esta relacionada con la probabilidad de encontrar a la partícula en el punto (x,y,z) en el instante de tiempo t.
En general una onda puede tomar valores positivos y negativos. Por ejemplo la onda:
![]()
En general una onda puede representarse por medio de una cantidad compleja:
![]()
Piense por ejemplo en el campo eléctrico de una onda electromagnética. Una probabilidad negativa, o compleja, es algo sin sentido. Esto significa que la función de onda no es algo observable. Sin embargo el módulo (o cuadrado) de la función de onda siempre es real y positivo. Por esto, a ![]()
se le conoce como la densidad de probabilidad.
Ahora sí podemos dar una interpretación física:
![]()

Nubes de probabilidad electrónicas: ![]()

En el caso más general de una función de onda compleja
![]()
el cuadrado esta dado por:
![]()
La función de onda depende de los valores de tres (03) variables que reciben la denominación de números cuánticos. Cada conjunto de números cuánticos, definen una función específica para un electrón.
Números Cuánticos:
Son cuatro (04) los números encargados de definir la función de onda (PSI) asociada a cada electrón de un átomo: el principal, secundario, magnético y de Spin. Los tres (03) primeros resultan de la ecuación de onda; y el último, de las observaciones realizadas de los campos magnéticos generados por el mismo átomo.
Número cuántico principal
Es un criterio positivo, representado por la letra "n", indica los niveles energéticos principales. Se encuentra relacionado con el tamaño. En la medida que su valor aumenta, el nivel ocupa un volumen mayor y puede contener más electrones, y su contenido energético es superior. Sus valores pueden ser desde 1 hasta infinito.
Número cuántico secundario
Representado por la letra "I", nos indica la forma que pueden tener el espacio donde se encuentra el electrón. El valor que se le asigna depende del número principal; va desde cero (0) hasta n-1.
Se ha conseguido que para dos (02) electrones que pertenecen al mismo nivel energético (igual "n"), las diferencias en valores de "I", se expresan en diferencias de contenidos energéticos, debido a esto reciben la denominación de subniveles de energía con un aumento progresivo en la medida que "I" aumenta de valor.
| I = 0 | I = 1 | I = 2 | I = 3 |
| Orbital s | Orbital p | Orbital d | Orbital f |
| I = 0 | I = 1 | I = 2 | I = 3 | Comparación | |||
| Orbital | Orbital | Orbital | Orbital | Desde el punto de | |||
| s | p | d | f | Vista energético |
Número cuántico magnético
Representa las orientaciones que pueden asumir los diferentes orbitales frente a un campo magnético; el símbolo utilizado es "m"; y los valores que tienen son los números orbitales enteros que van desde -1 hasta +1. El números de valores que pueden tener "m" indican el números de órbitas que puede contener un sub-nivel de energía.
Número cuántico de spin
Tiene dos(02) valores permitidos +1/2 y -1/2. Estos valores representan el movimiento del electrón, tipo de rotación sobre su eje, con dos (02) únicas posibilidades y opuestas entre sí, hacía la derecha o hacía la izquierda. Cada uni de los orbitales puede contener dos (02) electrones, uno con cada spin. De estar los dos (02), el momento magnético se anula, es cero, esto sucede debido a lo apuesto.
|
|
|
En el mismo orbital Se anulan los efectos | |
| Momento magnético | Momento magnético | Momento magnético | |
| (1) | (2) | (0) |
BIBLIOGRAFIA
En su totalidad, los conceptos plasmados en el presente trabajo, tienen su origen en investigaciones realizadas en INTERNET, a continuación se hace mención a las direcciones WEB de consulta:
http://wwwps.Inf.infn.it/particle/paitaliano/rutherford_result.html
http://wwwps.Inf.infn.it/particle/paitaliano/rutherford_result.html
http://wwwps.Inf.infn.it/particle/paitaliano/rutherford_result.html
http://kekule.fe.br/graduacao/edm431e2/marcos-a/dalton.html
http://www.ur.mx/cursos/diya/quimica/jescobed/esteq2.html
http://www.ur.mx/cursos/diya/quimica/jescobed/estequio.htm
http://www.cchen.cl/alumno/elementos-fisica.html
http://www.ifent.org/lecciones/teoriaatomica/ta12htm
http://luthien.nuclecu.unam.mx/~vieyra/cuant1.html (**)
Electrones
Material
Positivo
"n" principal
"I" secundario
"m" magnético
"S" spin
distancia
forma
posición
Giro sobre sí mismo
Descargar
| Enviado por: | Jesús Valdiviet |
| Idioma: | castellano |
| País: | Venezuela |




