Química
Reacciones exotérmicas y endotérmicas
Intro. no. 1 Reacciones exotérmicas y endotérmicas
La energía se conserva durante las reacciones químicas. En una reacción pueden considerarse dos fases diferenciadas: en primer lugar, los enlaces químicos de los reactivos se rompen, y luego se reordenan constituyendo nuevos enlaces. En esta operación se requiere cierta cantidad de energía, que será liberada si el enlace roto vuelve a formarse. Los enlaces químicos con alta energía se conocen como enlaces `fuertes', pues precisan un esfuerzo mayor para romperse. Si en el producto se forman enlaces más fuertes que los que se rompen en el reactivo, se libera energía en forma de calor, constituyendo una reacción exotérmica. En caso contrario, la energía es absorbida y la reacción se denomina endotérmica. Debido a que los enlaces fuertes se crean con más facilidad que los débiles, son más frecuentes las reacciones exotérmicas espontáneas; un ejemplo de ello es la combustión de los compuestos del carbono en el aire para producir CO2 y H2O, que tienen enlaces fuertes. Pero también se producen reacciones endotérmicas espontáneas, como la disolución de sal en agua.
Las reacciones endotérmicas suelen estar asociadas a la disociación de las moléculas. Esto último puede medirse por el incremento de la entropía del sistema. El efecto neto de la tendencia a formar enlaces fuertes y la tendencia de las moléculas e iones a disociarse se puede medir por el cambio en la energía libre del sistema. Todo cambio espontáneo a temperatura y presión constantes implica un incremento de la energía libre, acompañado de un aumento de la fuerza del enlace.
Una reacción química es el proceso en el que una o más sustancias se transforman en otras sustancias diferentes —los productos de la reacción. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, que reciben el nombre de magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
En algunos casos, como en la combustión, las reacciones se producen de forma rápida. Otras reacciones, como la oxidación, tienen lugar con lentitud. La cinética química, que estudia la velocidad de las reacciones, contempla tres condiciones que deben darse a nivel molecular para que tenga lugar una reacción química: las moléculas deben colisionar, han de estar situadas de modo que los grupos que van a reaccionar se encuentren juntos en un estado de transición entre los reactivos y los productos, y la colisión debe tener energía suficiente para crear el estado de transición y transformarlo en productos.
Las reacciones rápidas se dan cuando estas tres condiciones se cumplen con facilidad. Sin embargo, si uno de los factores presenta cierta dificultad, la reacción resulta especialmente lenta.
La velocidad de la reacción aumenta en presencia de un catalizador, una sustancia que no resulta alterada o se regenera, por lo que el proceso continúa. La mezcla de gases hidrógeno y oxígeno a temperatura ambiente no explota, pero si se añade platino en polvo la mezcla explosiona al cubrirse la superficie del platino con el oxígeno absorbido. Los átomos de platino alargan los enlaces de las moléculas de O2, debilitándolos y rebajando la energía de activación. Los átomos de oxígeno reaccionan rápidamente con moléculas de hidrógeno, colisionando contra ellas y formando agua y regenerando el catalizador. Las fases por las que pasa una reacción constituyen el `mecanismo de reacción'.
La velocidad de la reacción puede modificarse no sólo con catalizadores, sino también mediante cambios en la temperatura y en las concentraciones. Al elevar la temperatura se incrementa la velocidad a causa del aumento de la energía cinética de las moléculas de los reactivos, lo que provoca un mayor número de colisiones por segundo y hace posible la formación de estados de transición. Con el aumento de la concentración se consigue incrementar la velocidad de la reacción, al aumentar el número y la velocidad de las colisiones moleculares.
Intro. no. 2 Calores de reacción
La termodinámica es la ciencia que estudia las transformaciones de la energía.
Un concepto esencial de la termodinámica es el de sistema macroscópico, que se define como un conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable. El estado de un sistema macroscópico en equilibrio puede describirse mediante propiedades medibles como la temperatura, la presión o el volumen, que se conocen como variables termodinámicas. Es posible identificar y relacionar entre sí muchas otras variables (como la densidad, el calor específico, la compresibilidad o el coeficiente de expansión térmica), con lo que se obtiene una descripción más completa de un sistema y de su relación con el entorno.
Primera ley de la Termodinámica
Primera ley de la termodinámica: en un proceso, la energía no se crea ni se destruye.
Se trata de la energía que conocemos como energía interna, U, del sistema, la cual a veces también se denomina energía térmica.
Desde el punto de vista microscópico, la energía interna tiene que ver con el movimiento de las moléculas del gas, sus rotaciones, sus vibraciones, la energía de los electrones en los átomos presentes y tantos otros componentes energéticos que podemos intuir que existen.
Otro enunciado más completo de la primera ley de la termodinámica es el siguiente:
Para que la energía se conserve en un proceso, el flujo de calor, q, mas el trabajo, w, que atraviesan la frontera del sistema deben ser iguales al cambio en la energía interna del sistema, Ufinal - Uinicial
ðU = q + W
Segunda Ley de la termodinámica
La segunda ley de la termodinámica da una definición precisa de una propiedad llamada entropía. La entropía puede considerarse como una medida de lo próximo o no que se halla un sistema al equilibrio; también puede considerarse como una medida del desorden (espacial y térmico) del sistema. La segunda ley afirma que la entropía, o sea, el desorden, de un sistema aislado nunca puede decrecer. Por tanto, cuando un sistema aislado alcanza una configuración de máxima entropía, ya no puede experimentar cambios: ha alcanzado el equilibrio. La naturaleza parece pues `preferir' el desorden y el caos. Puede demostrarse que el segundo principio implica que, si no se realiza trabajo, es imposible transferir calor desde una región de temperatura más baja a una región de temperatura más alta.
El segundo principio impone una condición adicional a los procesos termodinámicos. No basta con que se conserve la energía y cumplan así el primer principio. Una máquina que realizara trabajo violando el segundo principio se denomina “móvil perpetuo de segunda especie”, ya que podría obtener energía continuamente de un entorno frío para realizar trabajo en un entorno caliente sin coste alguno. A veces, el segundo principio se formula como una afirmación que descarta la existencia de un móvil perpetuo de segunda especie.
Tercera Ley de la termodinámica
El segundo principio sugiere la existencia de una escala de temperatura absoluta con un cero absoluto de temperatura. El tercer principio de la termodinámica afirma que el cero absoluto no puede alcanzarse por ningún procedimiento que conste de un número finito de pasos. Es posible acercarse indefinidamente al cero absoluto, pero nunca se puede llegar a él.
La ley cero de la termodinámica
Dos cuerpos en equilibrio térmico con un tercero están en equilibrio térmico entre sí.
La definición de equilibrio térmico nos basta para construir una escala de temperatura. Para ello se escoge un sistema, llamado termómetro, con la característica que posea alguna propiedad que varíe cuando se le coloque en contacto térmico con otros sistemas (el caso representativo es la dilatación del mercurio en un tubo capilar). Cuando el termómetro se pone en equilibrio térmico con el hielo en el punto de fusión, se hace una marca sobre el similar, cuando se sumerge en agua en el punto de ebullición a nivel del mar, se hace la marca de 100 °C. Por ultimo, se divide la escala cien intervalos iguales y se acabó. Contamos con un termómetro que usa la escala llamada centígrada o celcius.
No hay que confundir calor con temperatura, aunque al lenguaje cotidiano nos traicione (estamos acostumbrados a decir que un cuerpo esta “caliente” cuando su temperatura es alta, y tal ves de aquí es donde proviene la confusión)
-
La temperatura es una propiedad de los sistemas.
-
El calor es una forma de energía en transito que solamente aparece al atravesar la frontera de un sistema durante un proceso.
-
Por tanto, no debemos decir que los cuerpos tienen calor, pero en cierta dirección, pero la temperatura nunca fluye.
-
La temperatura se mide en grados
-
El calor se mide en joules
-
El calor siempre fluye de los objetos que están a temperatura alta hacia los que tiene temperatura baja. Nunca se ha observado lo contrario, ni que haya un flujo neto de calor entre dos cuerpos a la misma temperatura.
-
La temperatura del sistema, Ts, y la de los alrededores, Ta, determinan entonces la dirección en la que fluye el calor en un proceso (cuando la frontera permite la transferencia). El calor entra al sistema cuando Ta > Ts; el calor sale del sistema en cuanto Ta < Ts.
Intro. no. 3 ENTROPÍA
La segunda ley de la termodinámica da una definición precisa de una propiedad llamada entropía. La entropía puede considerarse como una medida de lo próximo o no que se halla un sistema al equilibrio; también puede considerarse como una medida del desorden (espacial y térmico) del sistema. La segunda ley afirma que la entropía, o sea, el desorden, de un sistema aislado nunca puede decrecer. Por tanto, cuando un sistema aislado alcanza una configuración de máxima entropía, ya no puede experimentar cambios: ha alcanzado el equilibrio. La naturaleza parece pues `preferir' el desorden y el caos. Puede demostrarse que el segundo principio implica que, si no se realiza trabajo, es imposible transferir calor desde una región de temperatura más baja a una región de temperatura más alta.
El segundo principio impone una condición adicional a los procesos termodinámicos. No basta con que se conserve la energía y cumplan así el primer principio. Una máquina que realizara trabajo violando el segundo principio se denomina “móvil perpetuo de segunda especie”, ya que podría obtener energía continuamente de un entorno frío para realizar trabajo en un entorno caliente sin coste alguno. A veces, el segundo principio se formula como una afirmación que descarta la existencia de un móvil perpetuo de segunda especie.
El descubrimiento de que toda la materia está formada por moléculas proporcionó una base microscópica para la termodinámica. Un sistema termodinámico formado por una sustancia pura puede describirse como un conjunto de moléculas iguales, cada una de las cuales tiene un movimiento individual que puede describirse con variables mecánicas como la velocidad o el momento lineal. En ese caso, debería ser posible, al menos en principio, calcular las propiedades colectivas del sistema resolviendo las ecuaciones del movimiento de las moléculas. En ese sentido, la termodinámica podría considerarse como una simple aplicación de las leyes de la mecánica al sistema microscópico.
Los objetos de dimensiones normales, a escala humana, contienen cantidades inmensas de moléculas (del orden de 1024). Suponiendo que las moléculas fueran esféricas, harían falta tres variables para describir la posición de cada una y otras tres para describir su velocidad. Describir así un sistema macroscópico sería una tarea que no podría realizar ni siquiera la mayor computadora moderna. Además, una solución completa de esas ecuaciones nos diría dónde está cada molécula y qué está haciendo en cada momento. Una cantidad tan enorme de información resultaría demasiado detallada para ser útil y demasiado fugaz para ser importante.
Por ello se diseñaron métodos estadísticos para obtener los valores medios de las variables mecánicas de las moléculas de un sistema y deducir de ellos las características generales del sistema. Estas características generales resultan ser precisamente las variables termodinámicas macroscópicas. El tratamiento estadístico de la mecánica molecular se denomina mecánica estadística, y proporciona a la termodinámica una base mecánica.
Desde la perspectiva estadística, la temperatura representa una medida de la energía cinética media de las moléculas de un sistema. El incremento de la temperatura refleja un aumento en la intensidad del movimiento molecular. Cuando dos sistemas están en contacto, se transfiere energía entre sus moléculas como resultado de las colisiones. Esta transferencia continúa hasta que se alcance la uniformidad en sentido estadístico, que corresponde al equilibrio térmico. La energía cinética de las moléculas también corresponde al calor, y, junto con la energía potencial relacionada con las interacciones entre las moléculas, constituye la energía interna de un sistema.
La conservación de la energía, una ley bien conocida en mecánica, se transforma en el primer principio de la termodinámica, y el concepto de entropía corresponde a la magnitud del desorden a escala molecular. Suponiendo que todas las combinaciones de movimientos moleculares son igual de probables, la termodinámica demuestra que cuanto más desordenado sea el estado de un sistema aislado, existen más combinaciones que pueden dar lugar a ese estado, por lo que ocurrirá con una frecuencia mayor. La probabilidad de que se produzca el estado más desordenado es abrumadoramente mayor que la de cualquier otro estado. Esta probabilidad proporciona una base estadística para definir el estado de equilibrio y la entropía.
Definición Termodinámica de Entropía
La desigualdad de Clusiuss es válida para cualquier ciclo, no importando si este es reversible o no. Si se considera ahora un ciclo reversible y que es recorrido primero en un sentido y luego en el otro Luego, como el ciclo es reversible, la temperatura del sistema mientras intercambia calor con una fuente cualquiera es igual a la temperatura de ésta.
De esta manera, la única forma de cumplir ambas ecuaciones es que ambos términos sean iguales a 0 y no distintos. Se Obtiene de esta forma un resultado muy importante que se puede enunciar de la siguiente forma: "Cuando un sistema recorre un ciclo reversible y se divide la cantidad (diferencial) de Calor suministrada al sistema de cada punto, por su temperatura en ese punto, la suma de todos esos cocientes es nula".
Definición de Entropía:
Para un ciclo reversible como el de la figura, en donde los puntos 1 y 2 son dos puntos cualesquiera, la integral cerrada anterior se puede descomponer Como se vio anteriormente, para un ciclo reversible las dos cantidades del lado derecho son iguales, lo que implica que la cantidad integrada corresponde a una diferencial exacta. En otras palabras no depende del camino elegido, sino de los valores iniciales y finales.
Ejemplo de cálculo de Entropía:
A continuación se calculará el aumento de Entropía al calentar agua a presión atmosférica constante desde los 200°K (hielo) hasta los 400°K (vapor recalentado).
La transformación se encuentra representada por la curva abcdef y se consideran despreciables las variaciones de los calores específicos durante la evolución:
-
La primera etapa va desde 200°K a los 273°K
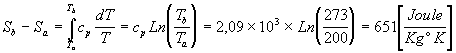
-
El aumento de Entropía cuando se funde el hielo es:
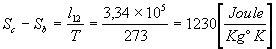
-
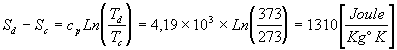
Al calentar el agua desde 273°K hasta los 373°K, el aumento de Entropía es:
-
En el proceso de vaporización a 373°K:
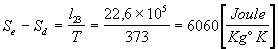
-
Finalmente al calentar el vapor hasta los 400°K:
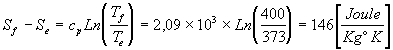
Variaciones de Entropía en procesos irreversibles.
Dado que la Entropía es una función de estado, lo relevante para su cálculo son los estados iniciales y finales. Esto significa que si calculamos la variación de Entropía por un camino reversible entre dos estados inicial y final, utilizando la formula ya vista, será la misma que si se calcula para un proceso irreversible.
"La Entropía no puede ser destruida pero puede ser creada"
Otra forma de mirar este enunciado es diciendo que todos los sistemas cerrados que evolucionan de forma irreversible, lo hacen hacia estados de mayor Entropía. Así, analizando los estados iniciales y finales de una evolución irreversible, se puede determinar la dirección del cambio que se producirá y también su espontaneidad. Comúnmente en la utilizando una equivalencia a las evoluciones de gases, se asocia el concepto de Entropía al de desorden de las partículas.
-
Zemansky, M.W., "Calor y Termodinámica", McGraw-Hill, México (1990)
-
De Teresa, J.M., Lumen, 6, 32 (1993)
Intro. No. 4 Reacciones de oxidación - reducción
En algunos casos, como en la combustión, las reacciones se producen de forma rápida. Otras reacciones, como la oxidación, tienen lugar con lentitud. La cinética química, que estudia la velocidad de las reacciones, contempla tres condiciones que deben darse a nivel molecular para que tenga lugar una reacción química: las moléculas deben colisionar, han de estar situadas de modo que los grupos que van a reaccionar se encuentren juntos en un estado de transición entre los reactivos y los productos, y la colisión debe tener energía suficiente para crear el estado de transición y transformarlo en productos.
Las reacciones rápidas se dan cuando estas tres condiciones se cumplen con facilidad. Sin embargo, si uno de los factores presenta cierta dificultad, la reacción resulta especialmente lenta.
La velocidad de la reacción aumenta en presencia de un catalizador, una sustancia que no resulta alterada o se regenera, por lo que el proceso continúa. La mezcla de gases hidrógeno y oxígeno a temperatura ambiente no explota, pero si se añade platino en polvo la mezcla explosiona al cubrirse la superficie del platino con el oxígeno absorbido. Los átomos de platino alargan los enlaces de las moléculas de O2, debilitándolos y rebajando la energía de activación. Los átomos de oxígeno reaccionan rápidamente con moléculas de hidrógeno, colisionando contra ellas y formando agua y regenerando el catalizador. Las fases por las que pasa una reacción constituyen el `mecanismo de reacción'.
La velocidad de la reacción puede modificarse no sólo con catalizadores, sino también mediante cambios en la temperatura y en las concentraciones. Al elevar la temperatura se incrementa la velocidad a causa del aumento de la energía cinética de las moléculas de los reactivos, lo que provoca un mayor número de colisiones por segundo y hace posible la formación de estados de transición. Con el aumento de la concentración se consigue incrementar la velocidad de la reacción, al aumentar el número y la velocidad de las colisiones moleculares.
Reacción química, proceso en el que una o más sustancias —los reactivos— se transforman en otras sustancias diferentes —los productos de la reacción. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, que reciben el nombre de magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
Un proceso químico es un conjunto de operaciones químicas y/o físicas ordenadas a la transformación de unas materias iniciales en productos finales diferentes. Un producto es diferente de otro cuando tenga distinta composición, esté en un estado distinto o hayan cambiado sus condiciones.
En la descripción general de cualquier proceso químico existen diferentes operaciones involucradas. Unas llevan inherentes diversas reacciones químicas. En cambio otros pasos son meramente físicos, es decir, sin reacciones químicas presentes. Podemos decir que cualquier proceso químico que se pueda diseñar consta de una serie de operaciones físicas y químicas. Cada una de estas operaciones es una operación unitaria dentro del proceso global.
Catalizador (química), sustancia que altera la velocidad de una reacción química sin sufrir en sí ningún cambio químico. Las enzimas, que se encuentran entre los catalizadores más importantes, tienen una función esencial en los organismos vivos donde aceleran reacciones que de otra forma requerirían temperaturas que podrían destruir la mayoría de la materia orgánica.
Un catalizador en disolución con los reactivos, o en la misma fase que ellos, se llama catalizador homogéneo. El catalizador se combina con uno de los reactivos formando un compuesto intermedio que reacciona con el otro más fácilmente. Sin embargo, el catalizador no influye en el equilibrio de la reacción, porque la descomposición de los productos en los reactivos es acelerada en un grado similar. Un ejemplo de catálisis homogénea es la formación de trióxido de azufre haciendo reaccionar dióxido de azufre con oxígeno, y utilizando óxido nítrico como catalizador. La reacción forma momentáneamente el compuesto intermedio dióxido de nitrógeno, que luego reacciona con el oxígeno formando óxido de azufre. Tanto al principio como al final de la reacción existe la misma cantidad de óxido nítrico.
Un catalizador que está en una fase distinta de los reactivos se denomina catalizador heterogéneo o de contacto. Los catalizadores de contacto son materiales capaces de absorber moléculas de gases o líquidos en sus superficies. Un ejemplo de catalizador heterogéneo es el platino finamente dividido que cataliza la reacción de monóxido de carbono con oxígeno para formar dióxido de carbono. Esta reacción se utiliza en catalizadores acoplados a los automóviles para eliminar el monóxido de carbono de los gases de escape.
Existen ciertas sustancias llamadas promotoras, que no tienen capacidad catalítica en sí, pero aumentan la eficacia de los catalizadores. Por ejemplo, al añadir alúmina a hierro finamente dividido, ésta aumenta la capacidad del hierro para catalizar la obtención de amoníaco a partir de una mezcla de nitrógeno e hidrógeno. Por otra parte, los materiales que reducen la eficacia de un catalizador se denominan venenos. Los compuestos de plomo reducen la capacidad del platino para actuar como catalizador; por tanto, un automóvil equipado con un catalizador para controlar la emisión de gases necesita gasolina sin plomo. Actualmente los catalizadores son muy importantes en el mundo industrial. Un área importante en la investigación actual es la catálisis de enzimas. Las enzimas naturales se han utilizado durante mucho tiempo en las industrias, pero en la actualidad sólo se dispone de menos de 20 enzimas en cantidades industriales. Los biotecnólogos buscan formas de ampliar estos recursos y de desarrollar enzimas semisintéticas para tareas muy específicas.
1. P.W. Atkins, "Química General", Omega, Barcelona, lª Edición l.992, 980 páginas, traducido de la lª edición inglesa por J.M. Marco, J. Ayala, L. Borrell, F.I. Talens, C. Mans, ISBN 84-282-0892-1.
2. K.W. Whitten, K.D. Gailey, R.E. Davis, "Química General", McGraw-Hill, México, 3ª Edición, l.992, 884 páginas, traducido de la 3ª Edición en lengua inglesa por M.T. Aguilar Ortega, ISBN 968-422-985-2.
3. R.E. Dickerson, H.B. Gray, M.Y. Darensbourg, D.J. Darensbourg, "Principios de Química", Reverté, Barcelona, 3ª Edición, l.989, l.002 páginas, traducido de la 4ª Edición inglesa por J. Gálvez Flores y G. López López, ISBN 84-291-7175-4.
Descargar
| Enviado por: | Alberto Guerra |
| Idioma: | castellano |
| País: | España |
