Industria y Materiales
Elementos de Máquinas
oxidación y corrosión
Índice:
Introducción
Oxidación:
¿Qué es la oxidación?
Velocidad de Oxidación
Protección contra la oxidación
Corrosión
¿Qué es la corrosión?
Reacciones Electroquímicas
Clasificación de los procesos de Corrosión
Protección contra la corrosión
0. Introducción:
Los requisitos que la industria moderna impone sobre útiles, herramientas y componentes mecánicos obligan a realizar un constante esfuerzo en cuatro direcciones: empleo de nuevos materiales, rediseño de los útiles, modificación de los procesos y empleo de tratamientos de superficie avanzados. Esta última solución, cuando es posible, tiene la ventaja de ser la menos traumática para los procedimientos de las empresas.
La superficie de un material es la región más sensible a las agresiones del entorno. En comparación con otras causas de deterioro de un material, los problemas que afectan a la superficie (desgaste, fricción, oxidación, corrosión), requieren un consumo energético mínimo debido a que son sólo los átomos de unas pocas capas superficiales y los enlaces que los unen entre sí los que deben hacer frente a las fuerzas y ataques químicos de entorno. Estas interacciones siempre van a estar presentes y ningún proyecto de ingeniería puede considerarse completo si no se ha previsto cuál va a ser el comportamiento de la superficie.
1.Oxidación:
¿Qué es la oxidación?
En un principio, se utilizaba el término de oxidación para designar aquellos procesos en los que una sustancia reaccionaba con el oxígeno; de esta forma, se decía que un compuesto se oxidaba cuando aumentaba su cantidad de oxígeno (igualmente, se decía que se reducía cuando ésta disminuía).
A partir de este primer concepto de oxidación, y con el tiempo, dicho vocablo ha ido evolucionando y generalizándose hasta abarcar hoy en día una gran cantidad de reacciones en algunas de las cuales ni siquiera interviene el oxígeno. De hecho, en la actualidad entendemos por oxidación el proceso mediante el cual un compuesto pierde electrones.
E inevitablemente, para que un compuesto pierda electrones otro los ha de ganar: así surge estrechamente ligado al concepto de oxidación el de reducción; se entiende por reducción el proceso mediante el cual un compuesto gana electrones. Así pues, cada vez que nos refiramos a la oxidación tendremos que hablar también de la reducción (ya que es el proceso contrario, y sin uno de ellos no existiría el otro).
La capacidad de determinadas compuestos para aceptar y donar electrones hace que puedan participar en las reacciones denominadas de oxidación-reducción. Esta capacidad no la poseen todas los compuestos.
REACCIÓN DE REDUCCIÓN : Hay sustancias que pueden aceptar electrones ; son sustancias oxidadas que en las condiciones adecuadas se pueden reducir, y por lo tanto transformarse en formas reducidas. Veámoslo en el siguiente dibujo :
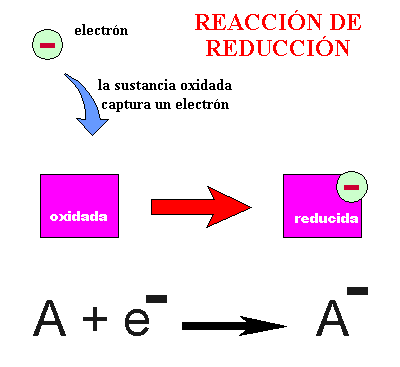
REACCIÓN DE OXIDACIÓN : Hay sustancias que pueden donar electrones ; son sustancias reducidas que en las condiciones adecuadas se pueden oxidar, y por lo tanto transformarse en formas oxidadas. Veámoslo en el siguiente dibujo :
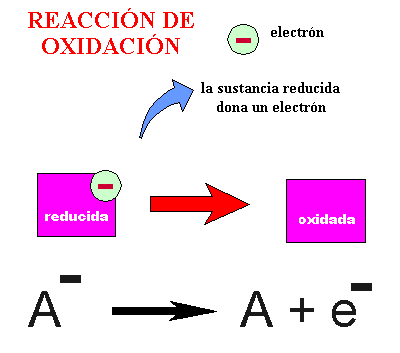
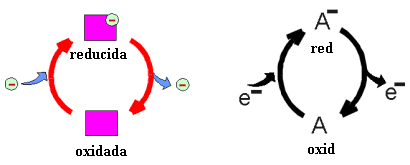
REACCIÓN DE OXIDACIÓN - REDUCCIÓN o REDOX : Las sustancias con capacidad para aceptar y donar electrones tienen dos formas interconvertibles, una de ellas es capaz de aceptar electrones, la otra es capaz de donarlos. Veámoslo en el siguiente gráfico:
Esto frecuentemente se representa así :
El oxidante es el reactivo capaz de provocar un proceso de oxidación por su tendencia a captar electrones. El oxigeno del aire puede ser considerado como el principal oxidante, atendiendo a la importancia de las reacciones en que interviene (metabolismo de los seres vivos, motores de combustión, y el tema que nos centra, su acción sobre metales, como el hierro o aceros, con las importantes perdidas económicas que produce).
De una forma esquemática se puede representar el proceso de oxidación de la siguiente manera:
±
El signo ± que precede a la energía indica que la reacción puede ser exotérmica, si este es + o endotérmica, si es - . Cuando la reacción es exotérmica, es decir, desprende energía, ésta se produce espontáneamente hacia la formación del óxido. En cambio, si ésta es endotérmica puede deducirse que el material será de difícil oxidación. En la tabla siguiente se recogen las energías correspondientes a la oxidación de diferentes metales a una temperatura de 273ºK :
| metal | Óxido | Energía (kJ · mol-1 de O2) | metal | Óxido | Energía (kJ · mol-1 de O2) |
| Berilio | BeO | 1182 | Molibdeno | MoO2 | 534 |
| Magnesio | MgO | 1162 | Wolframio | WO3 | 510 |
| Aluminio | Al2O3 | 1045 | Hierro | Fe3O4 | 508 |
| Zirconio | ZrO2 | 1028 | Estaño | SnO | 500 |
| Uranio | U3O8 | " 1000 | Níquel | NiO | 439 |
| Titanio | TiO | 848 | Cobalto | CoO | 422 |
| Silicio | SiO2 | 836 | Plomo | Pb3O4 | 309 |
| Tántalo | Ta2O5 | 764 | Cobre | CuO | 254 |
| Niobio | Nb2O5 | 757 | Platino | PtO2 | " 160 |
| Cromo | Cr2O5 | 701 | Plata | Ag2O | 5 |
| Zinc | ZnO | 636 | Oro | Au2O3 | -80 |
Se puede apreciar en la tabla, que el oro es el único elemento que tiene un valor de energía negativo, por lo que es el único metal estable y no se oxidará con el oxígeno en estas condiciones. Sin embargo, los demás elementos se oxidan con relativa facilidad, es lo que explica que en la naturaleza la mayor parte se encuentren en la corteza terrestre combinados con el oxígeno formando parte de óxidos, silicatos, aluminatos, etc...
Velocidad de Oxidación:
La oxidación de los materiales usados por la tecnología empeoran considerablemente sus propiedades mecánicas, debido, entre otros factores, a que los óxidos son mucho más frágiles que los metales puros de los que provienen. Es por ello que la vida útil de cualquier equipo industrial depende de forma decisiva de la velocidad a la que transcurra el proceso de oxidación.
Tras la observación de la anterior tabla de energías de oxidación, podríamos deducir que un elemento se oxida tanto más rápidamente cuanto mayor fuese la energía liberada en el proceso. Sin embargo, esto no sucede así en la realidad. Si se consideraran sólo las energías de oxidación, el aluminio se oxidaría a una velocidad aproximadamente el doble que el hierro; sin embargo, ocurre justo lo contrario, pues es el hierro el que se oxida mucho mas rápido que el aluminio. Por lo tanto en la velocidad de oxidación deben de influir otros factores a parte de la mayor o menor energía de oxidación del metal.
Observemos la siguiente tabla:
| metal | tiempo (horas) | T. Fusión (ºK) | metal | tiempo (horas) | T. Fusión (ºK) |
| Au | Infinito | 1336 | Ni | 600 | 1726 |
| Ag | Muy largo | 1234 | Cu | 25 | 1356 |
| Al | Muy largo | 933 | Fe | 24 | 1809 |
| Sn | Muy largo | 505 | Co | 7 | 1765 |
| Si | 2 · 106 | 1683 | Ti | < 6 | 1943 |
| Be | 106 | 1557 | Ba | << 0'5 | 983 |
| Pt | 1'8 · 105 | 2042 | Zr | 0'2 | 2125 |
| Mg | > 105 | 923 | Ta | Muy corto | 3250 |
| Zn | > 104 | 692 | Nb | Muy corto | 2740 |
| Cr | 1600 | 2148 | U | Muy corto | 1405 |
| Na | >1000 | 371 | Mo | Muy corto | 2880 |
| K | > 1000 | 337 | W | Muy corto | 3680 |
Horas transcurridas para que la oxidación en aire alcance una profundidad de 0'1 mm a una temperatura 0'7 · TF
En la anterior tabla se pone de manifiesto como se comentaba antes, que la energía de oxidación no es el factor único que interviene en la velocidad de oxidación. Se puede observar el caso del Aluminio y el Hierro, mirando ambas tablas. En la primera, se observa que la oxidación del Aluminio es más exotérmica que la del Hierro, lo que haría pensar que su velocidad de oxidación es mucho mas alta. Pero en esta segunda tabla sin embargo, se observa que la velocidad de oxidación del Hierro es solo de 24horas en las condiciones expuestas, mientras que la del Aluminio es muy alta.
Cuando un metal se encuentra expuesto a una atmósfera oxidante, su superficie se oxida más o menos rápido, en función de su energía de oxidación. El óxido resultante, en la mayoría de los casos, queda depositado en la superficie del metal, formando una capa que recubre todas las zonas expuestas a la atmósfera oxidante. De este modo, para que la reacción de oxidación continúe se deben de dar al menos uno de estos dos casos, o bien el metal, o bien el oxígeno deben atravesar por difusión esta capa de óxido.
En el caso de ser el metal, lo que se mueven son los cationes metálicos junto a un numero determinado de electrones, en función de su número de oxidación. De esta forma la oxidación se está produciendo en la zona externa de la capa. En este caso el proceso se denomina difusión catiónica.
Puede darse el otro caso, en el cual los electrones atraviesan por difusión la capa de óxido, y tras reducir al oxigeno, los iones O2- atraviesan de nuevo la capa en sentido contrario, produciéndose así la reacción de oxidación del metal. De esta forma la oxidación se está produciendo en la zona interna de la capa de óxido. Este proceso es conocido como difusión aniónica.
En ambos casos la capa de óxido se comporta oponiéndose al movimiento de estos iones, actuando como una capa protectora. El grado de protección de esta capa de óxido depende de múltiples factores, como norma general podemos decir que esta capa tendrá mas capacidad de protección cuanto:
-
Mayor sea la adherencia de la capa de óxido al metal.
-
Menor sea la fragilidad del óxido.
-
Más elevado sea el punto de fusión del óxido
-
Menor sea la conductividad eléctrica del óxido
-
Más se oponga la capa de óxido a la difusión de los iones metálicos y de oxígeno.
Otro factor importante es el volumen de esa capa de óxido en relación al material consumido. Ésta es conocida como la relación Pilling-Bedworth:
Relación P.B. = Vol. Óxido / Vol. Material Consumido
Si dicha relación se aproxima a 1, es decir, los volúmenes son muy similares, la capa puede actuar como protectora, siempre dependiendo de los demás factores anteriormente citados.
En cambio, si ésta relación es menor que 1, el volumen de óxido es menor que el del material consumido, por lo que la capa se agrieta. Éste es el caso por ejemplo de los metales alcalinos.
Si es mayor que 1, el volumen de óxido producido es mayor que el del material, por lo que se produce un fenómeno de compresión que acaba rompiendo la capa. Es el caso del Hierro.
La velocidad a la que tiene lugar la oxidación de un determinado metal no es constante, sino que depende, entre otros factores, de la temperatura y de la presión del oxígeno en la atmósfera oxidante. Cuanto mas altas sean la presión y temperatura, con mas rapidez se dará la reacción, pues con el aumento de temperatura se facilita el movimiento de los iones a través de la capa de oxido, mientras que con el aumento de la presión del oxigeno, se facilita su difusión a través de la capa.
Una forma muy común de medir esta velocidad, es relacionando la ganancia de peso por unidad de área (w) respecto al tiempo. Cuando un metal se oxida, aporta a su composición átomos de oxigeno, sin perder otro tipo de materia, es por ello que la masa se ve afectada, cuanto mas oxidado está el metal, más pesa éste. Estudiando experimentalmente esta relación se ha comprobado que los materiales, a una presión de O2 y temperatura determinadas, se comportan de la siguiente manera:
-
Lineal: en los que la velocidad a la que se produce la ganancia de peso no depende del tiempo. Viene representada por esta expresión:
W = kl · t
Donde W, es la ganancia de peso por unidad de área; t, es el tiempo transcurrido; kl, es una constante, característica de cada material.
Este comportamiento lineal es típico de materiales cuya capa de oxido es porosa, o cuya relación P.B. es muy diferente de 1, es decir en materiales en que la velocidad de oxidación no se ve influida por la presencia de la capa de óxido, ya que éste se agrieta o se desprende.
-
Parabólico: En los materiales en que se presente este comportamiento, la velocidad en que transcurre el proceso es alta al principio, pero conforme avanza el tiempo, va disminuyendo, debido a la protección de la capa de óxido. Se representa de esta forma:
W2 = kp · t
Donde W, es la ganancia de peso por unidad de área; t, es el tiempo transcurrido; kp, es una constante de cada material.
Las constantes kl y kp siguen la ley de Arrhenius, aumentando exponencialmente sus valores, y por tanto, los de la velocidad de oxidación, de forma exponencial.
Kl = Al · e-Ql / R·T ; kp = Ap · e-Qp / R·T
Donde Al, Ap, Ql y Qp son constantes de cada material, que en general también dependen de la presión de oxigeno existente en la atmósfera oxidante. R, es la constante universal de los gases ( 8'31 J · mol-1 · K-1), y T, es la temperatura absoluta, (ºK).
Protección contra la oxidación:
Existen varias formas de protección contra la oxidación de mayor o menor efectividad:
-
Se puede modificar la composición principal de un metal, formando aleaciones. Este es el caso de los aceros inoxidables, que contienen un 18% de cromo y un 8% de níquel; la presencia de cromo da lugar a la formación de una película superficial de cromato que se asienta sobre la superficie metálica.
-
También se podría proteger al metal que nos preocupe sobreponiendo una capa de un metal que no se oxide, como los metales nobles, por ejemplo el oro, que no se oxida espontáneamente al aire; o de un metal que de oxidarse forme una capa de óxido coherente, compacta y que impida que prosiga la corrosión.
-
Una variante de las anteriores propuestas es la de recubrir la pieza cuya corrosión queramos evitar directamente con una capa de óxido, como se suele hacer con el aluminio al aplicarle una capa de eloxal.
-
Otro de los procedimientos que se pueden seguir para evitar la oxidación de un metal es recubrirlo con una capa de polímero, como pinturas anticorrosivas (es frecuente la utilización de minio, Pb3O4, en la protección de aceros), esmaltes, resina artificial o recubrimientos cerámicos que sean impenetrables para la humedad y el oxígeno.
2.Corrosión:
¿Qué es la corrosión?
La corrosión es un fenómeno muy perjudicial para el ser humano, puesto que es capaz de destruir grandes cantidades de productos metálicos inadecuadamente protegidos, lo cual provoca una enorme inversión en maquinaria o bloques de metales oxidables. En Estados Unidos, la corrosión produce anualmente pérdidas superiores a los 10.000 millones de dólares (casi unos 2 billones de pesetas). Además, se ha calculado que aproximadamente una cuarta parte del hierro producido en el mundo se utiliza en compensar las pérdidas producidas por la corrosión.
La corrosión, definida como la destrucción de un metal debida a determinadas influencias químicas, es un fenómeno muy común y molesto que puede ser evitado fácilmente conociendo sus características.
El hecho de que este proceso sea tan frecuente es debido a que los metales afectados reaccionan con el medio ambiente de forma espontánea, produciendo una capa de óxido. Aunque la corrosión en ocasiones también es debida a un proceso de disolución, en el contexto de la oxidación es más apropiado analizar el mecanismo electroquímico que tiene lugar.
Reacciones Electroquímicas:
Para que un metal se oxide es necesario que en dos puntos distantes de su superficie se establezcan dos semi-pilas, en cada una de las cuales se producirá una de las semi-reacciones de oxidación y de reducción (estas zonas del metal actuarán como los dos polos de una pila galvánica); pero éstas no se producirán únicamente con la presencia del metal, pues también es necesaria la intervención de agua y de oxígeno -se ha podido comprobar que el hierro no se oxida en presencia de aire totalmente seco ni de agua sin oxígeno disuelto.
Con el fin de describir con mayor facilidad el proceso (o procesos) que tiene lugar hasta que un metal se oxida, utilizaré a partir de ahora el ejemplo de la oxidación del hierro.
El fenómeno de corrosión producido en un fragmento de hierro dejado a la intemperie se explica mediante un proceso electroquímico en el que se forman pilas galvánicas locales de tamaño microscópico en las que los electrodos son los diferentes granos de la superficie metálica.
En el ánodo el hierro se oxida a su ión ferroso, siguiendo la reacción expuesta a continuación:
Fe ![]()
Fe + 2e
Pero en esta reacción se desprenden electrones, y, a menos que se haga algo para eliminar dichos electrones, la reacción no podrá proseguir de este modo durante mucho tiempo. Dado que el hierro es un buen conductor eléctrico, los electrones sobrantes viajarán a zonas de la superficie del hierro donde puedan facilitar una reacción de reducción.
En el cátodo, con los electrones sobrantes de la reacción del ánodo, se reducirán los iones de hidrógeno según la reacción:
2H + 2e ![]()
2H
Estos átomos de hidrógeno formados reaccionarán con el oxígeno disuelto para formar moléculas de agua:
2H + ![]()
O2 ![]()
H2O
Por otra parte, los iones Fe del ánodo, tras haberse liberado de los electrones, se vuelven a oxidar en presencia de agua para formar óxido férrico hidratado (Fe2O3 . H2O), que será el que forme la herrumbre u orín.
Además de estas reacciones, en el cátodo también puede producirse otro proceso de reducción, al pasar a iones OH el oxígeno disuelto en el agua; mediante la reacción:
O2 + 2H2O + 4e ![]()
4OH
Más tarde, estos iones hidroxilo formarán hidróxido ferroso, el cual se oxidará para dar, de nuevo, óxido férrico hidratado.
2OH + Fe ![]()
Fe(OH)2
4Fe(OH)2 + O2 ![]()
2Fe2O3 . 4H2O
Tras el análisis de los procesos que hacen posible la “oxidación” del hierro, será más fácil comprender por qué la corrosión de este material se produce en un menor plazo de tiempo si nos encontramos en un medio ácido (puesto que además de haber más iones H , hay menos iones OH ; y esto favorece algunas de las reacciones producidas en el cátodo). También aumenta la velocidad corrosiva si se trata de hierro impuro, de una soldadura o de una pieza que ha sido sometida a tensiones, dado que de esta forma aparecen con más facilidad partes diferenciadas que se comportarán como los dos polos de una pila.
En casos como el del hierro, en los que el óxido formado presenta una superficie porosa, que no sea un material compacto, o que no sea adherente, la corrosión de dicho metal podrá consumir con facilidad la pieza entera. Sin embargo, hay otros elementos metálicos cuyo óxido forma una capa compacta que impide que la corrosión de dicho metal continúe produciéndose.
Clasificación de los procesos de corrosión:
Para su estudio los procesos de corrosión pueden ser clasificados según en el medio que se desarrollan o según su morfología. Una de las clasificaciones podría ser:
1. Clasificación según el medio:
-
Corrosión Química: son aquellos casos en que el metal reacciona con un medio no iónico ( por ejemplo oxidación en aire a alta temperatura, reacción con una solución de yodo en tetracloruro de carbono, etc).
-
Corrosión Electroquímica: considerados desde el punto de vista de la participación de iones metálicos, todos los procesos de corrosión son electroquímicos. Sin embargo, es usual designar corrosión electroquímica a la que implica un transporte simultáneo de electricidad a través de un electrolito. A este grupo pertenecen la corrosión en soluciones salinas y agua de mar, la corrosión atmosférica, en suelos, etc.
-
Corrosión Microbiológica :la corrosión puede acelerarse debido a la presencia de organismos microbianos, ya sea porque estos fabrican especies agresivas o porque actúan como catalizadores de las reacciones. La mayoría de los organismos activos son bacterias que reducen u oxidan compuestos de azufre como parte de su metabolismo.
2. Clasificación según la forma:
Esta clasificación es útil cuando es necesario un estudio de evaluación respecto de los daños producidos por la corrosión:
-
Corrosión Uniforme: es la forma más benigna de la corrosión. El ataque se extiende en forma homogénea sobre toda la superficie metálica, y su penetración media es igual en todos los puntos. Un ataque de este tipo permite calcular fácilmente la vida útil de los materiales expuestos a él.
-
Corrosión en placas: abarca los casos intermedios entre la corrosión uniforme y la corrosión localizada. En este caso la corrosión se extiende más en algunas zonas, pero se presenta mas como un ataque general.
-
Corrosión por picado: este tipo de ataque, así como el intergranular y el fisurante, son las formas mas peligrosas de la corrosión. En estos casos de ataque localizado la cantidad de material afectado no guarda relación con la magnitud de los inconvenientes que puede causar. Durante el picado, el ataque se localiza en puntos aislados de superficies metálicas pasivas, y se propaga al interior del metal, en ocasiones formando túneles microscópicos. En la práctica puede presentarse como perforación de cañerías o tanques. Una variación de la corrosión por picado es la denominada corrosión en rendijas ( “crevice corrosión”). Se presenta en uniones, intersticios, donde la renovación del medio corrosivo solo puede producirse por difusión.
-
Corrosión intergranular: se presenta como una franja estrecha de ataque que se propaga a lo largo de los límites de grano. Este ataque se extiende hasta inutilizar el material afectado.
-
Corrosión fisurante: conocida también como corrosión bajo tensión. Puede presentarse cuando un metal esta sometido simultáneamente a la acción de un medio corrosivo y a tensiones mecánicas de tracción. Se forman fisuras que pueden ser transgranulares o intergranulares y que se propagan hacia el interior del metal, hasta que las tensiones se relajan o el metal se fractura. La velocidad de propagación puede oscilar entre 1 y 10 mm./h.
Protección contra la Corrosión
Hemos descrito el mecanismo de corrosión electroquímico que se produce siempre, excepto en la oxidación a elevadas temperaturas que es un caso poco frecuente que no vamos a tratar. Por lo tanto, para luchar contra la corrosión debemos eliminar, o separar de los otros dos, uno de los tres elementos citados: ánodo, cátodo y electrolito. Si distinguimos entre corrosión atmosférica y corrosión de estructuras enterradas y sumergidas podemos también distinguir los métodos de protección.
En el caso de metales situados en una atmósfera agresiva, el electrolito es la zona húmeda cercana al metal, que no podemos modificar excepto en ciertos casos mediante inhibidores en fase vapor. No podemos tampoco emplear la protección catódica clásica. Nos queda pues tan solo el diseño y selección de metales y el empleo de recubrimientos protectores que separen el electrolito de los ánodos y cátodos y en algunos casos tengan además un carácter activo como el galvanizado. Cuando se trata de estructuras enterradas, además de lo anterior podemos aplicar la protección catódica y raramente modificar el electrolito. Finalmente, en estructuras sumergidas podemos actuar como en estructuras enterradas y, en muchos casos, modificar el electrolito. Por ejemplo, en el tratamiento químico del agua de una caldera.
Podemos subdividir los métodos a emplear como sigue.
Métodos de diseño.
Al proyectar cualquier estructura metálica deberán seleccionarse ante todo los materiales a emplear, teniendo la precaución, en el caso de trabajar con materiales con potenciales electroquímicos distintos, de aislarlos eléctricamente. Asimismo el diseño debe evitar las situaciones que propicien pilas de corrosión.
Recubrimientos protectores.
Entendemos como recubrimiento protector aquel que intenta evitar el contacto entre el electrólito y el metal.
Este recubrimiento puede ser metálico por inmersión, proyección, electrodeposición o deposición química; buscando recubrir el metal base con otro inatacable en el medio en cuestión, o que forma con él productos de corrosión pasivantes.
Otro método consiste en variar la composición de la superficie metálica con un anodizado, fosfatado, cromatado, pavonado, aplicación de un estabilizador de óxido, etc.
Asimismo pueden utilizarse recubrimientos inorgánicos como vitrificados, silicatos de zinc, cemento, o bien recubrimientos orgánicos aplicados en frío o en caliente, siendo estos últimos los más empleados en estructuras enterradas.
Los recubrimientos orgánicos deberían reunir las condiciones siguientes para constituir una solución idónea:
a) Perfecta adherencia a la superficie metálica, tanto en el momento de la aplicación como durante toda la vida de la instalación.
b) Ser compactos y no porosos.
c) Poder dieléctrico elevado.
d) No absorber humedad.
e) Dureza para evitar su rotura (lo que ocasiona que quede la superficie metálica al descubierto).
f) Elasticidad para absorber las dilataciones del metal base, sin fisurarse.
g) Inalterabilidad frente a los agentes químicos.
h) Inerte ante hongos y bacterias.
Métodos electroquímicos.
Pueden citarse: protección anódica, protección catódica y canalización de corriente vagabundas.
De ellos, la protección catódica es el método mas extendido y tiene un gran campo de aplicación en los metales enterrados o sumergidos y en los recipientes que contienen líquidos.
La protección catódica es, quizás, el método mas importante para conseguir el control de la corrosión, en los casos en que su aplicación es posible.
Mediante una corriente eléctrica aplicada exteriormente, desde unos ánodos situados en el mismo electrlito que la estructura, la corrosión se reduce virtualmente a cero y se puede mantener una superficie metálica en un medio corrosivo, sin sufrir deterioro durante un tiempo indefinido.
Por ello, el metal a proteger debe alcanzar un determinado potencial respecto a un electrodo de referencia, denominado Potencial de Protección.
Su campo clásico de aplicación es en protección externa de estructuras metálicas sumergidas o enterradas, y en protección interna de depósitos y grandes tubos que contengan agua.
TIPOS DE CORROSIÓN :

Anexo pág.12
15
MATERIAL
O2
ÓXIDO DEL MATERIAL
ENERGIA
metal
metal
metal
Descargar
| Enviado por: | El remitente no desea revelar su nombre |
| Idioma: | castellano |
| País: | España |
