Salud
Cáncer
La pluralidad de agentes causantes de cáncer, las múltiples manifestaciones que la enfermedad puede presentar y el fatal desenlace al que conduce en un proporcionalmente elevado número de casos, constituyen los tres rasgos definitorios de este proceso patológico; cuyas estadísticas ponen de manifiesto grandes variaciones para las diversas zonas geográficas en cuanto a incidencia se refiere.
El cáncer no corresponde a una sola enfermedad, sino a un grupo de procesos de degeneración de células que se puede producir a partir de cualquier tejido del organismo. El mecanismo a través del cual una célula normal se transforma en cancerosa se llama carcinogénesis. Si las células sanas se convierten en cancerosas, comienzan a crecer de forma incontrolada, se infiltran en los tejidos adyacentes mediante los vasos linfáticos y sanguíneos, y los destruyen. La rama de la medicina dedicada al estudio de todo lo relacionado con el cáncer es la oncología (del griego, onkos, masa, tumor).
Por acción de (los agentes cancerígenos, la célula normal sufre alteraciones diversas que modifican su ADN, lo que determina una transformación de su mensaje genético.
Como consecuencia, la célula cambia de forma y de tamaño, el núcleo se hace más grande y, en algunos casos, puede observarse que existen varios en una célula. Las divisiones celulares se realizan a un ritmo desordenado y mucho más rápido que el normal; las cromátidas no se separan y el número de cromosomas puede alterarse por la aparición de un cromosoma más o por la ausencia de uno de ellos.
Todas las alteraciones sufridas por las células normales hacen que éstas se transformen en cancerosas y originen un tumor maligno.
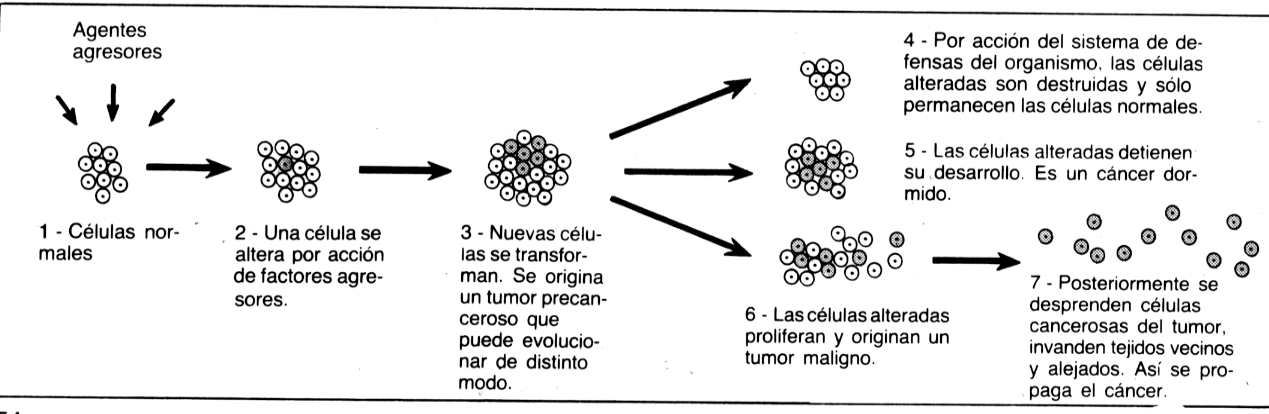
Características generales. Las células alteradas unidas entre sí constituyen una formación tumoral a la que se denomina neoplasia. Con frecuencia aparecen focos morbosos en áreas corporales no contiguas al núcleo primitivo. Se trata de las llamadas metástasis. Desde la formación de la primera célula cancerosa hasta el desarrollo de metástasis, la evolución del cuadro clínico es generalmente lenta y puede durar años. A este respecto es necesario diferenciar los tumores malignos. En este tipo de formaciones neoplásicas las células tumorales observadas al microscopio electrónico muestran cierta diferenciación (estructura y función especializadas en cada una de ellas), y presentan afinidades con las células del tejido del cual han degenerado. Pero, conforme avanza el proceso, las alteraciones se acentúan y la forma y la fisiología se distinguen progresivamente de las del tejido madre. Incluso los cromosomas de estas células al dividirse muestran anormalidades. Los tumores que no presentan tendencia a la proliferación y que pueden aislarse se denominan, por contraste con los anteriores, benignos.
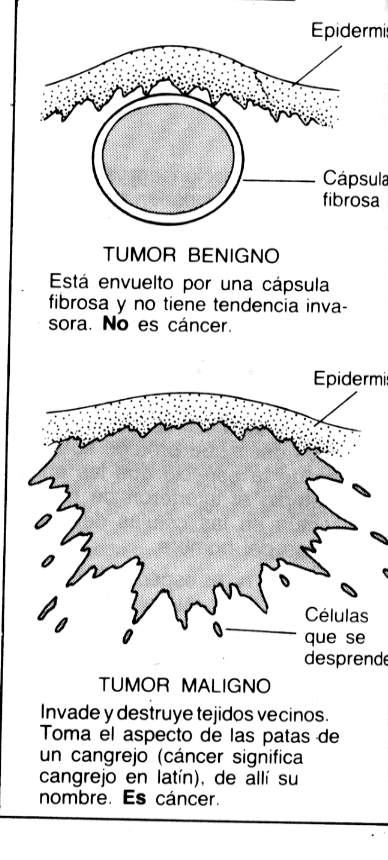
Los tumores benignos se distinguen por la presencia de una cápsula de tejido de sostén que rodea el tumor. Por el contrario, en los malignos no existe esta formación o, en último término, es incompleta. Además, en los benignos la masa de células es ordenada y sus componentes se parecen a los del tejido original, cosa que no sucede en las fases avanzadas de las neoplasias malignas.
Causas carcinógenas. Los mecanismos exactos del desarrollo de las enfermedades cancerosas son aún desconocidos, pero sí se dispone de información sobre agentes a los que se denomina carcinógenos. El conocimiento de estos agentes brinda la posibilidad de evitar su acción y así prevenir el mal en la medida de lo posible. La distribución geográfica de ciertos tipos de cáncer es diferente, debido a la presencia de distintos factores carcinógenos en el medio, según los países. Los principales desencadenantes del proceso canceroso son los factores de origen genético, los ambientales, los agentes químicos, los físicos y los virus y hormonas.
-
Origen genético. No se ha confirmado el carácter hereditario de ninguna forma de cáncer, aunque sí se ha observado la predisposición existente en ciertas familias para desarrollar determinadas manifestaciones tumorales. Así, hay familias en las que se registra una pronunciada tendencia a padecer cáncer de colon, lo que ha determinado la definición de un cuadro clínico específico llamado poliposis colónica familiar. Asimismo, el retinoblastinoma, que afecta a la retina, la más interna de las membranas oculares, se origina por transmisión de un gen dominante (unidad funcional, de la que dependen los caracteres hereditaria).
-
Factores ambientales. El entorno en que un ser vive puede provocar diferentes tipos de cáncer, debido a la presencia de los distintos agentes carcinógenos y a los que favorecen la acción de éstos sin serlo (cocarcinogénicos). Son agentes carcinógenos importantes la radiación solar, que da lugar al desarrollo de cáncer de piel; la contaminación atmosférica que, producida por combustión incompleta de hidrocarburos, origina predominantemente cáncer de pulmón, y la radiactividad e industrial.
-
Agentes químicos. Numerosos productos químicos inducen el desarrollo tumoral. Así, por ejemplo, un elevado porcentaje de los casos de cáncer de pulmón y laringe es consecuencia de consumo de tabaco. La aflatoxina, producida por el hongo Aspergillus flavus, da lugar a cáncer de hígado, lo mismo que el cloruro de vinilo y ciertos tintes azoicos. Otras sustancias cancerígenas son algunas derivados del petróleo, en especial el alquitrán y también colorantes, aditivos, etc.
-
Agentes físicos. Entre los fenómenos físicos que intervienen en la carcinogénesis destacan, por su confirmada incidencia, las radiaciones ionizantes (rayos x, beta, gamma, alfa) y ultravioletas. Asimismo pueden producir ìrritaciones las radiaclones de las sustancias radioactivas.
Su acción se debe a la liberación de energía, que altera la estructura celular al atravesar los tejidos provocando la aparición de cáncer y mutaciones celulares. También los traumatismos repetidos en una misma zona del organismo intervienen en la carcinogénesis.
-
Virus y hormonas. El avance de las técnicas de investigación biomédica ha permitido descubrir estrecha relación existente entre ciertos virus y a algunos tipos de cáncer en toda clase de animales.
Los virus de la familia herpes, por ejemplo, se encuentran vinculados al desarrollo de leucemias crónicas, procesos cancerosos que afectan a las células sanguíneas. Por otra parte, el hepatocarcinoma (cáncer de hígado) está muy relacionado con el virus B de la hepatitis, y virus tales como el de tumor mamario de ratón se asocian con el cáncer de mama humano. Además de la acción agresiva de los virus, las células pueden sufrir la influencia de otros factores que causan profundas modificaciones en su normal desarrollo y las transforman en células cancerosas.
-
Mecánicas: como las producidas por el roce continuo de una prótesis dental contra la encía o de la pipa sobre el labio.
-
Térmicas: originadas, por ejemplo, por, la acción de los alimentos demasiado calientes al pasar por el esófago.
Propagación. La invasión cancerígena se produce según dos vías principales. En la primera, el proceso se extiende a los tejidos contiguos, por lo que su evolución depende en gran parte de la naturaleza del aglomerado celular. Los tejidos blandos (adiposos, epìteliales, paredes de venas, etc.) no oponen resistencia; otros, sin embargo, son barreras infranqueables para el tumor. Se cuentan entre ellos aquellos tejidos en los que la densidad de las fibras es lo suficientemente elevada para frenar la proliferación de células anómalas.
La segunda vía invasiva la constituyen las metástasis. Se trata de formaciones tumorales que aparecen en zonas del organismo distintas de la primaria y cuyas principales conducciones son los vasos linfáticos y sanguíneos. Un elevado número de metástasis indica una enfermedad avanzada de difícil tratamiento. No todos los órganos alojan metástasis. El corazón y las arterias, por ejemplo no las presentan nunca. En cambio, otros, como el cerebro, el pulmón, la sangre o el hígado mantienen un elevado riesgo metastático.
El cáncer se desarrolla en el organismo de un modo semejante a las infecciones, es decir, por etapas.
En un comienzo se presenta como una enfermedad local caracterizada por la proliferación anormal de células de un lugar determinado del organismo, que da lugar a la formación del tumor maligno.
Después de un período de duración variable, las células cancerosas se desprenden del sitio inicial y siguen la vía linfática hasta llegar a los ganglios, que aumentan su tamaño y consistencia. Es la etapa ganglionar.
Luego de un tiempo de detención en esa etapa, las células cancerosas emigran por medio de los vasos sanguíneos y linfáticos hacia diversos órganos en los que se desarrollan tumores secundarios. Se forman de este modo colonias independientes: es la metástasis.
Las células cancerosas que originan esos tumores conservan los caracteres del órgano en el que se originaron, por eso en un cáncer óseo producido por células cancerosas de tiroides, éstas continúan secretando la hormona correspondiente a esa glándula.
A partir de la metástasis, las células cancerosas invaden todos los órganos hasta llegar a la etapa de la generalización, que abarca todo el organismo.
Las figuras precedentes representan la evolución del cáncer en el organismo humano.
Tipos de cáncer. Existen múltiples tipos de cáncer y en cada tejido se pueden originar distintas clases de manifestaciones oncológicas. Por ello se considera que la clasificación más significativa de los procesos tumorales ha de establecerse en función del tejido del que procedan.
Los carcinomas proceden de tejido epitelial, y suelen ser de dos tipos: escamoso y adenocarcinoma. A esta categoría pertenecen, entre otros, el cáncer de pulmón y el de mama, dos de los más frecuentes. Los sarcomas se forman a partir del tejido conjuntivo, también llamado de sostén. Pueden desarrollarse tumores con mezcla de elementos de sarcoma y carcinoma denominados carcinsarcomas. Los hemangioondeteliomas y 1os linfagiosarcomas proceden de los vasos sanguíneos linfáticos, respectivamente. A partir del tejido nervioso se forman los gliomas, y del tejido hematopoyético, es decir, que produce formación de sangre, se derivan las leucemias, los linfomas y mielomas. A partir de otros tejidos, como las células pigmentadas de la piel, también se pueden originar tumores cancerosos.
La presencia de elementos extraños, llamados antígenos, que penetren en el organismo o se formen en él desencadena una reacción que consiste en la elaboración de sustancias de defensa o anticuerpos.
Se supone que las células cancerosas se comportan cómo cuerpos extraños dentro del organismo que las posee y adquieren por eso las características de un antígeno que puede ser 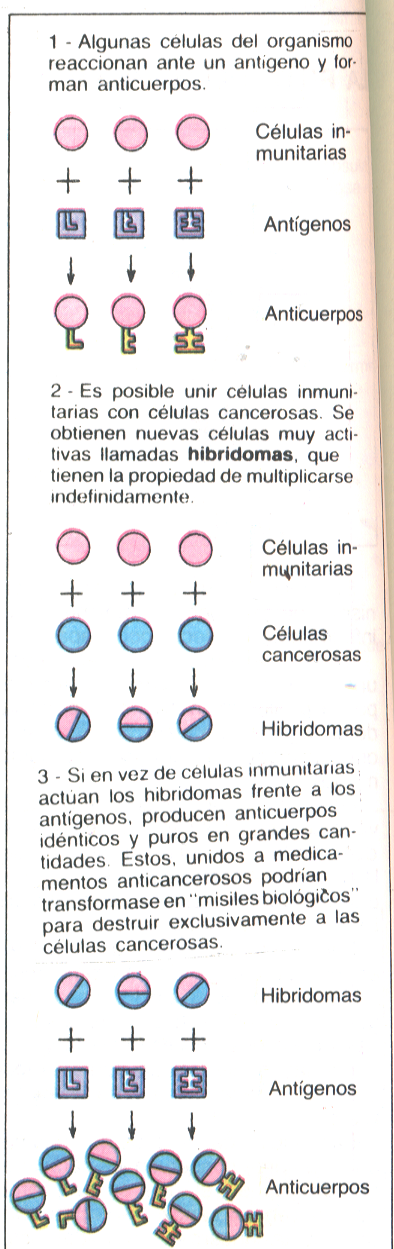
destruído por anticuerpos.
Según esta hipótesis, el sistema inmunológico vence al cáncer en sus primeros momentos, antes de ser detectado.
Sin embargo, no siempre ocurre así. Si, por ejemplo, las modificaciones de la célula cancerosa no son demasiado importantes como para convertirla en un cuerpo extraño, las defensas del organismo no actúan y sólo lo hacen cuando el aumento de las células cancerosas es demasiado grande como para ser controlado y destruido.
Según ésta y otras hipótesis similares, si el cáncer es descubierto por el propio paciente o por el médico significa que el sistema inmunológico ha fallado.
De allí la importancia de adelantarse a esa posibilidad visitando al médico periódicamente, en especial ante al aparición de determinados signos llamados de peligro. Ellos son:
Heridas que no cicatrizan ya sea en la piel, los labios o la boca.
Durezas en algún lugar del cuerpo, especialmente en las mamas.
Verrugas o lunares que cambian de aspecto, forma ,o tamaño.
Hemorragias anormales por cualquier orificio natural.
Dificultad para tragar y digestiones difíciles.
Tos o ronquera persistentes.
Cambios en las evacuaciones intestinales.
A estos siete signos se agregan la pérdida de apetito y el adelgazamiento sin causa aparente.
Las acciones que se realizan para la prevención del cáncer son muy diversas y corresponden a distintos niveles:
-
Acciones de promoción: están destinadas a informar a la población para lograr conductas sanitarias positivas. Ej: informar acerca de los factores que pueden actuar como agentes cancerígenos.
-
Acciones de prevención primaria: son realizadas por las personas sanas para evitar enfermedades. Tienden a la eliminación de un posible agente carcinógeno (como la supresión del hábito de fumar), Ej: no exponerse al sol entre las 10 y las 16 para evitar el cáncer de piel y otras posibles consecuencias.
-
Acciones de prevención secundaria: tratan de descubrir la enfermedad en personas aparentemente sanas a través del dignóstico precoz para tratarlas de inmediato y lograr la curación en caso de estar enfermas. Ej.: biopsia o sea la extracción y examen microscópico de tejido sospechoso procedente de cualquier órgano.
Termografía: o medición del calor irradiado por la superficie del cuerpo a partir de las distintas cantidades de calor emitidas por los tejidos normales y patológicos.
-
Acciones de prevención terciaria: son aplicadas a las personas enfermas para tratarlas adecuadamente y evitar complicaciones y secuelas. Ej: tratamiento quirúrgico en el que extirpa el tumor maligno y los tejidos adyacentes. Entre las numerosas operaciones y técnicas que se encuadran en este ámbito puede destacarse por su especificidad la autoexploración de mama, junto a otras medidas de aplicación terapéutica general como la observación preventiva por parte del médico cuando explora al paciente por otras afecciones o la realización de exámenes periódicos.
Tratamiento. La multiplicidad de formas cancerosas hace, que como norma general el principal objetivo terapéutico sea la prevención del estado patológico. En caso de que ya se haya manifestado la enfermedad, el diagnóstico precoz es la mejor garantía para un tratamiento adecuado. Modernamente, se dispone de procedimientos cada vez más perfeccionados para establecer el diagnóstico con la mayor brevedad posible. Algunas de las más difundidas son la técnica de Papanicolau, para el cáncer de cuello de útero; la mamografía, para detectar cáncer de mama, y la termografía, que registra las variaciones de temperatura en el cuerpo, que pueden ser indicativas de la presencia de un tumor. También el empleo de recursos tecnológicos más generales resulta útil para localizar las neoplasias. Los rayos x, por ejemplo, se emplean con profusión en la detección de cáncer de pulmón.
Los medios terapéuticos contra el cáncer se centran en tres áreas: la cirugía, la radioterapia y la quìmioterapia.
-
La cirugía es eficaz con el condicionamiento de que se consigan extirpar todas las células cancerosas. Se suele recurrir a la solución quirúrgica si el tumor está muy localizado y no se ha producido metástasis. Sin embargo, la intervención resulta difícil y de alto riesgo cuando el órgano afectado es vital.
-
La radioterapia trata de eliminar las células cancerosas que forman el tumor mediante la reducción de su capacidad de división y proliferación por irradiación con rayos x o con las radiaciones emitidas por isótopos radiactivos. A este respecto cabe citar por su interés en el tratamiento de diferentes procesos cancerosos la denominada bomba de cobalto. Se trata de un dispositivo de irradiación compuesto por una carga de cobalto radiactivo situada en el interior de un bloque de plomo y con una abertura que permite concentrar la radiación sobre el tumor.
-
Los métodos quimioterapéuticos se basan en el uso de sustancias químicas que bloquean la actividad reproductora celular (fármacos citostáticos). Los principios empleados, tanto naturales como de síntesis, ofrecen una gran variabilidad, dado que suelen ser específicos en cada caso. Así, por ejemplo, la actinomicina D ofrece resultados satisfactorios contra una forma de cáncer de riñón conocida como tumor de Wilms y el metotrexato ataca el corioepitelioma femenino, uno de los tipos de cáncer de las mucosas cutáneas. En general, los quimioterápicos se administran cuando la cirugía resulta ineficaz o de riesgo excesivo.
Los medios de observación constituyen un elemento preponderante en el diagnóstico precoz del cáncer. En la imagen, instalación de tomografía axial computadorizada, en la que se obtienen radiografías seriadas por planos paralelos.
El desarrollo de perfeccionadas técnicas diagnósticas y la instauración de múltiples pautas terapéuticas ha favorecido la estabilización y, en algunos casos, la remisión de diversas formas de cáncer. En la lucha contra la enfermedad desempeñan también un trascendental papel las ramas de la medicina que se orientan hacia las investigaciones inmunológicas y hacia la manipulación de los códigos genéticos de las células cancerígenas.
DANIEL W. NIXON
CRITERIOS PARA EL DIAGNÓSTICO
El diagnóstico de melanoma se basa en el examen histológico de la lesión cutánea sospechosa de malignidad.
MANIFESTACIONES CLÍNICAS
SUBJETIVAS
Por lo general, los melanomas primitivos de la piel incipientes son indoloros. Cuando las lesiones están más avanzadas, ulceradas y/o sobreinfectadas, el paciente puede experimentar algunas molestias. La enfermedad metastásica produce síntomas que dependen del órgano afectado.
OBJETIVAS
La señal de peligro mencionada por la American Cancer Society -cualquier modificación de un lunar o verruga- se aplica especialmente al melanoma. Es imposible afirmar con certeza que una lesión sospechosa no es un melanoma si no se efectúa la biopsia. Los cambios sospechosos se refieren a aumento de tamaño de la lesión, sangramiento y cambio de color.
Los subtipos patológicos de melanoma son variables en cuanto a su aspecto clínico. El melanoma lentigo maligno es generalmente una lesión grande y aplanada con bordes irregulares; puede haber cierto grado de nodularidad dentro de la lesión. Con frecuencia la lesión afecta a la cara, en pacientes ancianos. La variedad más común es el melanoma de extensión superficial. Puede ser muy grande (más de 2 a 3 en de diámetro) y afecta sobre todo a pacientes de edad mediana. El melanoma nodular invade en profundidad en lugar de hacerlo en forma radial y por lo común es negro azulado.
Él melanoma puede tener origen en otros órganos, aparte de la piel. El cáncer ocular más común es el melanoma. La enfermedad puede asemejarse a un carcinoma primario de la mama y comenzar en el cerebro, el aparato genitourinario o el sistema gastrointestinal.
El melanoma puede hacer metástasis extensas y producir hepatomegalia, adenopatía, lesiones distantes de la piel, alteraciones neurológicas y otras manifestaciones clínicas, según el órgano afectado.
PLANES
DIAGNÓSTICO
Una vez efectuado el diagnóstico histológico de un melanoma maligno primario es necesario un estudio completo de las metástasis. Para ello se harán centellograma óseo y de hígado (o tomografía axial computada del abdomen), tomografía axial computada de cerebro, análisis de sangre y radiografía de tórax.
TERAPÉUTICO
Se programará la terapéutica de acuerdo con el estadio clínico y patológico de la enfermedad. El estado clínico 1 es localizado sin adenopatía regional; el estadio 2 tiene adenomegalia de ganglios regionales o metástasis "in transit"; y el estadio 3 tiene metástasis a la distancia.
Resultan útiles los niveles patológicos de Clark tanto para el pronóstico como para la terapéutica, lo mismo que las medidas de la profundidad real de invasión del tumor (cuadro 32-1).
El melanoma localizado (estadio 1) se trata quirúrgicamente con escisión local amplia. El médico que cauteriza o congela un "lunar negro" no hace más que causar un desastre. Aun cuando el procedimiento es aún tema de controversias, en muchos centros se tratan las lesiones más profundas mediante disección de ganglios regionales después de la amplia escisión local. La extirpación de los ganglios regionales es el procedimiento de rutina cuando están afectados clínicamente (estadio 2). El tratamiento del melanoma metastásico es no quirúrgico, aun cuando algunos pacientes obtienen beneficios con la extirpación quirúrgica de lesiones metastásicas solitarias que aparecen después de un prolongado intervalo sin patología.
La mayoría de los melanomas son radiorresistentes, pero es posible por medio de la radioterapia obtener un efecto paliativo de metástasis sintomáticas en cerebro, huesos o tejidos blandos.
No está comprobada la eficacia de la quimioterapia como coadyuvante de la cirugía. En la enfermedad avanzada las respuestas a la quimioterapia son del 20 al 30 % o menos; la duración de las respuestas es breve. La droga más eficaz es la imidazol carboxamida (DTIC-Dome) que produce respuestas parciales en un 25 %, aproximadamente, de los casos. Los planes de quimioterapia combinada no mejoraron apreciablemente esta cifra.
Los programas de inmunoterapia local y sistémica, en el melanoma avanzado, en los que se utiliza BCG, Corynebacterfum paroum, levamisol, factor de transferencia, y muchos otros agentes resultaron, en general, poco satisfactorios. Se ven algunas respuestas ocasionales en la patología de los tejidos blandos, pero son muy raras las respuestas viscerales. Se hallan en curso ensayos de inmunoterapia coadyuvante.
EDUCACIONAL
La pronta detección y extirpación quirúrgica permiten la curación de un número apreciable de pacientes con melanoma maligno. A la inversa, la demora del diagn6stico casi siempre resulta fatal. En consecuencia, es importante insistir en que debe comunicarse cualquier cambio de una lesión de la piel o la aparición de una nueva lesión cutánea. Esto es importante sobre todo en pacientes que se han curado de un melanoma anterior y/o que se encuentran dentro de la población susceptible, de cabellos y tez claros. En este grupo es importante evitar la excesiva exposición al sol con el empleo de filtros para los rayos solares.
En la actualidad, el melanoma metastásico es incurable. El paciente y su familia deberán comprender que la terapéutica enérgica puede producir la regresión de la patología, pero que es improbable la supervivencia a largo término.
SEGUIMIENTO
Se verá a los pacientes que fueron sometidos a cirugía potencialmente curativa, cada tres meses durante uno a dos años, y cada seis meses después hasta un total de cinco años. En cada visita se examinará perfectamente al paciente tratando de descubrir nuevas lesiones sospechosas de 1a piel, 1o mismo que adenopatía regional, metástasis "in transit" y hepatomegalia. En cada visita se harán radiografías de tórax y laboratorio investigando con prontitud cualquier anomalía observada.
COMENTARIO
INFORMACIÓN FUNDAMENTAL Y DE LAS CIENCIAS BÁSICAS
Aun cuando la incidencia aumenta con la mayor exposición al sol en poblaciones susceptibles, no se conoce una relación de causa a efecto exacta. La frecuencia de la enfermedad en la superficie
plantar en ciertas poblaciones africanas que acostumbran a caminar descalzas, sugiere que podría intervenir en su etiología algún factor traumático crónico. También se ha sugerido una relación hormonal por la observación de receptores intracelulares de estrógeno y progesterona en muchos melanomas además, el embarazo podría estimular su crecimiento. No obstante, en general el pronóstico es más desfavorable en los hombres.
El melanoma tiene su origen en el melanocito, tipo celular permanente que se produce en la capa germinativa de la piel. También se encuentran melanomas en las meninges, el ojo, y en otros sitios.
El comportamiento clínico del melanoma es muy variable. Los melanomas oculares pueden permanecer más o menos dormidos durante periodos prolongados. También se han observado intervalos muy prolongados entre la extirpación de la lesión primaria y la aparición de metástasis.
En el cuadro 32-1 se da una lista de la sobrevida aproximada en las lesiones localizadas de la piel. En el melanoma más avanzado la sobrevida es mucho más corta. La supervivencia de dos años en pacientes con metástasis a la distancia es de alrededor del 5 %. Es aun mas sorprendente la sobrevida media de 4 a 5 meses después de iniciada la quimioterapia sistémica, en la mayoría de los pacientes con enfermedad avanzada.
PREVENCION Se aconseja evitar la excesiva exposición a los rayos solares. Las mujeres con antecedentes de melanoma deberán saber que el embarazo muestra tendencia a exacerbar la enfermedad.
DANIEL W. NIXON ·
CRiTERIOS PARA EL DIAGNGSTICO
El diagnóstico de sarcoma se basa en la confirmación histológica en una masa de tejido blando o de hueso.
MANIFESTACIONES CLÍNICAS
Los numerosos sarcomas diferentes que se originan en el hueso y en los tejidos blandos muestran una amplia escala de malignidad y diferentes manifestaciones clínicas.
SUBJETIVAS
A menudo, los sarcomas de hueso y de tejidos blandos son indoloros. Cuando hay dolor, éste puede ser fugaz y sordo. El dolor persistente en las extremidades por la noche en los niños sugiere una enfermedad ósea maligna. A veces, la fiebre, la anorexia y la pérdida ponderal acompañan al sarcoma de Ewing incipiente y al osteosarcoma.
OBJETIVAS
El hallazgo inicial más frecuente es una masa superficial o profunda, en la parte afectada. Por lo general el examen físico es normal, excepto por la lesión; son raros los ganglios regionales hipertrofiados. En los sarcomas de hueso se producen fracturas patológicas.
DÍAGNÓSTICO
Las radiografías y las tomografías axiales computadas del área afectada contribuyen a determinar el grado de extensión local y la posibilidad de resecabilidad; las arteriografías muestran la vascularización. Como algunas lesiones que, en un principio, parecen tumores de hueso primarios son en realidad metastásicos, es conveniente en el estudio inicial el estudio axial del esqueleto para explorar en numerosos sitios, siempre que se pueda efectuar rápidamente. En el sarcoma óseo primitivo se producen elevaciones triangulares del periostio a partir del tumor en expansión (triángulos de Codman).
Es necesario el examen histológico para confirmar el diagnóstico. La incisión inicial será limitada para evitar el excesivo "arrastre" del tumor junto con la biopsia, lo que haría más difícil la cirugía radical más adelante. El diagnóstico histológico debe ir seguido por un completo estudio de las metástasis. En éste se incluyen centellogramas óseo y hepático, análisis de sangre y tomografías de pulmón (o tomografía axial computada). Una tomografía axial computada del abdomen ayudará a descubrir metástasis intraabdominales.
PLANES
TERAPÉUTICO
El reciente interés por la terapéutica combinada lugar de la cirugía solamente, ha comenzado a cambiar la perspectiva antes poco favorable para los pacientes con ciertos sarcomas. Los regimenes de tratamiento actuales son muy complejos y deben ser efectuados por oncólogos expertos, o por el médico bajo la dirección de aquéllos. En el sarcoma de Ewing la radioterapia en dosis elevadas consigue eliminar la mayoría de las lesiones primarias. Es necesario utilizar una técnica cuidadosa para evitar el edema de los miembros, la radionecrosis de los huesos y las costras locales. La quimioterapia a continuación de la irradiación del tumor primitivo da una supervivencia de dos años sin patología, en más del 60 % de los pacientes. Las drogas efectivas incluyen: adriamicina, vincristina, ciclofosfamida y actinomicina D.
Los resultados cón la terapeutica combinada son algo menos favorables en el osteosarcoma, pero parecen haber aumentado los intervalos si recidivas: como la radioterapia no permite controlar en forma segura el osteosarcoma primario, en la actualidad se emplea en casi todos los centros la resección radical seguida por quimioterapia coadyuvante. Se hallani en curso programas de investigación destinados a preservar la función de las extremidades con quimioterapía preoperatoría íntensiva seguida por resección en bloque e injertos de hueso. Las drogas que resultan útiles en el osteosarcoma comprenden el metotrexato en altas dosis con rescate de leucovorina y combinaciones de ciclofosfamida, adriamicina, DTIC, actinomicina D y otras.
No se ha establecido el papel de la quimioterapia coadyuvante en el condrosarcoma, fibrosarcoma y otros sarcomas óseos. Los resultados de la quimioterapia no han sido satisfactorios en el sarcoma óseo metastásico.
En el sarcoma de tejidos blandos el pilar del tratamiento sigue siendo la cirugía radical. Los programas de investigación con cirugía conservadora seguida por radioterapia en altas dosis y regímenes de radioterapia-quimioterapia han permitido un buen control local en algunos casos. Las mismas drogas que se usan en los sarcomas de hueso se utilizan en el sarcoma de tejidos blandos.
EDUCACIONAL
Como muchos de los pacientes con sarcomas óseos son niños, es importante que la familia del mismo comprenda las razones de la terapia intensiva (es decir, el tratamiento destinado a la curación); de manera que puedan contribuir con su apoyo al paciente durante los momentos rigurosos de la terapéutica. La cirugía radical y la radioterapia proporcionan el control local de la enfermedad, mientras que los regímenes con varias drogas atacan a las metástasis ocultas o manifiestas. Cualquiera que sea la edad del paciente, se debe explicar claramente cuáles son los objetivos y los posibles efectos colaterales de la terapéutica.
SEGUIMIENTO
Los sarcomas de hueso y de los tejidos blandos tienden a su propagación al pulmón. Un programa de seguimiento razonable debe incluir radiografías de tórax cada dos o tres meses, después de la terapéutica primaria, durante dos años y luego cada seis meses hasta un total de cinco años. Con cada radiografía de tórax se realizará el examen físico para determinar si hay recidivas locales, regionales o a distancia, y se efectuarán análisis de sangre.
COMENTARIO
INFORMACIÓN FUNDAMENTAL Y DE LAS CIENCIAS BÁSICAS
Se desconoce la causa del sarcoma. La respuesta que se observa a veces en el osteosarcoma con el tratamiento con el factor de transferencia obtenido de contactos que conviven con el paciente, sugiere una influencia ambiental. Se produce osteosarcoma, después de la irradiación por otras enfermedades, en la enfermedad de Paget del hueso, en la osteogénesis imperfecta y, a veces, en parientes de los pacientes con osteosarcoma. En las extremidades linfadematosas crónicas se produce linfangiosarcoma. Se atribuye a los oncornavirus la producción de sarcoma de hueso en animales, y se han encontrado partículas de virus en el sarcoma humano.
HISTORIA NATURAL
Aproximadamente el 5 % de los cánceres son sarcomas. Los sarcomas de hueso y de los tejidos blándos más comunes son el osteosarcoma y el liposarcoma, respectivamente. La prevalencia del sarcóma óseo en edades por debajo de los 25 años confiere a la enfermedad una importancia que va más allá de su incidencia: Los hombres sé ven afectados más comúnmente por osteosarcoma, liposarcoma; fibrosarcoma y sarcoma de Kaposi; todós" ellos, salvó el primero, son enfermedades de las personas adultas de más de 30 años. El sarcoma de Ewing es el cáncer de hueso más común en él primer decenio de la vida, con picos de incidencia antes de los 20 años, mientras que el condrosarcoma afecta con mayor frecuencia a personas de edad mediana. El sarcoma alveolar de las partes blandas y el tumor de células gigantes del hueso se observan más a menudos en las mujeres.
El pronóstico del osteosarcoma varía de acuerdo con los hallazgos histológicos y su localización. Por lo general el osteosarcoma osteoblástico se comporta más agresivamente que los subtipos fibroblástico y condroblástico. El osteosarcoma parostial es menos maligno que la enfermedad intramedular. La sobrevida general de cinco años en el osteosarcoma tratado con cirugía únicamente es del 10 al 12 %.
El liposarcoma, lo mismo que el osteosarcoma, también tiene un comportamiento variable según su aspecto histológico. Los tipos bien diferenciados pueden ser muy indolentes, y a veces es difícil distinguirlos de la grasa normal. Las lesiones no diferenciadas son más malignas. La sobrevida general de cinco años es del 55 %.
PREVENCIÓN
Hasta el momento no existe un método comprobado para la prevención del sarcoma.
Que es el Cáncer?
Hoy se cree que el proceso de aparición de un cáncer se origina con la mutación de algún oncogén que conlleva un aumento de la capacidad proliferativa de una célula. A este evento inicial siguen otras mutaciones en oncogenes que progresivamente aumentan la proliferación celular, y también la mutación de algunos genes supresores que originan el cáncer.
Esto induce una respuesta defensiva, reguladora, de la célula que es la inducción de genes inhibidores del crecimiento, que tiende a bloquear el efecto de la estimulación oncogénica. Si se producen mutaciones que anulan la función de estos genes supresores el proceso carcinogénico progresa, aumentando descontroladamente la proliferación celular y adquiriéndose también mutaciones que llevan a la adquisición de invasividad y angiogénesis y, finalmente, a la capacidad de formar metástasis. Hoy se considera que es la acumulación sucesiva de mutaciones en oncogenes y genes supresores la que conduce a la aparición de cánceres.
A continuación tenemos varios artículos de las diferentes clases de cáncer que pueden ocurrir.
¿Qué es el cáncer de colon?
La palabra cáncer se refiere, no sólo a una enfermedad, sino que engloba alrededor de un centenar de cuadros clínicos distintos. Sin embargo, todos ellos comparten una serie de rasgos que les caracterizan.
Toda enfermedad cancerosa se produce porque algunas células del cuerpo, que se vuelven atípicas, comenzarán a crecer y se multiplicarán de forma rápida y desorganizada, dando como resultado la aparición del llamado tumor maligno o cáncer. Estas células anormales, que en principio aparecerán en un órgano determinado, pueden invadir a través de la sangre o la linfa a otros órganos o tejidos; estas localizaciones secundarias del cáncer reciben el nombre de metástasis.
El colon y el recto conforman el extremo inferior del tracto digestivo. También conocida como el intestino grueso, esta porción absorbe el agua de los alimentos ya digeridos por el estómago y por el intestino delgado, y convierte los sólidos en materia de deshecho hasta su eliminación a través del recto.
Causas.
Factores dietéticos.
Las dietas ricas en grasas animales y escasas en fibras presentan un riesgo elevado de aparición de esta enfermedad.
Pólipos esporádicos en el colon.
Cerca del 33% de los casos de colon afectados por cáncer presentan al menos un pólipo. En 90% de estas formaciones cólicas son benignas y sólo en 10% llegan a desarrollar un cáncer. El riesgo de malignidad depende del tipo, tamaño y número de pólipos existentes.
Síndromes de poliposis intestinal.
Hay enfermedades, como la Poliposis familiar hereditarias, que son claramente premalignas: Es una enfermedad hereditaria que consiste en la formación de múltiples pólipos a partir de la adolescencia y que conlleva un mayor riego de padecer cáncer de colon.
Otras enfermedades caracterizadas por la aparición de pólipos, como la poliposis juvenil, son procesos donde los pólipos se malignizan raramente.
Colitis Ulcerosa.
La aparición de cáncer colorrectal está determinada, más que por la gravedad de la colitis ulcerosa, por la duración: cuando esta patología presenta mas de diez años de evolución tiene un mayor riesgo de malignización.
¿Cómo se clasifica?.
La clasificación por etapas es una clasificación que se realiza tras los estudios adecuados que puedan definir la extensión del cáncer (de las células cancerosas) por la mucosa del colon y por áreas vecinas o a distancia.
·Etapa 0 o carcinoma in situ. Células cancerosas solo en tejidos superficiales del colon.
·Etapa I. Células cancerosas fuera de la capa mas interna del colon a la segunda y tercera capas y complica la pared interior del colon, pero no a la pared exterior del colon (cáncer del colon Dukes A).
·Etapa II. Células cancerosas diseminadas fuera del colon a los tejidos vecinos, pero no a los ganglios linfáticos. (cáncer del colon Dukes B).
·Etapa III. Células cancerosas diseminadas fuera del colon y a los ganglios linfáticos vecinos, pero no a otros órganos (Dukes C).
·Etapa IV. Células cancerosas diseminadas fuera del colon y por otros órganos del cuerpo (Dukes D).
·Recurrente. Cuando vuelven a parecer células una vez recibido tratamiento, pueden aparecer en el colon o a otra parte del cuerpo (hígado, pulmones)
¿Qué síntomas produce?
En general, las señales de alarma que pueden evidenciar un cáncer correctal son: cambios inexplicables en el ritmo intestinal: (estreñimiento-diarrea), sangre en las heces tenesmo (deseo continuo, doloroso e ineficaz de defecar). Eliminación de moco por via anal; anemia, pérdida de peso.
Aún cuando el pólipo sea una lesión benigna y no aparezca síntoma o signo alguno, se pueden producir, a partir de cierto tiempo y en relación con el tamaño y localización, pequeñas pérdidas de sangre. Esta eliminación de sangre aparece siempre que el pólipo es canceroso y tiene carácter intermitente.
Esas pequeñas cantidades no pueden apreciarse a simple vista y se necesitan métodos químicos (test de sangre oculta en heces) para su detección. Si el tumor continúa evolucionando dos, tres o cinco años podrán aparecer síntomas anteriormente expuestos y la eliminación de la sangre será visible macroscópicamente (sin necesidad de realizar el test de sangre oculta en la sangre).
¿Cómo se diagnostica?
La detección precoz es fundamental por ello se deben realizar exploraciones preventivas como el tacto rectal, la rectoscopia, y colonoscopia, sobre todo el las personas que tiene factores de riesgo (pólipos en el colon, colitis ulcerosa) o herencia familiar de cáncer de colon. Se realiza también un análisis de sangre para detectar el antígeno carcinoembrionario (CEA), que se eleva en la sangre en este tipo de cáncer.
El médico generalmente empezará por hacerle un reconocimiento del recto. Durante un examen rectal, el médico usa guantes delgados, introduce en el recto un dedo lubricado y suavemente trata de buscar masas anormales. A continuación, examina el material extraído del recto en busca de cualquier indicio de sangre.
Quizás el médico también desee observar dentro del recto y del colon inferior con un instrumento especial llamado un sigmoidoscopio o un proctosigmoidoscopio. Este reconocimiento, llamado proctoscopia o examen rectal, descubre cerca de la mitad de los cánceres del colon y el recto.
Generalmente, la prueba se hace en el consultorio médico. Se siente una leve presión, pero generalmente no se siente dolor.
Si se encuentra tejido anormal, el médico necesitará extraer un pedazo pequeño y observarlo a través del microscopio para determinar si hay células cancerosas. Este procedimiento se conoce como biopsia. Por lo general la biopsia se hace durante la proctoscopia o colonoscopia, en el consultorio médico.
¿Cuál tratamiento tiene?.
Para el manejo del cáncer de colon existen tres clases de tratamientos disponibles: cirugía, radioterapia y quimioterapia.
- La cirugía se utiliza en todas la etapas de extensión del cáncer de colon, pudiéndose utilizar:
·En tumores cancerosos muy iniciales: se puede realizar mediante el colonoscopio un corte del la zona afectada, que suele ser un pólipo (polipectomía).
·Si el cáncer es mayor se extirpara el cáncer y una parte circundante de tejido sano, luego se conectan las terminaciones resultantes, y se limpian los ganglios de la zona.
·Si la unión se hace dificultosa se realiza una apertura del colon hacia el exterior , lo que se llama colostomía. Esta puede ser transitoria y al mejorar el cuadro volverse a cerrar. Si la colostomía es permanente precisará de una bolsa especial para recoger las heces.
·La radioterapia en el cáncer de colon puede ser interna o externa y se usa sola o con cirugía y/o quimioterapia.
La quimioterapia se realiza a través de un tubo que se deja instalado en la vena mientras una bomba pequeña le proporciona tratamiento continuo por un periodo de semanas, o se realiza en inyecciones periódicas en la cánula instalada. Se suele administrar tras la operación de cirugía.
En el cáncer de colon se puede aplicar un tratamiento biológico con productos naturales o sintetizados para estimular ó restaurar las defensas inmunitarias.
El tratamiento por etapas del cáncer del colon dependerá de la extensión de la enfermedad y del estado general de salud de la persona afectada.
·CÁNCER DEL COLON - ETAPA 0.-
1.Polipéctomia colonoscópica simple con el fin de extraer todo el cáncer.
2. Resección intestinal
·CÁNCER DEL COLON - ETAPA I.
1.Cirugía con resección intestinal para eliminar el cáncer.
·CÁNCER DEL COLON - ETAPA II.
1.Cirugía con resección intestinal para eliminar el cáncer.
2. Estudios clínicos de quimioterapia, radioterapia o terapia biológica después de cirugía.
3. Si el tumor se ha diseminado se añade quimioterapia y/o radioterapia después de la cirugía
·CÁNCER DEL COLON - ETAPA III.
1.Cirugía con resección intestinal para eliminar el cáncer, seguido por quimioterapia.
2. Estudios clínicos de quimioterapia, radioterapia o terapia biológica después de cirugía.
·CÁNCER DEL COLON - ETAPA IV.
1.Cirugía con resección intestinal para eliminar el cáncer o para mejorar o mantener la función del colon
2. Cirugía invasiva de limpieza de otros órganos afectados
3. Radioterapia para aliviar el dolor.
4. Quimioterapia.
5. Estudios clínicos con quimioterapia o terapia biológica.
·CÁNCER DEL COLON - RECURRENTE.
1. Cirugía invasiva de limpieza de los órganos afectados
2. Radioterapia para aliviar el dolor.
3. Quimioterapia.
4. Estudios clínicos con quimioterapia o terapia biológica.
¿Qué pronóstico tiene?.
El pronóstico o perspectiva de recuperación y la elección del tratamiento dependen de la etapa en que se encuentra el cáncer si se encuentra solamente en el recubrimiento interno del colon o si se ha diseminado a otros sitios y del estado general de salud del paciente. Después del tratamiento, podrían hacerle un análisis de sangre para medir la cantidad de antígeno carcinoembrionario, o CEA por sus siglas en inglés, en la sangre y radiografías para determinar si el cáncer ha reaparecido.
¿Se debe operar o irradiar? ¿Dar tratamiento con quimioterapia? ¿Cuándo cada cual?.
La radioterapia consiste en el uso de rayos X de alta energía para eliminar células cancerosas y reducir tumores. La radiación podría provenir de una máquina fuera del cuerpo (radioterapia externa) o podría aplicarse por medio de materiales que contienen radiación a través de tubos plásticos delgados (radioterapia interna) en el área del intestino. La radioterapia podría usarse sola o junto con cirugía, con quimioterapia o con ambas.
La quimioterapia consiste en el uso de medicamentos para eliminar células cancerosas. La quimioterapia podría tomarse en forma de píldoras o administrarse en el cuerpo introduciendo una aguja en la vena. Se puede administrar la quimioterapia a través de un tubo que se deja instalado en la vena mientras una bomba pequeña le proporciona tratamiento continuo por un período de semanas.
La quimioterapia se considera un tratamiento sistémico ya que el medicamento es introducido al torrente sanguíneo, viaja a través del cuerpo y puede eliminar células cancerosas fuera del colon. Si el cáncer se ha esparcido al hígado, se podría administrar quimioterapia directamente en la arteria que conduce al hígado.
Si el médico elimina todo el cáncer que puede verse en el momento de la operación, se le podría administrar quimioterapia después de la cirugía para eliminar cualquier célula cancerosa que permanezca. La quimioterapia que se administra después de una operación a una persona que no tiene células cancerosas visibles se llama quimioterapia coadyuvante.
El tratamiento biológico es un procedimiento con el cual se intenta que el cuerpo combata el cáncer. Se emplea materiales producidos por el cuerpo o producidos en un laboratorio para estimular, dirigir o restaurar las defensas naturales del cuerpo contra la enfermedad. El tratamiento biológico también se conoce con el nombre de terapia modificadora de la respuesta biológica (BRM) o inmunoterapia.
¿Que es rectorragia? ¿Cuándo se presenta?.
Su causa más frecuente son las hemorroides, que producen un sangrado relativamente pequeño, a menudo apenas manchando el papel de baño. Sin embargo, si la rectorragia es de una cantidad de moderada a severa, hay que buscar inmediatamente cuidado médico
A veces, el sangrado en el tubo digestivo no se manifiesta por sangre roja en las heces, sino por sangre negra y pegajosa (melenas). Algunas comidas (calamares en su tinta, espinacas) o medicamentos (hierro, bismuto) pueden causar heces negras. Sin embargo, si usted observa heces negras de causa desconocida, consulte inmediatamente a su médico.
¿Qué es melenas?
Las melenas son la evacuación rectal de material negro y fétido, el resultado de la degradación bacteriana de la hemoglobina de sangre estancada en la luz intestinal, indicativa de sangrado a partir de un punto proximal al ligamento de Treitz. En pacientes con tránsito colónico lento, un sangrado a nivel del colon proximal puede presentarse como melena.
El Cáncer de Piel.
¿Qué es el cáncer de la piel?
El cáncer de la piel es una enfermedad en la que se encuentran células cancerosas (malignas) en las capas exteriores de la piel. La piel protege al cuerpo contra calor, luz, infección y lesión. También almacena agua, grasa y vitamina D.
La piel esta compuesta por dos capas principales y varias clases de células. La capa externa de la piel se llama epidermis. Esta contiene tres clases de células: células planas en forma de escamas en la superficie llamadas células escamosas; células redondas llamadas células basales y unas células llamadas melanocitos, que le dan el color a la piel.
La capa interna de la piel se llama dermis. Esta capa es mas gruesa y contiene vasos sanguíneos, nervios y glándulas sudoriparas. El pelo (vello) de la piel también crece en la dermis, en unas bolsas diminutas llamadas folículos. La dermis produce el sudor, que ayuda a enfriar el cuerpo, y aceites que evitan que se reseque la piel.
¿Cuantas clases de cáncer de la piel hay? ¿Cómo se manifiestan? ¿Qué síntomas da?
Hay varios tipos de cáncer que se originan en la piel. Los más comunes son el cáncer de células basales y el cáncer de células escamosas.
Estos tipos de cáncer de la piel se denominan cánceres de la piel no melanomas. El melanoma es un tipo de cáncer de la piel que se origina en los melanocitos. No es tan común como el cáncer de las células basales o el cáncer de células escamosas, pero es mucho más grave.
El aspecto del cáncer de la piel puede variar. El signo más común del cáncer de la piel es un cambio en el aspecto, como por ejemplo un crecimiento o una herida que no sana. A veces puede haber una pequeña protuberancia. Esta puede ser de apariencia suave, brillante y cerosa, o puede ser roja o marrón rojizo.
El cáncer de la piel también puede aparecer como una mancha roja plana que es áspera o escamosa. No todos los cambios en la piel son cancerosos; sin embargo, se debe consultar al medico cuando se note alguno. Si la persona tiene una mancha o protuberancia en la piel, el medico puede extraerla para analizar el tejido en el microscopio. Este procedimiento se conoce como biopsia. La biopsia generalmente puede llevarse a cabo en el consultorio medico. Antes de la biopsia, se administra un anestésico local para adormecer el área durante un corto periodo de tiempo.
Otros tipos de cáncer que pueden afectar la piel son, el linfoma cutáneo de células T, que es un cáncer del sistema linfático, y el sarcoma de Kaposi. Los cánceres que se han originado en otras partes del cuerpo también pueden diseminarse a la piel.
¿Qué relación tiene con el medio ambiente? ¿Con el sol?
El cáncer de la piel es más común entre las personas de piel pálida que han pasado mucho tiempo expuestas a los rayos solares. Puede presentarse en cualquier parte del cuerpo, pero es más común en las arreas con mayor exposición a los rayos solares como la cara, el cuello, las manos y los brazos.
Desde hace muchos años se relaciona el cáncer de la piel con la exposición solar, dado que este es mucho más frecuente en individuos que viven en áreas de gran irradiación solar. Es más frecuente en individuos de piel más blanca (más sensible al sol), principalmente en áreas expuestas al sol y ocurre con más frecuencia en personas que tienen condiciones benignas relacionadas con el sol. En los últimos 40 años se han agregado numerosas informaciones a las evidencias epidemiológicas y últimamente se ha descrito que el sol es el responsable de mutaciones genéticas que favorecen la aparición de tumores cutáneos.
¿Qué tan rápido se debe diagnosticar?
Todas las personas deben acudir al menos 1 vez al año al dermatólogo, quien examinará detenidamente toda la piel del paciente.
Los lunares sospechosos clínicamente deben examinarse con el DERMATOSCOPIO, aparato que permite visualizar con un aumento diez veces más que el ojo humano, la existencia de características de malignidad en la lesión de una forma no invasiva y rápida. En manos expertas, aumenta la posibilidad de detectar un cáncer de piel entre 80% y 88%. En caso de lesión sospechosa de malignidad, el dermatólogo está en la obligación de practicar una biopsia para estudio anatomopatológico, y de acuerdo a ella, programar luego el método más adecuado para su eliminación. El dermatólogo debe explicar al paciente el procedimiento quirúrgico a seguir, las restricciones postoperatorias y responder cualquier pregunta del paciente.
¿Que efectos tiene el sol sobre la piel? ¿Se acumula? ¿Es pasajero?
Los rayos ultravioleta del sol causan daño al tejido colágeno y sus efectos son acumulativos. El mayor daño a la piel lo producen los rayos ultravioleta emitidos por el sol al mediodía.
Se recomienda proteger la piel con cremas que contengan protector solar (Sun protection factor, SPF), que se aplica dependiendo del tono de la piel. Para piel oscura o personas que no obtienen enrojecimiento de la piel con el sol, se puede aplicar SFP 2 a 4. El SPF 4 a 6 actúa como protector moderado, SPF 6 a 8 da una protección extra y solo permite bronceado moderado y SPF 8 a 15 ofrece la máxima protección y permite muy poco bronceado.
¿Cuál es la forma ideal de proteger la piel? ¿Cuál crema? Que significa el factor de cada crema: 12,15,30, etc.?
Uno de los factores más importante en la prevención del cáncer cutáneo y en la detección precoz del mismo es adquirir conciencia del riesgo. Esto es el primer paso para que las personas inicien medidas que les permita disminuir el riesgo existente.
La protección física debería ser la primera medida preventiva. Esto implica, evitar la exposición solar 2 horas antes y después del mediodía y la utilización de estructuras que induzcan sombra (quitasoles, techos.) El uso de ropa protectora contra el sol, tales como sombreros, camisetas, manga larga, especialmente ropa oscura de trama apretada.
El uso de fotoprotectores o filtros solares, deben utilizarse como coadyuvantes de las medidas físicas. Solo se recomiendan los filtros con factor de protección mayor o igual a 15, de amplio espectro, es decir contra UVA y UVB. No es recomendable el uso de filtros solares en niños menores de 6 meses. En días nublados la radiación solar es idéntica a los días claros, ya que las nubes no filtran la radiación solar.
Las superficies como la nieve, el agua, el cemento y la arena, reflejan la radiación solar, por lo que se aumenta la radiación recibida por la piel. Los bloqueadores solares contienen compuestos que previenen el daño solar ya sea porque actúan absorbiendo o reflejando la radiación solar.
La aplicación de los filtros solares debe realizarse unos 20 minutos antes de la exposición solar y repetirse cada vez que la persona se moje, se seque, practique excesivo ejercicio físico, sude profusamente, o cada 3 horas de exposición solar. No deben olvidarse algunas zonas como son las orejas, los labios, la nariz, y la parte posterior del cuello.
La exposición solar en los niños y adolescentes se correlaciona estrechamente con la aparición de lunares. Está claro que aquellas personas que tienen un mayor numero de lunares tienen un mayor riesgo de tener melanoma. Debe tenerse en cuenta que el daño solar es acumulativo durante la vida e irreversible, y puede existir una latencia muy larga, generalmente muchos años desde la iniciación de la exposición solar y el momento del desarrollo clínico evidente del melanoma.
No existe el bronceado saludable. El bronceado es siempre la respuesta de la piel a la injuria de la radiación ultravioleta. Las fuentes de radiación ultravioleta artificiales (solarium)son causa de quemaduras, envejecimiento cutáneo y mayor incidencia de cáncer de piel por lo que no son recomendables.
¿Cómo se trata? ¿Cirugía?
Hay tratamiento para todos los pacientes con cáncer de la piel.
*Cirugía (extracción del cáncer).
*Quimioterapia (uso de medicamentos para eliminar las células cancerosas).
*Radioterapia (uso de rayos X para eliminar las células cancerosas).
Muchos cánceres de la piel son tratados por médicos especialistas en enfermedades de la piel (dermatólogos). Con frecuencia el cáncer puede tratarse en el consultorio medico.
La cirugía es el tratamiento más común para el cáncer de la piel. El medico puede extraer el cáncer por medio de alguno de los métodos siguientes:
-Electrodesecacion y curetaje. Operación en la que se usa corriente eléctrica para deshidratar el tumor (electrodesecación) y luego se emplea un instrumento especializado (cureta) para extraer el tumor.
-Criocirugía. Operación en la que se congela y destruye el tumor.
-Excisión simple. Operación en la que se extrae el cáncer de la piel junto con parte del tejido sano situado alrededor de este.
-Cirugía micrográfica. Operación en la que se extrae el cáncer y la menor cantidad posible de tejido normal. Durante este procedimiento, el médico extrae el cáncer y luego emplea un microscopio para analizar el área cancerosa y asegurarse que no quede ninguna célula maligna.
-Terapia de rayos láser. En este procedimiento se emplea un haz altamente concentrado de luz que destruye solo las células cancerosas.
La cirugía puede dejar una cicatriz en la piel. Según el tamaño del cáncer, se puede tomar piel de otra parte del cuerpo y colocarla en el área de donde se extrajo el tumor. A este procedimiento se le llama injerto de piel. Los nuevos métodos quirúrgicos, junto con los injertos, pueden reducir las cicatrices.
La radioterapia consiste en el uso de rayos X para eliminar células cancerosas y reducir tumores. Cuando se realiza esta para el cáncer de la piel, proviene de una maquina afuera del cuerpo (radioterapia externa).
La quimioterapia consiste en el uso de medicamentos para eliminar células cancerosas. En el tratamiento del cáncer de la piel, la quimioterapia se suele administrar en forma de una crema o loción aplicada a la piel para eliminar las células cancerosas (quimioterapia tópica). También puede tomarse en forma de pastillas o introducirse en el cuerpo a través de una aguja insertada en una vena o en un músculo. Se dice que la quimioterapia es un tratamiento sistémico porque el medicamento se introduce en la corriente sanguínea, viaja a través del cuerpo y destruye las células cancerosas situadas fuera de la piel.
La terapia biológica ( utilización del sistema inmunitario del cuerpo para combatir el cáncer ) se evalua en ensayos clínicos. El propósito es tratar de que el cuerpo mismo combata el cáncer. En la terapia biológica se emplean sustancias producidas por el propio cuerpo o fabricadas en un laboratorio para aumentar, dirigir o restaurar las defensas naturales del organismo contra la enfermedad. En la terapia fotodinámica se emplea un cierto tipo de luz y un producto químico especial para eliminar las células cancerosas.
¿Que relación tienen los lunares, las manchas de la piel, las pecas, con el cáncer de la piel?
Aunque todos pueden tener cáncer en la piel, la gente con ciertas características está particularmente en riesgo: a) Piel clara b) Antecedente familiar de cáncer en la piel. c) Antecedente personal de dicho cáncer. d) Exposición crónica al sol. e) Quemaduras de sol a temprana edad. f) Lunares atípicos. g) Gran cantidad de lunares. h) Pecas (un indicador de sensibilidad al sol y lesiones solares).
¿Qué relación hay entre el envejecimiento de la piel y el cáncer de la piel? ¿Cómo se previene el envejecimiento de la piel?
La piel es el órgano más grande del cuerpo y está compuesta de 3 capas. La epidermis es la capa más superficial, la dermis también llamada cutis, está por debajo de la epidermis y contiene un rico plexo de vasos sanguíneos, terminaciones nerviosas, vasos linfáticos, glándulas sudoríparas (sudor), células grasas y los folículos pilosos (pelo). La última capa de la piel que sigue a la dermis es la subdermis o tejido celular subcutáneo que contiene tejido graso, vasos sanguíneos y linfáticos y actúa como un colchón que nos da protección.
Los científicos anotan que el envejecimiento de la piel tiene lugar en el tejido conectivo de la dermis, formado en el 70% por colágeno, proteína principal de la dermis. Tenemos 2 tipos de colágeno. El soluble característico de la piel joven, con moléculas que se pueden desplazar (en relación a la otra), da posibilidad a la piel de absorber humedad.
Cuando la piel envejece, las moléculas de colágeno tienden a "cruzarse" y se forma el colágeno insoluble. Las moléculas ya no son flexibles, el tejido conectivo pierde su capacidad de absorber humedad y la piel se vuelve seca, arrugada y envejecida.
La aplicación de colágeno a la piel, ayuda a restaurar la producción de nuevo colágeno y la regeneración de las células. Las cremas en el mercado que dicen "Soluble collagen" son las únicas que son efectivas y realmente se absorben.
Las células de la piel, como cualquier otra célula del organismo, necesitan "todos" los nutrientes para mantener las funciones metabólicas, como la producción de colágeno y elastina. Una buena alimentación es fundamental para mantener una piel sana y joven.
Los ácidos grasos esenciales (omega 3 y omega 6) son nutrientes esenciales para la piel. Se obtienen en el pescado, como la trucha, el salmón y el atún azul del atlántico. También se encuentran en el aceite de semillas de lino o Flax seed, semillas de sésamo y semillas de girasol. La piel que tiene deficiencia de estos ácidos grasos esenciales, tiene menor capacidad de retener la humedad, se recesará con más facilidad y su carencia es un factor importante en la pérdida de cabello.
Muchas sustancias pueden ser absorbidas a través de la piel. La absorción se lleva a cabo a través del "aparato pilo-sebáceo" que comprende el pelo (vello) de la piel y las glándulas sebáceas. Tenemos cerca de cien glándulas sebáceas por pulgada cuadrada de piel. El sebum lubrica la piel y ayuda en la prevención de la evaporación de humedad, es un emoliente natural (ayuda a conservar la humedad de la piel) y también es una barrera contra los microbios.
La piel necesita humedad. La podemos ayudar con la aplicación de humectantes que "atraen" humedad y a la vez controlan el intercambio de humedad entre la piel y el medio ambiente. El humectante debe de aplicarse después del baño, cuando la piel está aún húmeda. El sorbitol es un humectante natural.
El emoliente suaviza, previene la resequedad y protege la piel actuando como barrera natural. Algunos emolientes naturales son el aceite de aguacate, lanolina, aceite de coco y aceite de oliva.
Por lo tanto, no hay una respuesta sencilla para proteger la piel del envejecimiento, pero si podemos hacer conciencia de los factores que se pueden corregir, como los efectos del sol, alimentación sana, agregar suplementos a la dieta, hacer ejercicio y leer a conciencia las etiquetas de los productos que se aplican en la piel.
¿Que son los ácidos grasos libres? Porque son dañinos? Que relación tienen con el cáncer?
El acné y otras afecciones cutaneas como la caspa tienen la participación de ácidos grasos libres, liberados por reacciones químicas intrafoliculares. Cuando existe sebo retenido en el interior de las capas de la piel, las bacterias producen sustancias como ácidos grasos libres que degeneran la piel y provocan lesiones e irritación, es decir, favorecen una infección cutánea.
Cancer de la Próstata.
La próstata es una glándula masculina localizada en la base de la vejiga y en frente al recto. Tiene el tamaño de una nuez y rodea parte de la uretra, o sea el tubo que conduce la orina desde la vejiga al exterior. La próstata produce fluidos que componen el semen.
HIPERTROFÍA PROSTÁTICA BENIGNA
A medida que el hombre envejece la próstata se hace más grande o llega a obstruir la uretra. Por mecanismos aún poco claros, lo anterior sucede de forma gradual, motivo por el cual, en las etapas iniciales no se siente la sintomatología. Poco a poco el paciente tiene dificultades para realizar la micción. Esto se manifiesta con un chorro de orina delgado y difícil, infección urinaria, orina con sangre y, en los casos extremos, retención completa de orina.
La condición descrita anteriormente se llama prostatismo, que aunque no es cáncer, en ocasiones requiere corrección quirúrgica. Muchas veces el paciente espera hasta sentir los síntomas descritos anteriormente para consultar al urólogo y en ese momento es cuando se encuentra la malignidad de la próstata. Como en muchos cánceres, la oportunidad de curar es mayor cuando se diagnostica y trata en forma temprana. Una vez avanzada la enfermedad, solo se pueden aliviar los síntomas.
ENFERMEDAD MALIGNA DE LA PRÓSTATA
La enfermedad maligna de la próstata es muy común y ataca a un alto porcentaje de hombres. Se define como una patología de la glándula prostática en la cual se encuentran células malignas o cancerosas.
A partir de los 50 años todo paciente masculino debe controlarse por medio de un examen urológico completo. Esta es la forma más precoz para diagnosticar la enfermedad. Aunque se encuentra principalmente en hombres mayores, no se excluyen los adultos de edad mediana. Cuando el individuo es de raza negra o tiene historia familiar de la enfermedad, el control debe iniciar a los 40 años.
SÍNTOMAS
Es frecuente preguntar al urólogo sobre la forma de identificar la sintomatología del cáncer de próstata.
Muchos pacientes desean conocer alguna señal de alarma al respecto. Es interesante saber que la patología maligna de la glándula prostática NO produce síntomas en los estados iniciales.
Da su primer llamado de atención cuando se encuentra el cáncer en estado avanzado y en ese momento ya no se puede ofrecer tratamiento curativo.
EXAMEN
Para examinar al paciente, el urólogo introduce un dedo por el recto y de esta forma realiza el tacto rectal de la glándula prostática. En ese momento evalúa si consistencia, tamaño y característica.
Además, ordena un examen sanguíneo denominado antígeno prostático específico ( APE o PSA según la sigla en inglés) . Esta es una proteína producida en la próstata y generalmente se encuentra elevada cuando hay cáncer prostático. Su valor normal depende del tamaño de la glándula, de edad del paciente.
Según lo encontrado en los exámenes anteriores, se puede ordenar un estudio de ultrasonido transrectal de la próstata, con posibilidad de toma de biopsia; el tejido tomado en el examen es enviado a patología, en donde el especialista lo analiza al microscopio y da le diagnóstico específico. El ultrasonido aislado aporta poco diagnóstico.
La patología maligna de la glándula prostática NO produce síntomas en los estados iniciales.
ESTADOS
Una vez diagnosticado el cáncer de la próstata, es necesario hacer más exámenes. Estos determinan si las células malignas están localizadas en la glándula o fuera de ella. Por medio de lo anterior se evalúa el estado de la enfermedad. Cuando el paciente de ha clasificado, es posible decidir el manejo ideal.
- Estado A: ( T1C)
El tumor no se puede sentir al tacto rectal y no produce síntomas. El antígeno prostático específico está elevado.
- Estado B: (T2)
Se puede sentir al tacto rectal, está localizado en la glándula y tampoco produce síntomas.
- Estado C : ( T3)
La patología maligna ha salido de la glándula a los tejidos vecinos.
- Estado D: ( N) ó (M)
Se encuentran metástasis o siembras a distancia en diferentes órganos
Además de la clasificación anterior, existe otra más específica, generalmente usada por el especialista y es la llamada TMN. Todo lo anterior sirve para darle al paciente un mejor plan de tratamiento. Los estudios a nivel mundial tienen un manejo recomendado para cada estado de la enfermedad.
MANEJO
Siempre hay alguna clase de tratamiento para los pacientes con cáncer en la próstata. Algunos de ellos son curativos y otros solo demoran el crecimiento del tumor o sea mejoran los síntomas de la enfermedad.
Cirugía
Es un tratamiento común en el cáncer de la próstata, el cual si es descubierto en los estados iniciales, puede ser curado.
- Postatectomía radical:
Consiste en retirar completamente la próstata y vesículas seminales. Solo se realiza si la enfermedad maligna se encuentra localizada en la glándula prostática. Posterior a este procedimiento quirúrgico, se puede presentar impotencia sexual e incontinencia urinaria.
- Prostatectomía transuretal:
Esta no es un acirugía curativa. Consiste en cortar el tejido prostático que obstruye ka uretra e impide la salida de orina desde la vejiga. Se le ofrece a los pacientes con tumor fuera de la próstata quienes presentan obstrucción urinaria.
Hormoterapia
El cáncer de la próstata se nutre gracias a las hormonas que producen los testículos y las glándulas suprarrenales. Al existir éstas en la circulación sanguínea se favorece el cre cimiento y diseminación de las células malignas. Debido a lo anterior el tratamiento hormonal consiste en bloquear estas sustancias.
Una forma sencilla de lograr esto es retirar los testículos. Además, existen medicamentos que anulan el efecto de las hormonas testiculares. Este tratamiento se hace generalmente cuando el paciente tiene cáncer prostático avanzado.
La clase de tratamiento para el cáncer de la próstata depende del estado de la enfermedad, edad y condición general del paciente. Debido a lo anterior, las modalidades de manejo se individualizan para cada persona.
Finalmente, es importante dejar en claro que lo mejor en el manejo del cáncer de la próstata es el diagnóstico precoz. Si éste se encuentra en estados iniciales, se puede curar.
Radioterapia
Es un método de manejo del cáncer por medio de radiación de alta energía, la cual mata las células malignas y de esta forma disminuye el tamaño del tumor. Puede ser externa por medio de máquinas fuera del cuerpo o con elementos radioactivos que se colocan dentro del mismo y se llaman braquiterapia. Cada cual tiene sus respectivas indicaciones y complicaciones .
Es urgente crear conciencia en los hombres sobre la realización del examen urológico anual. Esta conducta es la diferencia entre una muy buena calidad de vida y una desastrosa y dolorosa muerte.
Cáncer de Testículo.
El cáncer del testículo (también llamado testis), un tipo de cáncer poco común en los hombres. Es una enfermedad en la cual se encuentran células cancerosas (malignas) en los tejidos de uno o ambos testículos. El esperma (las células germinativas masculinas que al unirse con un óvulo femenino pueden llegar a formar un bebe) y las hormonas masculinas se producen en los testículos. Hay dos testículos localizados dentro del escroto (una bolsa de piel suelta que se encuentra suspendida directamente debajo del pene). Los testículos son similares a los ovarios en las mujeres (las bolsas pequeñas que contienen los óvulos femeninos).
Que es el cáncer del testículo?
El cáncer del testículo es el tumor más común en los hombres entre los 15 y los 35 anos de edad. Los hombres que tienen un testículo que no ha descendido (un testículo que nunca ha bajado al escroto) corren mayor riesgo de desarrollar cáncer testicular que los hombres cuyos testículos han descendido al escroto. Este riesgo sigue existiendo aun cuando se haya efectuado cirugía para colocar el testículo en el lugar correspondiente dentro del escroto.
El paciente deberá ver al medico si el escroto presenta alguna hinchazón. El medico le hará un examen de los testículos y los palpará para determinar la presencia de masas. Si el escroto no se siente normal, el medico quizás tenga que realizar un examen por ultrasonido, en el que se usan ondas de sonido para tomar una imagen del interior de los testículos.
El medico puede tener que extraer el testículo y observarlo en el microscopio para determinar la presencia de células cancerosas. Es muy importante que esto se haga correctamente.
La probabilidad de su recuperación (pronostico) y selección de tratamiento dependerá de la etapa en que se encuentra el cáncer de testiculo(sí se encuentra en el testículo únicamente o si se ha diseminado a otros lugares) y el estado de salud en general del paciente.
¿Cómo es el diagnóstico? ¿Que es el autoexamen? ¿En que consiste? ¿Quién se lo debe hacer? ¿Hasta que edad?
Es muy importante que los hombres se realicen el auto examen testicular, para detectar temprano cualquier anomalía(principios de cancer testicular). Unos minutos una vez al mes, puede ser en la ducha, mientras se bañan o después; el agua y el calor ayudan a relajar la piel del escroto. Se toma cada testículo con ambas manos. Colocando el dedo índice y los dedos medianos debajo del testículo y los pulgares encima, haciendo rodar el testículo suavemente entre los dedos pulgar e índice, y comprobando si está liso y firme al tacto. En la parte posterior del testículo se puede sentir la masa irregular y blanda del epidídimo. Luego se sujetan ambos testículos con una sola mano, y se compara el tamaño. Deben ser similares.
¿Cómo se clasifica? ¿Cuál es el peligro de no diagnosticarlo a tiempo?
Etapas del cáncer del testículo
Una vez que se ha diagnosticado el cáncer testicular, se hacen mas pruebas para determinar si el cáncer se ha diseminado del testículo a otras partes del cuerpo (clasificación por etapas). El medico necesita saber la etapa en la que se encuentra la enfermedad para planear el tratamiento adecuado.
Las siguientes etapas se usan para clasificar el cáncer del testículo:
Etapa I
El cáncer se encuentra en el testículo nada más.
Etapa II
El cáncer se ha diseminado a los ganglios linfáticos en el abdomen (los ganglios linfáticos son estructuras pequeñas en forma de frijol que se encuentran por todo el cuerpo y cuya función es producir y almacenar células que combaten la infección).
Etapa III
El cáncer se ha diseminado mas allá de los ganglios linfáticos en el abdomen. El cáncer puede propagarse a partes del cuerpo lejos de los testículos como, por ejemplo, a los pulmones y al hígado.
Recurrente
La enfermedad recurrente significa que el cáncer ha vuelto a aparecer (recurrido) después de haber sido tratado. Puede volver a aparecer en el mismo lugar o en otra parte del cuerpo. El paciente debe examinar el otro testículo con regularidad durante varios anos después de su tratamiento porque es posible que la enfermedad recurra. Probablemente el paciente tenga que hacerse exámenes médicos una vez al mes durante el primer ano después de la cirugía, un mes si y otro no durante el ano siguiente, y con menor frecuencia posteriormente.
Tratamiento del cáncer testicular
Existen tratamientos para todos los pacientes con cáncer del testículo, y la mayoría de los pacientes pueden curarse con los tratamientos disponibles.
Se emplean cuatro clases de tratamientos:
·cirugía :extracción del cáncer en una operación.
·radioterapia :uso de rayos X de alta energía u otros rayos de alta energía para eliminar las células cancerosas.
·quimioterapia : uso de medicamentos para eliminar las células cancerosas.
·trasplante de medula osea.
La cirugía es un tratamiento común para la mayoría de las etapas del cáncer del testículo. El medico puede eliminar el cáncer extrayendo uno o ambos testículos mediante una incisión (corte) en la ingle. Este procedimiento se llama orquiectomia inguinal radical.
También se pueden extraer algunos de los ganglios linfáticos en el abdomen (disección de ganglios linfáticos).
La radioterapia consiste en el uso de rayos X de alta energía para eliminar células cancerosas y reducir tumores. La radioterapia para el cáncer testicular por lo general proviene de una maquina fuera del cuerpo (radiación de haz externo).
La quimioterapia consiste en el uso de medicamentos para eliminar células cancerosas. La quimioterapia puede tomarse en forma oral o puede administrarse en el cuerpo con una aguja en una vena. La quimioterapia se considera un tratamiento sistemático ya que el medicamento es introducido al torrente sanguíneo, viaja a través del cuerpo y puede eliminar células cancerosas fuera del testículo.
El trasplante de medula osea es un tipo de tratamiento mas reciente. Durante un trasplante de medula osea autologo, se toma medula osea del paciente la cual es sometida a tratamientos con medicamentos para eliminar las células cancerosas. La medula se congela y el paciente luego recibe quimioterapia en dosis elevadas con o sin radioterapia para destruir toda la medula que queda. La medula congelada que fue guardada es descongelada y administrada con una aguja en una vena para reemplazar la que fue destruida.
¿Qué relación tiene con el dolor testicular? ¿Con la torsión testicular?
La forma en que se manifiesta el cáncer de testículo se caracteriza por los siguientes síntomas: el crecimiento de un testículo o la aparición de un bulto en el escroto ( la mayoría de los bultos que aparecen en el escroto no son causados por el cáncer testicular, pero los que se forman en los testículos sí); dolor de la parte afectada.
En algunos casos, la rotura de los vasos sanguíneos que se hallan dentro del tumor da como resultado el crecimiento veloz del mismo, así como también un fuerte dolor. Los especialistas consultados coinciden en que un bulto duro en un testículo debe ser examinado de inmediato por un médico, para que en caso de que se confirme un diagnóstico de cáncer testicular se pueda acceder a un tratamiento temprano del mismo.
¿Cuál es el diagnóstico diferencial?
El diagnóstico diferencial deberá incluir epididimitis, orquiepididimitis, hidrocele, hernia inguinal, hematocele, espermatocele, varicocele y torsión testicular.
¿Qué son los marcadores tumorales? ¿Cuáles son de importancia en el tumor del testículo?
Los marcadores tumorales son sustancias que a menudo pueden descubrirse en cantidades mayores que las normales en la sangre, orina, o tejidos del cuerpo de algunos pacientes con ciertos tipos de cáncer. Los marcadores tumorales son producidos
por el propio tumor o por el cuerpo como respuesta a la presencia de cáncer o ciertas condiciones benignas (no cancerosas).
Este prontuario describe algunos marcadores tumorales encontrados en la sangre.
La medición del nivel de los marcadores tumorales puede ser útil, cuando se utiliza junto con radiografías y otras pruebas, para la detección y el diagnóstico de algunos tipos de cáncer. Sin embargo, la medición de los niveles de los marcadores tumorales por sí sola no es suficiente para diagnosticar un cáncer por las siguientes razones:
El nivel de un marcador tumoral puede elevarse en personas con condiciones benignas. El nivel de un marcador tumoral no se eleva en todas las personas con cáncer, especialmente en las etapas tempranas de la enfermedad. Muchos marcadores tumorales no son específicos a un tipo particular de cáncer; el nivel de un marcador tumoral puede aumentar como consecuencia de más de un tipo de cáncer.
En la actualidad, el uso principal de los marcadores tumorales es evaluar la reacción del cáncer al tratamiento y controlar la recaída. Los científicos continúan estudiando el uso de estos marcadores tumorales, así como su papel potencial en la detección y diagnóstico temprano del cáncer. El médico puede explicarle al paciente el papel que juegan los marcadores tumorales en la detección, diagnóstico o tratamiento para un individuo en particular. A continuación se describen algunos de los marcadores tumorales que se miden con más frecuencia.
Para el cáncer de testículo se utilizan los siguientes marcadores: Gonadotrofina Coriónica Humana y Alfafetoproteína.
¿Cuantas clases de tumor testicular existen? ¿Qué pronóstico tiene cada cual?
Los tumores testiculares son más frecuentes en hombres jóvenes, principalmente el seminoma.
tumor testicular primario oculto o tumor testicular fundido.
Seminoma puro
a. Clásico
b. Anaplásico
c. Espermatocítico
Carcinoma embrionario, puro o con seminoma
d. Tipo adulto
e. Variante juvenil
Teratoma, puro o con seminoma
f. Maduro
g. Inmaduro
Teratocarcinoma (teratoma con carcinoma embrionario o coriocarcinoma o ambos, con o sin seminoma)
Coriocarcinoma (puro, o con carcinoma embrionario o seminoma o ambos)
¿En que consiste la cirugía?
Es la extirpación quirúrgica del testículo afectado. Esto no implica pérdida de virilidad porque la capacidad que queda en el otro testículo es suficiente para mantener una función sexual normal, así como una función normal en la producción de hormonas. Si se han perdido los dos testículos habrá infertilidad, pero inyectando hormonas masculinas cada 3 semanas más o menos se mantiene en esencia una función sexual normal.
Otras terapias
Se utilizarán la radiación y la quimioterapia para prevenir que se extienda el cáncer a otras partes del cuerpo, así como para combatirlo si ha comenzado a extenderse.
Cáncer de seno.
NIVELES Y GRADOS DE EVIDENCIA
Tipo de evidencia
I Evidencia obtenida por metaanálisis de múltiples estudios, controlados,
bien diseñados o de estudios clínicos controlados, aleatorizados de
alto poder.
II Evidencia obtenida proveniendo de al menos un estudio experimental
bien diseñado aleatorizado de bajo poder.
III Evidencia obtenida de estudios quasi experimentales no aleatorizados,
controlados, cohortes, grupos pequeños, casos y controles.
IV Evidencia de estudios no experimentales bien diseñados, descriptivos
y estudios de casos.
V Evidencia de reporte de casos
GRADOS
A. Evidencia tipo I o de múltiples estudios de tipo II, III, IV.
B. Evidencia de tipos II, III o IV. Hallazgos consistentes.
C. Evidencia de tipos II, III o IV. Hallazgos inconsistentes.
D. Hay poca o ninguna evidencia sistemática
*From de Canadian Medical Association. The CanadianTask force on
The periodic health examination. Can Med Assoc J 121: 1193, 1979,
with permisson
Epidemiología
Incidencia: se ha incrementado a partir de 1960, pero el número de muertes se mantiene relativamente estable, posiblemente debido a la creciente detección en estadíos más tempranos y también a mejores tratamientos para los estadíos más avanzados. En Colombia el cáncer de seno es la neoplasia maligna más frecuente en mujeres, luego del cáncer de cérvix y es la causa más frecuente de muerte por cáncer en mujeres entre 15 y 54 años.
Etiopatogenía
Factores de riesgo: diversos factores aparecen asociados con riesgo de cáncer de seno, pero en menos del 70% de las mujeres con este diagnóstico es posible identificar un factor de riesgo definido. Un aparente factor de incremento en el riesgo es la mayor duración de la vida menstrual como resultado de menarquía precoz o menopausia tardía. Las mujeres nulíparas exhiben un mayor riesgo, así como las mujeres cuyo primer embarazo se presenta después de los 30 años de edad. El uso de estrógenos en mujeres postmenopáusicas ha demostrado disminución en el riesgo de osteoporosis y de enfermedad coronaria, pero también un leve incremento en el riesgo de cáncer de seno con el uso continuo por más de 5 años. El riesgo de cáncer de seno por el uso prolongado de anovulatorios orales se ha obviado con el uso de concentraciones mucho menores de estrógenos. No hay evidencia de que la dieta rica en grasa aumente el riesgo de cáncer de seno. La presencia de una lesión benigna no proliferativa no se asocia con aumento en el riesgo de cáncer de seno, en tanto que una lesión proliferativa con atipia sí lo aumenta; el diagnóstico de hiperplasia atípica es considerado como premaligno.
Aproximadamente 5 a 10% de las pacientes con historia familiar de cáncer de seno pueden ser parte de síndrome de cáncer heredo-familiar.
Cuadro clínico
La presentación clínica del carcinoma de seno es de espectro amplio que varía desde la ausencia de signos y síntomas en cuya situación el diagnóstico es imagenológico, hasta cuadros clínicos evidentes que caracteriza los estados avanzados, como masa firme e indolora, alteraciones de la piel, como retracción, enrojecimiento, edema, ulceración o retracción del pezón.
En la enfermedad de Paget, la cual es indicativa de un cáncer subyacente, hay prurito y eczema de la piel del pezón, signos que pueden confundirse fácilmente con alteraciones benignas de la piel.
La secreción por el pezón no es un signo específico de cáncer, pero debe conducir a la sospecha de neoplasia subyacente, especialmente en los casos de telorragia (secreción sanguinolenta por el pezón).
La extensión axilar se manifiesta por ganglios palpables o visibles en la proyección oblicua de la mamografía. Los ganglios pueden ser móviles o fijos, o ser palpables como un conglomerado. Los mismos hallazgos pueden estar presentes en la región supraclavicular. Algunas pacientes pueden presentar la adenopatía axilar como primera manifestación clínica, sin que se pueda palpar una masa mamaria.
Factores predictores de pronósticos
Los factores predictores de pronósticos son:
Ganglios:
· Bajo riesgo: 0 ganglios comprometidos
· Moderado: 1 a 3 ganglios axilares comprometidos
· Alto: 4 o más ganglios axilares comprometidos
Tamaño tumoral: tumores de más de 6 cm son de mal pronóstico. Tumores de menos de 1.0 cm son de excelente pronóstico, y en éstos se debe tener en cuenta los tipos histológicos para definir tratamiento complementario.
Tipo histológico: el carcinoma ductal infiltrante con o sin diferenciación sarcomatoide, metaplasia ósea o cartilaginosa o células en anillo de sello es de peor pronóstico. Se consideran de mejor pronóstico los de tipo medular típico, papilar y coloide.
Factores histológicos: el grado nuclear se puede evaluar por medio de 2 escalas definidas:
· Scarf Bloom Richardson (SBR):
a) grado de diferenciación: habilidad para formar túbulos glándulas o papilas
b) extensión del pleomorfismo, que se refiere al tamaño del núcleo y a la irregularidad de
lacélula
c) índice mitótico
Esta escala tiene un puntaje de uno a tres y suma tres grados: grado 1 bien diferenciado, grado 2 moderadamente diferenciado y grado 3 mal diferenciado. Existe el SBR modificado que solamente tiene en cuenta el pleomorfismo y las mitosis.
· Fischer:
a) grado nuclear (tamaño, nucleolos, cromatina y mitosis)
b) formación de túbulos o glándulas.
Receptores de estrogéno y de progesterona: su presencia se relaciona inversamente con los medidores de proliferación y el grado de diferenciación. Las pacientes cuyos tumores tengan receptores hormonales negativos son de peor pronóstico.
Medidores de proliferación: existen varios, aunque no se usan en forma rutinaria: índice mitótico, índice de timidina, fracción S, KI 67, y antígeno proliferante. En nuestro medio, en algunos centros se realizan determinaciones de antioncogenes como p53 mutado, factores de crecimiento como el c-erb B2 y medición de catepsina D.
Otros factores adversos son: invasión vascular y linfática, extensión del componente intraductal, necrosis tumoral y reacción inflamatoria mononuclear. Se ha encontrado un peor pronóstico en mujeres menores de 35 años, usualmente asociado a alteraciones genéticas del tipo BRCA1 y BRCA2.
Detección precoz
El objetivo principal de cualquiera de los métodos de detección precoz es la reducción en la mortalidad y no precisamente disminución de la incidencia.
La mamografía permite encontrar lesiones no palpables. Igualmente, puede identificar cambios sospechosos de malignidad en lesiones clínicamente consideradas como benignas. El tamizaje o pesquisa (screening) con mamografía es la mejor herramienta en el control del cáncer de seno.
Para que un cáncer de seno sea detectable por examen clínico debe alcanzar por lo menos 0.5 a 1 cm de tamaño, o sea un poco menos de 1 x 106 (un millón) de células malignas. Por lo tanto, no se puede asumir que la sola detección clínica sea considerada detección precoz.
La repercusión de la mamografía de tamizaje en la evolución clínica del cáncer de seno se demuestra por una mejor supervivencia en mujeres mayores de 40 años.
| Tabla I VALOR DEL AUTOEXAMEN Y DE LA MAMOGRAFÍA EN LA DETECCIÓN TEMPRANA DEL CÁNCER DEL SENO
| ||
| Edad | Recomendación | Evidencia por estudios |
| 20 o más | Autoexamen mensual | No |
| 40 o más | + examen anual | No |
| 40-49 años | + mamografía anual | Beneficio establecido |
| 50 o más | + mamografía anual | Beneficio establecido |
Los estudios más importantes que han evaluado el impacto de la mamografía en el cáncer de seno incluyen:
1. Health Insurance Plan (HIP) of New York, el primer estudio aleatorizado controlado que evaluó los métodos de detección precoz para cáncer de cualquier localización, el cual incluyó 62.000 mujeres con un 45% entre los 40 y los 49 años de edad en el momento del ingreso. Se registra diferencia significativa después de 18 años con beneficio a favor de las mujeres entre 40 y 49 años.
2. The Breast Cancer Detection Demostration Project (BCDDP) de la Sociedad Americana de Cáncer y el Instituto Nacional de Cáncer de los Estados Unidos, que incluyó 10.000 mujeres entre los 35 y los 74 años, demostró mejoría en la capacidad de detección de la mamografía, en las mujeres menores de 50 años pero sin reducción de la mortalidad.
3. Estudio Kaiser permanente, con seguimiento desde 1964 hasta 1975. Los resultados no demostraron diferencia en la mortalidad por cáncer de seno.
Estadificación
La clasificación TNM de la UICC (1999) ha sido adoptada por el Instituto Nacional de Cancerología y es utilizada para el manejo del cáncer de la mama.
Clasificación TNM para cáncer de seno
Tx Tumor primario no puede ser evaluado
T0 No evidencia de tumor primario
Tis Carcinoma in situ: carcinoma intraductal, carcinoma lobulillar in situ, o enfermedad de
Paget del pezón sin tumor.
T1 Tumor de 2 cm o menos en su mayor dimensión
· T1mic Microinvasión 0.1 cm o menos en su diámetro mayor
· T1a Más de 0.1 cm pero no mayor de 0.
5 cm
· T1b Más de 0.5 cm pero no mayor de 1 cm
· T1c Más de 1 c pero no mayor de 2 cm
T2 Tumor mayor de 2 cm pero no mayor de 5 cm
T3 Tumor mayor de 5 cm
T4 Tumor de cualquier tamaño con extensión directa a la pared del tórax o a la piel
· T4a Extensión a la pared
· T4b Edema de piel (incluso piel de naranja), o ulceración de la piel o nódulos satélites
confinadosal mismo seno
· T4c Compromiso de la pared del tórax y de la piel
· T4d Carcinoma inflamatorio
Nx No es posible la evaluación de los ganglios
N0 No hay compromiso ganglionar
N1 Metástasis a uno o más ganglios axilares homolaterales móviles
N2 Metástasis a uno o más ganglios axilares fijos entre sí o a otras estructuras
N3 Metástasis a ganglios de cadena mamaria interna homolateral
MX No es posible evaluar la presencia de metástasis
M0 No hay compromiso metastásico a distancia
M1 Compromiso metastásico incluye compromiso supraclavicular
En nuestras pacientes el estadío clínico más frecuente es el localmente avanzado IIIB, aunque cada vez más, y por efecto de una mejor educación tanto a médicos como a la población en general, vemos pacientes en estadíos más tempranos, a pesar de que en nuestro medio no existen verdaderos programas de detección precoz para esta patología.
| Tabla II ESTADÍO CLÍNICO SEGÚN LA CLASIFICACIÓN TNM | |
| 0 | Tis N0 M0 |
| I | T1 N0 M0 |
|
IIA | T0 N1 M0 T1 N1 M0 T2 N0 M0 |
| IIB | T2 N1 M0 T3 N0 M0 |
| IIIA | T0 N2 M0 T1 N2 M0 T2 N2 M0 T3 N1 M0 T3 N2 M0 |
| IIIB
| T4 cualquier N M0 Cualquier T N3 M0 |
| IV | Cualquier T, cualquier N M1 |
Clasificación histopatológica
Carcinoma invasivo:
· Ductal o canalicular (usual tipo no especial, no especificado de otra manera)
· Lobulillar (subtipo específico)
a. Clásico
b. Variante (alveolar, sólido, pleomórfico, túbulo lobulillar)
Tubular
Medular
Mucinoso
Secretor
Papilar infiltrante
Adenoide quístico
Metaplásico
Cribiforme infiltrante
Otro (especificar)
Carcinoma in situ:
Ductal o canalicular in situ (carcinoma intraductal)
Subtipo específico
a.
Cribiforme
b. Micropapilar
c. Sólido (microacinar)
d. Papilar (incluye la mayor parte de los casos intraquísticos)
e. Comedo (requiere alto grado nuclear; necrosis usualmente presente)
Lobulillar in situ
Diagnóstico
Comienza con la historia clínica, haciendo énfasis en factores de riesgo y antecedentes. El enfoque diagnóstico depende de si la lesión es o no palpable.
Mamografía: la decisión de realizar biopsia se apoya en los hallazgos mamográficos según la clasificación BI-RADS propuesta por el Colegio Americano de Radiología. Las categorías 3, 4 y 5 ameritan estudios complementarios e histológicos.
Clasificación BI- RADS
(Breast Imaging Reporting and Data System)
Categoría 0 Requiere de imágenes diagnósticas adicionales
Categoría 1 Negativa
Categoría 2 Con hallazgos benignos
Categoría 3 Hallazgos probablemente benignos- seguimiento a corto plazo
Categoría 4 Anormalidad sospechosa -debe considerarse biopsia
Categoría 5 Altamente sugestivo de malignidad- (estudio histológico)
Ecografía: se realiza como complemento del examen clínico o de los hallazgos mamográficos y también para guiar procedimientos invasivos de tipo diagnóstico.
Escintigrafía mamaria y Resonancia Nuclear Magnética de seno: son métodos de apoyo que se utilizarán en casos especiales de difícil diagnóstico y seguimiento.
Biopsia: el método utilizado para la obtención de la muestra depende de si la lesión es o no palpable:
Lesiones no palpables: se basan en hallazgos imagenológicos; los procedimientos diagnósticos son:
Biopsia dirigida por estereotaxia
Biopsia dirigida por ultrasonido
Lesiones palpables: el material histológico puede ser obtenido mediante:
Citología aspirativa con aguja fina
Biopsia con aguja cortante
Biopsia abierta (incisional o excisional)
La muestra debe ser suficiente para hacer estudios de inmunohistoquímica.
Estudios de extensión
Toda paciente con diagnóstico de carcinoma infiltrante de seno requiere para su adecuada estadificación de los siguientes estudios:
· Radiografía de tórax PA y lateral
· Gammagrafía ósea
· Ecografía hepática
· Cuadro hemático y química sanguínea
Tratamiento
Estadío 0. En su fase temprana el cáncer de seno puede ser una enfermedad local sin diseminación a distancia. El estadío temprano de cáncer de seno usualmente es diagnosticado por mamografía y en un alto porcentaje su tratamiento es local. En el enfoque de tratamiento para el cáncer de seno estadío 0 se tiene en cuenta, en primer lugar, el tipo histológico. Se prefiere el tratamiento quirúrgico conservador (mastectomía parcial), seguido de radioterapia. En caso contrario, la conducta quirúrgica será mastectomía total (mastectomía simple) y se plantea reconstrucción. En el estadío 0 el objetivo del tratamiento es la curación, con una expectativa de supervivencia libre de enfermedad a 5 años del 98%.
En la enfermedad de Paget del pezón localizada, el tratamiento primario también es la cirugía conservadora seguida de radioterapia y el objetivo es la curación con una expectativa de supervivencia libre de enfermedad del 95%.
Figura 2
Estadíos I y II. El tratamiento inicial generalmente es quirúrgico. El esquema de quimioterapia adyuvante se decide según el número de ganglios axilares comprometidos, el tamaño tumoral (mayor de 1 cm), factores histológicos como el porcentaje de células en fase S, aneuploidia o infiltración vascular. La presencia de receptores hormonales positivos ayuda a definir el uso de antiestrógenos. La probabilidad de recurrencia es alta para las mujeres con ganglios axilares positivos y se incrementa en proporción al número de ganglios comprometidos.
La disección axilar proporciona información pronóstica, pero tiene un efecto terapéutico mínimo o ninguno en mujeres con examen axilar clínico negativo. Por este motivo se ha incrementado el interés en desarrollar métodos que proporcionen información pronóstica como el estudio de ganglio centinela.
Figura 3
Estadío III. Su manejo inicial es con terapia sistémica (quimioterapia u hormonoterapia), excepto en casos especiales en los cuales es factible la cirugía como primer abordaje terapéutico (edema mínimo o tumor sangrante).
La cirugía inicialmente está limitada a la biopsia, mediante sus diferentes modalidades, con el propósito de obtener tejido para diagnóstico histológico y estudios especiales. Se sigue con quimioterapia u hormonoterapia o radioterapia, y si la respuesta es favorable se realiza cirugía para remover el tumor residual (mastectomía radical modificada con o sin reconstrucción o cirugía conservadora en casos escogidos). Por cuanto varios reportes indican que cerca del 90% de los tumores operables de entrada disminuyen su tamaño en más del 50% con la quimioterapia, se puede practicar cirugía menos radical en pacientes que de otra forma habrían requerido de mastectomía.
La duración del tratamiento preoperatorio, o neoadyuvante, es de 3 ó 4 ciclos según la respuesta.
Las combinaciones de más frecuente uso son: ciclofosfamida, metotrexate y fluorouracilo (CMF); doxorrubicina y ciclofosfamida (AC); fluorouracilo, doxorrubicina y ciclofosfamida (FAC); fluorouracilo, epirrubicina y ciclofosfamida (FEC). Una alternativa en estudio es la combinación de doxorrubicina y docetaxel para pacientes con factores de mal pronóstico, como es el caso del carcinoma inflamatorio.
Estas combinaciones se administran con intervalos de 3 a 4 semanas. En el postoperatorio se utilizará el mismo esquema cuando se ha demostrado una respuesta superior al 50%; de lo contrario, debe cambiarse el esquema. Estudios recientes han sugerido que la adición de 4 ciclos de taxanos a 4 ciclos de AC mejora tanto la supervivencia como el período libre de enfermedad en aquellas mujeres con compromiso ganglionar masivo (definido como compromiso de más de 4 ganglios axilares).
En mujeres premenopáusicas con receptores hormonales positivos, la ablación ovárica más tamoxifeno ha demostrado un beneficio sustancial equivalente a la combinación de quimioterapia y tamoxifeno, y este beneficio persiste hasta 15 años después del tratamiento (12, 13, 16). Las mujeres postmenopáusicas con receptores hormonales positivos o desconocidos deben recibir antiestrógenos por 5 años.
La radiación externa deberá seguir a la mastectomía radical o radical modificada. La radiación externa sigue a la quimioterapia de inducción cuando no hay respuesta o esta respuesta es parcial y el tumor no se considera quirúrgico en ese momento.
Figura 4
Estadío IV. La intención del tratamiento es paliativa y la conducta se define según el estado funcional de la paciente, utilizando todas las terapias disponibles para obtener el máximo control de los síntomas, prevenir complicaciones serias y mejorar la calidad de vida.
En casos de metástasis óseas o cuando las lesiones son consideradas críticas (compromiso espinal alto o síndrome de compresión epidural y lesiones en el sistema nervioso central), el tratamiento inicial es con radioterapia. La radioterapia también puede estar indicada para el control del tumor primario o de metástasis en partes blandas
La hormonoterapia secuencial está indicada en pacientes con receptores hormonales positivos o desconocidos.
En pacientes jóvenes con buen estado funcional o en las que progresan luego de tratamiento con hormonoterapia o cuyo compromiso metastásico es visceral, está indicada la quimioterapia.
Figura 5
Los bifosfonatos se pueden agregar a la quimioterapia o a la terapia hormonal con el fin de reducir el dolor y prolongar la supervivencia libre de complicaciones óseas.
La cirugía tiene un papel paliativo, y generalmente se limita a la biopsia del tumor primario o de las metástasis para determinar el diagnóstico, a la ablación ovárica, a la extirpación de metástasis que comprometan la vida y cuya extirpación mejore la calidad de vida o a la obtención de muestras para estudios especiales. El tumor primario puede ser removido en ciertas circunstancias (tumores sangrantes, ulceradosetc. ) o cuando el grupo interdisciplinario así lo considere conveniente.
Quimioprevención: estudios experimentales han demostrando que los estrógenos son promotores de tumores en animales, este proceso puede ser bloqueado y los tumores pueden ser prevenidos mediante intervenciones antiestrogénicas como la ablación ovárica o el uso de antiestrógenos.
El grupo de riesgo más fácil de identificar es el de mujeres con historia familiar de cáncer mamario, este riesgo es más alto cuando se incrementa el número de familiares afectadas, cuando su diagnóstico ocurre en edad temprana o cuando hay carcinomas de tipo bilateral. Algunas de las mujeres de este grupo son actualmente identificables por análisis de ADN (BRCA1 BRCA2). La mutación BRCA 1 se ha asociado a un riesgo de 65% para cáncer de ovario, y un 80% de cáncer de seno durante el transcurso de su vida.
Otros factores de riesgo descritos son menarquía temprana, menopausia tardía, edad tardía para el primer embarazo a término, múltiples biopsias mamarias o biopsia con hiperplasia atípica, carcinoma lobulillar in situ, o antecedente personal de cáncer de seno.
Todos estos factores son considerados en un modelo matemático (Gail y cols) que permite calcular el riesgo relativo de desarrollar cáncer de seno; en el estudio NSABP P1 se demostró que en pacientes con un riesgo relativo mayor de 1.66 el tamoxifen redujo el riesgo de cáncer invasivo en un 49% y de cáncer no invasivo en el 50%.
En la actualidad se están llevando a cabo otros estudios de quimioprevención en Europa que evaluarán a más largo plazo la efectividad de los antiestrógenos y otros agentes.
Nuestra recomendación es que este tipo de intervención se desarrolle dentro de protocolos de investigación.
Seguimiento de la paciente con cáncer de seno
Historia clínica y examen físico cuidadoso cada 3 a 6 meses por los primeros 3 años, cada 6 a 12 meses por los siguientes 2 años y luego anualmente.
La paciente se debe practicar autoexamen del seno mensualmente.
En toda mujer con diagnóstico de cáncer de seno se practica mamografía anualmente. En las mujeres tratadas con cirugía conservadora de seno se practica la primera mamografía a los 6 meses luego de terminar la radioterapia, después anualmente o como lo indiquen la vigilancia de anormalidades. Una vez alcanzada la estabilidad mamográfica, se continúa practicando mamografía anual.
Dado que la mayoría de recurrencias ocurren en los períodos comprendidos entre las consultas médicas, se debe informar a la paciente acerca de los síntomas de recurrencia.
La mayoría de las recurrencias ocurren en los primeros cinco años luego de terminar el tratamiento primario. El control subsecuente debe ser coordinado y no-duplicado, y se lleva a cabo por un médico con experiencia en examen de mama normal e irradiada.
Se recomienda un examen pélvico anual, el cual puede ser a intervalos más prolongados en mujeres con histerectomía abdominal total.
Los datos disponibles no permiten recomendar el uso rutinario de cuadro hemático, química sanguínea, radiografía de tórax, gammagrafía ósea, ecografía hepática, Tomografía Computadorizada, marcadores tumorales como CA 15-3, CA 27.29, ACE.
Parámetros para la formulación de quimioterapia
· Exámenes iniciales: cuadro hemático, glicemia, creatinina sérica, nitrógeno ureico sanguíneo, transaminasas, fosfatasa alcalina, bilirrubinas, electrolitos, uroanálisis.
· La administración de antraciclinas requiere ventriculografía isotópica previa que se debe repetir cuando se alcance una dosis acumulada de 250 a 300 mg/m2/subcutáneos o signos clínicos de deterioro en la función miocárdica.
· Cada administración de quimioterapia amerita practicar el día antes cuadro hemático y en los protocolos que incluyan taxanos pruebas de función hepática (transaminas, fosfatasa alcalina, bilirrubinas).
Para la aplicación de la quimioterapia vesicante se considera adecuado la colocación de catéter venoso central.
Protocolo antiemético
1. Alto riesgo emetizante
a. Doxorrubicina-ciclofosfamida
Setrón endovenoso 30 minutos antes de quimioterapia
Granisetrón 10 mg/kg
Ondansetrón 32 mg
Tropisetrón 5 mg, más dexametasona 16 mg endovenoso 30 minutos antes
de quimioterapia.
Continua con setrón por vía oral durante 5 días a partir del día 2:
Granisetrón 1 mg cada 12 horas
Ondansetrón 8 mg cada 12 horas
Tropisetrón 5 mg por día
2. Moderado riesgo emetizante
a. Ciclofosfamida-methotrexante-5 fluoracilo
Setrón endovenoso 30 minutos antes de quimioterapia
Granisetrón 10 mg/kg
Ondansetrón 24 mg
Tropisetrón 5 mg más dexametasona 16 mg intravenoso 30 minutos antes de
quimioterapia
Continúa con setrón por vía oral durante 5 días a partir del día 2:
Granisetrón 1 mg cada 12 horas
Ondansetrón 8 mg cada 12 horas
Tropisetrón 5 mg por día
3. Bajo riesgo emetizante
a. Vinorelbine-5 fluoracilo
Dexametasona 16 mg intravenoso 30 minutos antes de la quimioterapia
Continuar con metoclopramida 10 mg cada 8 horas o Alizapride 50 mg vía oral cada 8
horas a partir del segundo día por 4 días
4. Mínimamente emetizante
Docetaxel o paclitaxel
Metoclopramida hasta 30 mg intravenoso 30 minutos antes de la quimioterapia y
continuar con 10 a 30 mg vía oral cada 6 horas por 4 días, asociado con antihistamínico
cuando se usen dosis altas de metoclopramida, tipo difenhidramina 50 mg vía oral cada 6 horas
NOTA: a los pacientes que presenten emesis no controladas con estos protocolos se les hará cambio o adición de nuevos medicamentos como benzodiacepinas.
GLOSARIO
Biopsia incisional: procedimiento de tipo invasivo mediante el cual se toma muestra de un tejido tumoral para estudio histológico, sin extracción completa del tumor. Puede realizarse percutánea con aguja tipo trucut o a cielo abierto en salas de cirugía.
Biopsia escisional: es la extirpación completa de una lesión para estudio anatomopatológico.
Mastectomía parcial o mastectomía parcial: corresponde a resecciones parciales de la glándula mamaria cuya extensión puede comprender desde la tumorectomía hasta la mamoplastia oncológica.
Tumorectomía: mastectomía parcial con la cual se obtiene extirpación completa de un tumor con margen de 1 cm de tejido sano.
Cuadrantectomía: mastectomía parcial mamaria con la cual se realiza extirpación de un cuadrante de la misma.
Mamoplastia oncológica: mastectomía parcial mamaria que permite extirpaciones más amplias que las cuadrantectomías apoyándose en diferentes tipos de cirugía cosmética.
Mastectomía simple: extirpación completa de la glándula mamaria.
Mastectomía simple ampliada: extirpación completa de la glándula mamaria incluyendo el nivel I o base axilar.
Mastectomía radical modificada: extirpación completa de la glándula mamaria con disección axilar de los tres niveles, con conservación de los músculos pectorales.
Mastectomía radical: extirpación completa de la glándula mamaria con los músculos pectorales mayor y menor asociada al vaciamiento de los tres niveles.
Multifocalidad: este concepto implica la existencia de varios focos tumorales dentro de un mismo cuadrante de la glándula.
Multicentricidad: este concepto implica la existencia de varios focos tumorales en varios cuadrantes de la misma glándula
Quimioterapia neoadyuvante: primaria o de inducción.
Bibliografía
1. Shapiro S, Venet W, Strax P, et al. Pediodicscreening for breast cáncer. The healtInsurance Plan Project and itssequelae, 1963 - 1986 Baltimor. The John Hopkins University Press, 1988.
2. Treatment of early-stage breast cáncer, JAMA 265: 391-395, 1991.
3. Recht A, Come SE, Henderson IC, et al. The secuencing of chemotherapyand radiation therapy afterconservative sugery for early-stage breastcáncer. N Engl J Med 334: 1356-1361, 1996.
4. Recommended breast cáncer surveillance quidelines. American Society of Clinical Oncology. J Clin Oncol 15: 2149-2156, 1997.
5. Fisher B, Bauer M, Margolese R, et al. Five years results of a randomized clinical trial comparing total mastectomy and segmental mastectomy with or without radiation in the treatment of breast cancer. N Engl J Med 312: 665-673, 1985.
6. FisherB, et al. Tamoxifen for prevention of breast cancer. Peport of the National Surgical Breast and BowelProject P-1 Study. J of Nat Cancer Inst 90 (18): sept 16, 1998.
Cáncer de cuello uterino:
El cáncer cervicouterino es un tipo frecuente de cáncer en mujeres, y consiste en una enfermedad en la cual se encuentran células cancerosas (malignas) en los tejidos del cuello uterino.
¿Qué es el cáncer de cuello uterino?
El cáncer cervicouterino es un tipo frecuente de cáncer en mujeres, y consiste en una enfermedad en la cual se encuentran células cancerosas (malignas) en los tejidos del cuello uterino.
El útero es el órgano hueco, en forma de pera invertida, donde se desarrolla el feto. El cuello o cérvix uterino es una abertura que conecta el útero con la vagina (canal de nacimiento).
El cáncer cervicouterino empieza creciendo lentamente. Antes de que aparezcan células cancerosas en el cuello uterino, los tejidos normales del cuello uterino pasan por un proceso conocido como displasia, durante el cual empiezan a aparecer células anormales. Una citología con tinción de Papanicolaou generalmente encontrará estas células pre-malignas.
Posteriormente, las células cáncerosas comienzan a crecer y se diseminan con mayor profundidad en el cuello uterino y en las áreas circundantes.
Ya que en general no hay síntomas asociados con cáncer cervicouterino, suelen ser necesarias una serie de pruebas para diagnosticarlo.
¿Cómo se diagnostica?
Citología con tinción de Papanicolaou: Se lleva a cabo usando un pedazo de algodón, un cepillo o una espátula de madera pequeña para raspar suavemente el exterior del cuello uterino con el fin de recoger células. La paciente puede sentir algo de presion, que se acompañará en algunos casos de dolor.
Biopsia: Si se encuentran células anormales en la citología, el médico tendrá que extraer una muestra de tejido del cuello uterino y lo observará a través del microscopio para determinar la presencia de células cancerosas. Para efectuar una biopsia sólo se necesita una pequeña cantidad de tejido y puede hacerse en la consulta del médico. A veces se necesita extraer una muestra de biopsia en forma de cono, más grande (conización), para lo cual quizás sea necesario ir al hospital.
El pronóstico (posibilidades de recuperación) y selección de tratamiento dependen de la etapa en que se encuentra el cáncer (si está sólo en el cuello uterino o si se ha diseminado a otros lugares) y el estado de salud en general.
¿Qué es una citología?
El útero se comunica con la vagina a través del cérvix o cuello del útero. El cuello se encuentra recubierto por un epitelio de células escamosas y cilíndricas.
El cáncer de cérvix se origina por una degeneración o malignización de esas células, pero antes de que se llegue a ese extremo, las células del epitelio sufren una serie de alteraciones (premalignas) que pueden ser observadas mediante el microscopio.
La citología vaginal es una prueba que consiste en la toma de una muestra de las células epiteliales que recubren el cuello de útero para su posterior estudio con microscopio, y así poder observar precozmente cambios en la forma de las células que, tras la aplicación de medidas oportunas, impidan una posible progresión hacia el cáncer.
Etapas del cáncer cervicouterino:
Las siguientes etapas se usan en la clasificación del cáncer cervicouterino:
Estadio 0 o carcinoma in situ: El carcinoma in situ es un cáncer muy temprano. Las células anormales se encuentran sólo en la primera capa de células que recubren el cuello uterino, y no invaden los tejidos más profundos del cuello uterino.
Estadio I: El cáncer afecta el cuello uterino, pero no se ha diseminado a los alrededores.
I-a: una cantidad muy pequeña de cáncer, sólo visible por microscopio, se encuentra ya en el tejido más profundo del cuello uterino.
I-b: una cantidad mayor de cáncer se encuentra en dicho tejido.
Estadio II: El cáncer se ha diseminado a áreas cercanas, pero aún se encuentra en el área pélvica.
II-a: El cáncer se ha diseminado fuera del cuello uterino a los dos tercios superiores de la vagina.
II-b: el cáncer se ha diseminado al tejido alrededor del cuello uterino.
Estadio III: El cáncer se ha diseminado a toda el área pélvica. Puede haberse diseminado a la parte inferior de la vagina, o infiltrar los uréteres (los tubos que conectan los riñones a la vejiga).
Estadio IV: El cáncer se ha diseminado a otras partes del cuerpo.
IV-a: Diseminación a la vejiga o al recto (órganos cerca del cuello uterino)
IV-b: Diseminación a órganos distales como los pulmones.
Recurrente. Enfermedad recurrente (recidiva) significa que el cáncer ha vuelto después de haber sido tratado. Puede ocurrir en el propio cérvix o aparecer en otra localización.
Tratamiento del cáncer cervicouterino.
Existen tratamientos para todas las pacientes con cáncer cervicouterino. Se emplean tres clases de tratamiento:
Cirugía: (extracción del cáncer en una operación)
Radioterapia: (radiaciones de alta energia para eliminar las células cancerosas)
Quimioterapia: (medicamentos o "venenos" para eliminar las células cáncerosas).
El cáncer se puede extraer empleando alguna de las siguientes operaciones:
La criocirugía consiste en la eliminación del cáncer por congelamiento.
La cirugía con rayo láser consiste en el uso de un haz de luz intensa para eliminar células cáncerosas.
La conización consiste en la extracción de un pedazo de tejido en forma de cono en el lugar donde se encuentra la anormalidad. Se emplea para biopsias, pero también para el tratamiento de cánceres tempranos del cuello uterino.
La escisión electroquirúrgica (LEEP, siglas en inglés) usa una corriente eléctrica que pasa por un aro de alambre delgado, el cual sirve como cuchilla.
Una histerectomia es una operación en la cual se extraen todo el útero, incluyendo todo el cuello uterino, además del cáncer.
1.Histerectomia vaginal.El útero se extrae a través de la vagina.
2.Histerectomia abdominal. El útero se extrae mediante una incisión en el abdomen. Puede ser necesario extraer también los ovarios y las trompas de Falopio (Salpingooforectomia bilateral).
3.Histerectomia radical es una operación en la cual se extraen el cuello uterino, el útero y parte de la vagina. También se extraen los ganglios linfáticos del área. (Los ganglios linfáticos son estructuras pequeñas en forma de alubia que se encuentran por todo el cuerpo y cuya función es producir y almacenar células que combaten las infecciones).
Exenteración: Si el cáncer se ha diseminado afuera del cuello uterino o los órganos femeninos, puede ser necesario extraer el colon inferior, recto o vejiga (dependiendo del lugar al que se haya diseminado el cáncer) junto con el cuello uterino, útero y vagina. La paciente puede necesitar cirugía plástica para formar una vagina artificial (vaginoplastia) después de esta operación.
Tratamiento por etapas
Los tratamientos para cáncer cervicouterino dependerán de la etapa en que se encuentra la enfermedad, el tamaño del tumor, la edad y estado de salud general, y el deseo de tener hijos.
Estadio 0 (carcinoma in situ). El tratamiento puede consistir de:
1.Conización.
2.Cirugía con rayo láser.
3.Procedimiento de escisión electroquirúrgica (LEEP).
4.Criocirugía.
5.Cirugía para eliminar el área cáncerosa, cuello uterino y útero (total abdominal o histerectomia vaginal) para aquellas mujeres que no pueden o no desean tener niños.
Estadio I. El tratamiento depende de la profundidad de invasión del tumor:
I-a:1. Histerectomia abdominal total, con o sin salpingooforectomia bilateral.
2. Conización.
3. Histerectomia radical, con o sin disección de ganglios linfáticos).
4. Radioterapia.
I-b1. Radioterapia.
2. Histerectomia radical ampliada con o sin radioterapia.
Estadio II. El tratamiento depende de la profundidad de invasión del tumor:
II-a:1. Radioterapia.
2. Histerectomia abdominal total, con o sin salpingooforectomia bilateral..
II-b:1. Radioterapia.
2. Ensayos clínicos de nuevas formas de radioterapia/quimioterapia.
Estadio III. El tratamiento podría consistir en:
III-a: Radioterapia.
III-b: Ensayos clínicos de nuevas formas de radioterapia/quimioterapia.
Estadio IV. El tratamiento podría consistir en:
IV-a:1. Radioterapia.
2. Ensayos clínicos de nuevas formas de radioterapia/quimioterapia.
IV-b:1. Radioterapia para aliviar los sintomás como el dolor.
2. Quimioterapia.
RECIDIVAS. El tratamiento de la recidiva local podría consistir en:
1. Cirugía para extraer el colon inferior, el recto o vejiga (dependiendo del lugar al que se ha diseminado el cáncer) junto con el cuello uterino, útero y vagina (exenteración).
2. Radioterapia y quimioterapia.
Si el cáncer ha recurrido fuera de la pelvis, se puede optar a una prueba clínica con quimioterapia sistémica.
¿Cómo se previene?
1. Diagnóstico del Cáncer de Cuello uterino mediante el examen anual de Papanicolau.
2. Mejorar la higiene personal, empleando agua y jabón.
3. Tratamiento adecuado y rápido de las infecciones vaginales (descensos) y del cuello uterino.
4. Tratamiento rápido de las lesiones sospechosas (inflamaciones, heridas, úlceras) encontradas en el examen de Papanicolau
¿Desde qué edad se debe hacer la citología? ¿Qué grupo está en mayor peligro de presentar cáncer de cuello uterino?
La citología vaginal está indicada en toda mujer sexualmente activa, y debe realizarse con una periodicidad que suele oscilar entre el año y los 5 años, en función de los resultados de las citología previas, y de la pertenencia o no a grupos de riesgo. Es frecuente observar que los programas estatales de prevención del cáncer de cérvix se dirigen fundamentalmente a la población de mujeres de entre 35 y 65 años, tramo de edad en el que se suele observar mayor número de casos. Este hecho, no debe llevarnos al error de pensar que no exista riesgo de padecer cáncer de cérvix en las mujeres jóvenes (desde que inician su vida sexual) y en las mayores de 65 años.
Son factores de riesgo para el desarrollo del cáncer de cérvix, y por tanto la indicación de la citología es más importante y se debe realizar con más frecuencia, los siguientes:
*Inicio de relaciones sexuales en edades jóvenes.
*Relaciones sexuales con múltiples compañeros.
*Relaciones sexuales con compañero que haya tenido múltiples parejas.
*Antecedentes de infección por el virus del papiloma humano (HPV).
*Nivel socioeconómico bajo.
*Tabaquismo.
*Multiparidad.
¿Qué relación tiene con el virus papiloma humano? ¿Cómo se adquiere?
El virus de papiloma humano, o papilomavirus humano (HPV, por sus siglas en inglés) es un grupo de más de 80 tipos de virus. Se llaman papilomavirus porque ciertos tipos pueden causar verrugas, o papilomas, que son tumores benignos (no cancerosos).
Diferentes tipos de virus de papiloma humano causan las verrugas comunes que crecen en las manos y en los pies y aquéllas que se desarrollan en la boca y en el área genital. De los más de 80 tipos de virus de papiloma humano, existen más de 30 que tienen la habilidad de infectar el tracto genital. Estos virus de papiloma humano genitales pueden pasarse de una persona a otra a través de contacto sexual. Algunos virus de papiloma humano pueden causar verrugas que aparecen en o alrededor de los genitales y el ano, tanto de los hombres como de las mujeres.
Las verrugas genitales son técnicamente conocidas como condilomas acuminadas y están generalmente asociadas con dos tipos de virus de papiloma humano, el número 6 y número 11. El virus de papiloma humano también puede causar crecimientos planos anormales en el área genital y en el cuello del útero (la parte más baja del útero que se extiende a la vagina).
¿Qué pasa con el cáncer de cuello uterino en el embarazo?
El embarazo no predispone a la aparición de neoplasias y tampoco confiere ningún factor de protección. Los tumores que aparecen durante la gestación son similares, en frecuencia, a los que se presentan en mujeres no embarazadas. Los expertos comentan que los cuatro cánceres más frecuentes durante la gestación son el cáncer de cuello uterino, el de mama, el melanoma y el de ovario.
El cáncer de cuello uterino es, sin duda, la neoplasia más frecuente entre mujeres durante la gestación (1 cada 1 200 a 2 200 gestantes).
Dilema que se asocia con esta neoplasia durante el embarazo. Esta situación genera problemas de índole médico y ético. El mayor se establece ante la necesidad de brindar el mejor tratamiento oncológico sin afectar la salud del feto. La terapia puede acompañarse con pérdida del embarazo, pérdida de la fertilidad y, posiblemente, disfunción sexual subsiguiente.
Asimismo se debe considerar el impacto del embarazo sobre la biología del cáncer. Todos estos aspectos deben ser analizados por el médico, la paciente y sus familiares con la finalidad de tomar las mejores decisiones para cada caso.
Cáncer de la próstata.
A medida que el hombre envejece la próstata se hace más grande o llega a obstruir la uretra. Por mecanismos aún poco claros, lo anterior sucede de forma gradual, motivo por el cual, en las etapas iniciales no se siente la sintomatología
PRESENTACIÓN
Dentro de la política del Grupo Docente Con-Ciencia Médica, se continúa con el interés de informar a los pacientes sobre diferentes patologías. La idea es darles elementos de fácil compresión y utilidad en el entendimiento de las enfermedades. Se pretende que junto con su médico tratante, puedan combatir la batalla biológica que día a día enfrenta la especie humana. De esta forma se mejorará la calidad de vida del paciente y sus familiares. Además, es importante que el enfermo tenga conocimiento sobre su patología actual para que pueda utilizar los consejos de su médico y colabore en el respectivo manejo. Aunque el profesional de la salud tiene el conocimiento científico, es el paciente quien toma la última decisión.
Esperamos que las siguientes líneas ayuden a entender la importancia de un adecuado control preventivo de la próstata. Esa es la única forma como se puede intentar un tratamiento curativo de la enfermedad maligna a nivel de la glándula prostática.
GENERALIDADES
La próstata es una glándula masculina localizada en la base de la vejiga y en frente al recto. Tiene el tamaño de una nuez y rodea parte de la uretra, o sea el tubo que conduce la orina desde la vejiga al exterior. La próstata produce fluidos que componen el semen.
HIPERTROFÍA PROSTÁTICA BENIGNA
A medida que el hombre envejece la próstata se hace más grande o llega a obstruir la uretra. Por mecanismos aún poco claros, lo anterior sucede de forma gradual, motivo por el cual, en las etapas iniciales no se siente la sintomatología. Poco a poco el paciente tiene dificultades para realizar la micción. Esto se manifiesta con un chorro de orina delgado y difícil, infección urinaria, orina con sangre y, en los casos extremos, retención completa de orina.
La condición descrita anteriormente se llama prostatismo, que aunque no es cáncer, en ocasiones requiere corrección quirúrgica. Muchas veces el paciente espera hasta sentir los síntomas descritos anteriormente para consultar al urólogo y en ese momento es cuando se encuentra la malignidad de la próstata. Como en muchos cánceres, la oportunidad de curar es mayor cuando se diagnostica y trata en forma temprana. Una vez avanzada la enfermedad, solo se pueden aliviar los síntomas.
ENFERMEDAD MALIGNA DE LA PRÓSTATA
La enfermedad maligna de la próstata es muy común y ataca a un alto porcentaje de hombres. Se define como una patología de la glándula prostática en la cual se encuentran células malignas o cancerosas.
A partir de los 50 años todo paciente masculino debe controlarse por medio de un examen urológico completo. Esta es la forma más precoz para diagnosticar la enfermedad. Aunque se encuentra principalmente en hombres mayores, no se excluyen los adultos de edad mediana. Cuando el individuo es de raza negra o tiene historia familiar de la enfermedad, el control debe iniciar a los 40 años.
A partir de los 50 años todo paciente masculino debe controlarse por medio de un examen urológico completo.
Chorro de orina delgado y difícil, infección urinaria, orina en la sangre y , en los casos extremos, retención completa de orina.
SÍNTOMAS
Es frecuente preguntar al urólogo sobre la forma de identificar la sintomatología del cáncer de próstata.
Muchos pacientes desean conocer alguna señal de alarma al respecto. Es interesante saber que la patología maligna de la glándula prostática NO produce síntomas en los estados iniciales.
Da su primer llamado de atención cuando se encuentra el cáncer en estado avanzado y en ese momento ya no se puede ofrecer tratamiento curativo.
EXAMEN
Para examinar al paciente, el urólogo introduce un dedo por el recto y de esta forma realiza el tacto rectal de la glándula prostática. En ese momento evalúa si consistencia, tamaño y característica.
Además, ordena un examen sanguíneo denominado antígeno prostático específico ( APE o PSA según la sigla en inglés) . Esta es una proteína producida en la próstata y generalmente se encuentra elevada cuando hay cáncer prostático. Su valor normal depende del tamaño de la glándula, de edad del paciente.
Según lo encontrado en los exámenes anteriores, se puede ordenar un estudio de ultrasonido transrectal de la próstata, con posibilidad de toma de biopsia; el tejido tomado en el examen es enviado a patología, en donde el especialista lo analiza al microscopio y da le diagnóstico específico. El ultrasonido aislado aporta poco diagnóstico.
La patología maligna de la glándula prostática NO produce síntomas en los estados iniciales.
ESTADOS
Una vez diagnosticado el cáncer de la próstata, es necesario hacer más exámenes. Estos determinan si las células malignas están localizadas en la glándula o fuera de ella. Por medio de lo anterior se evalúa el estado de la enfermedad. Cuando el paciente de ha clasificado, es posible decidir el manejo ideal.
Estado A: ( T1C)
El tumor no se puede sentir al tacto rectal y no produce síntomas. El antígeno prostático específico está elevado.
Estado B: (T2)
Se puede sentir al tacto rectal, está localizado en la glándula y tampoco produce síntomas.
Estado C : ( T3)
La patología maligna ha salido de la glándula a los tejidos vecinos.
Estado D: ( N) ó (M)
Se encuentran metástasis o siembras a distancia en diferentes órganos
Además de la clasificación anterior, existe otra más específica, generalmente usada por el especialista y es la llamada TMN. Todo lo anterior sirve para darle al paciente un mejor plan de tratamiento. Los estudios a nivel mundial tienen un manejo recomendado para cada estado de la enfermedad.
MANEJO
Siempre hay alguna clase de tratamiento para los pacientes con cáncer en la próstata. Algunos de ellos son curativos y otros solo demoran el crecimiento del tumor o sea mejoran los síntomas de la enfermedad.
Cirugía
Es un tratamiento común en el cáncer de la próstata, el cual si es descubierto en los estados iniciales, puede ser curado.
Postatectomía radical:
Consiste en retirar completamente la próstata y vesículas seminales. Solo se realiza si la enfermedad maligna se encuentra localizada en la glándula prostática. Posterior a este procedimiento quirúrgico, se puede presentar impotencia sexual e incontinencia urinaria:
Prostatectomía transuretal:
Esta no es una cirugía curativa. Consiste en cortar el tejido prostático que obstruye la uretra e impide la salida de orina desde la vejiga. Se le ofrece a los pacientes con tumor fuera de la próstata quienes presentan obstrucción urinaria.
Hormoterapia
El cáncer de la próstata se nutre gracias a las hormonas que producen los testículos y las glándulas suprarrenales. Al existir éstas en la circulación sanguínea se favorece el crecimiento y diseminación de las células malignas. Debido a lo anterior el tratamiento hormonal consiste en bloquear estas sustancias.
Una forma sencilla de lograr esto es retirar los testículos. Además, existen medicamentos que anulan el efecto de las hormonas testiculares. Este tratamiento se hace generalmente cuando el paciente tiene cáncer prostático avanzado.
La clase de tratamiento para el cáncer de la próstata depende del estado de la enfermedad, edad y condición general del paciente. Debido a lo anterior, las modalidades de manejo se individualizan para cada persona.
Finalmente, es importante dejar en claro que lo mejor en el manejo del cáncer de la próstata es el diagnóstico precoz. Si éste se encuentra en estados iniciales, se puede curar.
Radioterapia
Es un método de manejo del cáncer por medio de radiación de alta energía, la cual mata las células malignas y de esta forma disminuye el tamaño del tumor. Puede ser externa por medio de máquinas fuera del cuerpo o con elementos radioactivos que se colocan dentro del mismo y se llaman braquiterapia. Cada cual tiene sus respectivas indicaciones y complicaciones .
Es urgente crear conciencia en los hombres sobre la realización del examen urológico anual. Esta conducta es la diferencia entre una muy buena calidad de vida y una desastrosa y dolorosa muerte.
Cáncer de seno.
Es un crecimiento maligno del tejido mamario. El cáncer se puede extender fundamentalmente a los ganglios linfáticos cercanos y menos frecuentemente a órganos a distancia (pulmones, pleura, hueso, pelvis e hígado).
¿Qué es el cáncer de seno?
Es un crecimiento maligno del tejido mamario. El cáncer se puede extender fundamentalmente a los ganglios linfáticos cercanos y menos frecuentemente a órganos a distancia (pulmones, pleura, hueso, pelvis e hígado). Raro en hombres (aunque posible) y en mujeres por debajo de los 30 años, con mayor incidencia entre los 45 y los 65, aumenta después de la menopausia.
¿Cuáles son sus causas?
Son desconocidas.
Se han descrito dos alteraciones genéticas que predisponen al mismo en los genes BCR1 y 2, aunque éstas sólo justifican menos del 5 % del total de los cánceres de mama (se constata la alteración en estos genes en 1 de cada 200 mujeres).
¿Cómo se manifiesta? Que síntomas da?
Los síntomas más característicos son:
*Asintomático, al principio.
*Retracción del pezón.
*Bultos en mama o en axilas
*Líquido sanguinolento en los pezones, a veces.
¿Cómo se diagnostica?
Para verificar la naturaleza de los síntomas observados, el médico cuenta con varios elementos que le permiten tener una visión más completa de los senos:
*Ultrasonido o ecografía: ofrece una imagen del seno y de las formaciones extrañas que aloje en su estructura.
*Citopunción o aspiración: consiste en la extracción, mediante una aguja, de líquido y células provenientes de la masa extraña, para ser estudiados bajo el microscopio.
*Mamografía: es una imagen muy exacta del tejido de los senos, tomada para identificar posibles masas en las mamas.
*Biopsia: extracción de una pequeñísima porción de tejido para ser estudiado en el laboratorio y determinar su malignidad.
*Resonancia magnética: técnica basada en imágenes aún más exactas que la mamografía y la ecografía.
*Estudios genéticos: desde que se identificaron los genes causantes del cáncer de seno ha surgido la posibilidad de efectuar análisis genéticos a las mujeres con historia familiar de cáncer, con el fin de mantener un control precoz de la enfermedad. No obstante, tal análisis genético no está todavía muy aceptado dentro de la comunidad médica.
¿Es hereditario? ¿Qué mujer está más en posibilidad de tenerlo?
Factores de riesgo:
Las mujeres por encima de los 50. El cáncer de mama tiene un futuro preocupante, pues día a día la incidencia de esta patología aumenta.
La población más afectada va desde los 40 años en adelante, sin embargo mujeres jóvenes entre 25 y 30 años también se han visto afectadas.
El factor genético es determinante. La historia familiar de cáncer de mama (grupo en el que se incluyen las pacientes con las citadas mutaciones genéticas, por lo que quizás las mujeres con historia familiar importante, varias familiares consanguíneas directas diagnosticadas de cáncer de mama, podrían someterse a las pruebas para detectarlas.
En caso de ser positivas, los expertos aconsejarán el mejor plan individualizado de tratamiento y un seguimiento muy estricto. Otros factores son:
*Antecedente de cáncer de mama.
*Exposición a radiaciones.
*Pacientes con cáncer de ovario o endometrio.
¿Cómo se previene?
Algunas recomendaciones de tipo general para disminuir el riesgo de sufrir cáncer de seno son:
*Mantener una dieta baja en grasas, especialmente de origen animal
*Beber alcohol con moderación
*No fumar
*Hacer ejercicio regularmente
*Autoexamen de los senos una vez al mes
*La lactancia natural reduce la aparición de cáncer de mama.
Tratamiento.
Existen tratamientos para todas las pacientes con cáncer del seno. Se emplean cuatro tipos:
-Cirugía (la extracción del cáncer en una operación)
-Radioterapia (el uso de dosis elevadas de rayos X para eliminar las células cancerosas)
-Quimioterapia (el uso de fármacos para eliminar las células cancerosas)
-Terapia hormonal (el uso de fármacos para cambiar la forma en que actúan las hormonas, o la extirpación de órganos que producen hormonas, como los ovarios).
Se evaluan en pruebas clínicas la terapia biológica (el uso del sistema inmunitario para combatir el cáncer), el trasplante de médula ósea, y el transplante de células madres periféricas sanguíneas.
Pronóstico
La mayoría son curables si se detectan a tiempo.
La probabilidad de recuperación (pronóstico) y la selección de tratamiento dependerán de la etapa en la que se encuentra el cáncer (si sólo se encuentra en el seno o si se ha diseminado a otros lugares del cuerpo), el tipo de cáncer del seno, ciertas características de las células cancerosas y si el cáncer se encuentra en ambos senos. La edad, peso, estado menopáusico (si tiene o no aún período menstrual) y salud en general de la paciente también pueden afectar el pronóstico y la selección de tratamiento.
¿Qué es el autoexamen y que utilidad tiene?
La mujer debe conocer sus senos sobre todo después de la menstruación, cuando el flujo hormonal baje, con el seno más relajado debe hacer una exploración, sin embargo, hay tumores que crecen muy rápido, en uno o dos meses, pueden demorar años creciendo, es importante la autoexploración, la exploración del médico y la mamografía períodica.
Se deben mirar los senos en el espejo, mírelos de frente y de costado. Deje sus brazos a los costados, luego junte sus manos detrás de tu cabeza y presiona hacia adelante, luego presione sus manos sobre las caderas.
Palpe sus senos cuando este parada o sentada. Mueva las yemas de los dedos en forma circular para no dejar ningún área del pecho y del seno sin controlar. Luego chequee por alguna protuberancia arriba y abajo del área de la clavícula y de la axila. Puede hacer esto cuando este en la ducha.
Palpe sus senos cuando este acostada.
Esto es lo que usted debe buscar en el autoexámen:
-Un nódulo, que generalmente esta solo, es firme y en la mayoría de los casos indoloro.
- Un endurecimiento en el seno.
- Una porción de la piel del seno que se inflama y aparece diferente.
- Las venas en la superficie de la piel se hacen más prominentes en un pecho que en el otro.
- El pezón se invierte, aparece un salpullido, o algún tipo de descarga o sangrado del pezón.
- Aparece una depresión en algún lugar de la piel del seno.
- Recuerda que la mayoría de las mujeres experimenta algún tipo de hinchazón en los senos.
Solo un pequeño porcentaje de esos nódulos son malignos.
¿Cuándo se debe consultar al médico?
Se debe ver a un médico si se observa cambios en los senos. Éste puede recomendarle una mamografía, un tipo especial de radiografía de los senos que puede encontrar tumores que son demasiado pequeños para ser detectados mediante el tacto. Si se encuentra una masa en el seno, su médico quizás tenga que cortar un pedazo pequeño y observarlo bajo el microscopio para determinar la presencia de células cancerosas. Este procedimiento se conoce como biopsia. Algunas veces la biopsia se hace insertando una aguja en el seno con el propósito de extraer parte del tejido del seno. Si la biopsia indica que hay cáncer, es importante que se hagan algunos análisis de las células cancerosas (llamados análisis de receptores de estrógeno y progesterona).
Cáncer del estomago.
El cáncer del estómago, también conocido como cáncer gástrico, es una enfermedad en la que se encuentra células cancerosas (malignas) en los tejidos del estomago. El estómago es un órgano en forma de J que se encuentra en la parte superior del abdomen donde los alimentos se descomponen.
¿Qué es el cáncer del estómago?
El cáncer del estómago, también conocido como cáncer gástrico, es una enfermedad en la cual se encuentran células cancerosas ( malignas ) en los tejidos del estómago. El estómago es un órgano en forma de J que se encuentra en la parte superior del abdomen donde los alimentos se descomponen ( digestión ).
Los alimentos llegan al estómago a través de un tubo llamado esófago que conecta la boca con el estómago. Después de pasar por el estómago, los alimentos parcialmente digeridos pasan al intestino delgado y luego al intestino grueso o colon.
A veces el cáncer puede encontrarse en el estómago durante mucho tiempo y crecer considerablemente antes de causar síntomas. En las etapas iniciales del cáncer del estómago, el paciente podría sufrir de indigestión y malestar estomacal, sentirse inflamado después de comer, tener nausea leve, perdida de apetito o acidez. En las etapas mas avanzadas del cáncer del estómago, el paciente podría presentar sangre en las heces, vomito, perdida de peso o dolor de estomago.
La probabilidad de que al paciente le de cáncer gástrico es mas alta si ha tenido una infección del estomago causada por Helicobacter pylori, si es de edad avanzada, si es hombre, si fuma cigarrillos o si consume con frecuencia una dieta de comida seca y salada.
El médico también puede mirar dentro del estómago con un tubo delgado iluminado que se llama gastroscopio. Este procedimiento, conocido con el nombre de gastroscopia, detecta la mayoría de los cánceres del estómago. Para efectuar este examen, se introduce el gastroscopio por la boca y se dirige hacia el estómago. El médico pone anestesia local ( un medicamento que causa perdida de la sensibilidad durante un periodo corto ) en la garganta, o administra otra medicina para relajar al paciente antes del examen y de esta forma la persona no siente dolor o molestia.
¿Qué síntomas presenta? ¿Cómo se diagnostica?
Los síntomas incluyen un dolor impreciso en el abdomen superior, que puede asociarse con mal apetito y perdida de peso. Muchos individuos se ponen anémicos pero, por lo demás, no muestran ningún síntoma antes que ocurra la diseminación metastática. Otros síntomas pueden incluir nausea, vómitos, variación en los hábitos intestinales, mal apetito y debilidad e infección con Helicobacter pylori.
El tratamiento debe incluir la cirugía. Cuando no se puede hacer una extirpación quirúrgica completa, se puede utilizar la radioterapia junto con agentes quimioterapéuticos.
Otros factores que aumentan la probabilidad de contraer cáncer del estómago son un trastorno del estomago llamado gastritis atrófica, la enfermedad de Menetrier, un trastorno de la sangre llamado anemia perniciosa o un estado hereditario de crecimientos ( pólipos ) en el intestino grueso.
Si hay síntomas, el medico suele ordenar una radiografía de la región gastrointestinal superior (también conocida como serie GI superior). Para este examen, el paciente bebe un liquido que contiene bario, el cual permite que se observe el estomago con mayor facilidad en la radiografía. Generalmente, esta prueba se realiza en la oficina del medico o en el departamento de radiología del hospital.
Si el medico observa tejido anormal, quizás tenga que extraer un pedazo pequeño para observarlo en el microscopio con el fin de determinar si hay células cancerosas. Este procedimiento se conoce como biopsia. Generalmente, las biopsias se hacen durante la gastroscopia.
La probabilidad de recuperación ( pronostico ) y la selección del tratamiento dependerán de la etapa en la que se encuentre el cáncer (si se encuentra en el estomago o si se ha diseminado a otras partes del cuerpo) y del estado de salud general del paciente.
¿Tiene tendencia familiar?
Además de factores hereditarios y ambientales, ciertas enfermedades suponen un mayor riesgo para el desarrollo de cáncer gástrico:
1)Metaplasia intestinal del epitelio gástrico, tal como sucede en la gastritis crónica atrófica ( igual que en pacientes con anemia perniciosa ).
2)Adenomas gástricos ( pólipos )
Sin conocer su etiología, la única esperanza para mejorar el pronóstico de los enfermos con cáncer gástrico es el diagnóstico precoz, cuando la extirpación curativa todavía es posible.
Los factores reconocidos de riesgo de cáncer del estómago incluyen: infección gástrica con helicobacter pylori, edad avanzada, genero masculino, dieta que incluya alimentos salados secos, gastritis atrófica, anemia perniciosa, fumar, enfermedad de Menetrier y poliposis familiar.
¿Quién lo debe manejar?
Preferiblemente un gastroenterólogo, quien se debe ascesorar adecuadamente de un cirujano general, oncólogo o quimioterapeuta, según el caso. Es importante recordar que el manejo del cáncer gástrico debe ser multidisciplinario.
¿Existe alguna condición de la dieta que lo aumente?
Los alimentos pueden contener sustancias cancerígenas naturales, como la cafeína --relacionada con el cáncer de vejiga--, hongos como la aflatoxina -- relacionada con el cáncer de hígado--, contaminantes de residuos industriales o pesticidas.
El consumo de nitratos se ha relacionado con el cáncer de estómago. Estos se reducen a nitritos por las bacterias del tubo digestivo, con producción de unas sustancias de efecto cancerígeno llamadas nitrosaminas. Los pescados congelados y ahumados, y las carnes curadas son especialmente ricos en nitrosaminas.
También se ha señalado que el consumo de carnes a la brasa genera hidrocarburos aromáticos, que son cancerígenos. Además, muchos alimentos contienen estos hidrocarburos aromáticos policíclicos, tales como el bonito ahumado, el aceite de coco y las salchichas.
¿Que población tiene más frecuentemente cáncer gástrico?
Raramente se da antes de los 40 años. Su incidencia aumenta a partir de esa edad y alcanza un pico en la séptima década de la vida. Es el doble de frecuente en el varón que en la mujer.
Tratamiento.
Existen tratamientos para la mayoría de los pacientes con cáncer del estómago. Se emplean dos clases de tratamiento:
*cirugía (extracción del cáncer en una operación)
*Quimioterapia (uso de medicamentos para eliminar las células cancerosas).
La radioterapia y la terapia biológica se evaluan en ensayos clínicos. La cirugía es un tratamiento común para todas las etapas del cáncer del estómago.
El medico puede eliminar el cáncer por medio de uno de los siguientes procedimientos:
En una gastrectomia subtotal se extrae la parte del estómago que contiene cáncer y parte de otros tejidos y órganos que están cerca del tumor. También se extraen ganglios linfáticos cercanos (disección de ganglios linfáticos). El bazo (un órgano en el abdomen superior que filtra la sangre y extrae glóbulos viejos) puede extraerse si fuera necesario.
En una gastrectomia total se extrae todo el estómago y partes del esófago, el intestino delgado y otros tejidos cercanos al tumor. El bazo se saca en algunos casos. Lo mismo sucede con los ganglios linfáticos cercanos. El esófago se conecta al intestino delgado para que el paciente pueda continuar comiendo y tragando.
Si sólo se extrae parte del estómago, el paciente podrá seguir comiendo de una manera bastante normal. Si se extirpa todo el estomago, es posible que necesite ingerir comidas pequeñas y frecuentes, con alimentos que contengan poca azúcar, mucha grasa y proteína. La mayoría de los pacientes pueden ajustarse a este nuevo régimen alimenticio.
La quimioterapia consiste en el uso de medicamentos para eliminar células cancerosas. Se puede tomar en forma de píldoras o introducirse en el cuerpo con una aguja en una vena o músculo. Es un tratamiento sistémico debido a que el medicamento se introduce al torrente sanguíneo, viaja a través del cuerpo y puede eliminar células cancerosas fuera del estómago.
El tratamiento que se administra después de la cirugía, cuando no se pueden ver células cancerosas, se llama terapia adyuvante. La terapia adyuvante para el cáncer del estomago se evalúa en ensayos clínicos.
La radioterapia consiste en el uso de rayos X, de alta energía para eliminar células cancerosas y reducir tumores. La radiación puede provenir de una maquina fuera del cuerpo ( radioterapia externa ) o de materiales que producen radiación ( radioisotopos ) introducidos a través de tubos plásticos delgados al área donde se encuentran las células cancerosas ( radioterapia interna ).
¿Cuál es el pronóstico?
El pronostico depende de la diseminación de la enfermedad en el momento en que se hace el diagnostico y del éxito del tratamiento correcto para la situación clínica. Debido a que ocurre con tan poca frecuencia en el grupo de edad pediátrica, hay información muy escasa acerca de los resultados del tratamiento en los niños.
INTERVENCION PSICOLOGICA
EN PACIENTES DE CANCER
El tratamiento psicológico del paciente de cáncer tiene como objetivo mejorar la calidad de vida y la adaptación, tanto del paciente como de los miembros de su entorno familiar. Por otro lado, en todo momento la intervención psicológica ha de estar integrada con el servicio de atención médica de un modo inter/multidisciplinar.
El estilo de afrontamiento y el nivel de ajuste o adaptación del paciente ante el cáncer va a depender:
del grado de patología a nivel clínico
de los efectos de los tratamientos (cirugía, quimioterapia, radioterapia, etc.)
del nivel y modo de información que reciba
del apoyo social y recursos ambientales
así como de las competencias del paciente para hacer frente al estrés y la disponibilidad de tratamiento psicológico
Las líneas de intervención psicológica en el área del cáncer son las siguientes:
Intervenciones preventivas: Eliminación de hábitos de consumo de sustancias de riesgo, afrontamiento del estrés, adopción de hábitos saludables y de conductas que faciliten la detección temprana de tumores.
Información adecuada al paciente: Contenidos, tipos de información, estilo, vías de administrar la información al paciente y familiares, así como el momento y la secuencia más oportuna.
Preparación a la hospitalización y tratamientos: Con el objeto de reducir la ansiedad y el impacto estresor que conllevan y adquirir respuestas adaptativas a esta situación. En este caso, el objetivo es controlar las reacciones emocionales y repertorios de afrontamiento ante la hospitalización y la cirugía.
Tratamiento tras el diagnóstico de cáncer: Con el objetivo de reducir la ansiedad, depresión y reacciones emocionales desadaptativas; promover un sentido de control personal y participación activa; dotar al sujeto de estrategias para hacer frente al estrés y facilitar la comunicación del paciente con su pareja y su familia.
Tratamientos asociados a la patología del cáncer o tratamientos médicos del Cáncer. En este apartado las áreas de mayor aplicación de intervención psicológica son:
Control de reacciones condicionadas y otros efectos asociados a la quimioterapia: ansiedad, náuseas y vómitos anticipatorios asociados, control de la fatiga, cambios en aspecto físico (alopecia), etc. O la radioterapia: miedo a posibles quemaduras, efectos de fatiga y malestar.
Afrontamiento del transplante de médula ósea: un tratamiento altamente agresivo que implica muchos estresores físicos y psicológicos, incluyendo aislamiento en un ambiente libre de gérmenes, fluctuaciones en el estatus médico, procedimientos médicos invasivos, infecciones repetidas, etc.
Dolor agudo asociado a procedimientos diagnósticos tales como punciones lumbares, endoscopias, biopsias, etc.
Dolor crónico producto de la patología del cáncer.
Anorexia, que puede ocurrir secundariamente a las tres principales modalidades de tratamiento, cirugía, quimioterapia y radiación o por la propia patología de cáncer.
Problemas sexuales. Cierta proporción de los pacientes de cáncer adquieren, como resultado o en asociación con el tratamiento, algún tipo de disfunción o problema sexual, esto es particularmente cierto en algunas localizaciones tumorales tales como colorrectales, ginecológicas, urológicas y mama.
Adaptación a amputaciones, ostomías y otros efectos de intervenciones quirúrgicas.
Intervención en la fase terminal: Con el objetivo de paliar el proceso lo más posible tanto en el paciente como en sus familiares.
Selección y entrenamiento de personal voluntario: Que sirven de apoyo social y ayuda a las intervenciones médicas y psicológicas.
Entrenamiento de afrontamiento del estrés para personal médico y de enfermería: Dirigido al entrenamiento de habilidades para la relación terapéutica, así como a dotar de estrategias para el manejo de situaciones problemáticas ante el paciente oncológico.
1. INFORMACIÓN AL PACIENTE DE CÁNCER
Un tema prioritario es la información que se administra al paciente acerca del diagnóstico, pronóstico y tratamiento. Aunque hasta la década de los sesenta la mayor parte de los médicos tendía a informar escasamente o no informar a los pacientes de cáncer del trastorno que padecían, la tendencia en los últimos años se ha invertido, en algunos países, cono Estados Unidos, por imperativos legales, en otros por razones diversas entre las que se incluyen la demanda de los propios pacientes y la adopción de un modelo de atención médica más centrado en el papel activo del paciente. Probablemente, también sea importante el haber constatado que los pacientes informados correctamente muestran una mejor adaptación social a largo plazo, aunque no de forma inmediata.
Los efectos positivos de la información al paciente de cáncer dependen del contenido de la información, de cómo y de cuándo se emita. Respecto al contenido de la información ésta debe incluir al menos:
-
El diagnóstico y características clínicas del cáncer.
-
Características de los procedimientos de diagnóstico y tratamiento, las razones por las que se aplican y los efectos benéficos que comportan.
-
Efectos colaterales de los tratamientos, tipos e incidencia y estrategias o medios para disminuir o paliar los efectos negativos: prótesis, posible caída del cabello, náuseas y vómitos, etc.
En cuanto al cómo y el cuándo:
-
La información ha de ser secuencial, es decir, ha de tener en cuenta los diferentes
momentos o fases del proceso asistencial, de forma que sea específica y concreta a la situación en que se encuentre.
-
Debe estar administrada por el especialista del área en cuestión, de forma que los aspectos acerca de las características y curso de la enfermedad han de ser comunicados por el médico, mientras que los aspectos psicosociales han de ser comunicados por el psicólogo. Inicialmente, la información se dará por medio de conversación, pudiendo complementarse mediante folletos, películas o información provenientes de otras personas que hayan pasado por una experiencia similar (en este caso es imprescindible un entrenamiento específico de esas personas).
- Debe ser congruente, de forma que lo que se le dice al paciente a través de los
distintos canales de información sea similar. Por eso es importante que la
comunicación tanto del diagnóstico, como del pronóstico y efectos de los
tratamientos sea dada al mismo tiempo que al paciente a su pareja y a los
familiares más allegados. La adecuada comunicación entre los miembros del
equipo de intervención asegurará dicha congruencia.
-
Hay que adecuar la información al estilo de afrontamiento del paciente. La investigación ha revelado distintos estilos de afrontamiento por parte de los pacientes, algunos prefieren olvidar, negar o evitar la evidencia de la enfermedad. En este caso, una información reiterada y exhaustiva puede serles negativa, mientras que otros prefieren buscar cuanta más información mejor, por lo que se les debe facilitar la máxima posible.
-
La información ha de estar estructurada integrando un esquema conceptual de lo que significa el cáncer, pues en muchos casos es necesario hacer comprender al paciente que el concepto que tiene sobre el cáncer es incorrecto e inadaptivo. Asimismo hay que insistir en las posibilidades de intervención actuales, insistiendo en las elevadas tasas de recuperación que se consiguen, y destacar la importancia de la actuación que debe llevar a cabo el propio paciente.
En todo caso, la información ha de ser realista y hay que abstenerse de ofrecer panaceas, ni expectativas positivas infundadas.
La información del diagnóstico o tratamientos a seguir, puede hacerle sentir al paciente mayor ansiedad inicialmente, pero a medio y largo plazo los pacientes informados y sus familiares logran desarrollar una mejor adaptación al proceso: la ausencia de información puede producir una mejor adaptación pero sólo a corto plazo. Ha de tenerse en cuenta que el dar información puede llevar a un mayor estado de estrés sólo si no se acompaña de entrenamiento en estrategias para afrontar los problemas que se originarán. Conviene, por tanto, registrar los efectos de la información, así como la precisión y comprensión por el paciente de lo que se ha comunicado.
2. PREPARACIÓN DE INTERVENCIONES QUIRÚRGICAS EN PACIENTES DE CÁNCER.
La aplicación de cirugía, con el propósito de eliminar las fuentes tumorales, es uno de los primeros y más efectivos tratamientos en oncología. Sin embargo, es al mismo tiempo que una garantía de curación, un fuerte estresor para muchos pacientes ya que provoca, en ellos y sus familiares cercanos, reacciones de miedo a la muerte, a la desfiguración, dolor, pérdida de control, etc. Se distinguen cuatro áreas que afectan a la adaptación del paciente a la cirugía:
el peligro representado por la cirugía en sí misma, esto es la amenaza de la anestesia
general, incisión, amputación, etc. ;
los efectos postoperatorios del procedimiento: dolor, malestar, reducida capacidad
para la actividad física y la ambulación;
la incapacidad para reasumir los roles sociales deseables, como son actividades
recreativas, deberes familiares y ocupacionales;
aspectos asociados a la condición médica a largo plazo, registro de síntomas y
signos de enfermedad, así como la perspectiva de próximas intervenciones médicas (radioterapia, quimioterapia, etc.).
Las intervenciones adecuadas para la preparación quirúrgica incluyen las siguientes áreas:
Información de procedimiento: Si ha aportar información precisa de lo que se le va
A hacer al paciente, el momento en que se va a llevar a cabo, y las razones por las que se realiza, lo que contribuirá a reducir el distress y minimizará la incertidumbre.
Información subjetiva y de sensaciones: Se ha de ofrecer información al paciente
Sobre las sensaciones somáticas producidas por la operación, el los que se distinguen de aquellas producidas por la enfermedad, así como de las reacciones emocionales que experimentará el paciente ante sucesos específicos. Se trata de que el paciente haga interpretaciones benignas de estas sensaciones y que sean percibidas correctamente y no como signos de alarma. La información, ya sea de procedimiento o subjetiva, se ha de dar personalmente, secuenciada, para no sobrecargar al paciente, mediante entrevista directa y con la ayuda de folletos informativos o medios audiovisuales.
c) Estrategias de afrontamiento específicas: Dotar al paciente de estrategias orientadas al problema y al control de la emoción. Entre las estrategias orientadas al problema se aplican frecuentemente: entrenamiento en respiración profunda,
relajación, toser, movilización de extremidades y ejercicios de ambulación para facilitar la recuperación de capacidades físicas. Entre las estrategias de afrontamiento centradas en emociones: petición apropiada de la medicación,
distracción cognitiva, visualización, atención orientada a los aspectos positivos,
interpretación positiva de sensaciones y control autoinstruccional. Los pacientes han
de ser entrenados en estas técnicas, y expuestos en imaginación o en vivo
gradualmente a estímulos que permitan la práctica y habituación a los estímulos
estresantes relacionados con la cirugía.
3. PROGRAMAS DE INTERVENCIÓN TRAS EL DIAGNÓSTICO DE CÁNCER
Los objetivos en este momento implican:
reducir la ansiedad, depresión, y otras reacciones emocionales desadaptativas
facilitar la adaptación al cáncer induciendo un estilo de afrontamiento positivo
promover en los pacientes un sentido de control personal sobre sus vidas y una participación activa en su tratamiento del cáncer
desarrollar estrategias de resolución de problemas para ocuparse de los relacionados con el cáncer
facilitar la comunicación del paciente con su pareja y otros miembros familiares
estimular la participación en actividades y mejorar relaciones sociales
Los procedimientos de intervención que se han aplicado con mayor profusión han sido fundamentalmente programas cognitivo-conductuales.
Comienzo de la terapia (2-4 sesiones)
Alivio de síntomas: El terapeuta enseña al paciente a desarrollar estrategias de
afrontamiento para los problemas inmediatos como malestar emocional,
depresión, ansiedad o crisis vitales. Se utilizan técnicas como resolución de problemas, técnicas de distracción, relajación, asignación de tareas graduales y secuenciación de actividades.
Vivir una vida ordinaria: El terapeuta explica los principios para maximizar la
calidad de vida. Se trata de ayudar al paciente y a su pareja a planificar y usar el tiempo disponible tan activa y recompensantemente como se pueda. Se aplican técnicas de secuenciación y planificación diaria, que incluyen actividades de maestría y placer, que ayudan a estimular el sentido de control del paciente, al observar que puede realizar un amplio rango de actividades, y su motivación y disfrute, puesto que se eligen actividades agradables para el sujeto.
Enseñar el modelo cognitivo: Se enseña al paciente la conexión entre los pensamientos automáticos y los estados de humor y la conducta, con ejemplos de su vida diaria.
Estimular la expresión manifiesta de sentimientos: Se estimula al paciente a expresar y aceptar emociones negativas tales como la ira y la desesperación antes de estar sujeta a cualquier prueba de realidad, las emociones no son “buenas” o “malas”, simplemente se sienten, su identificación correcta permite conocer cuáles son sus causas y, posteriormente, la forma de hacerles frente.
Fase intermedia (3-6 sesiones): Disminuido el primer impacto estresor y conocido el modelo cognitivo por el paciente, la intervención se puede centrar más en dichos aspectos cognitivos siguiendo estos pasos:
Enseñar a desafiar pensamientos automáticos y principios básicos de pruebas de
realidad para aplicarlos a sus problemas emocionales.
Continuar el uso del proceso de resolución de problemas: Ahora, a diferencia del
primer nivel, el objetivo se centra en reducir el estrés emocional ante temas menos
urgentes pero igualmente importantes, por ejemplo, aislamiento social, problemas de comunicación con la pareja, dificultades en afrontar posibles consecuencias del cáncer, etc. El paciente y su pareja adoptan un papel activo en resolución de problemas conforme la terapia avanza.
Terminación de la terapia (1-3 sesiones): Esta fase se compone de los siguientes
elementos:
Prevención de recaídas: Se discuten y entrenan las estrategias a utilizar ante el
posible retorno de problemas emocionales.
Planificar el futuro: Según progresa la terapia se abordan metas a más largo plazo.
Se estimula a las parejas a establecer metas realistas para 3, 6 ó 12 meses por delante y a hacer planes prácticos para alcanzarlas.
Identificar supuestos subyacentes: Al seleccionar pacientes es apropiado explorar
creencias que dan lugar a sus problemas emocionales y ayudarles a cambiar reglas y supuestos que relacionan su modo de estar en el mundo.
La investigación acerca de los tratamientos cognitivo-conductuales en cáncer, aunque escasa, muestra consistentemente que las intervenciones cortas (de menos de 10 sesiones) aplicadas tras el diagnóstico de cáncer son altamente beneficiosas, tanto a corto plazo como a largo plazo para producir un afrontamiento positivo de los pacientes de este acontecimiento estresante, que les lleva a disminuir problemas de ansiedad, depresión y mantener su calidad de vida.
4. TRATAMIENTO PSICOLÓGICO DE LAS REACCIONES CONDICIONADA A LA QUIMIOTERAPIA
Si bien el tratamiento con quimioterapia es enormemente eficaz para impedir e desarrollo de nuevos tumores, lleva consigo efectos colaterales, los más comunes de los cuales son la ansiedad, náuseas y vómitos. Los estudios epidemiológicos revelan que entre el 25% y el 65% de los pacientes tratados con quimioterapia se sensibilizan al tratamiento, desarrollando reacciones de ansiedad y presentando náuseas antes del mismo.
Tan frecuentes y conocidos son estos fenómenos que los pacientes que comienzan la terapia generalmente presentan ya una cierta aprensión por este tipo de procedimientos.
Los programas de tratamiento psicológico más empleados han sido los siguientes:
Hipnosis: Consiste en la inducción de la hipnosis, con sugestiones de relajación
profunda y visualización de escenas placenteras. Para asegurar su eficacia se ha de practicar fuera de la sesión.
Relajación muscular progresiva con imaginación: Consiste en que antes y durante
la infusión de quimioterapia, se aplica relajación muscular progresiva e imaginación de escenas relajantes. El terapeuta debe aplicar la relajación durante las 4 primeras infusiones, después debe aplicarla el sujeto solo y practicar fuera de la sesión. Eficacia 50% de reducción en náuseas y vómitos.
Biofeedback-EMG con imaginación: Consiste en la aplicación de biofeedback de
tensión muscular, en localizaciones múltiples, en conjunción con entrenamiento en relajación e imaginación durante las infusiones. Se comienza con el entrenamiento en biofeefback, y una vez reducida la activación fisiológica, se introducen imágenes distractoras. Los resultados de estas intervenciones se han mostrado eficaces.
Desensibilización sistemática: Se construye una jerarquía de estímulos ansiógenos relacionados con la quimioterapia y se expone en imaginación a los sujetos al mismo tiempo que se aplica relajación. Un aspecto importante es que la efectividad de la desensibilización se mantiene aunque no se administre al mismo tiempo que la quimioterapia. Existe evidencia experimental de la eficacia de este procedimiento.
Técnicas de control atencional: Técnicas de distracción mediante estímulos externos, mediante videojuegos u otras actividades distractoras (televisión, contar historias, etc.) durante la sesión de quimioterapia con el objetivo de impedir que se forme el condicionamiento clásico. El videojuego implica actividades motoras y cognitivas, una atención sostenida, que se puede aumentar según se eleva la dificultad del juego y que dificulta la formación de las reacciones condicionadas. Además, son muy atractivos para los niños y adolescentes, y es una intervención muy económica, ya que requiere poco entrenamiento.
5. CONTROL DEL DOLOR
El dolor en cáncer está fuertemente influenciado por dimensiones cognitivas, afectivas, conductuales, además de los aspectos somáticos, por lo cual el tratamiento adecuado debe implicar tanto intervenciones médicas como psicológicas. En pacientes de cáncer el dolor es un problema usual, si bien su prevalencia e intensidad aumenta a medida que lo hace la enfermedad, de forma que el dolor moderado a severo puede afectar al 40-50% de los pacientes en el diagnóstico inicial; al 35-40% en estados intermedios, y en el cáncer avanzado al 60-85% de los pacientes. Algunos estudios indican que pacientes con metástasis tienen un riesgo de 1:5 a 1:3 de padecer dolor significativo, que aumenta a 2:3 y 4:5 cuando la enfermedad se encuentra en estados finales.
La etiología del dolor de cáncer puede clasificarse en:
dolor agudo, provocado por los tratamientos y pruebas diagnósticas del cáncer.
dolor del cáncer.
dolor crónico de origen no maligno.
La evaluación del dolor ha de comprender las dimensiones:
conductuales -niveles de actividades o hábitos que se ven interrumpidos o deteriorados -;
sensoriales y fisiológicos, (intensidad y características del dolor);
cognitivas -patrones de pensamiento y aspectos atencionales que sirven para aumentar o disminuir el impacto de los aspectos sensoriales -;
así como el impacto del dolor en el funcionamiento físico, interacción social y síntomas afectivos concurrentes.
Las intervenciones psicológicas que se han utilizado con mayor frecuencia para el tratamiento del dolor, tanto agudo como crónico, han aplicado técnicas de hipnosis, relajación progresiva y biofeedback.
Se han llevado a cabo programas de condicionamiento operante que se han mostrado útiles para aumentar niveles de actividad motora y social del paciente, disminución de conductas de quejas y frecuencia de conducta cooperativa con el personal sanitario.
Por último, los programas que recientemente han adquirido mayor desarrollo son los cognitivo-conductuales, en especial los programas de inoculación del estrés, que abordan la modificación de aspectos sensoriales, motores, afectivos y cognitivos implicados en el dolor.
Tales intervenciones se componen de los siguientes elementos:
Educación, información al paciente acerca de los aspectos sensoriales, motores, afectivos y cognitivos implicados en el dolor.
Adquisición y consolidación de habilidades de afrontamiento como relajación y respiración controlada, entrenamiento en control de la atención, graduación de tareas y habilidades sociales y detención de pensamiento, resolución de problemas y control de dialogo interno.
Ensayo y aplicación de las habilidades entrenadas.
Entrenamiento en generalización y mantenimiento.
A la hora de diseñar las técnicas de intervención hay que tener presente la magnitud y características del dolor y los recursos o capacidades cognitivas que posee el paciente. En el dolor asociado al cáncer estas técnicas han de aplicarse en combinación con las intervenciones farmacológicas, ya que en el caso de dolor continuo y/o de alta intensidad las técnicas de relajación o redirección de la atención no son aplicables.
Con el objeto de disminuir la ansiedad y el estrés ante procedimientos diagnósticos o de tratamiento que implican dolor agudo tales como punciones lumbares o aspiraciones de médula ósea, sobre todo en niños.
6. INTERVENCIÓN EN LA FASE TERMINAL.
Los cuidados paliativos son el conjunto de intervenciones médicas, sociales y psicológicas encaminadas a mantener o mejorar la calidad de vida de los pacientes y familiares cercanos en la fase terminal, cuando la enfermedad ya no responde por más tiempo a tratamientos específicos y es potencialmente fatal en un lapso corto de tiempo. Como características de la situación terminal se han señalado:
enfermedad avanzada, incurable y en fase de progresión rápida, claramente diferenciada de una situación de cronicidad alta relativamente estable
ausencia razonable de respuesta a tratamientos específicos
pronóstico de vida pronóstico de vida probable inferior a 6 meses
impacto emocional intenso sobre el enfermo, sus familiares y los propios terapeutas, suscitado por la proximidad de la muerte, y modulado por el sufrimiento físico, el aislamiento y la soledad.
La atención puede dispensarse mediante unidades de cuidados paliativos que son servicios hospitalarios especializados en este tipo de atención, que han de estar integrados por equipos multidisciplinares que incluyen médicos, enfermeras, trabajadores sociales, psicólogos, asesores espirituales, terapeutas ocupacionales y fisioterapeutas, así como voluntarios. De forma alternativa la atención puede ser domiciliaria.
En primer lugar, los cuidados paliativos han de orientarse al control de los síntomas físicos: dolor, fatiga, debilidad, problemas del sueño, anorexia, etc.
Los objetivos generales del tratamiento psicológico se centran en tres áreas fundamentales:
Respecto al enfermo terminal:
-
Reducir la soledad y el aislamiento del paciente.
-
Aumentar su control sobre el entorno y su autonomía.
-
Reducir la apreciación de amenaza.
-
Aumentar la autoestima.
-
Disminuir la ansiedad y depresión.
-
Control de síntomas.
Respecto a la familia son dos los objetivos:
-
Soporte emocional para el afrontamiento de la situación actual y para la pérdida inminente.
-
Soporte informativo de los recursos que pueden usar.
Respecto del personal sanitario, hay dos objetivos:
-
Ayudar al manejo de sus propias emociones ante la situación terminal.
-
Formación para la detección de las necesidades reales del paciente terminal.
Para conseguir estos objetivos ha de hacerse uso de técnicas cognitivo-conductuales: inoculación de estrés, relajación, hipnosis, técnicas operantes para reforzar conductas apropiadas, etc. La cooperación de voluntarios que hayan tenido familiares con cáncer, bien entrenados y seleccionados, es un elemento de aprendizaje vicario de respuestas de afrontamiento que es muy útil.
Descargar
| Enviado por: | Asier |
| Idioma: | castellano |
| País: | Venezuela |
