Química
Benceno
Benceno
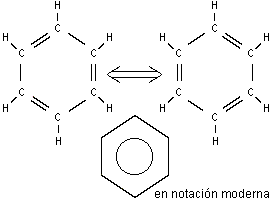
Líquido incoloro de olor característico y sabor a quemado, de fórmula C6H6. La molécula de benceno consiste en un anillo cerrado de seis átomos de carbono unidos por enlaces químicos que resuenan entre uniones simples y dobles. Cada átomo de carbono está a su vez unido a un átomo de hidrógeno.
Aunque insoluble en agua, es miscible en cualquier proporción con disolventes orgánicos. El benceno es un disolvente eficaz para ciertos elementos como el azufre, el fósforo y el yodo, también para gomas, ceras, grasas y resinas, y para los productos orgánicos más simples. Es uno de los disolventes más empleados en los laboratorios de química orgánica. El benceno tiene un punto de fusión de 5,5 °C, un punto de ebullición de 80,1 °C, y una densidad relativa de 0,88 a 20 °C. Son conocidos sus efectos cancerígenos, y puede resultar venenoso si se inhala en grandes cantidades. Sus vapores son explosivos, y el líquido es violentamente inflamable. A partir del benceno se obtienen numerosos compuestos, como el nitrobenceno. También es empleado en la producción de medicinas y de otros derivados importantes como la anilina y el fenol. El benceno y sus derivados se encuentran incluidos en el grupo químico conocido como compuestos aromáticos.
El benceno puro arde con una llama humeante debido a su alto contenido de carbono. Mezclado con grandes proporciones de gasolina constituye un combustible aceptable. En Europa era frecuente añadir al benceno mezclado con tolueno y otros compuestos asociados al combustible de los motores, y sólo recientemente se ha tenido en cuenta su condición de agente cancerígeno.
El benceno fue descubierto en 1825 por el científico inglés Michael Faraday, pero hasta 1842 en que se descubrió la existencia del benceno en el alquitrán de hulla, no pudo disponerse de él en grandes cantidades. Una tonelada de carbón transformada en coque en un horno produce unos 7,6 litros de benceno. En la actualidad se obtienen del petróleo grandes cantidades de benceno, ya sea extrayéndolo directamente de ciertos tipos de petróleo en crudo o por tratamiento químico del mismo (reforming y ciclación).
La estructura de la molécula de benceno es de gran importancia en química orgánica. El primero en formular la teoría de la estructura de anillo de resonancia descrita anteriormente fue el químico alemán August Kekulé von Stradonitz, en 1865. Por diversos motivos, los científicos del siglo XX tuvieron dificultades para asimilar esta idea, y desarrollaron en su lugar una descripción molecular orbital de los electrones orbitando por toda la molécula en vez de por los átomos de carbono. En la década de 1980, tras nuevos estudios, se ha vuelto a la descripción de Kekulé, aunque con los electrones en órbitas deformadas alrededor de sus átomos concretos.
CONCLUSIONES
El benceno es sin duda alguna un compuesto muy versátil y de mucha importancia en la química ya que de el surgen algunos compuestos derivados del mismo y además es uno de los mejores disolventes para el yodo azufre fósforo, gomas, ceras.
Una de las cosas que también llaman la atención acerca del benceno es sin duda alguna su estructura atómica que se compone de 6 átomos de carbono cíclicos y unidos a un átomo de hidrógeno que a su vez se encuentran unidos a otro semejante por medio de ligaduras sencillas o dobles lo cual ha causado cierta controversia entre varios químicos a lo largo de la historia.
Otra cosa interesante del benceno son su propiedad física ya que presenta un olor a quemado y además es muy flamable tiene un punto de fusión de 5,5 ° C y un punto de ebullición de 80,1 ° C.
Esto fue lo mas considerable acerca de este gran compuesto de muchos usos por la industria química tanto como para la fabricación de fármacos como también en la anilina y el fenol. Gracias a estos usos esta incluido en los llamados compuestos aromáticos.
Descargar
| Enviado por: | Damhian |
| Idioma: | castellano |
| País: | México |
