Medicina
Aminoácidos y proteínas
AMINOACIDOS Y PROTEÍNAS.
Aminoácidos.
Se hablara ahora de las propiedades físicas y químicas de los aminoácidos, ya que estos constituyen el alfabeto de la estructura de las proteínas y determinan muchas propiedades importantes de las proteínas.
H
R-C- COOH
NH2
Ésta es la estructura general de los 20 aminoácidos hallados regularmente o corrientemente en las proteínas, llamados también aminoácidos corrientes. Excepto la prolina, todos ellos tienen como denominadores comunes un grupo carboxilo libre y un grupo amino libre e insustituido en el átomo de carbono . Difieren entre sí en la estructura de sus cadenas laterales distintivas, llamados grupos R.
Se han propuesto varios métodos para clasificar los aminoácidos sobre la base de sus grupos R. El más significativo se funda en la polaridad de los grupos R. Existen cuatro clases principales:
Grupos R no polares o hidrofóbicos.
Polares, pero sin carga.
Grupos R con carga positiva y
Grupos cargados negativamente (a pH 6-7, que es la zona del pH intracelular).
Los aminoácidos se suelen designar mediante símbolos de tres letras. Recientemente se ha adoptado también un conjunto de símbolos de una letra para facilitar la comparación de las secuencias aminoácidas de las proteína homólogas.
- Aminoácidos con grupos R no polares o hidrofóbicos
Existen 8 aminoácidos que contienen grupos R no polares o hidrofóbicos. Aquí se encuentran la alanina, la leucina, la isoleucina, la valina, la prolina, la fenilalanina, el triptófano y la metionina. Estos aminoácidos son menos solubles en el agua que los aminoácidos con grupos R polares. El menos hidrófobo de esta clase de aminoácidos es la alanina, la cual se halla casi en la línea fronteriza entre los aminoácidos no polares y los que poseen grupos R polares.
- Aminoácidos con grupos R polares sin carga.
Estos aminoácidos son relativamente más solubles en el agua que los aminoácidos anteriores. Sus grupos R contienen grupos funcionales polares, neutros que pueden establecer enlaces de hidrógeno con el agua. La polaridad de la serina, la treonina y la tirosina se debe a sus grupos hidroxilos; la de la aspargina y la glutamina, a sus grupos amídicos y de la cistina a la presencia del grupo sulfhidrilo (-SH). La glicola, a veces se clasifica como una aminoácido no polar. La cistina y la tirosina poseen las funciones mas polares de esta clase de aminoácidos, sus grupos tilo e hidroxilo fenólico tienden a perder mucho más fácilmente protones por ionización que los grupos R de otros aminoácidos de esta clase.
- Aminoácidos con grupos R cargados positivamente.
Los aminoácidos en los que los grupos R poseen carga positiva neta a PH 7, poseen todos seis átomos de carbono. Aquí se encuentran la lisina, la arginina y la histidina. Esta última tiene propiedades límite. A pH 6 más del 50 % de las moléculas de la histidina, poseen un grupo R cargado positivamente, pero a pH 7 menos del 10 % de las moléculas poseen carga positiva.
- Aminoácidos con grupos R cargados negativamente.
Los dos miembros de esta clase son los ácidos aspártico y glutámico, cada uno de los cuales posee un segundo grupo carboxilo que se halla completamente ionizado y por tanto cargado negativamente a pH 6 y 7.
- Características de los aminoácidos.
| Los aminoácidos son compuestos sólidos; incoloros; cristalizables; de elevado punto de fusión (habitualmente por encima de los 200 ºC); solubles en agua; con actividad óptica y con un comportamiento anfótero. La actividad óptica se manifiesta por la capacidad de desviar el plano de luz polarizada que atraviesa una disolución de aminoácidos, y es debida a la asimetría del carbono El comportamiento anfótero se refiere a que, en disolución acuosa, los aminoácidos son capaces de ionizarse, dependiendo del pH, como un ácido (cuando el pH es básico), como una base (cuando el pH es ácido) o como un ácido y una base a la vez (cuando el pH es neutro). En este último caso adoptan un estado dipolar iónico conocido como zwitterión. El pH en el cual un aminoácido tiende a adoptar una forma dipolar neutra (igual número de cargas positivas que negativas) se denomina Punto Isoeléctrico. La solubilidad en agua de un aminoácido es mínima en su punto isoeléctrico. |
Proteínas.
| - Péptidos y Enlace peptídico. |
| Los péptidos son cadenas lineales de aminoácidos enlazados por enlaces químicos de tipo amídico a los que se denomina Enlace Peptídico. Así pues, para formar péptidos los aminoácidos se van enlazando entre sí formando cadenas de longitud y secuencia variable. Para denominar a estas cadenas se utilizan prefijos convencionales como: a)Oligopéptidos.- si el nº de aminoácidos es menor 10.
b) Polipéptidos o cadenas polipeptídicas.- si el nº de aminoácidos es mayor 10. Cada péptido o polipéptido se suele escribir, convencionalmente, de izquierda a derecha, empezando por el extremo N-terminal que posee un grupo amino libre y finalizando por el extremo C-terminal en el que se encuentra un grupo carboxilo libre, de tal manera que el eje o esqueleto del péptido, formado por una unidad de seis átomos (-NH-CH-CO-), es idéntico a todos ellos. Lo que varía de unos péptidos a otros, y por extensión, de unas proteinas a otras, es el número, la naturaleza y el orden o secuencia de sus aminoácidos. El enlace peptídico es un enlace covalente y se establece entre el grupo carboxilo (-COOH) de un aminoácido y el grupo amino (-NH2) del aminoácido contiguo inmediato, con el consiguiente desprendimiento de una molécula de agua. Por otra parte, el carácter parcial de doble enlace del enlace peptídico (-C-N-) determina la disposición espacial de éste en un mismo plano, con distancias y ángulos fijos. Como consecuencia, el enlace peptídico presenta cierta rigidez e inmoviliza en el plano a los átomos que lo forman. |
Las proteínas son moléculas muy complejas en cuya composición elemental se encuentran siempre presentes carbono, hidrógeno, oxígeno y nitrógeno. La mayoría de ellas también incluye en su composición al azufre y en algunas se observa además la presencia de fósforo, hierro, zinc, molibdeno. Desde el punto de vista estructural, los elementos químicos que constituyen a las proteínas se encuentran distribuidos en bloques o unidades estructurales que son los aminoácidos, que unidos entre si integran una estructura polimérica; las proteínas son fundamentalmente polímeros de aminoácidos.
Hay dos tipos principales de proteínas: las simples que están constituidas únicamente por aminoácidos, y las proteínas conjugadas que son las que tienen en su composición otras moléculas diferentes además de aminoácidos.
- Estructura de las proteínas.
La organización de una proteína viene definida por cuatro niveles estructurales denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria. Cada una de estas estructuras informa de la disposición de la anterior en el espacio.
El primer nivel estructural que se puede delimitar en una proteína, está constituido tanto por el número y la variedad de aminoácidos que entran en su composición, como por el orden también llamado secuencia en que se disponen éstos a lo largo de la cadena polipeptídica, al unirse covalentemente por medio de sus grupos amino y carboxilo alfa. A este primer nivel se le llama estructura primaria.
El segundo nivel estructural se refiere a la relación espacial que guarda un aminoácido con respecto al que le sigue y al que le antecede en la cadena polipeptídica; en algunos casos el polipéptido entero, o algunas zonas de éste se mantienen extendidas, mientras que en otros casos se enrollan en forma helicoidal como si formaran un resorte. A este segundo nivel se le llama estructura secundaria. Existen dos tipos de estructura secundaria:
la a(alfa)-hélice
la conformación beta
1. Esta estructura se forma al enrollarse helicoidalmente sobre sí misma la estructura primaria. Se debe a la formación de enlaces de hidrógeno entre el -C=O de un aminoácido y el -NH- del cuarto aminoácido que le sigue.
2. En esta disposición los aas. no forman una hélice sino una cadena en forma de zigzag, denominada disposición en lámina plegada.
Presentan esta estructura secundaria la queratina de la seda o fibroína.
El tercer nivel estructural se refiere a la relación espacial que guardan entre sí las diferentes zonas o áreas de cada cadena polipeptídica que forman a una proteína. A este nivel se le llama estructura terciaria. En una proteína compuesta de una sola cadena polipeptídica, el nivel máximo de estructuración corresponde precisamente a su estructura terciaria. Cuando se trata de una proteína oligomérica, que es aquel tipo de proteína que esta compuesta de más de una cadena polipeptídica, se puede considerar un siguiente nivel de organización, que se refiere a ala manera en que cada cadena polipeptídica en la proteína se arregla en el espacio en relación con las otras cadena polipeptídicas que la constituyen. A este nivel estructural se le llama estructura cuaternaria.
La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular. Esta conformación globular facilita la solubilidad en agua y así realizar funciones de transporte , enzimáticas , hormonales. Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los radicales R de los aminoácidos. Aparecen varios tipos de enlaces:
el puente disulfuro entre los radicales de aminoácidos que tiene azufre.
los puentes de hidrógeno
los puentes eléctricos
las interacciones hifrófobas.
- Desnaturalización.
Muchas moléculas proteicas sólo retienen su actividad biológica dentro de una fluctuación muy limitada de temperatura y de pH. La exposición de proteínas solubles o globulares a pH extremos o a temperaturas elevadas, les hace experimentar un cambio conocido como desnaturalización, el efecto más visible del cual, consiste en un descenso de su solubilidad. Puesto que los enlaces químicos covalentes del esqueleto peptídico de las proteínas no se rompen durante este tratamiento relativamente suave, se lha llegado a la conclusión de que la estructura primaria permanece intacta. La mayoría de las proteínas globulares experimentan el proceso de desnaturalización cuando se calientan por encima de 60°-70° C. La formación de un coágulo insoluble blanco cuando se hierve la clara de huevo es un ejemplo común de desnaturalización térmica. La consecuencia más significativa de la desnaturalización es que las proteínas pierden su actividad biológica característica, por ejemplo, al calentar las enzimas se suele perder su capacidad catalítica.
La desnaturalización consiste en el desplegamiento de la estructura nativa plegada característica de la cadena polipeptídica de las moléculas de las proteínas globulares. Cuando la agitación térmica provoca que la estructura nativa plegada se desarrolle o se distienda, originando una cadena libremente ondulada, la proteína pierde su actividad biológica.
-
Especificidad.
La especificidad se refiere a su función; cada una lleva a cabo una determinada función y lo realiza porque posee una determinada estructura primaria y una conformación espacial propia; por lo que un cambio en la estructura de la proteína puede significar una pérdida de la función.
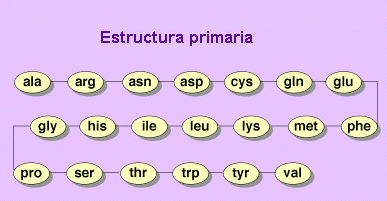
ESTRUCTURA PRIMARIA
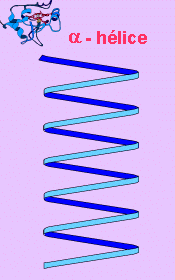
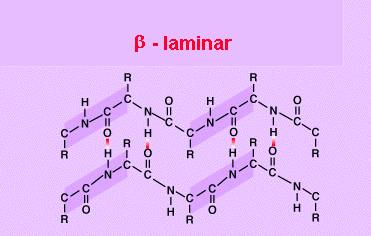
ESTRUCTURAS SECUNDARIAS
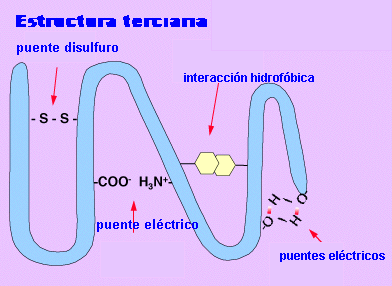
ESTRUCTURA TERCIARIA
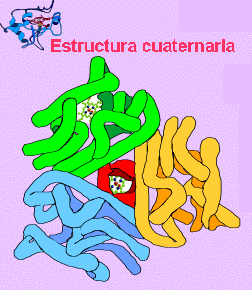
ESTRUCTURA CUATERNARIA.
Bibliografía
Bioquímica
Lehninger L. Albert
Segunda edición.
Ediciones Omega
Barcelona 1990
Bioquímica
Peña Díaz Antonio et. All.
Segunda edición
Editorial Limusa
México 1990
Página de Internet
Universidad de Medicina
UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MORELOS
FACULTAD DE MEDICINA
AMINOÁCIDOS Y PROTEÍNAS
BIOQUÍMICA
1ER SEMESTRE GRUPO “A”
25-FEBRERO-2002
Descargar
| Enviado por: | Comegalletas |
| Idioma: | castellano |
| País: | México |
