Química
Velocidad de Reacción
LABORATORIO
VELOCIDAD DE REACCIÓN
Concepción,15 de septiembre de 2003
INTRODUCCIÓN
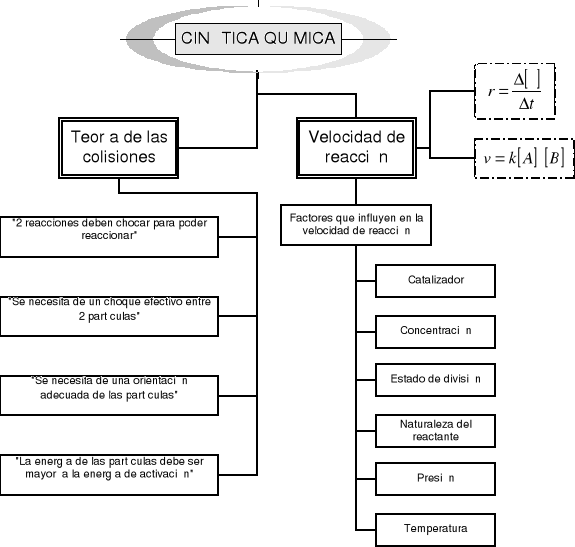
La cinética química es una rama de la química que trata sobre la velocidad o la rapidez de una reacción. En una reacción, 2 aspectos de primordial importancia son el equilibrio y la velocidad de reacción. Al tratar las velocidades no solo nos interesa cuan rápidamente los reaccionantes se transforman en productos, sino también la secuencia de procesos físicos y químicos por la cual ocurre esta reacción.
Se sabe que cualquier reacción se puede representar por la ecuación:
Reactivos productos
Esto significa que durante el curso de una reacción las moléculas de reactivos son consumidas (o descompuestas), mientras se forman las moléculas del producto. (a partir de los reactivos “descompuestos”)
Algunas de estas reacciones pueden ser instantáneas, mientras que otras pueden tardar años en completarse. Así también, hay algunas que comienzan muy rápido para luego decaer en su velocidad, mientras que otras lo hacen de la manera contraria; en su inicio son lentas para posteriormente acelerarse. La mayor o menor rapidez con que se transforma una sustancia reactante y se forma un producto queda expresada por la velocidad de reacción.
La velocidad de reacción queda establecida como el cambio en la concentración que experimenta un reactante en un determinado periodo de tiempo. Esto es:
Donde “r” es la velocidad de reacción, " [ ] es el cambio en la concentración y "t corresponde al cambio de tiempo.
El tiempo de reacción también se puede expresar ya sea referido a la concentración del reactante así como a la concentración de producto, expresándose:
Donde k es una constante de proporcionalidad propia para la reacción química que se utilice. Esta constante se puede determinar experimentalmente y su magnitud está en directa relación con la cinética de la reacción. Por ejemplo, a valores altos de k, reacciones rápidas; mientras que a valores bajos, reacciones
lentas. Si las concentraciones son iguales a la unidad, entonces k representa la velocidad de la reacción.
Las distintas velocidades de las reacciones no son aleatorias. Cada una de ellas tiene una causa específica. Para poder explicar teóricamente las velocidades de reacción se formuló la llamada teoría de las colisiones.
La teoría de las colisiones se basa en los siguientes puntos:
Para que dos sustancias reaccionen, las partículas reactantes deben chocar entre si. Esto posibilita que; o se rompen los enlaces de las moléculas de los reactantes y se forman nuevos enlaces en los productos; o simplemente que las partículas se encuentren, formando nuevos enlaces sin romperse.
Las reacciones se desarrollan a través de varias etapas, donde se necesita el choque efectivo de 2 partículas. Cuando una colisión forma productos, la llamamos colisión efectiva; mientras cuando no lo hace, la llamamos colisión inefectiva.
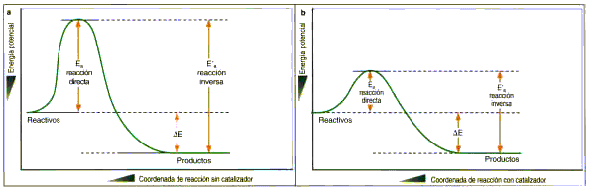
Dos de los factores más importantes que determinan si una reacción es efectiva es el factor energético y la orientación de las partículas. Cuando dos partículas chocan, necesitan de una mínima energía para poder romper sus enlaces y así iniciar una reacción química. Esta energía la llamamos energía de activación. En una reacción con una energía por debajo de la energía de activación no pueden ocurrir colisiones efectivas.
Es preciso señalar que aunque dos partículas tengan la energía necesaria para reaccionar, sino tienen la orientación adecuada no podrán hacerlo. Cuando hablamos de orientación no estamos refiriendo a la alineación que tiene las partículas al chocar.
En términos de la teoría de las colisiones, la velocidad de reacción es directamente proporcional al número de colisiones moleculares. Cuanto mayor es la frecuencia de las colisiones efectivas, más rápidamente sucederán las reacciones. Por el contrario, entre menor porcentaje de colisiones efectivas, menor velocidad de reacción. Por lo tanto:
Todo factor que puede ayudar a los reactantes a alcanzar la energía de activación afectará la velocidad de reacción. Los principales factores que influyen en la velocidad de la reacción son: la concentración de los reactantes, la temperatura a la que ocurre la reacción, la presión en un sistema gaseoso, el estado de división de los reactantes, la naturaleza de los mismos o la presencia de un catalizador en la reacción.
Concentración: Es un factor muy fácil de reconocer, pues es lógico discernir que entre más partículas de una misma sustancia más rápido es la velocidad de reacción. Dicho de otro modo, la concentración es directamente proporcional a la velocidad de reacción.
Temperatura: Al igual que la concentración, la temperatura es directamente proporcional a la velocidad de reacción. Esto se debe a que las partículas tiene una mayor energía cinética, por lo que las moléculas tienen una mayor velocidad y chocan con mayor frecuencia y con mayor energía. Esto se traduce en una mayor frecuencia de colisiones efectivas.
Presión: Si se disminuye el volumen o se aumenta la presión de un sistema, encontramos a los reaccionantes más cercas unos de otros. Por lo tanto, chocaran más y se aumentará la velocidad de reacción.
Estado de división: Entre más dividido se encuentre un reactante, mayor será su superficie de contacto. Esto posibilita que haya más partículas que puedan reaccionar, aumentando la velocidad de reacción.
Naturaleza de los reactantes: Cuando chocan los reactantes, la interacción de sus electrones con los enlaces puede determinar si la reacción se produce o no. Por ejemplo, en el caso del agua, los iones de hidrógeno (H+) se combinan rápidamente con los iones hidróxilos (OH-) para formar agua. Pero cuando la descomposición es de moléculas de enlaces fuertes, la reacción se efectúa lentamente. En el mismo caso del agua, se necesitan de altas temperaturas o de una fuente eléctrica para poder disociar la molécula.
Catalizadores: La presencia de un catalizador acelera la velocidad de una reacción disminuyendo la energía de activación de ésta. Con una energía de activación baja, una mayor cantidad de partículas alcanza la energía necesaria para chocar y de esta manera reaccionar.
OBJETIVOS
Identificar las variables de la velocidad de reacción.
Comprobar el cambio en la velocidad de la reacción en la relación al aumento o disminución del factor.
Reconocer la importancia que tiene la velocidad de reacción en nuestra vida cotidiana.
Reconocer la eficacia de los catalizadores en nuestro diario vivir.
DESARROLLO
Materiales:
-
Matraz Erlenmeyer.
-
Probeta.
-
Pipeta.
-
Cronómetro.
-
Hoja de papel blanco.
-
Plumón marcador.
Reactivos:
-
Tiosulfato de sodio (Na2S2O3)
-
Ácido clorhídrico (HCl)
-
Agua (H2O)
Procedimiento:
Dibujamos una cruz en la hoja de papel blanco.
Vertimos en un matraz 12.5 ml de tiosulfato de sodio, y luego, por medio de una pipeta, le adicionamos 2 ml de HCl. Inmediatamente controlamos el tiempo de la reacción.
Repetimos el experimento, pero utilizando esta vez 10, 7.5, 5, 2.5 ml de tiosulfato de sodio por cada 2 ml de HCl, completando con agua el volumen sobrante hasta alcanzar un volumen de 12.5 ml en el matraz.
Determinamos la concentración del tiosulfato de sodio para cada una de las soluciones utilizando la siguiente ecuación:
Resultados:
| ml de solución de tiosulfato | ml de agua | ml de HCl | Na2S2O3 | Tiempo | |
| de sodio [0,15 M] |
| [2 M] |
|
| |
| 12,5 | - | 2 | 0,15 | 63 | 0,0016 |
| 10 | 2,5 | 2 | 0,12 | 80 | 0,0125 |
| 7,5 | 5 | 2 | 0,09 | 120 | 0,0083 |
| 5 | 7,5 | 2 | 0,06 | 203 | 0,0049 |
| 2,5 | 10 | 2 | 0,03 | 332 | 0,003 |
Preguntas de análisis
Escriba la ecuación para la reacción de la tableta efervescente en agua.
La ecuación para la reacción es:
2NaHCO3 (s) H2O Na2CO3 (s) + CO2 + H2O
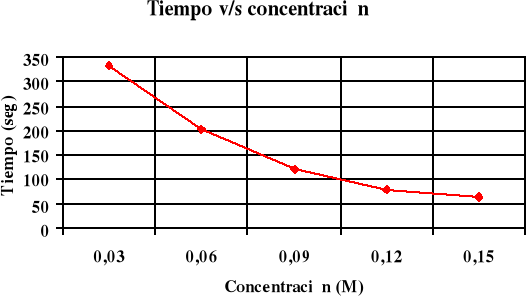
Confecciona un gráfico de velocidad versus tiempo para la reacción del tiosulfato y el ácido clorhídrico.
Confecciona un gráfico de velocidad versus recíproco del tiempo para la reacción del tiosulfato y el ácido clorhídrico.
Represente la ecuación para la reacción anterior entre el tiosulfato y el ácido clorhídrico.
La reacción es la siguiente:
Na2S2O3 + 2HCl H2O + SO2(g) + S(g) + 2NaCl(s)
El cinc reacciona con el ácido clorhídrico formando cloruro de cinc e hidrógeno gaseoso, según la siguiente ecuación:
Zn(s) + 2HCl ZnCl2(ac) + H2(g)
Diseña una experiencia que permita medir la velocidad de reacción.
Una buena manera de medir la reacción entre el ácido y el cinc es preparar un montaje que permita medir la cantidad de producto (ZnCl2 o H2) que origina la reacción por intervalo de tiempo.
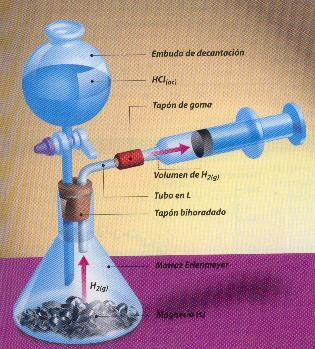
Para armar el montaje, necesitaremos de un embudo de decantación, de un matraz Erlenmeyer, de un tapón de goma, de una jeringa y de un tubo en “L”, además del cinc y el HCl. Lo armaremos así como se muestra en el diagrama.
Una vez colocado el HCl en el embudo de decantación, lentamente abriremos la llave para dejar caer algunas gotas del ácido, las que reaccionaran inmediatamente con el cinc. Inmediatamente, mediremos la cantidad de H2 liberado y recogido por la jeringa, de tal manera que registremos la cantidad de gas liberado durante la reacción entre el HCl y el cinc, en un intervalo de tiempo determinado.
En relación a los catalizadores:
¿Qué son?
Frecuentemente, relacionamos a los catalizadores como sustancias que tienen la propiedad de acelerar las reacciones (aun en cantidades pequeñas) sin consumirse durante ella. A decir verdad, esta definición a resultado ser inexacta. Existen muchos ejemplos de sustancias que aumentan la velocidad de la reacción al mismo tiempo que ella cambia durante ella; y sin embargo, la sustancia no es requerida en la estequiometría de la reacción. Así también, existen catalizadores positivos o negativos. Los primeros aceleran la reacción, mientras que los segundos la disminuyen.
Según estas limitaciones, sería más apropiado definir a un catalizador como toda compuesto que aun en cantidades muy pequeñas puede afectar en gran medida la velocidad o el tiempo de una reacción. Durante su acción, modifican la Ea, para que el estado de transición los alcancen un mayor número de moléculas, sin afectar las variables "H o "G.
Los catalizadores positivos, como las enzimas, son los más conocidos. Pueden actuar de varias maneras, pero lo más importante es que proveen caminos nuevos y más rápidos por los cuales una reacción puede proceder. Por ejemplo, modificando la estructura electrónica de los reaccionantes.
Averigua si el convertidor catalítico que se usa actualmente en los automóviles, actúa como catalizador de la combustión de la bencina o de la transformación de gases producidos.
La combustión de la gasolina dentro de un motor no es perfecta. Si lo fuera, originaría CO2 y agua. Es por esto que se generan gran cantidad de gases contaminantes. Un convertidor catalítico tiene como propósito acelerar una serie de reacciones que disocian estos gases en moléculas más simples y que no contaminan.
Principalmente, un convertidor catalítico tiene 2 funciones:
-
Oxidar el CO y los hidrocarburos no quemados en CO2 y H2O.
-
Reducir el NO y NO2 en N2 y O2.
Para esto, los gases nocivos provenientes del motor pasan por 2 cámaras. En la primera hay catalizadores como Platino, Paladio y Rodio, que permiten acelerar la combustión completa de los hidrocarburos y disminuir la emisión de CO. Sin embargo, las altas temperaturas aumentan la producción de NO, por lo que es necesario nuevos catalizadores en una segunda cámara. Estos catalizadores son principalmente metales de transición (o sus óxidos) que actúan en temperaturas más bajas y permiten disociar el NO en N2 y O2.
¿Qué gases son los que se producen en un convertidor catalítico?
En un motor, la quema de hidrocarburos de la gasolina a altas temperaturas producen óxidos de nitrógeno (NOx). Por ejemplo, el NO en contacto con el oxígeno se transforma en NO2. También se libera monóxido de carbono (CO) e hidrocarburos crudos (sin combustionar).
Con un convertidor catalítico en tanto, todos estos gases son disociados, liberándose solo CO2, NO, NO2, H2O, que no son contaminantes.
Realiza un esquema de un convertidor catalítico.
Los catalizadores también se utilizan mucho en la conservación de los alimentos. Averigua como actúan.
Existen 2 tipo de catalizadores, los positivos (que aceleran la reacción) y los negativos. (que la disminuyen) En estos últimos encontramos los inhibidores, quienes juegan un papel muy importante a la hora de retardar la descomposición de alimentos. Por ejemplo, la hidrogenación (la adición de hidrógeno a compuestos que contiene múltiples enlaces) es un proceso muy importante para ello, y se utiliza para disminuir el número de dobles enlaces de carbono de aceites poliinsaturados con tal de retardar su enranciamiento, ya que la oxidación de los dobles enlaces lo pone rancio el aceite. Esto se logra agregando una pequeña cantidad de níquel (0.1%), que actúa como inhibidor.
El ácido nítrico es un compuesto de gran importancia usado industrialmente en la preparación de fertilizantes, productos farmacéuticos, explosivos, colorantes, etc. Describe el proceso para obtener este ácido. (método industrial)
En la actualidad, el ácido nítrico se obtiene mediante el llamado proceso Otswald, en honor al premio Nóbel de química Alemán Wilhelm Otswald, creador de este proceso. El proceso Otswald utiliza amoniaco (NH3) y oxígeno molecular (O2), que luego se calientan en presencia de un catalizador de platino-rodio a una temperatura de 800º C. La reacción es:
4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)
Este dióxido nítrico se oxida rápidamente a dióxido de nitrógeno:
2NO(g) + O2(g) 2NO2(g)
El dióxido de nitrógeno se disuelve en agua obteniendo ácido nitroso y ácido nítrico:
2NO2(g) + H2O(l) HNO2(ac) + HNO3(ac)
A su vez, el ácido nitroso se puede convertir en ácido nítrico al calentarse:
3HNO2(ac) HNO3(ac) + H2O(l) + 2NO(g)
Y como todo se aprovecha, el NO resultante se puede volver a ocupar como en el segundo paso.
Elabore un mapa conceptual donde intervengan los conceptos relacionados a tema relacionados a tema velocidad de reacción.
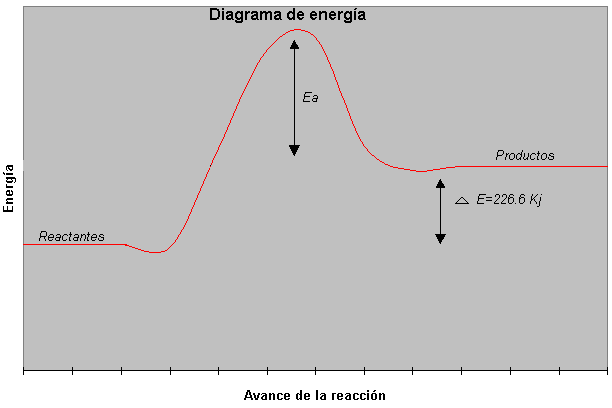
Realiza un esquema de un diagrama de energía para la reacción:
C2H2(g) + 5/2O2 (g) 2CO2(g) + H2O(l) "E= +226.6 Kj
El diagrama de esta reacción es el siguiente:
En la actualidad, los científicos pueden determinar la edad de los objetos arqueológicos aplicando la cinética química y la técnica de datación con carbono radioactivo (C-14) Explica ¿Cómo funciona esta técnica?
Nuestra atmósfera recibe constantemente el bombardeo de rayos cósmicos, que están compuestos de electrones, protones de alta energía o núcleos atómicos. A raíz de esto, mucho átomos de las capas superiores de la atmósfera sufren transmutaciones. Por ejemplo, protones sueltos capturan electrones y forman átomo de hidrógeno en las capas superiores. Pero también puede suceder que un átomo capture neutrones sueltos, que es lo que le pasa al Nitrógeno atmosférico (Isótopo Nitrógeno-14):
7N14 + 0n1 6C14 + 1H1
Como podemos observar, cuando un neutrón choca con un núcleo de Nitrógeno-14 se produce Carbono-14 e Hidrógeno.
El Carbono-14 es un isótopo que se presenta en una proporción mínima en comparación al isótopo estable Carbono-12, que se encuentra principalmente en forma de CO2 en la atmósfera. Al igual que el carbono-12, el Carbono-14 se une al oxígeno para formar CO2, lo que nos lleva deducir que plantas o otros seres vivos tienen incorporado (aunque en una pequeñísima cantidad) este isótopo radioactivo.
El isótopo de Carbono-14 radioactivo es un Beta emisor (es decir, emite electrones) para volver a formar nitrógeno:
6C14 7N14 + -1e0
La velocidad de decaimiento (electrones perdidos por segundo) de este isótopo sigue una cinética de primer orden. (cuando la velocidad de una reacción depende la concentración de los reactivos elevada a la primera potencia)
El organismo, en tanto, sigue incorporando CO2 con C14, gracias a que el C14 que se pierde durante la desintegración se renueva por la producción de nuevos isótopos en la atmósfera. Esto crea un equilibrio dinámico donde la relación entre el C14 y el C12 permanece constante en la materia viva.
Al morir el organismo, se detiene el reabastecimiento de C14, porque éste no puede seguir inhalando CO2, que es de donde conseguía el C14. A raíz de esto, el porcentaje de C14 en el organismo empieza a disminuir. Se sabe que la edad media del C14 es de 5730 años, por lo que la mitad de los átomos de C14 se desintegrarán en ese tiempo, mientras que la otra mitad lo hará en los 5730 años restantes y así sucesivamente.
A pesar de la gran utilidad que este sistema, no es demasiado exacto, pues en virtud de las fluctuaciones que ha tenido el C14 a través de los siglos (debido a los cambios en el campo magnético de la Tierra o la intensidad de los rayos cósmicos), esta técnica tiene un margen de incertidumbre de un 15% aproximadamente.
BIBLIOGRAFÍA
José López Vivar, Eugenia Águila Garay. Química III educación media. Editorial Santillana, 2001. Páginas 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 55, 56, 60, 63, 64.
Chang, Raymond. Química, cuarta edición. Editorial Mc Graw Hill interamericana 1992. Páginas 542, 543, 544, 546, 561, 562, 563, 564, 573, 576, 578, 579, 581, 582, 583.
Mahan, Bruce H. Química, curso universitario. Fondo educativo interamericano S.A. 1977. Páginas 351, 352, 563, 359, 374, 375, 376, 380, 387, 388, 393.
Química 2, Bachillerato. Editorial Mc Graw Hill. Páginas 134, 135.
Wolf, Drew H. Química general, orgánica y biológica. Editorial Mc Graw Hill. Páginas 150, 151, 152, 153, 154, 155, 156, 157.
Hewitt, Paul G. Física Conceptual. Addison Wesley Longman, Primera edición 1999. Página 623, 624.
CD PSU preuniversitario Cepech Ciencias. Contenido_61ª.
Asignatura: Química común.
Profesor:
Alumno:
Curso: 3º medio B
Velocidad ~ nº de colisiones
segundos
C1 x V1 = C2 x V2
Reacciones con y sin catalizador
Descargar
| Enviado por: | Carlos FGuzmán Inostroza |
| Idioma: | castellano |
| País: | Chile |
