Biología, Botánica, Genética y Zoología
Triquinosis
Triquinosis
ÍNDICE:
1-. INTRODUCCIÓN
2-.MORFOLOGÍA
3-.EPIDEMIOLOGÍA
4-.UBICACIÓN
5-.EVOLUCIÓN DE LA LARVA
6-.SÍNTOMAS Y MANIFESTACIONES
7-.EVOLUCIÓN DE LA ENFERMEDAD
8-.DIAGNÓSTICO CLÍNICO
9-.INFESTACIÓN
10-.TRATAMIENTO PARA LAS CARNES
11-.SITUACIÓN EN EUROPA
11.1-.LA RELACIÓN ENTRE LA TRIQUINOSIS Y EL HÁBITAT
12-.SITUACIÓN EPIDEMIOLÓGICA EN AMÉRICA
1-.INTRODUCCIÓN
Es una zoonosis que está muy difundida en casi todo el mundo, su nombre vulgar más común, es el de triquinosis, aunque la denominación correcta es triquinelosis. Esta confusión en la denominación proviene del vocablo genérico Trichina, con el que Richard Owen (1835), designó originalmente a los agentes productores de la afección. En la actualidad, el nombre de Trichina no se usa más, ya que este nombre estaba ocupado desde 1830, para designar a un género de dípteros. Railliet (1895) propuso el nombre Trichinella para clasificarlo, de allí su verdadera denominación actual.
La triquinelosis es una parasitosis que afecta a mamíferos producida por nematodos del género Trichinella, transmitida por carnivorismo; y caracterizada por síndrome febril, mialgias, eosonofilia elevada y signos oculopalpebrales. Este parásito tiene una amplia gama de huéspedes además del hombre, compuesta por animales domésticos (ciclo sinantrópico) y silvestres (ciclo silvestre).
Desde 1972 se mantiene el nombre de Trichinella spiralis (cabellito en espiral) para designar la forma doméstica y zoonótica (sinantrópica) de la parasitosis que se registra en cerdos, ratas, perros, gatos así como en el hombre; mientras que los nombres de T. pseudospiralis, T. nativa, T. britovi, T. nelsoni, T. papuae y T. murrelli son utilizados para las especies halladas en los ciclos silvestres en que participan animales salvajes.
2-.MORFOLOGÍA
Enfermedad parasitaria causada por el nematodo trichinella spiralis, gusano de pequeñas dimensiones, cuyo macho es de aproximadamente 1,5mm de longitud, mientras que la hembra puede alcanzar cuatro mm. La extremidad cefálica de este helminto, en correspondencia con la zona de apertura oral, presenta un minúsculo punzón. El esófago filiforme puede ocupar mas de un tercio de la longitud del cuerpo. El macho está dotado de dos pequeños apéndices únicos que entran en función durante el acoplamiento. La hembra es opistodelfa, es decir sus ovarios están situados posteriormente respecto a la apertura vulvar que en esta especie esta colocada aproximadamente en la mitad de la región esofágica. En su estadio adulto ambos sexos viven en el primer tramo del intestino delgado de sus huéspedes.
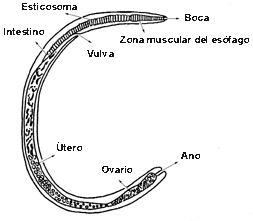
Hembra Adulta
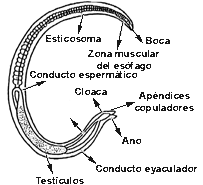
Macho Adulto
3-.EPIDEMIOLOGIA
Estos helmintos pueden parasitar cualquier mamífero, incluso ser encontrados en el cuerpo de las aves. En el laboratorio los experimentos efectuados han demostrado que la trichinella spiralis puede desarrollarse hasta en animales de sangre fría(anfibios, reptiles, etc.....) con tal de que la temperatura ambiente sea lo suficientemente elevada.
En la epidemiología de la enfermedad humana el cerdo juega un papel de fundamental importancia. De hecho, en la mayor parte de los casos el hombre contrae la parasitosis comiendo carne de este mamífero que, sobre todo en algunos países, esta frecuentemente infectado por trichinella spiralis.
4-.UBICACIÓN
El ciclo biológico del parásito es muy simple. Los adultos se establecen en la mucosa del intestino delgado del animal huésped y rápidamente se acoplan. El macho, una vez efectuada su función sexual, concluye su propia existencia y es eliminado con las heces, mientras que la hembra, después de un par de días, comienza a parir microscópicos embriones, de una longitud de cerca de cien micras. Estos (a excepción de algunos individuos que accidentalmente van a caer a la luz intestinal y son expulsados) alcanzan los vasos linfáticos de las paredes intestinales y las venas mesentéricas, transportadas así, pasivamente llegan a las cavidades derechas del corazón y, después de haber superado el filtro pulmonar, pasan a las cavidades izquierdas a partir de las cuales se distribuyen con la sangre arterial por todo el organismo.
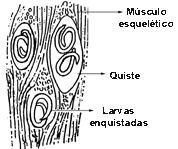
En los animales infestados se ha demostrado la existencia de larvas de nemátodos en cualquier órgano o tejido, pero solo aquellos que llegan a los músculos estriados, por los cuales poseen un marcado tropismo, tienen la probabilidad de desarrollarse. En particular, tienen la probabilidad mayor de desarrollarse. En particular, los territorios preferidos por la trichinella spiralis son el diafragma, la lengua, los bíceps, los músculos laringes, masticatorios, intercostales y abdominales. No son raras las localizaciones en los músculos del globo ocular. Introducidas en el tejido muscular, bajo el sarcolema, las jóvenes larvas se nutren y comienzan a crecer. Pueden llegar a alcanzar un tamaño máximo de un mm y enrollándose sobre si mismas, en forma de espiral, se inmovilizan y se enquistan en el músculo. En realidad son los mismos tejidos del huésped los que, por reacción, forman una cápsula fibrosa en doble capa que aísla al parásito. Estas cápsulas (o quistes), que son aproximadamente de 0,5 mm de largo, tienen una forma que recuerda groseramente a la de un limón de pequeñísimo tamaño. Alojada en la envuelta muscular, la larva de trichinella no puede evolucionar posteriormente en el mismo huésped. En estas condiciones sobrevive durante algunos años: parece que en el hombre puede superar incluso el decenio. Al pasar el tiempo intervienen procesos de calcificación que no siempre la destruyen. Las larvas encapsuladas poseen de hecho una notable resistencia e incuso después de la muerte del huésped, en su carne putrefacta, mantienen su propia vitalidad durante un periodo que va de sesenta días a noventa días.
Larvas enquistadas
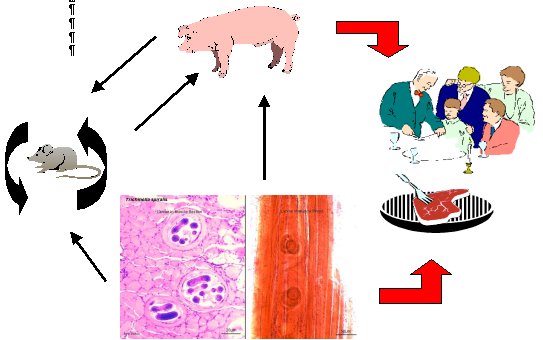
Ciclo biológico de la trichinella spiralis
5-.EVOLUCION DE LA LARVA
La evolución de la larva de trichinella spiralis reemprende su curso normal si el músculo que contiene el quiste es ingerido por un nuevo huésped (hombre u otro carnívoro) En estos casos los jugos gástricos e intestinales digieren las paredes de la cápsula, liberando la larva infestante; esta se fija la mucosa del intestino delgado, donde se nutre ingiriendo los distintos componentes nutritivos. Su crecimiento es muy veloz y los gusanos se hacen adultos, y por lo tanto sexualmente maduros, en dos o tres días. Al cuarto o quinto día las hembras empiezan a parir los embriones y estos alcanzan su máxima concentración en la sangre entre el octavo y el veinticinco habo día. Ya hacia el doceavo día de la ingestión infestante es posible encontrar las primeras larvas en los músculos del nuevo huésped mientras que el enquistamiento se complementara alrededor de la octava semana o incluso mas tarde.
6-.SÍNTOMAS Y MANIFESTACIONES
El conocimiento del ciclo biológico de la trichinella spiralis nos permite ya intuir los fenómenos patológicos inducidos por el parásito en el organismo humano. La triquinosis se caracteriza esencialmente por dos síntomas: uno intestinal, debido a la presencia de los gusanos adultos (sobre todo hembras fecundadas) en el intestino delgado, y otro muscular, causado por la invasión de los músculos estriados por parte de las larvas. Este segundo síndrome es el más importante y característico. No debemos, sin embargo, olvidarnos de que los embriones, en su recorrido a través del torrente circulatorio, pasan por los capilares pulmonares y las cavidades cardiacas, por lo que también pueden darse manifestaciones patológicas a cargo de estos órganos. Además, como hemos dicho, la sangre arterial distribuye los embriones en los más diversos órganos y tejidos, aunque la localización mas útil para el desarrollo del parásito esta representada por la musculatura estriada. Por lo tanto, podemos encontrar lesiones provocadas por estos parásitos errantes en sedes anómalas.
Para comprender mejor la patología de la triquinosis debemos también tener presente que estos gusanos, tanto en su estado larval como en el estado adulto, ejercen una notable acción toxica sobre el organismo huésped. Tanto es así que si inyectamos extractos de trichinella spiralis en animales de laboratorio (por ejemplo, ratas), estas mueren. Además en la sangre de los individuos afectados por triquinosis es posible ponerle manifiesto anticuerpos antitóxicos, mientras que esta demostrado que su orina contiene sustancias toxicas elaboras por el helminto
Algunas manifestaciones de la enfermedad parecen tener un origen alérgico, es decir serian el resultado de una reacción antígeno-anticuerpo. Generalmente los efectos lesivos son tanto mas graves cuanto más rica es la carga de larvas infectantes. Esta puede ser importante si se piensa que en caso de infestaciones masivas un solo gramo de salchicha puede contener de 1500 a 3000 quistes.
Resumiremos los fenómenos patológicos que encontramos en el hombre después de la ingestión de carne infectada. Durante la primera semana la presencia de millares de gusanos en el intestino provoca una enteritis catarral con edema de la mucosa y eventuales hemorragias de pequeña entidad. Los síntomas posibles consisten: náuseas, vómitos, dolores abdominales, diarreas, fiebre elevada, manifestaciones cutáneas urticariales y posteriormente edema de la cara y de los párpados. Los fenómenos tóxicos y alérgicos se acentúan en las dos semanas posteriores, durante la migración de las larvas por el torrente circulatorio y su asentamiento en los músculos.
Algunas larvas, a su paso por la luz de los capilares pulmonares, pueden salir y causar pequeños focos hemorrágicos, bronquitis, bronconeumonías y, aunque son más raros, infartos y embolias pulmonares. Las larvas migrantes causan a veces trastornos cardíacos transitorios con edema e hiperemia del miocardio y del endocardio, un derrame pericárdico leve, hemorragias puntiformes, degeneración de grasa y necrosis de las fibras musculares del corazón, en el cual los parásitos no llegan a enquistarse. La taquicardia, hipotensión y debilidad del pulso, con tonos cardíacos apagados, son los síntomas clínicos más comunes a los que podemos asociar la alteración en el electrocardiograma.
A veces sucede que la sangre arterial distribuye un cierto número de larvas incluso al sistema nervioso central con las consiguientes reacciones inflamatorias que se traducen en meningitis, formaciones de nódulos granulomatosos alrededor del parásito, en el encéfalo, cerebelo y en la médula espinal, trombosis capilares, hemorragias petequiales de dichos órganos, etc. La cefalea, rigidez de la nuca, somnolencia y desorientación son síntomas neurológicos frecuentes en estas formas. A veces la sintomatología hace sospechar una meningoencefalitis, o una poliomielitis o incluso una enfermedad mental.
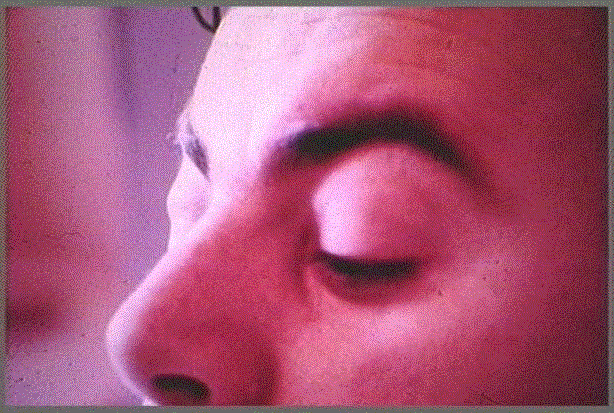
También los ojos, médula ósea, hígado, vesícula biliar, páncreas, riñones, testículos, vejiga y otros órganos pueden presentar alteraciones debidas a la presencia de larvas errantes. Con frecuencia se encuentra afectación de los ojos con un síntoma particularmente importante y característico: el edema extraorbitario(Foto 1), que se manifiesta precozmente. A éste se asocian quemosis de la conjuntiva, trastornos visuales y dolores oculares; pueden darse incluso hemorragias retinianas. Pero los fenómenos patológicos que se encuentran a cargo de los músculos estriados representan la verdadera localización de elección del T. Spiralis.
Las fibras musculares invadidas se hinchan, haciéndose fusiformes y comienzan a degenerar, perdiendo la estriación característica; su núcleo se deforma y se multiplica. También las fibras contiguas son afectadas por procesos de degeneración, mientras que alrededor se produce una inflamación intersticial. Las fibras degeneradas forman una parte de la capa externa del quiste que cierra el parásito.
La sintomatología ligada a la invasión muscular es la de una miositis aguda (que puede simular una forma reumática) con fiebre, dolor intenso y un impedimento transitorio de la función de los músculos afectados. Se suele asociar un edema generalizado que está provocado por las sustancias de origen parasitario. En las infestaciones masivas, graves, el pronóstico es infausto y la muerte sobreviene dentro de las cuatro o seis semanas. Entre las causas de muerte figuran las bronconeumonías, insuficiencia cardíaca, meningitis, encefalitis, etc.
7-.EVOLUCIÓN DE LA ENFERMEDAD
La evolución de la enfermedad dependerá, además de la carga infectante, de la localización de las larvas, de la edad del paciente y de sus condiciones generales. La mortalidad puede variar del 0 al 35%. Los individuos que superan el período crítico de la enfermedad, después de la sexta semana evolucionan hacia una lenta curación. Los dolores musculares pueden persistir durante dos o tres meses. Afortunadamente en la mayor parte de los casos la infestación es de leve importancia, pudiendo incluso llegar a ser asintomática o presentarse con una sintomatología vaga y poco importante. Es normal que no se reconozca el origen real de los trastornos vagos y transitorios.
8-.DIAGNÓSTICO CLÍNICO
El diagnóstico clínico de la triquinosis es además difícil y sólo la variación de todos los datos anamnésicos y un atento estudio de los síntomas hace que se sospeche su origen. Este diagnóstico clínico debe ser confirmado por las investigaciones específicas llevadas a cabo en el laboratorio. Es posible tomar una muestra de una minúscula porción muscular (biopsia) para buscar los eventuales parásitos enquistados. Se puede incluso recurrir al xenodiagnóstico, haciendo ingerir a un ratón de laboratorio un fragmento de músculo afectado. Si éste contiene larvas enquistadas, el ratón contrae la parasitosis y la autopsia del animal (aconsejable después de un mes) demostrará la presencia de los quistes en el nuevo huésped. También para la triquinosis, como para muchas otras enfermedades, han sido puestas a punto distintas reacciones serológicas capaces de poner de manifiesto la existencia de anticuerpos específicos (desviación del complemento, test de floculación y de aglutinación, etcétera). Se utiliza también una intradermorreacción (de Backmann). La fórmula leucocitaria puede proporcionar una información orientativa. Recordaremos a este propósito que los eosinófilos disminuyen o incluso llegan a desaparecer en la fase inicial de la enfermedad y aumentan (aunque esto sea con irregularidad) en la segunda semana. Después de la tercera semana su porcentaje suele ser elevado (del 15 al 40% y más) para ir disminuyendo lentamente durante el curso de la larga convalecencia.
No existe todavía un fármaco satisfactorio para el tratamiento de la triquinosis. En los raros casos en los cuales se diagnostica a tiempo la enfermedad, es decir cuando todavía los nematodos se encuentran en el intestino, éstos pueden ser expulsados, al menos en parte, gracias al empleo de purgantes y vermífugos. Se ha propuesto la administración precoz de una solución de sulfato de magnesio, mediante sonda duodenal. La mayor parte de los antihelmínticos experimentados no poseen eficacia segura sobre estos parásitos, especialmente sobre los que ya se han enquistado; entre los más utilizados recordaremos el tiabendazol. La gravedad de la enfermedad requiere una medida terapéutica para aliviar los síntomas y situar al paciente en condiciones de superar el estado más peligroso. Son muy útiles algunos fármacos antiinflamatorios, siendo recomendable la utilización de cortisona o de ACTH.
9-.INFESTACIÓN
Antes de recordar las normas profilácticas contra la triquinosis es necesario citar la epidemiología de esta parasitosis. Como hemos dicho, la infestación afecta a un gran número de especies animales tanto domésticas como salvajes. Los cerdos, que representan el reservorio más peligroso para el hombre, son particularmente sensibles a la infestación en aquellos países en los que se alimentan con los restos de los mataderos. Este sistema de alimentación, que se utiliza en los Estados Unidos de América, suele tender a perpetuar la transmisión del parásito.
La triquinosis es muy frecuente en el ratón gris (rattus norvegicus) y su difusión se ve favorecida por las costumbres alimenticias de estos roedores que, además de frecuentar los mataderos, practican el canibalismo. Por lo tanto estos ratones, devorándose entre sí, contribuyen ampliamente al mantenimiento de la parasitosis en la naturaleza. Estos, a su vez, representan la fuente de infestación más importantes para los gatos, perros, lobos y otros carnívoros semisalvajes que cazan roedores. Ni los carnívoros del Ártico se encuentran exentos de la triquinosis. La enfermedad afecta hasta a los lobos polares, los osos blancos, focas y otros animales de este tipo. En Groenlandia los perros que comen carne cruda de estos animales suelen estar infestados con mucha frecuencia.
De todo lo expuesto se deduce que las carnes parasitadas por larvas vivas de T. Spiralis representan el material infestante. Todavía algunos autores sostienen que también las heces de animales no receptivos que han devorado carne contaminada pueden contener larvas infestantes y deben por lo tanto figurar entre las posibles fuentes de infestación. Este es el caso de ciertas aves carnívoras y las rapaces, que diseminarían con sus propias deyecciones larvas que pueden infestar un nuevo huésped. Incluso algunos insectos que se nutren de carroña se comportarían de forma análoga. En casos extremadamente raros se pueden dar en el hombre infestaciones congénitas por transmisión de la larva de la madre al feto. Esta posibilidad ha sido confirmada experimentalmente en las cobayas.
Mientras que los Estados Unidos (sobre todo los estados nororientales) tienen la primacía de la triquinosis, esta parasitosis es muy rara en otros países donde se pueden manifestar esporádicamente pequeñas epidemias por otro lado muy circunscritas. En nuestro país, de hecho, los cerdos no son alimentados con desechos de los mataderos. La infestación humana suele estar causada por la ingestión de carne poco cocida. Un programa de profilaxis contra la triquinosis debe por lo tanto proponer el extinguir las fuentes de la enfermedad. Se han obtenido resultados satisfactorios aboliendo la costumbre de dar de comer a los cerdos trozos de carne cruda procedente de los mataderos. Podría ser utilizada sólo si ha sido expuesta a esterilización mediante una cocción suficiente.
En cuanto al cuidado de otros animales receptivos hay que tener la precaución higiénica de colocarlos en recintos donde no exista la posibilidad de que ingieran material contaminado. Ya que los cerdos no suelen comer ratones, sino en forma ocasional, es necesario el alejar a estos peligrosos roedores de las pocilgas; ello se lleva a cabo con desratizaciones repetidas. Los restos de otros animales receptivos a la triquinosis no deben ser nunca abandonados sobre el terreno, sino que es mejor quemarlos o enterrarlos al menos a un metro de profundidad. Su incineramiento constituye la medida más satisfactoria.
10-.TRATAMIENTO PARA LAS CARNES
Puede ser útil el control obligatorio de las carnes de cerdo que hay que efectuar en los mataderos mediante el triquinoscopio. Este aparato permite el ver detectados sobre una fuente de luz, y por lo tanto muy aumentados, fragmentos de músculos aplastados entre dos vidrios y observados por transparencia. Este método no puede en la práctica llegar a explorar de forma suficiente toda la carne que es remitida al comercio; por lo tanto el sistema de profilaxis más válido es el que cada consumidor puede efectuar en su propia casa. Cociendo completamente la carne de cerdo. El calor es capaz de matar las larvas de triquina, pero debido a que éstas están muy protegidas por el músculo que las hospeda, es indispensable que la temperatura alcance valores elevados (80ºC) durante un tiempo prolongado (una hora). Cortando la carne en finos filetes, el resultado es más rápido y seguro. También el frío destruye las triquinas, a condición de que se empleen temperaturas adecuadas. La congelación a -30ºC durante tres días o a -15ºC durante un mes constituye un medio óptimo para la profilaxis. Recordaremos también que mientras que el ahumado no posee ninguna acción eficaz sobre la T. Spiralis, la salazón de las carnes, efectuada tanto en seco como mediante inmersión en salmuera, puede conseguir buenos resultados. Es necesario, sin embargo, que las carnes estén expuestas durante un período suficiente y a concentraciones de sal apropiadas.
Otro sistema de tratamiento de las carnes con triquina consiste en exponerlas a la irradiación con rayos X. Pueden ser también utilizados los rayos gamma. Este tratamiento no altera las características organolépticas de la carne y parece muy prometedor. Basta una modesta dosificación de radiaciones, es decir que estas sean suficientes para provocar en las larvas lesiones degenerativas que comprometan su evolución normal y su futura capacidad reproductiva. Se ha objetado que la irradiación podría determinar en la población de los consumidores desaparición de la inmunidad contra la enfermedad. No excluimos que se llegue rápidamente a la producción de una vacuna eficaz contra la triquinosis, ya que son numerosas las investigaciones en curso que tratan de conseguir este importante objetivo.
11-.SITUACIÓN EN EUROPA
Las infecciones de trichinella spiralis en los humanos se relacionan con el consumo de animales importados y por las prácticas de comida del hombre. En los últimos 20 años, el número más alto de infecciones ha sido por el consumo de carne de caballo en Francia e Italia (mas de 2600 casos desde 1975). Estos caballos infectados provenían de países no pertenecientes a la UE como países de Europa Oriental y de América del Norte. El primer brote, aparecido en Italia en octubre de 1975, afectó a 89 personas en la zona de Bagnolo in Piano. La relación con la carne de caballo fue sugerida por las elevadas tasas de exposición al consumo de carne de caballo, comprada en el mismo punto de venta, entre los casos. La investigación de los departamentos veterinarios identificó al animal, que procedía de Yugoslavia o Polonia. Los especialistas se mostraron escépticos y el suceso no originó ninguna respuesta operativa por parte de las autoridades sanitarias.
En agosto de 1984 se inició un brote de 431 casos en Francia, con dos agrupaciones de casos de igual tamaño, una en Melun, en la región de la Isla de Francia, y otra en el distrito 14 de París. La investigación epidemiológica incluyó varios estudios de casos y controles que demostraron sin lugar a dudas que la carne de caballo era la responsable de la epidemia, a pesar de no haber confirmación parasitológica. Se identificaron dos medias canales del mismo animal, y se demostró que habían sido distribuidas por un solo carnicero en cada una de las zonas. La canal había sido importada por vía aérea desde un matadero de los Estados Unidos. A pesar de que dos casos murieron y gran número de ellos presentaron complicadas formas de triquinosis (neurotriquinosis), el brote no atrajo mucho la atención de la comunidad científica.
En octubre de 1985 estalló un nuevo brote en Francia. Hubo 642 casos, tres de ellos con resultado de muerte, distribuidos en 13 agrupaciones de casos en todo el país. Los estudios epidemiológicos y veterinarios detectaron una única canal de caballo importada por el mismo mayorista del brote anterior, con la diferencia de que esta vez el caballo provenía de un matadero de la República Federal de Alemania. Este segundo episodio provocó una enorme campaña de prensa y una cascada de demandas entre los consumidores, minoristas y mayoristas importadores. Pero además, las autoridades sanitarias francesas exigieron que se realizaran análisis parasitarios de las canales de todos los caballos sacrificados en Francia o en países exportadores. Durante los meses siguientes, la Comisión Europea estableció normativas internas que, como sucede en el caso del cerdo, exigían la investigación mediante `triquinoscopia' o digestión enzimática de una muestra, de al menos 1 g de carne, de todas las canales de caballo destinadas al consumo humano. En las canales que pasaran el control se estamparía una señal indicadora de que no contenían larvas de trichinella
.
Las infecciones debido al consumo de carne de cerdo son raras, excepto en España dónde las investigaciones epidemiológicas mostraron que la fuente de carne de cerdo infectada proviene de faenado de granjas familiares (más de 1000 casos en los últimos diez años). Las fuentes alternativas son cerdos domésticos expuestos al contacto con áreas de hospedadores salvajes (12 casos en Austria en 1970; 21 casos en Francia en 1983; casi 500 casos en Alemania desde 1970 y 13 casos en Italia desde 1970). El aumento en las poblaciones del jabalí salvaje en Europa en los últimos 20 años ha causado un incremento en las infecciones humanas debido al consumo de su carne en Francia, Alemania, Italia y España. Muy pocos casos de triquinosis en la UE han provenido de otras fuentes como por ejemplo, consumo de zorro.
En los últimos 25 años, la triquinosis humana debido al consumo de animales locales (domésticos o salvajes) no se ha informado en Austria, Bélgica, Finlandia, Gran Bretaña, Irlanda, Luxemburgo, Portugal, Suecia, Países Bajos y Dinamarca, en este país controles estrictos que se hacen sobre los cerdos no han dado positivos desde 1930. Las áreas libres de triquinosis (donde el ciclo doméstico y el salvaje están ausentes) son las regiones nordestes de Francia, el Valle de Po y otras llanuras en Italia, y las islas del Mar Mediterráneo (Córcega, Cerdeña, Sicilia, etc...).
Generalmente la triquinosis salvaje afecta a los carnívoros en la mayoría de las regiones de la UE. El depósito específico de la enfermedad es el zorro rojo, aunque en Finlandia el perro mapache también lo es. Aunque otros carnívoros (tejones, marta, osos, lince, lobos, etc.) también pueden infectarse, ellos tienen sólo un papel secundario en la ecología de la triquinosis debido a los bajos niveles de sus poblaciones.
11.1-.Las relaciones entre la triquinosis y el hábitat:
En Italia, la infección por T. britovi donde los zorros rojos son los infectados y donde aumenta la infección con la altitud y el grado de desertificación, los jabalís y cerdos domésticos que contactan con las áreas salvajes remotas pueden a veces adquirir esta infección.
Donde el ciclo salvaje existe y anteriormente ha existido el ciclo doméstico (ej: Austria, Bélgica, Francia, Alemania y sur de Suecia; probablemente también en Grecia y Portugal) el zorro es el depósito principal de T. spiralis, T. britovi y T. nativa. La prevalencia de infección aumenta también con la altitud y el grado de desertificación.
T. spiralis es prevalente entre los zorros que viven a baja altitud mientras que los que habitan altitudes superiores portan T. britovi . Los jabalís y los cerdos domésticos que contactan con estas áreas pueden adquirir la infección, o sea que la relación entre ambos ciclos todavía existe.
En la región de Extremadura en España, el zorro es el principal depósito de T. britovi, mientras los cerdos domésticos y jabalís salvajes son el depósito de T. spiralis.
En regiones de Suecia y Finlandia se encuentra en zorros y otros carnívoros, no habiendo ninguna correlación con la altitud.
12-.SITUACIÓN EPIDEMIOLÓGICA EN AMÉRICA
En Estados Unidos (Tabla 1 y 3) la tendencia es declinante, donde la enfermedad se notifica desde 1947 y donde se siguen presentando casos que se deben principalmente al hábito del consumo de cerdo y su forma de preparación, así mismo como al consumo de animales salvajes tales como jabalís, osos y zorros. Por ejemplo, el estado de Alaska posee altas tasas de incidencia de triquinelosis para los períodos 1987-1990 y 1991-1996, esto se encuentra asociado al alto consumo de carne de animales salvajes.
En México y en las Islas Bahamas, la triquinelosis es endémica y evoluciona con brotes epidémicos esporádicos. En México (Tabla 3), estudios sistemáticos en autopsias han demostrado la existencia del parásito entre el 4 y el 15%; pero, desde el punto de vista clínico, la mayoría de los casos se presenta con sintomatología atenuada o son subclínicos. En 1997 se reportaron dos brotes en cerdos, pero solamente un caso de triquinelosis humana.
La frecuencia es variable en los países latinoamericanos (Tabla 3) y sólo en algunos países la infección tiene importancia clínica y epidemiológica. En los países del Cono Sur - Argentina, Chile y Uruguay -, la triquinelosis es endémica y evoluciona con brotes epidémicos esporádicos. En Uruguay estudios necrópsicos han demostrado la presencia de triquinelosis en el 3% de su población, pero también la mayoría de las infecciones son subclínicas. En Argentina ocurre algo similar, pero no es raro que se denuncien brotes epidémicos esporádicos.
En algunas regiones, en las cuales la triquinelosis es endémica, la infección del cerdo es más bien baja y varía entre el 0,14% y el 0,33%. Sin embargo, la investigación de los porcinos con resultados negativos no indica, necesariamente, que no exista triquinelosis en determinadas regiones; por el contrario, cualquier resultado positivo, aunque sea en un número bajo de animales, implica siempre una situación de endemia o de enzootia potencial.
En las ratas la infección se mantiene, por sus hábitos de canibalismo. Es normal que la infección de las ratas que habitan en el interior o en los alrededores de los mataderos o de los vertederos, sea varias veces superior al de aquellas que lo hacen en otras áreas de una ciudad.
Los perros y los gatos también pueden ser huéspedes de T. spiralis. Encuestas epidemiológicas en perros han demostrado un cuadro similar al observado en las ratas; una prevalencia muy superior de la infección en aquellos animales examinados en las cercanías de los mataderos, en relación con los de otras zonas de la ciudad.
En Latinoamérica por lo general no se han descrito casos de triquinelosis humana de otro origen que el del cerdo doméstico.
Aparentemente, en Argentina y Chile (Tabla 3) se observa el mayor número de triquinelosis clínica y subclínica. Esta circunstancia puede deberse al estudio sistemático de la infección emprendido en estos países desde hace muchos años.
La situación epidemiológica en Chile es parecida a la descrita en otros países. Se presenta como una endemia con aumento de los casos en el segundo semestre del año, época en que se incrementa el consumo de carnes de cerdo y son frecuentes los brotes epidémicos. En Chile existe un descenso de la frecuencia de triquinelosis humana con una tasa de prevalencia del 2.2 al 0.8% en el período 1966-1997. Este descenso se debe probablemente a una mejor y mayor implementación de medidas de control.
El Boletín Epidemiológico Nacional de Argentina durante el periodo 1997-1998, muestra que los casos reportados (1996/98) fueron los siguientes: Buenos Aires (1257), Capital Federal (2), Catamarca (13), Córdoba (185), Corrientes (2), La Pampa (21), Neuquén (11), Río Negro (83), San Juan (4), San Luis (17), Santa Cruz (6), Santa Fe (349), Tierra del Fuego (1) y según el informe del Departamento de Bromatología Reseña epidemiológica (1999): Chubut (89).
TABLA 1. Ubicación geográfica de larvas de Trichinella identificadas en el Centro de Referencia de Trichinella (TRC). Ts = T. spiralis, Tna = T. nativa, Tb = T. britrovi,
Tne = T. nelsoni,Tp = T. pseudospiralis, Tm = T. murrelli, T6 = Trichinella T6,
T8 = Trichinella T8
| País | Nº aislamientos examinados | Especies o fenotipos (Nº de aislamientos) |
| Alaska | 5 | Tna |
| Alemania | 3 | Ts |
| Argentina | 7 | Ts |
| Austria | 1 | Ts |
| Balcanes (área) | 1 | Tb |
| Bulgaria | 2 | Ts, Tb |
| Canadá | 6 | Ts(1), Tna(5) |
| Cáucaso (Georgia) | 1 | Tp |
| Chile | 1 | Ts |
| China | 8 | Ts |
| Croacia | 1 | Tb |
| Dinamarca | 1 | Ts |
| Dinamarca | 9 | Tna |
| Egipto | 3 | Ts |
| España | 137 | Ts (111), Tb (26) |
| Estonia | 15 | Tna(6), Tb(9) |
| Federación Rusa | 11 | Ts (2), Tna (9) |
| Finlandia | 2 | Ts, Tn |
| Francia | 31 | Ts(10), Tb (21) |
| Hungría | 1 | Ts |
| Irlanda | 1 | Ts |
| Islas Swalbard (Noruega) | 5 | Tna |
| Italia | 93 | Ts (3), Tb (90) |
| Japón | 2 | Tb |
| Kenia | 1 | Tne |
| Lituania | 1 | Tb |
| Macedonia | 1 | Tb |
| Namibia | 1 | T8 |
| Noruega | 5 | Tna |
| Nueva Zelanda | 1 | Ts |
| Origen desconocido | 21 | Ts (17),Tna (4) |
| Países Bajos | 1 | Ts |
| Polonia | 10 | Ts (8), Tb (2) |
| Reino Unido | 2 | Ts |
| República Eslovaca | 7 | Ts (1), Tb (6) |
| República Kazajstán | 15 | Tna (6), Tb (8), Tp (1) |
| Serbia | 2 | Ts |
| Suecia | 9 | Ts (3), Tna (1), Tb (5) |
| Suiza | 1 | Tb |
| Sur África | 3 | Tne (1), T8 (2) |
| Tailandia | 4 | Ts (3), Tp (1) |
| Tanzania | 10 | Tne |
| Tasmania | 1 | Tp |
| USA | 44 | Ts (13), Tp (1), Tm (18), T6 (12) |
| Tabla 2. Recientes brotes de triquinelosis informados por Internacional Comisión Trichinellosis para Europa y Asia | |||
| País (Fecha) | Nº Casos | Fuente | Especies |
| China (1992-1996) | 467 | Cerdo, Carnero | T. spiralis? |
| Eslovaquia (1998 ?) | 336 | Carne de perro | T. britovi |
| España (1995) | 15 | Cerdo | Trichinella sp.? |
| Francia (1998) | 126 | Caballos importados | T. spiralis |
| Italia (1996) | 20 | Jabalí | T. britovi |
| Italia (1998) | 92 | Caballos importados | T. spiralis |
| Kamchatka (1996) | 49 | Cerdo | T. pseudospiralis |
| Korea (1998) * | 3 | paleta-perro | Trichinella sp.? |
| Letonia (1995-1998) | 255 | ? | Trichinella sp.? |
| Líbano (1995) | 200 | Cerdo | T. spiralis |
| Lituania (1996-1997) | 328 | ? | Trichinella sp.? |
| N. Zelanda (1997-98) | - | 4 cerdos | Trichinella sp.? |
| Polonia (1992-1997) | 571 | Cerdo, Jabalí | Trichinella sp.? |
| Rumania (1997) | 2027 | Cerdo | Trichinella sp.? |
| Tailandia (1994) | 59 | Cerdo salvajes | T. pseudospiralis |
| Tailandia (1995) | 45 | Cerdo salvajes | Trichinella sp.? |
| * Primer reporte para Korea. | |||
Tabla 3: Casos reportados de triquinelosis al ICT para América (1995-1997).
| Países | Nº casos humanos | Nº cerdos infectados | Fuente de la |
| (fatalidad) | ó prevalencia | infección | |
| Argentina | 1274 (3) | 416 | cerdos principal. |
| Canadá (1995) | 9 (0) | 2 | animales salvajes |
| Chile (1995-97) | 169 (1) | 0.001% | cerdos exclusiv. |
| Chile (1998) | 5 (?) | ? | cerdos |
| México (1993-95) | 282 (0) | no reportados | cerdos mayorm. |
| USA (1995-96) | 36 (0) | 0.028 - 0.13% | animales salvajes |
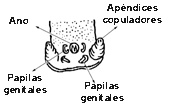
Detalle del apéndice de un macho adulto
Descargar
| Enviado por: | Palmero |
| Idioma: | castellano |
| País: | España |
