Química
Termodinámica
ÍNDEX:
PRIMER PRINCIPI DE LA TERMODINÀMICA..................................... pàg.3
Experiència de Joule........................................................................ pàg.3
1.2 Formulació del Primer Principi de la Termodinàmica.................... pàg.4
1.3 Definició de procés reversible....................................................... pàg.5
ENERGIA INTERNA D'UN GAS IDEAL.............................................. pàg.5
2.1 Canvi d'estat d'un gas ideal.......................................................... pàg.5
2.2 Transformacions........................................................................... pàg.6
ENTALPIA.............................................................................................. pàg.8
PROCESSOS REVERSIBLES................................................................ pàg.9
4.1 Procés adiabàtic reversible per a un gas ideal.............................. pàg.9
4.2 Procés politròpic reversible per a un gas ideal............................. pàg.10
LIMITACIONS DEL PRIMER PRINCIPI.............................................. pàg.12
BIBLIOGRAFIA...................................................................................... pàg.13
PRIMER PRINCIPI DE LA TERMODINÁMICA
Primer principi de la termodinàmica: “El treball total que es realitza en cadascun dels processos adiabàtics possibles, reversibles o no reversibles, entre dos estats d'equilibri a i b d'un sistema termodinàmic, és el mateix.”
La primera llei de la termodinàmica no es altra cosa que el principi de conservació de l'energia a un sistema constituït per moltes partícules. A cada estat del sistema li correspon energia interna U. Quan el sistema passa de l'estat A a l'estat B, la seva energia canvia:
Experiència de Joule
James Joule pensava que el que fa que un cos estigui més calent no és la major concentració calorífica, sinó la major energia cinètica de les seves molècules. El treball realitzat per la força de fregament s'inverteix en augmentar l'energia cinètica de les molècules. Si això fos així, calor i treball haurien de ser la mateixa cosa, el treball necessari per escalfar un cos per fricció hauria de ser proporcional a la calor necessària per produir aquest mateix calentament.
En els experiments realitzats per Joule, agitava aigua tancada per parets adiabàtiques amb unes “paletes”, les quals giraven mitjançant un pes que queia entre dues altures, h1 i h2. El treball subministrat al sistema es calculava per l'altura que el pes queia: W12ad=mg(h1-h2). Quan parava l'agitació de l'aigua, observà que s'havia escalfat, passant d'una temperatura de T1 a T2. aquest mateix calentament podia obtenir-se subministrant a l'aigua una calor, Q12=(T1-T2) C (sent C la capacitat calorífica de l'aigua). D'aquesta manera, Joule va observar que la calor i el treball eren equivalents, arribant a determinar el valor que els relacionava: J=4,18 J/cal.
Això deixava clar que la calor, igual que el treball es, simplement, una forma de transferir energia. Per tant, l'energia d'un sistema podrà variar degut a un intercanvi de calor o a una realització de treball.
"U=Q+W on "U=U2-U1
Si es tracta d'un procés elemental seria:
d"U=dQ+dW
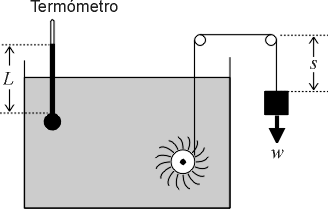
Fig. 1: Experiència de Joule
Formulació del Primer Principi de la Termodinàmica
El Primer Principi expressa que la calor, Q, que s'intercanvia entre el sistema i el medi es veu invertida quan l'energia interna del sistema, "U, varia i quan es realitza un treball, W (utilitzant el criteri de signes químic, que hi ha a continuació):
Q="U-W
I en un procés elemental:
dQ=d"U-dW
On Q1 és la calor absorbida pel sistema, Q2 és la calor cedida pel sistema, W1 és un treball de compressió, W2 és un treball d'expansió.
Fig. 2: criteri de signes per a l'intercanvi energètic.
Definició procés reversible
Procés per tal d'anar d'un estat d'equilibri termodinàmic fins a un altre estat final d'equilibri termodinàmic, és a dir, un procés que passa per una successió infinita d'estats d'equilibri termodinàmic.
Caldria tenir en compte que tots els processos reals són irreversibles, els reversibles són només una idealització.
ENERGIA INTERNA D'UN GAS IDEAL
Un sistema termodinàmic té una certa energia anomenada energia interna (U), provocada per la constitució pròpia de la matèria (enllaç de les molècules, interaccions entre elles...). Per tant, l'energia total d'un sistema es la suma de la seva energia interna, energia potencial, energia cinètica, i la causada pel fet de trobar-se sota l'acció de qualsevol camp.
L'energia interna és una propietat extensiva del sistema a causa de la seva pròpia naturalesa, a les partícules que el constitueixen i la interacció entre elles. Les unitats són unitats d'energia, el Joule.
Aquesta energia es pot modificar de diverses maneres equivalents, realitzant un treball o transferint energia en forma de calor.
Si variem l'energia interna del nostre sistema, la primera llei de la termodinàmica ens diu, que aquesta variació ve donada per la mateixa variació d'energia, però de signe contrari als voltants. D'aquesta manera l'energia total del sistema més l'entorn, romandrà constant.
La forma d'expressar aquesta llei, centrant-nos en l'estudi del sistema, és:
L'energia interna és una funció d'estat ![]()
; i per tant la seva variació únicament depèn de l'estat inicial i de l'estat final i no de la trajectòria o camí per realitzar-ho.
L'energia interna d'un sistema és una funció d'estat, però la calor i el treball no ho són.
La calor i el treball desenvolupats en un procés són funció de la trajectòria que segueix el procés. Calor i treball no són propietats del sistema, són solament formes de modificar l'energia del mateix.
2.1 Canvi d'estat d'un gas ideal
El gas ideal és un model molt senzill el sistema del qual està format per partícules que no interaccionen entre si, i que a més a més no ocupen volum. Evidentment el gas ideal no existeix, però com a model serveix per descriure el comportament dels gasos a baixes pressions i altes temperatures.
Per a un gas ideal l'energia interna no depèn del volum ni de la pressió ja que les molècules són independents entre si. Tampoc depèn de l'entalpia ni de la pressió ni del volum, i per tant;
![]()
![]()
i si el rang de T és petit, les capacitats calorífiques es poden considerar constants, i per tant:
![]()
![]()
A més a més en el cas de gasos ideals es compleix que:
![]()
d'on deduïm l'anomenada Relació de Mayer:
Cp = Cv + R
2.2 Transformacions
L'energia interna U del sistema depèn únicament de l'estat del sistema, mentre que en un gas ideal depèn solament de la seva temperatura. La transferència de calor o del treball mecànic, depenen del tipus de transformació o camí seguit per anar de l'estat inicial al final.
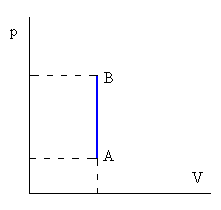
Isòcor (volum constant):
|
| No hi ha variació de volum del gas, així W=0 Q=ncV(TB-TA) On cV és la calor específica a volum constant |
Fig. 3: Gràfic P/V d'un procés isòcor.
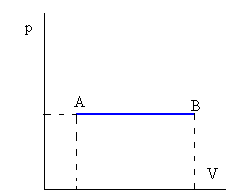
Isòbar (pressió constant):
|
| Aquest procés es caracteritza perquè la temperatura es manté constant. p1v1 = p2v2 = rT = constant (J/kg) Q=ncP(TB-TA) On cP es la calor específica a pressió constant |
Fig. 4: Gràfic P/V d'un procés isòbar.
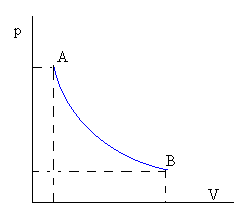
Isoterm (temperatura constant):
pV=nRT
La corba p=cte/V que representa la transformació en un diagrama p-V és una hipèrbola, les asímptotes de la qual són els eixos coordenats.
|
|
dU=0 Q=W |
Fig. 5: Gràfic P/V d'un procés isoterm.
| Transformació | Calor | Treball | Var. Energía Interna |
| Isòcor (v=cte) | Q=ncV(TB-TA) | 0 | dU=ncV(TB-TA) |
| Isòbar (p=cte) | Q=ncp(TB-TA) | W=p(VB-VA) | dU=ncV(TB-TA) |
| Isoterm (T=cte) | Q=W |
| dU=0 |
ENTALPIA
L'entalpia és una funció d'estat que es defineix com la suma de l'energia interna del sistema, U, i el producte de la pressió pel volum PV:
H = U + PV
I la diferencial és una diferencial exacta que té com a expressió:
dH = dU + PdV + VdP
La formulació del primer principi per a un sistema tancat ens dóna:
dQ = dU + PdV = dH - VdP
i si el procés és isobàric, entre els estats A i B:
Qp = "H = HB - HA
Com que l'entalpia és una funció d'estat, "H no depèn del camí recorregut per l'evolució del sistema (tant en procés reversible com si no ho és), i en un cicle, "H=0.
Per a un sistema a pressió constant, es compleix:
i per tant,
L'expressió de l'entalpia per a un procés isobàric es pot generalitzar a qualsevol procés, suposant comportament de gas ideal.
dH = ncpdT
PROCESSOS REVERSIBLES
Procés adiabàtic (aïllat tèrmicament, Q=0) reversible per a un gas ideal
Tot procés en el que no existeix flux de calor ni d'entrada ni de sortida del sistema es denomina procés adiabàtic. Es pot donar quan el sistema està molt bé aïllat, o quan el procés succeeix molt ràpidament.
L'equació d'una transformació adiabàtica l'hem obtingut a partir d'un model simple de gas ideal. Ara anem a obtenir-la a partir del Primer Principi de la Termodinàmica:
|
| Equació de la transformació adiabàtica Del primer principi dU=-pdV
Integrant
On l'exponent de V, , es denomina índex adiabàtic del gas ideal:
|
Fig.6: Gràfic P/V d'un procés adiabàtic.
Per tant,
![]()
Si s'elimina T de la equació mitjançant PV=nRT, s'obté
![]()
Per consegüent,
![]()
Aquesta equació relaciona les variables P i V per expansions i compressions adiabàtiques.
Si A i B son els estats inicials i finals d'una transformació adiabàtica es compleix que
![]()
Per calcular el treball es necessari realitzar una integració semblant a la transformació isoterma.

Com podem comprovar, el treball és igual a la variació d'energia interna canviada de signe
Si Q=0, llavors W= -dU = -ncV(TB-TA)
| Transformació | Calor | Treball | Var. Energia Interna |
| Adiabàtic (Q=0) | 0 | W=-dU | dU=ncV(TB-TA) |
Procés politròpic reversible per a un gas ideal
Els processos politròpics tenen lloc al llarg d'una trajectòria per a la qual la calor específica o molar que li correspon és constant en tots els estats intermedis i extrems. Els processos adiabàtics, isoterms, isòcors i isobàrics són casos especials de processos politròpics.
Suposarem un mol de gas ideal que realitza una transformació politròpica reversible, i en aquesta, la calor molar que li correspon és constant. Suposarem també que aquest gas té una calor molar a volum constant, Cv, que no depèn de la temperatura. Es compleix el primer principi, la llei de Joule, la relació de Mayer:
Integrant l'expressió resultant de la forma:
Resulta:
Es defineix l'índex de politropia n d'una transformació politròpica com el valor constant que resulta de l'expressió:
Amb la qual cosa s'obté l'equació de les politròpiques en funció de T i V:
O en funció de les altres variables:
Que tenen igual forma que les equacions de les adiabàtiques substituint el coeficient adiabàtic per l'índex de politropia n.
El treball d'expansió en un procés politròpic amb val:
5. LIMITACIONS DEL PRIMER PRINCIPI
El Primer Principi només es limita als processos que no impliquin creació o destrucció d'energia. No hi ha cap restricció sobre el sentit que han de tenir els processos que ocorren a la naturalesa. És a dir, si posem en contacte un cos calent amb un altre de fred, no s'especifica en quin sentit avançarà la reacció: si el flux tèrmic passarà del cos fred al calent o del calent al fred. El Primer Principi solament posa la condició que la quantitat de calor que s'ha cedit per un cos sigui igual a l'absorbida per l'altre, i tal Principi seria satisfactori només si el flux tèrmic té lloc del cos fred al calent.
Tampoc el Primer Principi nega la possibilitat de què un cos que hagi caigut des d'una certa altura (i s'ha escalfat per conseqüència de l'impacte), converteixi la seva energia tèrmica en potencial, tornant al seu punt de partida.
També sabem, per experiència, que si un cos cau a un recipient d'aigua, quan penetra a l'interior, la seva velocitat disminueix fins arribar al fons del dipòsit. El Principi no nega la possibilitat de què existeixi el procés invers: que el cos es posés de nou en moviment a augmentar la seva energia per conseqüència del refredament de l'aigua lleument escalfada en el fregament. Aquest procés invers, igualment com altres són exemples no naturals, ja que no els podem trobar en la naturalesa.
Lògicament és necessari establir una llei que deixi predir el sentit en el qual ha d'evolucionar un sistema per a què la transformació sigui natural: SEGON PRINCIPI DE LA TERMODINÀMICA.
6. BIBLIOGRAFIA
Llibres:
-
Tipler, P. A.; "Física". Volumen I, traducció de la 3a edició, Editorial Reverté (1994).
-
Vicent Gandia. “Manual de Termodinàmica”. Universitat de València, 1995. Col·lecció: Educació. Materials.
-
José Segura y Juan Rodriguez. "Problemas de termodinámica técnica”. Editorial Reverté.
-
José Segura Clavell. "Termodinámica Técnica” Editorial Reverté.
-
Zemansky, M. W., y Van Ness, H. C., “Termodinámica técnica fundamental”, Editorial Aguilar, Madrid, 1972
Pàgines web:
-
http//:www.sc.ehu.es/sbweb/fisica/estadistica/termo/Termo.html
-
http//:www.sc.ehu.es/sbweb/fisica/estadistica/termo1/termo1.html
-
htttp//:www.sc.ehu.es/sbweb/fisica/estadistica/adiabatico/adibatico.html
-
htttp//joule.qfa.uam.es/beta-2.0/temario/tema1/tema1.php
-
http//www.biopsychology.org/apuntes/termodin/termodin.htm
http://www.fisicanet.com.ar/fisica/f2ap02/apf2_16d_Primer_Principio.php
-
http://www.quimica.urv.es/~w3fa/assignat/quimica/pt.html
“Manual de Termodinàmica” Vicent Gandia. Universitat de València, 1995
http://www.biopsychology.org/apuntes/termodin/termodin.htm#Introducción
“Manual de Termodinàmica” Vicent Gandia. Universitat de València, 1995
http://www.sc.ehu.es/sbweb/fisica/estadistica/termo/Termo.html
http://www.sc.ehu.es/sbweb/fisica/estadistica/termo/Termo.html
http://www.sc.ehu.es/sbweb/fisica/estadistica/termo/Termo.html
http://www.sc.ehu.es/sbweb/fisica/estadistica/termo/Termo.html
Q1>0
W1>0
Q2<0
S. T.
S. T.
W2<0
Descargar
| Enviado por: | Laialaia |
| Idioma: | catalán |
| País: | España |